解题方法
1 . Ⅰ.2SO2(g)+O2(g) 2SO3(g) ΔH=akJ•mol-1,反应过程的能量变化如图所示。已知1molSO2(g)完全转化为1molSO3(g)放热99kJ。请回答:
2SO3(g) ΔH=akJ•mol-1,反应过程的能量变化如图所示。已知1molSO2(g)完全转化为1molSO3(g)放热99kJ。请回答:
(1)a=___ kJ•mol-1。
(2)该反应常用V2O5作催化剂,加入V2O5会使图中B点___ (填“升高”“降低”或“不变”),使图中ΔH___ (填“升高”“降低”或“不变”)。
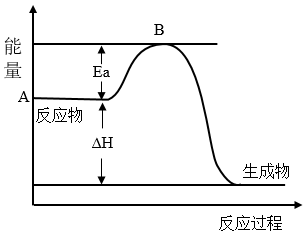
(3)已知单质硫的燃烧热为296kJ•mol-1,写出反应的热化学方程式:__ 。
(4)工业上用H2和Cl2反应制HCl,各键能数据为:H—H:436kJ/mol,Cl—Cl:243kJ/mol,H—Cl:431kJ/mol。该反应的热化学方程式是__ 。
(5)已知:
①C(s)+O2(g)=CO2(g) ΔH=ΔH1;
②2CO(g)+O2(g)=2CO2(g) ΔH=ΔH2;
③TiO2(g)+2Cl2(g)=TiCl4(s)+O2(g) ΔH=ΔH3;
则TiO2(g)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的ΔH=___ 。(列出关于ΔH1、ΔH2、ΔH3的表达式)
 2SO3(g) ΔH=akJ•mol-1,反应过程的能量变化如图所示。已知1molSO2(g)完全转化为1molSO3(g)放热99kJ。请回答:
2SO3(g) ΔH=akJ•mol-1,反应过程的能量变化如图所示。已知1molSO2(g)完全转化为1molSO3(g)放热99kJ。请回答:(1)a=
(2)该反应常用V2O5作催化剂,加入V2O5会使图中B点

(3)已知单质硫的燃烧热为296kJ•mol-1,写出反应的热化学方程式:
(4)工业上用H2和Cl2反应制HCl,各键能数据为:H—H:436kJ/mol,Cl—Cl:243kJ/mol,H—Cl:431kJ/mol。该反应的热化学方程式是
(5)已知:
①C(s)+O2(g)=CO2(g) ΔH=ΔH1;
②2CO(g)+O2(g)=2CO2(g) ΔH=ΔH2;
③TiO2(g)+2Cl2(g)=TiCl4(s)+O2(g) ΔH=ΔH3;
则TiO2(g)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的ΔH=
您最近一年使用:0次
名校
解题方法
2 . 已知某反应A(g)+B(g) C(g)+D(g)过程中的能量变化如图所示,回答问题。
C(g)+D(g)过程中的能量变化如图所示,回答问题。

该反应是_____ (填“吸热”或“放热”)反应,该反应的ΔH=______ kJ· mol-1(用含E1、E2的代数式表示),1 mol气体A和1 mol气体B具有的总能量____ ”(填“>”“<”或“=”)1 mol气体 C和1 mol气体D具有的总能量。
 C(g)+D(g)过程中的能量变化如图所示,回答问题。
C(g)+D(g)过程中的能量变化如图所示,回答问题。
该反应是
您最近一年使用:0次
2020-09-15更新
|
251次组卷
|
3卷引用:福建省南安市柳城中学2020-2021学年高二上学期第一次月考化学试题
3 . (1)碳化铝,黄色晶体,熔点2200°C,熔融状态不导电,据此判断,碳化铝属于______ 晶体;水结冰后体积膨胀,与水分子间存在_________________ 有关。
(2)1 mol C在高温下与水蒸气反应,生成水煤气,吸收b kJ热量。写出反应的热化学方程式_____ 。
(3)今有如下三个热化学方程式:
H2(g)+1/2 O2(g)=H2O(g);ΔH=aKJ·mol-1
H2(g)+1/2 O2(g)=H2O(l);ΔH= bkJ·mol-1
2H2(g)+O2(g)=2H2O(l);ΔH=ckJ·mol-1
关于它们的下列表述正确的是________
A.a、b和c均为正值 B.a >b C.a <b D.2b = c
(4)现有两个反应:①NaOH + HCl = NaCl + H2O, ②Fe +H2SO4 = FeSO4 + H2 ↑。其中为放热反应的是_______ (填序号,下同)能设计成原电池的是______ ,若设计成原电池,则:(Fe:56)负极材料为_________ 、电极反应式为_____________ ;正极材料可以用_______ 、电极反应式为_____________________ 。如果反应中一个电极质量减少了2.8g,则放出的气体在标准状况下的体积为____________ L,转移的电子数目 为___________________ 。
(2)1 mol C在高温下与水蒸气反应,生成水煤气,吸收b kJ热量。写出反应的热化学方程式
(3)今有如下三个热化学方程式:
H2(g)+1/2 O2(g)=H2O(g);ΔH=aKJ·mol-1
H2(g)+1/2 O2(g)=H2O(l);ΔH= bkJ·mol-1
2H2(g)+O2(g)=2H2O(l);ΔH=ckJ·mol-1
关于它们的下列表述正确的是
A.a、b和c均为正值 B.a >b C.a <b D.2b = c
(4)现有两个反应:①NaOH + HCl = NaCl + H2O, ②Fe +H2SO4 = FeSO4 + H2 ↑。其中为放热反应的是
您最近一年使用:0次
11-12高二·福建龙岩·阶段练习
解题方法
4 . 回答下列问题:
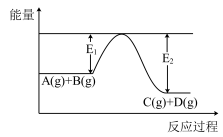
(1)反应A(g)+B(g) C(g)+D(g)过程中的能量变化如右图所示,判断该反应△H
C(g)+D(g)过程中的能量变化如右图所示,判断该反应△H______ 0(填“>”、“<”或“无法确定”)。
(2)在Al2O3、Ni催化下气态甲酸发生下列反应:
甲酸(g)=CO (g)+ H2O (g) △H1= +34.0 kJ/mol
甲酸(g)= CO2(g)+ H2(g) △H2=-7.0 kJ/mol
则甲酸的分子式为___________ ,在该条件下,气态CO2和气态H2反应生成气态CO和气态H2O的热化学方程式为_______________ 。
(3)如图所示,水槽中试管内有一枚铁钉,放置数天观察:

I若试管内液面上升,则正极反应:____________ 。
II若试管内液面下降,则发生___________ 腐蚀。
III若溶液甲为水,溶液乙为海水,则铁钉在_______ (填“甲”或“乙”)溶液中腐蚀的速度快。
(1)反应A(g)+B(g)
 C(g)+D(g)过程中的能量变化如右图所示,判断该反应△H
C(g)+D(g)过程中的能量变化如右图所示,判断该反应△H
(2)在Al2O3、Ni催化下气态甲酸发生下列反应:
甲酸(g)=CO (g)+ H2O (g) △H1= +34.0 kJ/mol
甲酸(g)= CO2(g)+ H2(g) △H2=-7.0 kJ/mol
则甲酸的分子式为
(3)如图所示,水槽中试管内有一枚铁钉,放置数天观察:

I若试管内液面上升,则正极反应:
II若试管内液面下降,则发生
III若溶液甲为水,溶液乙为海水,则铁钉在
您最近一年使用:0次
13-14高三·全国·课时练习
名校
解题方法
5 . 碳是形成化合物种类最多的元素,其单质及其部分化合物是人类生产生活的主要能源物质。请回答下列问题:
(1)有机物M经过太阳光光照可转化成N,转化过程如下:
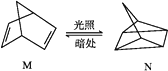
ΔH=+88.6 kJ·mol-1,则M、N相比,较稳定的是__________ 。
(2)CH3OH+O2(g) =CO2(g)+2H2O(g) ΔH=-akJ·mol-1,则a________ (填“>”“<”或“=”)238.6。(已知甲醇的燃烧热为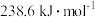 )
)
(3)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2,当有1 mol Cl2参与反应时释放出145 kJ热量,写出该反应的热化学方程式:____________________________ 。
(4)将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料,4Al(s)+3TiO2(s)+3C(s) ===2Al2O3(s)+3TiC(s) ΔH= -1 176 kJ·mol-1,则反应过程中,每转移1 mol电子放出的热量为_____________ 。
(1)有机物M经过太阳光光照可转化成N,转化过程如下:

ΔH=+88.6 kJ·mol-1,则M、N相比,较稳定的是
(2)CH3OH+O2(g) =CO2(g)+2H2O(g) ΔH=-akJ·mol-1,则a
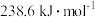 )
) (3)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2,当有1 mol Cl2参与反应时释放出145 kJ热量,写出该反应的热化学方程式:
(4)将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料,4Al(s)+3TiO2(s)+3C(s) ===2Al2O3(s)+3TiC(s) ΔH= -1 176 kJ·mol-1,则反应过程中,每转移1 mol电子放出的热量为
您最近一年使用:0次
2016-12-08更新
|
2132次组卷
|
14卷引用:【全国百强校】福建省三明市第一中学2018-2019学年高二上学期第一次月考化学试题
【全国百强校】福建省三明市第一中学2018-2019学年高二上学期第一次月考化学试题山西省实验中学2017-2018学年高二上学期10月月考化学试题河南省鹤壁市淇县第一中学2018-2019学年高二(普通班)上学期第一次月考化学试题(已下线)2014年高考化学一轮复习课后规范训练6-1练习卷重庆市九校联盟2017-2018学年高二上学期期中考试化学试题(已下线)二轮复习 专题8 化学反应中与能量变化 押题专练【全国百强校】广东仲元中学2017-2018学年高二下学期期中考试(理)化学试题河北省安平中学2017-2018学年高一下学期期末考试化学试题12018-2019学年人教版高二化学选修四章:化学反应与能量末测试题2018-2019学年人教版高中化学选修四 章末综合测评1 化学反应与能量四川省成都经济技术开发区实验中学校2019届高三上学期入学考试化学试题(已下线)《2018-2019学年同步单元双基双测AB卷》第一单元 化学反应与能量单元测试(A卷)高二人教版选修4 期末学业测评(二)辽宁省普兰店市第一中学2019届高三上学期期中考试化学试题
6 . 氢气燃烧生成液态水的热化学方程式是:2H2(g)+O2(g) =2H2O(l) ΔH=-572kJ/mol
请回答下列问题:
(1)生成物能量总和____ (填“大于”、“小于”或“等于”)反应物能量总和。
(2)若2 mol氢气完全燃烧生成水蒸气,则放出的热量______ (填“>”、“<”或“=”)572 kJ。
请回答下列问题:
(1)生成物能量总和
(2)若2 mol氢气完全燃烧生成水蒸气,则放出的热量
您最近一年使用:0次



