名校
解题方法
1 . 宏观辨识和微观探析是化学学科的核心素养之一,下列相关描述中正确的是
A. (白磷,s) (白磷,s) (红磷,s) (红磷,s)  kJ⋅mol kJ⋅mol ,则白磷比红磷稳定 ,则白磷比红磷稳定 |
B.表示 燃烧热的热化学方程式 燃烧热的热化学方程式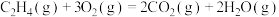 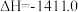 kJ⋅mol kJ⋅mol |
C.已知稀溶液中  kJ⋅mol kJ⋅mol ,则稀硫酸与稀氢氧化钡溶液反应生成1 mol水时放出57.3 kJ的热量 ,则稀硫酸与稀氢氧化钡溶液反应生成1 mol水时放出57.3 kJ的热量 |
D.已知500℃、30 MPa下, 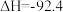 kJ⋅mol kJ⋅mol ,则相同条件下1 mol ,则相同条件下1 mol  和3 moI 和3 moI  充分反应,放出热量小于92.4 kJ 充分反应,放出热量小于92.4 kJ |
您最近一年使用:0次
名校
解题方法
2 . 下列关于热化学方程式的说法正确的是
A.若 的燃烧热为 的燃烧热为 ,则热化学方程式为: ,则热化学方程式为: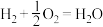 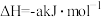 |
B.若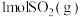 和 和 完全反应放热 完全反应放热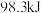 ,则热化学方程式为: ,则热化学方程式为: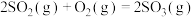  |
C.若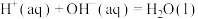 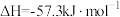 ,则稀硫酸与稀 ,则稀硫酸与稀 反应的热化学方程式为: 反应的热化学方程式为: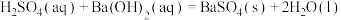 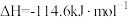 |
D.若 白磷的能量比 白磷的能量比 红磷多 红磷多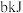 ,则白磷转化为红磷的热化学方程式为: ,则白磷转化为红磷的热化学方程式为: 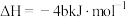 |
您最近一年使用:0次
名校
解题方法
3 . 下列推论正确的是
| A.S(g)+O2(g)=SO2(g)ΔH1,S(s)+O2(g)=SO2(g) ΔH2,则:ΔH1>ΔH2 |
| B.石墨燃烧热为393.5kJ·mol-1,则有2C(s)+O2(g)=2CO(g)ΔH=-393.5kJ·mol-1 |
| C.中和热为57.4kJ/mol,则有Ba(OH)2(aq)+H2SO4(aq)=BaSO4(s)+2H2O(l) ΔH<-114.8kJ/mol |
| D.已知CaCO3(s)=CaO(s)+CO2(g)ΔH>0,该反应任何温度下都能自发进行 |
您最近一年使用:0次
2024-01-28更新
|
28次组卷
|
2卷引用:四川省眉山市彭山区第一中学2023-2024学年高二下学期开学考试化学试题
名校
4 . 下列说法正确的是
A.甲烷的燃烧热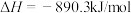 。则 。则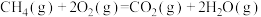 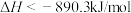 |
B.25℃ 时, 时,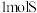 和 和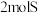 的燃烧热相等 的燃烧热相等 |
C.一定条件下,将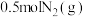 和 和 置于密闭的容器中充分反应生成 置于密闭的容器中充分反应生成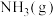 ,放热19.3kJ,热化学方程式为: ,放热19.3kJ,热化学方程式为: 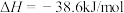 |
D.在稀溶液中: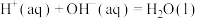 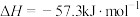 ,若将含 ,若将含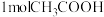 的醋酸稀溶液与含 的醋酸稀溶液与含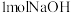 的稀溶液混合,放出的热量大于57.3kJ 的稀溶液混合,放出的热量大于57.3kJ |
您最近一年使用:0次
2023-12-04更新
|
138次组卷
|
5卷引用:四川省绵阳中学2023-2024学年高二下学期开学化学试题
名校
5 . 下列关于反应2C4H10(g)+13O2(g)=8CO2(g)+10H2O(l) ΔH= -5800 kJ·mol-1的叙述错误的是
| A.该反应是放热反应 |
| B.该反应的ΔH与各物质的状态有关,与化学计量数也有关 |
| C.该热化学方程式表示在25 ℃、101 kPa下,2 mol C4H10气体完全燃烧生成CO2气体和液态水时放出热量5800 kJ |
| D.该反应表明2 分子 C4H10气体完全燃烧时放出5800 kJ的热量 |
您最近一年使用:0次
解题方法
6 . 下列说法正确的是
A.已知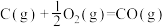  , ,  ,则 ,则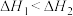 |
B.甲烷的燃烧热 ,则甲烷燃烧的热化学方程式可表示为: ,则甲烷燃烧的热化学方程式可表示为: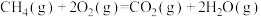  |
C.由反应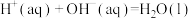  可知,醋酸溶液与 可知,醋酸溶液与 溶液恰好反应生成 溶液恰好反应生成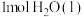 时,放出的热量小于 时,放出的热量小于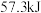 |
| D.反应过程中使用催化剂可降低反应热从而提高反应速率 |
您最近一年使用:0次
名校
解题方法
7 . 下列有关叙述不正确的是
A.101kPa,20℃和25℃时, 的燃烧热不同 的燃烧热不同 |
B.已知: 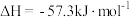 ,则稀 ,则稀 溶液与浓硫酸完全反应生成 溶液与浓硫酸完全反应生成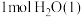 时,放出的热量少于 时,放出的热量少于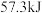 |
C.由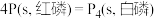  ,可知红磷比白磷稳定 ,可知红磷比白磷稳定 |
| D.用键能计算出的反应热是估算值,但与实验测得的反应热很接近 |
您最近一年使用:0次
2023-07-14更新
|
154次组卷
|
2卷引用:四川省内江市第六中学2023-2024学年高二上学期入学考试化学试题
名校
8 . 下列说法正确的是
| A.测定中和反应的反应热时,将碱缓慢倒入酸中,所测得ΔH偏大 |
B.500℃、30MPa下,将0.5molN2和1.5molH2置于密闭容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为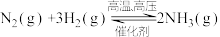 ΔH=-38.6kJ·mol-1 ΔH=-38.6kJ·mol-1 |
| C.1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热 |
| D.金刚石和石墨的燃烧热相等 |
您最近一年使用:0次
2023-07-12更新
|
312次组卷
|
3卷引用:四川省宜宾市兴文第二中学校2023-2024学年高二上学期开学考试化学试题
9 . 甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理如下:
①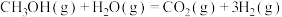
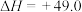 kJ⋅mol
kJ⋅mol
②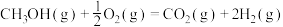
 kJ⋅mol
kJ⋅mol
下列说法正确的是
①
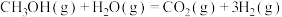
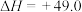 kJ⋅mol
kJ⋅mol
②
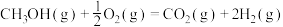
 kJ⋅mol
kJ⋅mol
下列说法正确的是

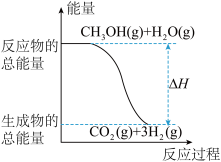
A. 的燃烧热 的燃烧热 kJ⋅mol kJ⋅mol |
| B.反应①中的能量变化如图所示 |
C. 转变成 转变成 的过程一定要吸收能量 的过程一定要吸收能量 |
D.根据②推知反应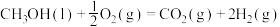  kJ⋅mol kJ⋅mol |
您最近一年使用:0次
2023-06-20更新
|
234次组卷
|
97卷引用:四川省凉山州西昌天立学校高2021-2022学年高二上学期入学考试化学试题
四川省凉山州西昌天立学校高2021-2022学年高二上学期入学考试化学试题(已下线)2011-2012学年四川省南山中学高二上学期期末模拟考试化学试卷(已下线)2011-2012学年吉林省油田高中高一下学期期初考试化学试卷2014-2015四川省邛崃市高埂中学高二下学期第一次月考化学试卷2016-2017学年四川省成都外国语学校高二上10月月考化学试卷河北省景县中学2017-2018学年高二开学摸底考试化学试题【市级联考】四川省达州市2018-2019学年高二上学期期末检测化学试题辽宁省六校协作体2020届高三上学期初考化学试题四川省绵阳市三台县芦溪中学2017-2018学年高二上学期第五次月考化学试题四川省射洪中学校2020-2021学年高二上学期第二次月考化学试题四川省广元市八二一中学2021-2022学年高二上学期期中考试化学试题(已下线)2012届广西桂林十八中高三上学期第三次月考化学试卷(已下线)2012届辽宁省沈阳四校协作体高三上学期12月月考化学试卷(已下线)2011-2012学年黑龙江龙东地区高二第一学期高中教学联合体期末考试化学试卷(已下线)2011-2012学年甘肃兰州一中高二上学期期末考试化学试卷(已下线)2011-2012学年江苏省射阳中学高二上学期期末考试化学(选修)试卷(已下线)2012届吉林省吉林市高三上学期期末考试化学试卷(已下线)2011-2012天津南开中学高二第一学期期中考试理科化学试卷(已下线)2011-2012学年江西上饶中学高一零点、实验班下期末化学试卷(已下线)2012-2013学年河北省石家庄市第一中学高一下学期期中考试化学试卷(已下线)2013-2014学年江西赣州市四所重点中学高二上学期期末联考化学试卷(已下线)2014年高考化学 题型八 能量变化型专题练习卷(已下线)2012届南京师大附中高三模拟考试试卷(十)化学试卷(已下线)2014-2015学年黑龙江安达市高级中学高二第一次月考试题化学试卷(已下线)2015届福建省安溪第八中学高三上学期期中质量检测化学试卷2014-2015江西省上高县二中高二上第三次月考化学试卷2014-2015辽宁省沈阳市东北育才高一下学期第一次阶段考试化学试卷2015-2016学年内蒙古奋斗中学高二上9月质检化学试卷2015-2016学年河南省南阳部分高中高二上学期第一次联考化学试卷2015-2016学年陕西省镇安中学高二上期中质检化学试卷2016届河北省行唐启明中学高三上学期12月月考化学试卷2015-2016学年江西省樟树中学、高安二中高二上期中联考化学试卷2015-2016学年宁夏育才中学高二上期末考试化学试卷2016-2017学年广东佛山一中高二上第一次段考化学卷2016-2017学年贵州省思南中学高二上半期考试化学卷2016-2017学年山西省大同一中高二上期中化学试卷2016-2017学年浙江省温州市十校联合体高二上期末化学试卷2016-2017学年湖南省长沙市第一中学高二下学期第一次模块检测化学试卷2017届江苏省南通市高三高考全真模拟(五)化学 试卷河北省石家庄市第一中学2016-2017学年高一下学期期中考试化学试题吉林省延边安图第一中学2016-2017学年高二练习化学试题江苏省盐城中学2018届高三上学期第一次阶段性考试化学试题安徽省江淮名校2017-2018学年高二期中考试化学试题江苏省盐城市阜宁县2017-2018学年高二上学期期中考试化学(选修)试题河南省中原名校(即豫南九校)2017-2018学年高二上学期第二次联考化学试题浙江省温州市“十五校联合体”2017-2018学年高二上学期期末考试化学试题高二化学(人教版)选修四专题同步练习卷:燃烧热 能源2018-2019学年人教版高中化学选修四 章末综合测评1 化学反应与能量【全国百强校】海南省海南中学2017-2018学年高二(理)上学期期末考试化学试题【全国百强校】河北省武邑中学2018-2019学年高二上学期第二次月考化学试题山西省晋中市平遥县第二中学2019-2020学年高二10月月考化学试题(已下线)考点08 化学反应中的能量变化——《备战2020年高考精选考点专项突破题集》湖南省常德市石门县第二中学2019-2020学年高二上学期第二次月考化学试题海南省海口市第四中学2019-2020学年高二上学期期末考试化学试题2020年春季人教版高中化学选修4第一章《化学反应与能量》测试卷江苏省淮安市涟水县第一中学2020届高三上学期第二次月考化学试题云南省昆明市寻甸县民族中学2019-2020学年高二下学期第一次月考化学试题山西省临猗县临晋中学2020-2021学年高二9月月考化学试题江西省南昌市第十中学2020-2021学年高二上学期第一次月考化学试题人教版(2019)高二选择性必修第一册 第一章 化学反应的热效应 第一节 反应热1山东省济南市山东师范大学附属中学2020-2021学年高二上学期10月学业质量检测化学试题(已下线)【南昌新东方】7. 南昌十中 徐钢 刘惠文.山东省莱州市第一中学2020-2021学年高二上学期10月月考化学试题人教版(2019)高二化学选择性必修1第一章 化学反应的热效应 过模拟 2年模拟精编精练安徽省广德县实验中学2020-2021学年高二上学期10月月考化学试题河南省郑州市第106中学2020-2021学年高二上学期9月月考化学(理)试题甘肃省天水市武山县三校2020-2021学年高二上学期期中联考化学试题 河南省长垣市第十中学2020-2021学年高二上学期第二次月考化学试题广西玉林市普通中学2020-2021学年高二下学期月考化学试题江苏省盐城市阜宁中学2017-2018学年高二上学期期中考试化学(选修)试题选择性必修1(SJ)专题1第一单元专项拓展训练1 利用盖斯定律书写热化学方程式及反应焓变的相关计算山东省滕州市第五中学2021-2022学年高二上学期第一次单元测试化学试题山东省德州市夏津第一中学2021-2022学年高二上学期第一次月考化学试卷(已下线)专题18 化学反应与能量(限时精练)-2022年高三毕业班化学常考点归纳与变式演练黑龙江省大庆市东风中学2021-2022学年高三上学期10月质量检测化学试题黑龙江省哈尔滨市德强高中2021-2022学年高二上学期期中考试化学试题第一节 反应热 第2课时 热化学方程式 燃烧热甘肃省兰州市西固区三校2021-2022学年高二上学期期中联考化学(理科)试题安徽省滁州市定远县育才学校2021-2022学年高二上学期期末考试(实验班)化学试题山东省德州市陵城区祥龙高级中学2022-2023学年高二上学期9月月考化学试题安徽省芜湖市无为襄安中学2022-2023高二上学期第一次月考化学试题黑龙江省哈尔滨市第三中学2022-2023学年高二上学期第二次验收化学试题天津市第二中学2022-2023学年高二上学期第一次月考化学试题河北省石家庄市第二十一中学2022-2023学年高二上学期十月月考化学试题陕西宝鸡市眉县槐芽中学2022-2023学年高二上学期期中考试化学试题北京市顺义牛栏山第一中学2022-2023学年高二上学期10月月考化学试题贵州省贵阳市花溪第六中学2021-2022学年高二上学期月考化学试题吉林省长春市实验中学2022-2023学年高二上学期期末考试化学试题湖南省长沙市芙蓉高级中学2022-2023学年高二上学期期中考试化学试题江苏省南京师范大学附属扬子中学、江浦高级中学两校2022-2023学年高一下学期联合调研化学试题广东省东莞市众美中学2022-2023学年高三上学期10月月考化学试题安徽省安庆二中2022-2023学年高一下学期5月月考化学试题辽宁省辽东南协作校2023-2024学年高二上学期10月月考化学试题宁夏回族自治区石嘴山市第三中学2023-2024学年高二9月月考化学试题黑龙江省齐齐哈尔市普高联谊校2023-2024学年高三上学期11月月考化学试题广东省深圳市南山为明学校2023-2024学年高二上学期期中考试化学试题(已下线)化学反应的热效应
名校
解题方法
10 . 在25 oC,101 kPa下,0.2 mol C2H2完全燃烧生成CO2和H2O(l)时放出259.92 kJ热量。表示上述反应的热化学方程式正确的是
| A.2C2H2(g)+5O2(g) = 4CO2(g)+2H2O(g) ∆H=+259.92 kJ/mol |
| B.2C2H2(g)+5O2(g) = 4CO2(g)+2H2O(l) ∆H=-259.92 kJ/mol |
| C.2C2H2(g)+5O2(g) = 4CO2(g)+2H2O(l) ∆H=+2599.2 kJ/mol |
| D.2C2H2(g)+5O2(g) = 4CO2(g)+2H2O(l) ∆H=-2599.2 kJ/mol |
您最近一年使用:0次
2023-05-16更新
|
569次组卷
|
3卷引用:四川省宜宾市第四中学校2023-2024学年高二上学期开学考试化学试题



