名校
解题方法
1 . CCUS是一种二氧化碳的捕获、利用与封存的技术,这种技术可将CO2资源化,产生经济效益。请回答下列问题:
(1)利用废气中的二氧化碳为原料可以制取甲醇。一定条件下,在恒容密闭容器中发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g)。
CH3OH(g)+H2O(g)。
①已知:H2(g)、CH3OH(1)的燃烧热(△H)分别为-285.8kJ·mol-1和-726.5kJ ·mol-1
CH3OH(l)= CH3OH(g)△H=+35.2kJ·mol-1
H2O(l)=H2O(g)△H=+44kJ·mol-1。
则CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H=
CH3OH(g)+H2O(g)△H=_____ kJ·mol-1。有利于提高H2平衡转化率的条件是_______ (填选项字母)。
A高温低压B低温高压C高温高压D低温低压
②某温度下,向体积为2L的容器中充入6molH2、4molCO2,发生反应CO2(g)+3H2(g) CH3OH(g)+H2O(g),达到平衡时H2的转化率为50%,其平衡常数为
CH3OH(g)+H2O(g),达到平衡时H2的转化率为50%,其平衡常数为____ (保留两位有效数字)。
③起始条件(T1℃、2L密闭容器)如下表所示:

达到平衡时,该反应的平衡常数K(I)____ K(II)(填“>”“<”或“=”,下同)。平衡时CH3OH的浓度:c(I)______ c(II)。
(2)CO2可用来合成低碳烯烃:2CO2(g)+6H2(g)→CH2=CH2(g)+4H2O(g)△H= -127.8 kJ·mol-1。0.1MPa下,按n(CO2):n(H2)=1:3的投料比充入体积固定的密闭容器中,发生上述反应,不同温度(T)下平衡时的四种气态物质的质量分数(φ)如图所示:
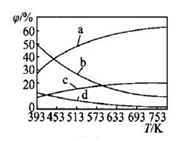
①曲线b、c表示的物质分别为_________________ (填化学式)。
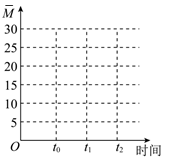
②保持温度不变,在体积为VL的恒容容器中以n(CO2):n(H2)=2:3的投料比加入反应物,t0时达到化学平衡。t1时将容器体积瞬间扩大至2VL并保持不变,t2时重新达到平衡。请在图中画出容器内混合气体的平均相对分子质量M随时间的变化图象_________
(3)工业上,还可以利用太阳能以CO2为原料制取C,使得二氧化碳资源化,其原理如下图所示:
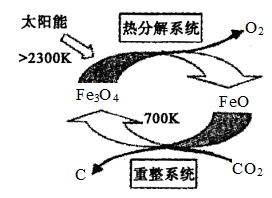
整个过程中____ (填“Fe3O4”或“FeO”)是反应的催化剂。重整系统中每生成1mol Fe3O4,转移电子的物质的量为____ 。
(1)利用废气中的二氧化碳为原料可以制取甲醇。一定条件下,在恒容密闭容器中发生反应:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)。
CH3OH(g)+H2O(g)。①已知:H2(g)、CH3OH(1)的燃烧热(△H)分别为-285.8kJ·mol-1和-726.5kJ ·mol-1
CH3OH(l)= CH3OH(g)△H=+35.2kJ·mol-1
H2O(l)=H2O(g)△H=+44kJ·mol-1。
则CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)△H=
CH3OH(g)+H2O(g)△H=A高温低压B低温高压C高温高压D低温低压
②某温度下,向体积为2L的容器中充入6molH2、4molCO2,发生反应CO2(g)+3H2(g)
 CH3OH(g)+H2O(g),达到平衡时H2的转化率为50%,其平衡常数为
CH3OH(g)+H2O(g),达到平衡时H2的转化率为50%,其平衡常数为③起始条件(T1℃、2L密闭容器)如下表所示:

达到平衡时,该反应的平衡常数K(I)
(2)CO2可用来合成低碳烯烃:2CO2(g)+6H2(g)→CH2=CH2(g)+4H2O(g)△H= -127.8 kJ·mol-1。0.1MPa下,按n(CO2):n(H2)=1:3的投料比充入体积固定的密闭容器中,发生上述反应,不同温度(T)下平衡时的四种气态物质的质量分数(φ)如图所示:

①曲线b、c表示的物质分别为
②保持温度不变,在体积为VL的恒容容器中以n(CO2):n(H2)=2:3的投料比加入反应物,t0时达到化学平衡。t1时将容器体积瞬间扩大至2VL并保持不变,t2时重新达到平衡。请在图中画出容器内混合气体的平均相对分子质量M随时间的变化图象

(3)工业上,还可以利用太阳能以CO2为原料制取C,使得二氧化碳资源化,其原理如下图所示:

整个过程中
您最近一年使用:0次
2 . 为有效控制雾霾,各地积极采取措施改善大气质量,研究并有效控制空气中的氮氧化物、碳氧化物含量显得尤为重要。
(1)一定条件下,将2moLNO与2molO2置于恒容密闭容器中发生反应2NO(g)+O2(g)⇌2NO2(g),下列各项能说明反应达到平衡状态的是_____________ ;
a.体系压强保持不变
b.混合气体颜色保持不变
c.NO和O2的物质的量之比保持不变
d.每消耗1molO2同时生成2molNO2
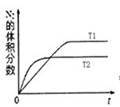
(2)汽车内燃机工作时会引起N2和O2的反应:N2+O2═2NO,是导致汽车尾气中含有NO的原因之一;在T1、T2温度下,一定量的NO发生分解反应时N2的体积分数随时间变化如图所示,根据图象判断反应N2(g)+O2(g)═2NO(g)的△H__________ 0(填>或<)。
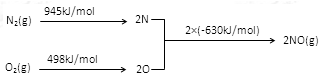
(3)NOx是汽车尾气中的主要污染物之一。汽车发动机工作时会引起N2和O2反应,其能量变化如图所示,写出该反应的热化学方程式_____________________ ;
(1)一定条件下,将2moLNO与2molO2置于恒容密闭容器中发生反应2NO(g)+O2(g)⇌2NO2(g),下列各项能说明反应达到平衡状态的是
a.体系压强保持不变
b.混合气体颜色保持不变
c.NO和O2的物质的量之比保持不变
d.每消耗1molO2同时生成2molNO2
(2)汽车内燃机工作时会引起N2和O2的反应:N2+O2═2NO,是导致汽车尾气中含有NO的原因之一;在T1、T2温度下,一定量的NO发生分解反应时N2的体积分数随时间变化如图所示,根据图象判断反应N2(g)+O2(g)═2NO(g)的△H

(3)NOx是汽车尾气中的主要污染物之一。汽车发动机工作时会引起N2和O2反应,其能量变化如图所示,写出该反应的热化学方程式

您最近一年使用:0次



