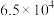1 . CO2和CH4合成CH3COOH对实现“碳中和”目标具有重要意义。回答下列问题:
(1)25℃时,CH4和CH3COOH的燃烧热分别为890.3kJ·mol-1和873.7kJ·mol-1,写出CO2和CH4合成CH3COOH(l)的热化学方程式___________ 。
(2)在硫酸酸化的ZrO2催化剂表面发生反应时,涉及多个基元反应,反应经历pathA,pathB两个路径,其能量变化如下图所示。吸附在催化剂表面的物种用*标注,TS1、TS2、TS3表示过渡态。___________ (填“放出热量”或“吸收热量”)。
②上述基元反应pathA路径中,速率最慢的一步的反应方程式为___________ 。
③pathA和pathB路径相比,___________ 更容易进行。
(3)已知 能自发进行,
能自发进行,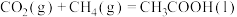
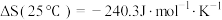 ,下列说法正确的是___________。
,下列说法正确的是___________。
(4)以CuO-ZrO2作催化剂,CO2、CH4投料比为1:1,300℃反应,平衡时CH4转化率为12%,CH3COOH选择性为95%,则CH3COOH的平衡产率为___________ 。(选择性指转化为目标产物的某反应物的质量与发生反应的该反应物的质量之比)
(5)立方ZrO2的晶胞如图,晶胞参数为apm,O2-和Zr4+间的最小距离为___________ pm,晶体密度为___________ g·cm-3。(列出计算式,阿伏加德罗常数的值用 表示)
表示)
(1)25℃时,CH4和CH3COOH的燃烧热分别为890.3kJ·mol-1和873.7kJ·mol-1,写出CO2和CH4合成CH3COOH(l)的热化学方程式
(2)在硫酸酸化的ZrO2催化剂表面发生反应时,涉及多个基元反应,反应经历pathA,pathB两个路径,其能量变化如下图所示。吸附在催化剂表面的物种用*标注,TS1、TS2、TS3表示过渡态。
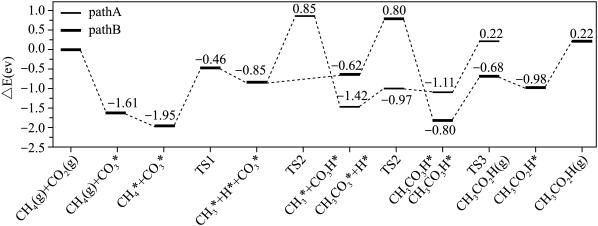
②上述基元反应pathA路径中,速率最慢的一步的反应方程式为
③pathA和pathB路径相比,
(3)已知
 能自发进行,
能自发进行,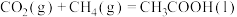
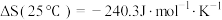 ,下列说法正确的是___________。
,下列说法正确的是___________。| A.25℃时,该反应能自发进行 |
| B.降低温度能提高CH4的平衡转化率 |
C. ,反应达平衡状态 ,反应达平衡状态 |
| D.温度越高反应速率越快 |
(4)以CuO-ZrO2作催化剂,CO2、CH4投料比为1:1,300℃反应,平衡时CH4转化率为12%,CH3COOH选择性为95%,则CH3COOH的平衡产率为
(5)立方ZrO2的晶胞如图,晶胞参数为apm,O2-和Zr4+间的最小距离为
 表示)
表示)
您最近半年使用:0次
2024-04-21更新
|
140次组卷
|
2卷引用:山西省平遥中学2023-2024学年高三二模考试化学试题
解题方法
2 . 我国化学家研究的一种新型光催化剂(碳纳米点/氮化碳)可以利用太阳光高效实现分解水,其原理如图所示,下列说法不正确的是

| A.碳纳米纳米点和氮化碳均为新型无机非金属材料 |
| B.若反应Ⅱ是放热反应,则反应Ⅰ一定是吸热反应 |
| C.反应Ⅰ和反应Ⅱ均存在O-H键的断裂 |
D.总反应为H2O2  H2+O2 H2+O2 |
您最近半年使用:0次
解题方法
3 . 2SO2(g)+O2(g)  2SO3(g) ΔH 的反应机理如下:
2SO3(g) ΔH 的反应机理如下:
反应I:V2O5(s)+SO2(g) V2O4(s)+SO3(g) ΔH1=+24 kJ·mol-1
V2O4(s)+SO3(g) ΔH1=+24 kJ·mol-1
反应II:2V2O4(s)+O2(g) 2V2O5(s) ΔH2=-246 kJ·mol-1
2V2O5(s) ΔH2=-246 kJ·mol-1
反应中的能量变化如图,下列说法不正确的是

 2SO3(g) ΔH 的反应机理如下:
2SO3(g) ΔH 的反应机理如下:反应I:V2O5(s)+SO2(g)
 V2O4(s)+SO3(g) ΔH1=+24 kJ·mol-1
V2O4(s)+SO3(g) ΔH1=+24 kJ·mol-1反应II:2V2O4(s)+O2(g)
 2V2O5(s) ΔH2=-246 kJ·mol-1
2V2O5(s) ΔH2=-246 kJ·mol-1反应中的能量变化如图,下列说法不正确的是

| A.ΔH=-198kJ·mol-1 | B.反应速率由反应I决定 |
| C.反应II的平衡常数K=c-1(O2) | D.通入过量空气,可提高SO2的平衡转化率 |
您最近半年使用:0次
名校
解题方法
4 . 2022年中国航天在诸多领域实现重大突破。空间站一种处理 的重要方法是对
的重要方法是对 进行收集和再生处理,重新生成可供人体呼吸的氧气。部分技术路线可分为:
进行收集和再生处理,重新生成可供人体呼吸的氧气。部分技术路线可分为:_______ 。
(2)Sabatier反应
已知:H2(g)、CH4(g)的燃烧热分别为285.8kJ•mol-1、890.3kJ•mol-1,H2O(l)=H2O(g) ΔH = +44kJ•mol-1。
①则反应Ⅰ:CO2(g) +4H2(g) CH4(g) +2H2O(g) 的ΔH =
CH4(g) +2H2O(g) 的ΔH =_____ kJ•mol-1。
②科学家研究Sabatier反应,部分历程如图所示,吸附在催化剂表面上的物种用“·”标注,Ts表示过渡态。下列说法中错误的是_______ 。
B.该转化反应的速率取决于Ts1的能垒
C.·HOCO转化为·CO和·OH的反应ΔH<0
D.催化剂能降低反应的活化能,提高反应物的平衡转化率
③空间站的反应器内,通常采用反应器前段加热,后段冷却的方法以提高CO2的转化效率,原因是_______ 。
④在CO2催化加氢制甲烷过程中存在竞争性的反应Ⅱ:CO2(g)+ H2(g) CO(g)+ H2O(g),一定温度下,向10L恒容密闭容器中充入1mol CO2和1mol H2,发生反应Ⅰ和反应Ⅱ,5min末达到平衡时测得CO2的转化率为50%,CH4与CO的分压之比为1∶4,H2O(g)的分压为p0.则0~5min内,平均反应速率v(H2)=
CO(g)+ H2O(g),一定温度下,向10L恒容密闭容器中充入1mol CO2和1mol H2,发生反应Ⅰ和反应Ⅱ,5min末达到平衡时测得CO2的转化率为50%,CH4与CO的分压之比为1∶4,H2O(g)的分压为p0.则0~5min内,平均反应速率v(H2)= ______ mol•L-1•min-1;反应Ⅱ的平衡常数Kp=______ (Kp是用分压表示的平衡常数,用各组分的分压代替浓度)。
 的重要方法是对
的重要方法是对 进行收集和再生处理,重新生成可供人体呼吸的氧气。部分技术路线可分为:
进行收集和再生处理,重新生成可供人体呼吸的氧气。部分技术路线可分为: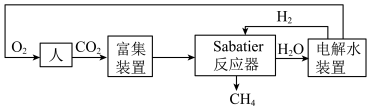
(2)Sabatier反应
已知:H2(g)、CH4(g)的燃烧热分别为285.8kJ•mol-1、890.3kJ•mol-1,H2O(l)=H2O(g) ΔH = +44kJ•mol-1。
①则反应Ⅰ:CO2(g) +4H2(g)
 CH4(g) +2H2O(g) 的ΔH =
CH4(g) +2H2O(g) 的ΔH =②科学家研究Sabatier反应,部分历程如图所示,吸附在催化剂表面上的物种用“·”标注,Ts表示过渡态。下列说法中错误的是

B.该转化反应的速率取决于Ts1的能垒
C.·HOCO转化为·CO和·OH的反应ΔH<0
D.催化剂能降低反应的活化能,提高反应物的平衡转化率
③空间站的反应器内,通常采用反应器前段加热,后段冷却的方法以提高CO2的转化效率,原因是
④在CO2催化加氢制甲烷过程中存在竞争性的反应Ⅱ:CO2(g)+ H2(g)
 CO(g)+ H2O(g),一定温度下,向10L恒容密闭容器中充入1mol CO2和1mol H2,发生反应Ⅰ和反应Ⅱ,5min末达到平衡时测得CO2的转化率为50%,CH4与CO的分压之比为1∶4,H2O(g)的分压为p0.则0~5min内,平均反应速率v(H2)=
CO(g)+ H2O(g),一定温度下,向10L恒容密闭容器中充入1mol CO2和1mol H2,发生反应Ⅰ和反应Ⅱ,5min末达到平衡时测得CO2的转化率为50%,CH4与CO的分压之比为1∶4,H2O(g)的分压为p0.则0~5min内,平均反应速率v(H2)=
您最近半年使用:0次
2024-01-22更新
|
33次组卷
|
2卷引用:山西省晋中市介休市第十中学2022-2023学年高二上学期期末考试化学试卷
名校
解题方法
5 . 灰锡(以粉末状存在)和白锡是锡的两种同素异形体。下列说法正确的是
已知:①
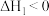
②
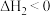
③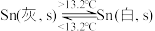
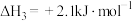
已知:①

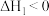
②

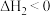
③
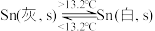
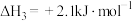
A.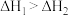 |
| B.锡在常温下以灰锡状态存在 |
| C.灰锡转化为白锡的反应是放热反应 |
D.锡制器皿长期处在低于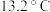 的环境中,会自行毁坏 的环境中,会自行毁坏 |
您最近半年使用:0次
2023-12-18更新
|
71次组卷
|
88卷引用:山西省晋中市平遥县第二中学2019-2020学年高二10月月考化学试题
山西省晋中市平遥县第二中学2019-2020学年高二10月月考化学试题(已下线)2010~2011学年辽宁省瓦房店市高级中学高一下学期期末考试(已下线)2011-2012学年湖北武汉部分重点中学高一下学期期末考试化学题(已下线)2011-2012天津南开中学高二第一学期期中考试理科化学试卷(已下线)2011-2012学年安徽省舒城晓天中学高二下学期质量测试2化学试卷(已下线)2013-2014黑龙江省哈六中学高一下学期期中考试化学试卷(已下线)2014-2015学年广东东莞市第七中学高二上学期第一次月考化学试卷2015-2016学年山西太原五中高二上第一周考理科化学试卷2015-2016学年山东寿光中学高二上10月月考化学试卷2015-2016学年黑龙江哈尔滨附属中学高二上期中化学试卷2016-2017学年河北冀州中学高二上第一次月考化学试卷云南省姚安县第一中学2017-2018学年高二10月月考化学试题江西省南康中学2017-2018学年高二上学期第一次月考化学试题浙江省嘉兴市第一中学2017-2018学年高二上学期期中考试化学试题云南省峨山彝族自治县第一中学2017-2018学年高二上学期11月考试化学试题高中化学人教版 选修四 第一章 化学反应与能量 第三节 化学反应热的计算 化学反应热的计算第一课时(盖斯定律)(已下线)黄金30题系列 高二化学(选修4) 小题好拿分【提升版】【全国百强校】黑龙江省牡丹江市第一高级中学2017-2018学年高一下学期期末考试化学试题【全国校级联考】浙江省金华市十校2017-2018学年高二下学期期末联考化学试题湖南辰溪博雅实验学校2018-2019学年高二8月月考化学试题浙江省宁波市北仑中学2018-2019学年高二上学期期初返校考试化学试题云南省曲靖市会泽县一中2018-2019学年高二上学期第一次半月考化学试题安徽省芜湖市顶峰美术学校2018-2019学年高二上学期第一次月考化学试题陕西省西安市远东第一中学2018-2019学年高二上学期10月月考化学试题吉林省白城市通榆县第一中学2019-2020学年高二上学期第一次月考化学试题福建2020届高三化学总复习专题训练——选修四化学反应原理测试福建省泉州第十六中学2019-2020学年高二10月份月考化学试题湖南省长沙市第一中学2019-2020学年高二上学期第一次月考化学试题四川省乐山市2019-2020学年高二上学期期末教学质量检测化学试题海南省海口市海南中学2020届高三下学期第七次月考化学试题海南省海南中学2020届高三下学期第七次月考化学试题(已下线)1.1.3 反应焓变的计算 练习——【高中新教材同步备课】鲁科版高中化学选择性必修1(已下线)第01章 化学反应的热效应(B卷能力提高篇)-2020-2021学年高二化学选择性必修1同步单元AB卷(新教材人教版)吉林省辽源市田家炳高级中学校2020-2021学年高二上学期第一次月考化学试题陕西省汉中市洋县中学2020-2021学年高二上学期第一次月考化学试题广东省汕头市澄海中学2020-2021学年高二上学期期中考试化学(选考)试题江西省赣州市南康区南康中学2020-2021学年高二上学期第三次大考化学试题河北省张家口市宣化第一中学2020-2021学年高二上学期1月月考化学试题河北省石家庄市第二十三中学2020-2021学年高一第二学期5月月考化学试题云南省通海县一中2020-2021学年高二下学期期中考试化学试题吉林省长春市十一高中2020-2021学年高一下学期第三学程考试化学试题(已下线)第一节 化学反应与能量变化 (第2课时 热化学方程式 中和热的测定)(备作业)-【上好课】2021-2022学年高二化学同步备课系列(人教版选修4)(已下线)1.1.2 热化学方程式-2021-2022学年高二化学课后培优练(人教版选修4)(已下线)1.1.2 热化学方程式 燃烧热-2021-2022学年高二化学课后培优练(人教版2019选择性必修1)安徽省合肥新城高升学校2021-2022学年高二上学期第一次月考化学试题江西省九江一中2020-2021学年高二上学期月考化学试题河北省藁城新冀明中学2021-2022学年高二上学期10月月考化学试题内蒙古赤峰市第二中学2021-2022学年高二上学期第一次月考化学试题广东省珠海市第二中学2021-2022学年高二上学期期中考试化学试题河北省衡水市第十四中学(西校区)2021-2022学年高二上学期二调考试化学试题江西省六校2021-2022学年高二上学期期末联考化学试题四川省遂宁市射洪中学校2021—2022学年高二上学期第三次(12月)月考化学试题宁夏银川市第二中学2021-2022学年高二下学期第一次月考化学试题河北省石家庄市第二中学2021-2022学年高一下学期期中考试化学试题内蒙古包头市第四中学2021-2022学年高二上学期期中考试化学试题河南省豫西顶级名校2021-2022学年高二下学期4月联考化学试题第二节 反应热的计算 第1课时 盖斯定律(已下线)第04讲 第一章《化学反应的热效应》单元测试(培优提升)-【帮课堂】2022-2023学年高二化学同步精品讲义(人教2019选择性必修1)(已下线)1.2 反应热的计算-同步学习必备知识江西省丰城市第九中学2021-2022学年高二上学期期中考试(日新班)化学试题江西省金溪县第一中学2022-2023年度高二上学期第一次月考化学试题河南省通许县一中2022—2023年高二上学期第一次月考化学试题安徽省芜湖市无为襄安中学2022-2023高二上学期第一次月考化学试题陕西省安康市2022-2023学年高二上学期11月期中化学试题宁夏回族自治区银川一中2022-2023学年高二上学期期中考试化学试题浙江省金华市江南中学等两校2022-2023学年高二上学期12月阶段测试化学试题河南省南乐县第一高级中学2021-2022学年高二上学期9月半月考化学试题广东仲元中学2021-2022学年高二上学期开学检测 化学试题广东省广州大学附属中学2022-2023学年高二上学期期中考试化学试题福建省平潭翰英中学2021-2022学年高二上学期第一次月考(选考)化学试题安徽省马鞍山市第二十二中学2022-2023学年高二上学期阶段检测化学试题内蒙古自治区包头市第九中学2022-2023学年高二上学期期末考试化学试题广东省广州市第八十六中学2022-2023学年高二上学期期中考试化学试题广东华侨中学2022-2023学年高二上学期期中考试化学试题安徽省安庆二中2022-2023学年高一下学期5月月考化学试题作业(三) 反应热的计算作业(三) 反应焓变的计算河南省开封市祥符高级中学2023-2024学年高二上学期第一次月考化学试题黑龙江省佳木斯市第一中学2023-2024学年高二上学期10月月考化学试题宁夏回族自治区石嘴山市第三中学2023-2024学年高二9月月考化学试题河南省焦作市博爱县第一中学2023-2024学年高二上学期10月月考化学试题广东省广州市越秀区第七中学2023-2024学年高二上学期10月月考化学试题广东省佛山市顺德区罗定邦中学2023-2024学年高二上学期期中考试化学试题广东省深圳市罗湖外语学校2023-2024学年高二上学期期中考试化学试题湖南省常德市汉寿县第一中学2023-2024学年高三下学期开学化学试题山西省朔州市怀仁市第九中学高中部2023-2024学年高二上学期11月期中化学试题云南省腾冲市第八中学2022-2023学年高二下学期第三次月考化学试题黑龙江省方正县高楞高级中学校2023-2024学年高二上学期期中化学试题
9-10高一下·江西·期中
6 . 已知一定条件下,有下列反应(相同质量的金刚石、石墨完全反应):
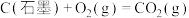
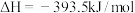
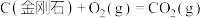
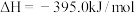
据此判断,下列说法正确的是
| A.由石墨制备金刚石是吸热反应,等质量时,石墨的能量比金刚石的低 |
| B.由石墨制备金刚石是吸热反应,等质量时,石墨的能量比金刚石的高 |
| C.由石墨制备金刚石是放热反应,等质量时,石墨的能量比金刚石的低 |
| D.由石墨制备金刚石是放热反应,等质量时,石墨的能量比金刚石的高 |
您最近半年使用:0次
2023-10-26更新
|
112次组卷
|
34卷引用:2011-2012年山西省平遥中学高二上学期期中考试化学(理)试卷
(已下线)2011-2012年山西省平遥中学高二上学期期中考试化学(理)试卷山西省晋中市和诚中学2019-2020学年高一4月月考化学试题(已下线)09~10年江西四校高一下学期期中联考化学卷(已下线)2010年甘肃省康县一中高二第二学期期末考试化学试题(已下线)2011-2012年陕西宁强天津中学高二下学期期中考试化学试卷(已下线)2012年人教版高中化学必修二2.1 化学能与热能练习卷(已下线)2012-2013学年福建省东山县第二中学高二第一次月考化学试卷(已下线)2012-2013学年昆明三中、滇池中学(滇中)高二下期中考试化学卷(已下线)2012-2013学年河北省石家庄市第一中学高一下学期期中考试化学试卷(已下线)2013届河北省石家庄市第二实验中学高二上学期期中考试文科化学试卷(已下线)2013-2014山西省广灵县第一中学第二学期期末考试高一化学试卷(已下线)2014-2015学年北京市第六十六中学高二上第一次质量检测化学试卷2014-2015浙江省杭州市西湖高级中学高一下学期5月月考化学试卷2015-2016学年湖南省岳阳县第一中学高二上学期第一次月考化学试卷2015-2016学年浙江省台州市书生中学高二上学期第一次月考化学试卷2015-2016学年安徽省阜阳市太和八中高二上学期期末理化学试卷2015-2016学年福建省漳州市东山二中高二上第一次月考化学试卷黑龙江省大庆市第十中学2016-2017学年高一下学期期末考试化学试题河北省景县中学2017-2018学年高二开学摸底考试化学试题福建省惠安惠南中学2017-2018学年高二10月月考(理)化学试题甘肃省甘谷县第一中学2018-2019学年高二上学期第一次月考子材班化学试题福建省东山县第二中学2018-2019学年高二上学期第一次(10月)月考化学试题山西省应县第一中学校2018-2019学年高一下学期期中考试化学试题福建省长泰县第一中学2020届高三上学期期中考试化学试题云南省楚雄市楚雄实验中学2018—2019学年高二上学期9月月考化学试题安徽省阜阳市2019-2020学年高一下学期开学考化学试题江西省赣州市赣县第三中学2020-2021学年高二上学期9月入学考试化学试题(重点班)天津市静海区大邱庄中学2020-2021学年高二上学期第一次月考化学试题宁夏吴忠市吴忠中学2021-2022学年高二上学期月考化学试题陕西省宜君县高级中学2021-2022学年高二上学期第一次月考化学(理)试题陕西省西安市第八十九中学2022-2023学年高二上学期期末测试化学试题天津市第四十七中学2023-2024学年高二上学期10月月考化学试题天津市第四十七中学2023-2024学年高二上学期第一次月考化学试题云南省保山市腾冲市第八中学2020-2021学年高一下学期期中考试化学试题
解题方法
7 . 1-丁烯是仅次于乙烯和丙烯的重要石油化工基本原料,可以利用正丁烷催化脱氢制备,催化脱氢又分为无氧催化脱氢和有氧催化脱氢。实际化工生产中需对反应条件(催化剂、温度等)进行探究,以获取最佳效益。
已知:I.温度过高会引发正丁烷裂解生成低碳烃类的副反应。
II.产物收率=生成某产物的原料量/投入的原料量×100%。
(1)利用正丁烷无氧催化脱氢制备1-丁烯反应原理如下:
CH3CH2CH2CH3 H2C=CHCH2CH3+H2 ΔH
H2C=CHCH2CH3+H2 ΔH
已知CH3 CH2CH2CH3、CH2 =CHCH2CH3、H2的燃烧热分别为2 878 kJ/mol、2 720 kJ/mol、286 kJ/mol,计算ΔH=___________ 。
(2)无氧催化脱氢用Pt系催化剂时,正丁烷单位时间转化率和1-丁烯选择性如表所示。
①仅从1-丁烯选择性的角度考虑,应选择的催化剂为___________ (填催化剂序号,下同)。
②工业上,从1-丁烯单位时间收率的角度考虑,应选择的最佳催化剂为___________ 。
(3)其他条件相同,30 min时测得正丁烷转化率、1-丁烯收率随温度的变化关系如图所示。
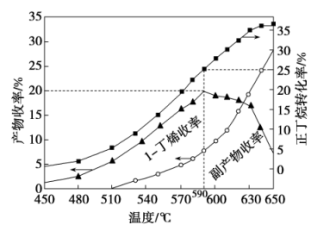
温度高于590 ℃时1-丁烯收率降低的原因是_________________ 。
(4)有氧催化脱氢通常选择O2或CO2为氧化剂,VOx-MgO为催化剂,反应原理如下:
2CH3CH2CH2CH3+O2 2CH2 =CHCH2CH3 +2H2O i
2CH2 =CHCH2CH3 +2H2O i
CH3 CH2CH2CH3+CO2 H2C=CHCH2CH3+H2O+CO ii
H2C=CHCH2CH3+H2O+CO ii
一定温度下,在体积为10 L的恒容密闭容器中,加入10 mol CH3CH2CH2CH3、7 mol O2、3 mol CO2进行反应i和ii.测得初始压强为20kPa,经过10h,反应达到平衡,此时压强变成25kPa,其中O2的体积分数为16%。回答下列问题:
①v(O2)=___________ kPa/h (用O2分压表示速率)。
②该温度下,反应ii的平衡常数Kp=___________ kPa。
③O2为氧化剂时,1-丁烯的选择性明显低于CO2为氧化剂时的选择性,分析可能原因:______________ 。
已知:I.温度过高会引发正丁烷裂解生成低碳烃类的副反应。
II.产物收率=生成某产物的原料量/投入的原料量×100%。
(1)利用正丁烷无氧催化脱氢制备1-丁烯反应原理如下:
CH3CH2CH2CH3
 H2C=CHCH2CH3+H2 ΔH
H2C=CHCH2CH3+H2 ΔH已知CH3 CH2CH2CH3、CH2 =CHCH2CH3、H2的燃烧热分别为2 878 kJ/mol、2 720 kJ/mol、286 kJ/mol,计算ΔH=
(2)无氧催化脱氢用Pt系催化剂时,正丁烷单位时间转化率和1-丁烯选择性如表所示。
| 催化剂 | 单位时间转化率/% | 1-丁烯选择性/% |
| 催化剂1:PtSn/γ-Al2O3 | 23.0 | 92.0 |
| 催化剂2:PtSnSr0.2/γ-Al2O3 | 38.5 | 88.1 |
| 催化剂3:PtSn(0.3%)/MgAl2O4 | 27.0 | 98.9 |
②工业上,从1-丁烯单位时间收率的角度考虑,应选择的最佳催化剂为
(3)其他条件相同,30 min时测得正丁烷转化率、1-丁烯收率随温度的变化关系如图所示。

温度高于590 ℃时1-丁烯收率降低的原因是
(4)有氧催化脱氢通常选择O2或CO2为氧化剂,VOx-MgO为催化剂,反应原理如下:
2CH3CH2CH2CH3+O2
 2CH2 =CHCH2CH3 +2H2O i
2CH2 =CHCH2CH3 +2H2O iCH3 CH2CH2CH3+CO2
 H2C=CHCH2CH3+H2O+CO ii
H2C=CHCH2CH3+H2O+CO ii一定温度下,在体积为10 L的恒容密闭容器中,加入10 mol CH3CH2CH2CH3、7 mol O2、3 mol CO2进行反应i和ii.测得初始压强为20kPa,经过10h,反应达到平衡,此时压强变成25kPa,其中O2的体积分数为16%。回答下列问题:
①v(O2)=
②该温度下,反应ii的平衡常数Kp=
③O2为氧化剂时,1-丁烯的选择性明显低于CO2为氧化剂时的选择性,分析可能原因:
您最近半年使用:0次
名校
解题方法
8 . 乙二醇是一种重要的化工原料,可用于生产聚酯纤维、防冻剂、增塑剂等。由合成气直接法制乙二醇的主要反应如下:
反应Ⅰ
反应Ⅱ
(1)已知298K、101kPa下, ,
, ,则
,则
_______  。
。
(2)在恒压密闭容器中充入合成气 ,仅考虑发生反应Ⅰ,维持10%转化率,所需反应条件(温度、压强)如表:
,仅考虑发生反应Ⅰ,维持10%转化率,所需反应条件(温度、压强)如表:
则
____________ (填“>”或“<”)0,随着温度升高所需压强增大的原因是_____________________ 。
(3)在2L刚性容器中充入合成气 ,总压
,总压 ,温度473K,催化剂
,温度473K,催化剂 (含
(含 )下进行反应。
)下进行反应。
①测得 和
和 的时空收率分别为
的时空收率分别为 和
和 (时空收率是指催化剂中单位质量Rh在单位时间内所获得的产物量),则用
(时空收率是指催化剂中单位质量Rh在单位时间内所获得的产物量),则用 表示的反应速率为
表示的反应速率为_____________  。
。
②平衡时,若 和
和 体积分数相等,
体积分数相等, 的分压为
的分压为 ,则
,则 的选择性为
的选择性为_______ ,反应Ⅰ的平衡常数
___________ (用含x的式子表示)。(已知: 的选择性
的选择性 ;分压=总压×物质的量分数。)
;分压=总压×物质的量分数。)
(4)合成气直接法制乙二醇的反应Ⅰ、反应Ⅱ的反应历程(部分)如图1,一定条件下CO分压对选择性影响如图2所示。
 图2
图2
结合图1,图2,从速率角度解释CO分压增大 选择性升高的原因
选择性升高的原因_________________ 。
反应Ⅰ

反应Ⅱ

(1)已知298K、101kPa下,
 ,
, ,则
,则
 。
。(2)在恒压密闭容器中充入合成气
 ,仅考虑发生反应Ⅰ,维持10%转化率,所需反应条件(温度、压强)如表:
,仅考虑发生反应Ⅰ,维持10%转化率,所需反应条件(温度、压强)如表:温度T/K | 298.15 | 300 | 354.7 | 400 |
压强P/kPa | 5.73 | 6.38 | 49.27 | 260.99 |
反应Ⅰ平衡常数K |
|
| 1 |
|

(3)在2L刚性容器中充入合成气
 ,总压
,总压 ,温度473K,催化剂
,温度473K,催化剂 (含
(含 )下进行反应。
)下进行反应。①测得
 和
和 的时空收率分别为
的时空收率分别为 和
和 (时空收率是指催化剂中单位质量Rh在单位时间内所获得的产物量),则用
(时空收率是指催化剂中单位质量Rh在单位时间内所获得的产物量),则用 表示的反应速率为
表示的反应速率为 。
。②平衡时,若
 和
和 体积分数相等,
体积分数相等, 的分压为
的分压为 ,则
,则 的选择性为
的选择性为
 的选择性
的选择性 ;分压=总压×物质的量分数。)
;分压=总压×物质的量分数。)(4)合成气直接法制乙二醇的反应Ⅰ、反应Ⅱ的反应历程(部分)如图1,一定条件下CO分压对选择性影响如图2所示。

 图2
图2结合图1,图2,从速率角度解释CO分压增大
 选择性升高的原因
选择性升高的原因
您最近半年使用:0次
2023-05-05更新
|
397次组卷
|
3卷引用:2024届山西省介休市定阳高级中学高三下学期模拟考试(九)理综试题-高中化学
解题方法
9 . 尿素 是人体和动物的代谢产物之一,氨基甲酸铵(
是人体和动物的代谢产物之一,氨基甲酸铵(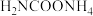 )是以氨气和二氧化碳为原料合成尿素的中间产物。
)是以氨气和二氧化碳为原料合成尿素的中间产物。
(1)合成尿素的总反应可表示为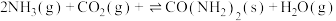 ,该反应一般认为通过如下步骤来实现:
,该反应一般认为通过如下步骤来实现:
I.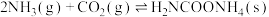
 kJ/mol
kJ/mol
II.
 kJ/mol
kJ/mol
①总反应的
______ 。
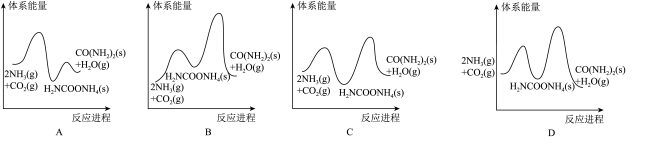
②若反应II为慢反应,下列示意图中能体现上述反应能量变化的是______ 。
③能定性表示反应I的 随温度变化的曲线是
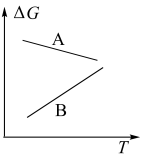
随温度变化的曲线是______ (填“A”或“B”)。
④尿素中C原子的杂化方式为________________________ 。
(2)尿素废水使水体富营养化,通过电解法处理后可排放,其装置示意图如图所示。
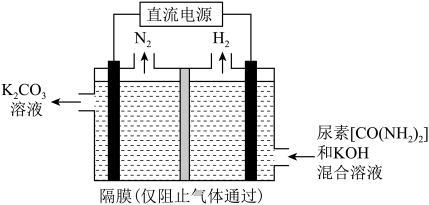
①该装置阳极的电极反应式为__________________ 。
 是人体和动物的代谢产物之一,氨基甲酸铵(
是人体和动物的代谢产物之一,氨基甲酸铵(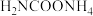 )是以氨气和二氧化碳为原料合成尿素的中间产物。
)是以氨气和二氧化碳为原料合成尿素的中间产物。(1)合成尿素的总反应可表示为
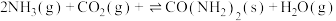 ,该反应一般认为通过如下步骤来实现:
,该反应一般认为通过如下步骤来实现:I.
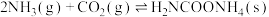
 kJ/mol
kJ/molII.

 kJ/mol
kJ/mol①总反应的

②若反应II为慢反应,下列示意图中能体现上述反应能量变化的是

③能定性表示反应I的
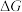 随温度变化的曲线是
随温度变化的曲线是
④尿素中C原子的杂化方式为
(2)尿素废水使水体富营养化,通过电解法处理后可排放,其装置示意图如图所示。

①该装置阳极的电极反应式为
您最近半年使用:0次
10 . Ⅰ.在氮及其化合物的化工生产中,对有关反应的反应原理进行研究有着重要意义。
(1)一定温度下,将2 mol N2和6 mol H2置于1 L的恒容密闭容器中发生如下反应: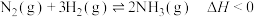 ,测得不同温度、不同时间段内合成氨反应中N2的转化率,数据如下:
,测得不同温度、不同时间段内合成氨反应中N2的转化率,数据如下:
①上表中T1_______ T2(用含“>”“<”“=”的关系式表示),其中a、b、80%三者的大小关系是_______ (用含“>”“<”“=”的关系式表示)。
②研究表明,合成氨的速率与相关物质的浓度关系为 ,k为速率常数。以下说法正确的是
,k为速率常数。以下说法正确的是_______ (填字母序号)。
A.升高温度,k值增大
B.T2℃时若容器内混合气体平均相对分子质量为12且保持不变,则反应达到平衡状态
C.一定温度下将原容器中的NH3及时分离出来可使v减小
D.合成氨达到平衡后,增大c(N2)可使正反应速率在达到新平衡的过程中始终增大
③已知某温度下该反应达平衡时各物质均为1 mol,容器容积为1 L,保持温度和压强不变,又充入3 mol N2后,平衡_______ (填“向左移动”“向右移动”或“不移动”)。
Ⅱ.甲醚(CH3OCH)是重要的化工原料,可用CO和H2制得,总反应的热化学方程式如为 。该过程可分为以下两步反应完成:
。该过程可分为以下两步反应完成:
甲醇合成反应:_______。
甲醇脱水反应: 。
。
(2)起始时向容器中投入2 mol CO和4 mol H2,测得某时刻上述总反应中放出的热量为51.5 kJ,此时CO的转化率为_______ 。
(3)请写出甲醇合成反应的热化学方程式:_______ 。
(4)在一定条件下,将CO和H2按体积比1:2充入恒容密闭容器中,反应生成CH3OCH3(g)和H2O(g)。下列能说明该反应达到平衡状态的是_______ (填字母)。
a.混合气体的总物质的量保持不变
b.混合气体的密度保持不变
c.CH3OCH3(g)和H2O(g)的物质的量之比保持不变
d.每生成1 mol CH3OCH3(g),同时生成2 mol CO
(1)一定温度下,将2 mol N2和6 mol H2置于1 L的恒容密闭容器中发生如下反应:
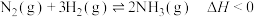 ,测得不同温度、不同时间段内合成氨反应中N2的转化率,数据如下:
,测得不同温度、不同时间段内合成氨反应中N2的转化率,数据如下:| 1小时 | 2小时 | 3小时 | 4小时 | |
| T1 | 30% | 50% | 80% | 80% |
| T2 | 35% | 60% | a | b |
①上表中T1
②研究表明,合成氨的速率与相关物质的浓度关系为
 ,k为速率常数。以下说法正确的是
,k为速率常数。以下说法正确的是A.升高温度,k值增大
B.T2℃时若容器内混合气体平均相对分子质量为12且保持不变,则反应达到平衡状态
C.一定温度下将原容器中的NH3及时分离出来可使v减小
D.合成氨达到平衡后,增大c(N2)可使正反应速率在达到新平衡的过程中始终增大
③已知某温度下该反应达平衡时各物质均为1 mol,容器容积为1 L,保持温度和压强不变,又充入3 mol N2后,平衡
Ⅱ.甲醚(CH3OCH)是重要的化工原料,可用CO和H2制得,总反应的热化学方程式如为
 。该过程可分为以下两步反应完成:
。该过程可分为以下两步反应完成:甲醇合成反应:_______。
甲醇脱水反应:
 。
。(2)起始时向容器中投入2 mol CO和4 mol H2,测得某时刻上述总反应中放出的热量为51.5 kJ,此时CO的转化率为
(3)请写出甲醇合成反应的热化学方程式:
(4)在一定条件下,将CO和H2按体积比1:2充入恒容密闭容器中,反应生成CH3OCH3(g)和H2O(g)。下列能说明该反应达到平衡状态的是
a.混合气体的总物质的量保持不变
b.混合气体的密度保持不变
c.CH3OCH3(g)和H2O(g)的物质的量之比保持不变
d.每生成1 mol CH3OCH3(g),同时生成2 mol CO
您最近半年使用:0次