解题方法
1 . 利用反应A可将释放的CO2转化为具有工业利用价值的产品。
反应A:
已知:
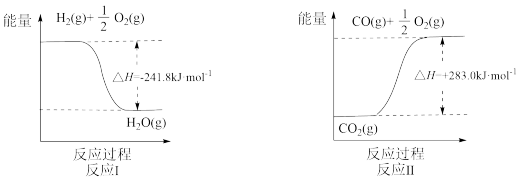
(1)反应Ⅱ是___________ 反应(填“吸热”或“放热”),其原因是___________ 。
(2)反应A的热化学方程式是___________ 。
反应A:

已知:

(1)反应Ⅱ是
(2)反应A的热化学方程式是
您最近一年使用:0次
2022-01-28更新
|
98次组卷
|
2卷引用:山西省晋中市平遥县第二中学2021-2022学年高二上学期12月考试化学试题
名校
解题方法
2 .  是一种廉价的碳资源,其综合利用具有重要意义,用
是一种廉价的碳资源,其综合利用具有重要意义,用 与
与 为原料合成尿素
为原料合成尿素 是固定和利用
是固定和利用 的成功范例。
的成功范例。
已知:①
②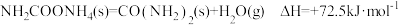
③
则:反应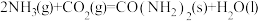 的
的 为
为
 是一种廉价的碳资源,其综合利用具有重要意义,用
是一种廉价的碳资源,其综合利用具有重要意义,用 与
与 为原料合成尿素
为原料合成尿素 是固定和利用
是固定和利用 的成功范例。
的成功范例。已知:①

②
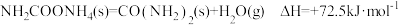
③

则:反应
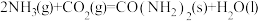 的
的 为
为A. | B.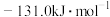 |
C.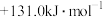 | D. |
您最近一年使用:0次
2021-03-18更新
|
1381次组卷
|
7卷引用:山西省(晋中市)2020-2021学年高二上学期期末调研化学试题
名校
3 . 设NA为阿伏加德罗常数的值。已知反应:
(1)CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=akJ/mol
(2)CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=bkJ/mol。其他数据如表:
下列说法正确的是( )
(1)CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=akJ/mol
(2)CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=bkJ/mol。其他数据如表:
| 化学键 | C‒O | O‒O | C‒H | O‒H |
| 键能/(kJ•mol‒1) | 798 | x | 413 | 463 |
A.上表中x=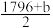 |
| B.H2O(g)=H2O(l)的△S<0,△H=(a-b)kJ/mol |
| C.当有4NA个C‒H键断裂时,反应放出的热量一定为akJ |
| D.a>b且甲烷燃烧热为bkJ/mol |
您最近一年使用:0次
2020-12-08更新
|
275次组卷
|
9卷引用:山西省晋中市祁县中学校2019-2020学年高二上学期10月月考化学试题
山西省晋中市祁县中学校2019-2020学年高二上学期10月月考化学试题江西省上饶市横峰中学2020-2021学年高二上学期开学考试化学(统招班)试题山西省运城市景胜中学2020-2021学年高二10月月考化学试题山东省德州市10校联考2020—2021学年高二上学期期中模块检测(人教版) 化学试题(已下线)【南昌新东方】9.2020年11月江西南昌三中高三上学期期中化学河北省沧州市黄骅中学2020-2021学年高二上学期第三次月考化学试题江苏省泰州中学2021-2022学年高二上学期期中检测化学试题甘肃省张掖市高台县第一中学2022-2023学年高三上学期10月月考化学试题甘肃省庆阳市等3地2022-2023学年高二上学期12月期中化学试题
名校
解题方法
4 . 下列说法或表示方法不正确的是
| A.盖斯定律实质上是能量守恒定律的体现 |
| B.在稀溶液中:H+(aq)+OH-(aq)=H2O(l) △H = -57.3kJ/mol,若将含0.5mol H2SO4的浓硫酸与含1mol NaOH的溶液混合,放出的热量大于57.3kJ |
| C.由一定条件下石墨合成金刚石吸热,可知石墨比金刚石稳定 |
| D.在101kPa时,2g H2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O(l) △H = –285.8kJ/mol |
您最近一年使用:0次
2020-11-12更新
|
324次组卷
|
17卷引用:山西省晋中市平遥县第二中学2018-2019学年高二上学期期中考试化学试题
山西省晋中市平遥县第二中学2018-2019学年高二上学期期中考试化学试题2014-2015学年山东省微山一中高二下学期期末考试化学试卷安徽省池州市第一中学2019-2020学年高二上学期期中考试化学试题山西大学附属中学2019-2020学年高二10月月考化学试题云南省曲靖市罗平县第三中学2020届高二下学期开学考试化学试题四川省成都外国语学校2020-2021学年高二10月月考化学试题河北省唐山市河北唐山外国语学校2020-2021学年高二上学期期中考试(理科)化学试题河北省尚义县第一中学2020-2021学年高二上学期期中考试化学试题湖北省巴东县第二高级中学2020-2021学年高二上学期期中考试化学试题(已下线)小题必刷24 盖斯定律及反应热计算——2021年高考化学一轮复习小题必刷(通用版)甘肃省天水市第六中学2019-2020学年高二上学期期末考试化学试题(普通班)河北省唐山市遵化市2021-2022学年高二上学期期中考试化学试题内蒙古自治区第二地质中学2020-2021学年高二下学期第二次阶段检测化学试题陕西省宝鸡市金台区2021-2022学年高二上学期期末考试化学(理)试题吉林省辽源市等2地高中友好学校2022-2023学年高二上学期期末联考化学试题安徽省安庆市怀宁县第二中学2022-2023学年高二上学期期末考试化学试题吉林省辽源、通化等2市2022-2023学年高二上学期1月期末考试化学试题
5 . 某反应在催化剂的作用下按以下两步进行:第一步为X+Y=Z;第二步为Y+Z=M+N+X。此反应的总的化学方程式是___ ,反应的催化剂是___ 。
您最近一年使用:0次



