解题方法
1 . 我国化学家研究的一种新型光催化剂(碳纳米点/氮化碳)可以利用太阳光高效实现分解水,其原理如图所示,下列说法不正确的是
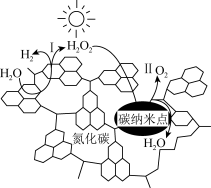

| A.碳纳米纳米点和氮化碳均为新型无机非金属材料 |
| B.若反应Ⅱ是放热反应,则反应Ⅰ一定是吸热反应 |
| C.反应Ⅰ和反应Ⅱ均存在O-H键的断裂 |
D.总反应为H2O2  H2+O2 H2+O2 |
您最近一年使用:0次
解题方法
2 . 2SO2(g)+O2(g)  2SO3(g) ΔH 的反应机理如下:
2SO3(g) ΔH 的反应机理如下:
反应I:V2O5(s)+SO2(g) V2O4(s)+SO3(g) ΔH1=+24 kJ·mol-1
V2O4(s)+SO3(g) ΔH1=+24 kJ·mol-1
反应II:2V2O4(s)+O2(g) 2V2O5(s) ΔH2=-246 kJ·mol-1
2V2O5(s) ΔH2=-246 kJ·mol-1
反应中的能量变化如图,下列说法不正确的是

 2SO3(g) ΔH 的反应机理如下:
2SO3(g) ΔH 的反应机理如下:反应I:V2O5(s)+SO2(g)
 V2O4(s)+SO3(g) ΔH1=+24 kJ·mol-1
V2O4(s)+SO3(g) ΔH1=+24 kJ·mol-1反应II:2V2O4(s)+O2(g)
 2V2O5(s) ΔH2=-246 kJ·mol-1
2V2O5(s) ΔH2=-246 kJ·mol-1反应中的能量变化如图,下列说法不正确的是

| A.ΔH=-198kJ·mol-1 | B.反应速率由反应I决定 |
| C.反应II的平衡常数K=c-1(O2) | D.通入过量空气,可提高SO2的平衡转化率 |
您最近一年使用:0次
名校
解题方法
3 . 2022年中国航天在诸多领域实现重大突破。空间站一种处理 的重要方法是对
的重要方法是对 进行收集和再生处理,重新生成可供人体呼吸的氧气。部分技术路线可分为:
进行收集和再生处理,重新生成可供人体呼吸的氧气。部分技术路线可分为:_______ 。
(2)Sabatier反应
已知:H2(g)、CH4(g)的燃烧热分别为285.8kJ•mol-1、890.3kJ•mol-1,H2O(l)=H2O(g) ΔH = +44kJ•mol-1。
①则反应Ⅰ:CO2(g) +4H2(g) CH4(g) +2H2O(g) 的ΔH =
CH4(g) +2H2O(g) 的ΔH =_____ kJ•mol-1。
②科学家研究Sabatier反应,部分历程如图所示,吸附在催化剂表面上的物种用“·”标注,Ts表示过渡态。下列说法中错误的是_______ 。
B.该转化反应的速率取决于Ts1的能垒
C.·HOCO转化为·CO和·OH的反应ΔH<0
D.催化剂能降低反应的活化能,提高反应物的平衡转化率
③空间站的反应器内,通常采用反应器前段加热,后段冷却的方法以提高CO2的转化效率,原因是_______ 。
④在CO2催化加氢制甲烷过程中存在竞争性的反应Ⅱ:CO2(g)+ H2(g) CO(g)+ H2O(g),一定温度下,向10L恒容密闭容器中充入1mol CO2和1mol H2,发生反应Ⅰ和反应Ⅱ,5min末达到平衡时测得CO2的转化率为50%,CH4与CO的分压之比为1∶4,H2O(g)的分压为p0.则0~5min内,平均反应速率v(H2)=
CO(g)+ H2O(g),一定温度下,向10L恒容密闭容器中充入1mol CO2和1mol H2,发生反应Ⅰ和反应Ⅱ,5min末达到平衡时测得CO2的转化率为50%,CH4与CO的分压之比为1∶4,H2O(g)的分压为p0.则0~5min内,平均反应速率v(H2)= ______ mol•L-1•min-1;反应Ⅱ的平衡常数Kp=______ (Kp是用分压表示的平衡常数,用各组分的分压代替浓度)。
 的重要方法是对
的重要方法是对 进行收集和再生处理,重新生成可供人体呼吸的氧气。部分技术路线可分为:
进行收集和再生处理,重新生成可供人体呼吸的氧气。部分技术路线可分为: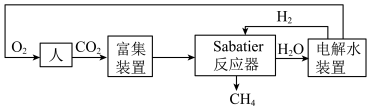
(2)Sabatier反应
已知:H2(g)、CH4(g)的燃烧热分别为285.8kJ•mol-1、890.3kJ•mol-1,H2O(l)=H2O(g) ΔH = +44kJ•mol-1。
①则反应Ⅰ:CO2(g) +4H2(g)
 CH4(g) +2H2O(g) 的ΔH =
CH4(g) +2H2O(g) 的ΔH =②科学家研究Sabatier反应,部分历程如图所示,吸附在催化剂表面上的物种用“·”标注,Ts表示过渡态。下列说法中错误的是

B.该转化反应的速率取决于Ts1的能垒
C.·HOCO转化为·CO和·OH的反应ΔH<0
D.催化剂能降低反应的活化能,提高反应物的平衡转化率
③空间站的反应器内,通常采用反应器前段加热,后段冷却的方法以提高CO2的转化效率,原因是
④在CO2催化加氢制甲烷过程中存在竞争性的反应Ⅱ:CO2(g)+ H2(g)
 CO(g)+ H2O(g),一定温度下,向10L恒容密闭容器中充入1mol CO2和1mol H2,发生反应Ⅰ和反应Ⅱ,5min末达到平衡时测得CO2的转化率为50%,CH4与CO的分压之比为1∶4,H2O(g)的分压为p0.则0~5min内,平均反应速率v(H2)=
CO(g)+ H2O(g),一定温度下,向10L恒容密闭容器中充入1mol CO2和1mol H2,发生反应Ⅰ和反应Ⅱ,5min末达到平衡时测得CO2的转化率为50%,CH4与CO的分压之比为1∶4,H2O(g)的分压为p0.则0~5min内,平均反应速率v(H2)=
您最近一年使用:0次
2024-01-22更新
|
41次组卷
|
2卷引用:山西省晋中市介休市第十中学2022-2023学年高二上学期期末考试化学试卷
4 . 2021年11月2日,第四届世界顶尖科学家碳大会——通往“双碳目标”的科技之路论坛在上海召开。我国科学家刘科提到了绿色甲醇技术,将CO2转化为甲醇是实现碳达峰、碳中和的一种非常重要的路径。回答下列问题:
(1)已知H2(g)和CH3OH(l)的燃烧热分别为285.8kJ·mol-1、726.5kJ·mol-1,则CO2与H2反应生成液态甲醇和液态水的热化学方程式为_____ 。
(2)最近科学家采用真空封管法制备磷化硼纳米颗粒,在发展非金属催化剂实现CO2电催化还原制备甲醇方向取得重要进展,反应历程如图所示:
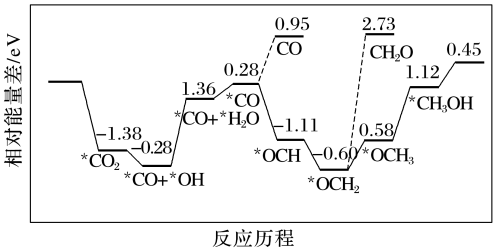
①反应容易得到的副产物有CO和CH2O,其中相对较少的副产物为_____ 。
②上述合成甲醇的反应速率较慢,要使反应速率加快,主要降低下列变化中_____ (填字母)的能量变化。
A.*CO+*OH→*CO+*H2O B.*CO+*H2O→*CO
C.*OCH2→*OCH3 D.*OCH3→*CH3OH
(3)一定条件下,在1L恒容密闭容器中充入1molCO2和3molH2发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),温度对CO2平衡转化率及催化剂的催化效率影响如图所示:
CH3OH(g)+H2O(g),温度对CO2平衡转化率及催化剂的催化效率影响如图所示:
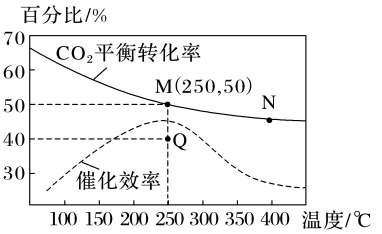
①下列说法能说明该反应达到化学平衡状态的是_____ (填字母)。
A.混合气体的密度不再变化
B.混合气体的平均相对分子质量不再变化
C.CO2、H2、CH3OH、H2O的物质的量之比为1∶3∶1∶1
D.H2O(g)和CO2(g)的生成速率之比为1∶1
②反应速率:v正(M)_____ (填“大于”“小于”“等于”或“无法判断”,下同)v逆(N),化学平衡常数:KM_____ KN。
③M点甲醇的体积分数为_____ ,该温度下,反应的平衡常数K=_____ 。
④已知:反应速率v=v正-v逆=k正c(CO2)·c3(H2)-k逆c(CH3OH)·c(H2O),k正、k逆分别为正、逆反应速率常数,则Q点时 =
=_____ (保留2位小数)。
(1)已知H2(g)和CH3OH(l)的燃烧热分别为285.8kJ·mol-1、726.5kJ·mol-1,则CO2与H2反应生成液态甲醇和液态水的热化学方程式为
(2)最近科学家采用真空封管法制备磷化硼纳米颗粒,在发展非金属催化剂实现CO2电催化还原制备甲醇方向取得重要进展,反应历程如图所示:

①反应容易得到的副产物有CO和CH2O,其中相对较少的副产物为
②上述合成甲醇的反应速率较慢,要使反应速率加快,主要降低下列变化中
A.*CO+*OH→*CO+*H2O B.*CO+*H2O→*CO
C.*OCH2→*OCH3 D.*OCH3→*CH3OH
(3)一定条件下,在1L恒容密闭容器中充入1molCO2和3molH2发生反应:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g),温度对CO2平衡转化率及催化剂的催化效率影响如图所示:
CH3OH(g)+H2O(g),温度对CO2平衡转化率及催化剂的催化效率影响如图所示:
①下列说法能说明该反应达到化学平衡状态的是
A.混合气体的密度不再变化
B.混合气体的平均相对分子质量不再变化
C.CO2、H2、CH3OH、H2O的物质的量之比为1∶3∶1∶1
D.H2O(g)和CO2(g)的生成速率之比为1∶1
②反应速率:v正(M)
③M点甲醇的体积分数为
④已知:反应速率v=v正-v逆=k正c(CO2)·c3(H2)-k逆c(CH3OH)·c(H2O),k正、k逆分别为正、逆反应速率常数,则Q点时
 =
=
您最近一年使用:0次
解题方法
5 . 我国提出争取在2030年前实现碳峰值,2060年实现碳中和,这对改善环境、实现绿色发展至关重要。以含碳物质为原料的“碳-化学”将处于化学产业的核心,成为科学家研究的重要课题。请回答下列问题:
(1)已知CO、H2、 的燃烧热分别为:
的燃烧热分别为: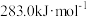 、
、 、
、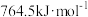 。则反应:
。则反应:
_______ 。
(2)在一容积可变的密闭容器中充入 和
和 ,发生反应
,发生反应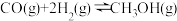 ,CO的平衡转化率(
,CO的平衡转化率( )与温度(T)、压强(p)的关系如图所示。
)与温度(T)、压强(p)的关系如图所示。
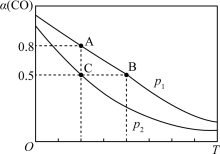
则压强
_______ (填“<”“=”或“>”) ;A、B、C三点的平衡常数
;A、B、C三点的平衡常数 、
、 、
、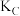 的大小关系为
的大小关系为_______ (用“<”“=”或“>”表示)。
(3) 经催化加氢可合成低碳烯烃:
经催化加氢可合成低碳烯烃: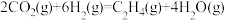 。在
。在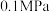 时,按
时,按 投料,如图所示为不同温度(T)下,平衡时四种气态物质的物质的量(n)关系。
投料,如图所示为不同温度(T)下,平衡时四种气态物质的物质的量(n)关系。
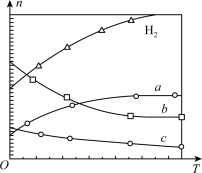
则:
①该反应的
_______ (填“>”或“<”)0。
②曲线c表示的物质为_______ 。
(4)在 、
、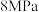 下,将
下,将 和
和 按物质的量之比1∶3通入一密闭容器中发生反应:
按物质的量之比1∶3通入一密闭容器中发生反应: ,达到平衡时,测得
,达到平衡时,测得 的平衡转化率为50%,则该反应条件下的平衡常数
的平衡转化率为50%,则该反应条件下的平衡常数
_______ 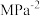 (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(1)已知CO、H2、
 的燃烧热分别为:
的燃烧热分别为: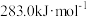 、
、 、
、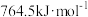 。则反应:
。则反应:
(2)在一容积可变的密闭容器中充入
 和
和 ,发生反应
,发生反应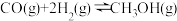 ,CO的平衡转化率(
,CO的平衡转化率( )与温度(T)、压强(p)的关系如图所示。
)与温度(T)、压强(p)的关系如图所示。
则压强

 ;A、B、C三点的平衡常数
;A、B、C三点的平衡常数 、
、 、
、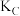 的大小关系为
的大小关系为(3)
 经催化加氢可合成低碳烯烃:
经催化加氢可合成低碳烯烃: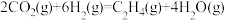 。在
。在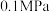 时,按
时,按 投料,如图所示为不同温度(T)下,平衡时四种气态物质的物质的量(n)关系。
投料,如图所示为不同温度(T)下,平衡时四种气态物质的物质的量(n)关系。
则:
①该反应的

②曲线c表示的物质为
(4)在
 、
、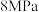 下,将
下,将 和
和 按物质的量之比1∶3通入一密闭容器中发生反应:
按物质的量之比1∶3通入一密闭容器中发生反应: ,达到平衡时,测得
,达到平衡时,测得 的平衡转化率为50%,则该反应条件下的平衡常数
的平衡转化率为50%,则该反应条件下的平衡常数
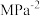 (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
您最近一年使用:0次
6 . 工业接触法制硫酸的关键工序是 的催化氧化:
的催化氧化: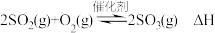 。回答下列问题:
。回答下列问题:
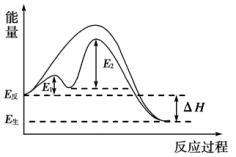
(1)当加入催化剂时,该反应机理为:
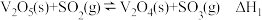
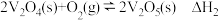
有关反应过程中的能量变化如图所示,下列说法错误的是_______ (填标号)
A. B.
B.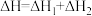
C. 是该反应的催化剂 D.加入催化剂后反应的活化能为
是该反应的催化剂 D.加入催化剂后反应的活化能为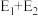
(2)一定条件下,将 和
和 混合置于
混合置于 密闭容器中发生反应:
密闭容器中发生反应: ,当反应从开始进行到
,当反应从开始进行到 时达到平衡状态,测得此时的压强是反应开始时的0.8倍。
时达到平衡状态,测得此时的压强是反应开始时的0.8倍。
① 内用
内用 表示的平均反应速率为
表示的平均反应速率为_______ 。
②达到平衡时 的转化率为
的转化率为_______ 。
③能说明该反应已达到平衡状态的是_______ (填标号)。
A.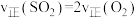 B.
B. 的生成速率等于
的生成速率等于 的生成速率
的生成速率
C.容器内压强保持不变 D.混合气体的平均相对分子质量不变
E.容器内密度保持不变 F.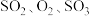 物质的量比为
物质的量比为
④该条件下的平衡常数K=_______ ;上述反应中,正反应速率为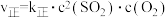 ,逆反应速率为
,逆反应速率为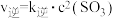 ,其中
,其中 为速率常数,则
为速率常数,则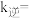
_______  。
。
 的催化氧化:
的催化氧化: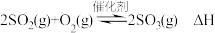 。回答下列问题:
。回答下列问题:(1)当加入催化剂时,该反应机理为:
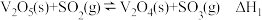
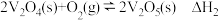
有关反应过程中的能量变化如图所示,下列说法错误的是

A.
 B.
B.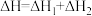
C.
 是该反应的催化剂 D.加入催化剂后反应的活化能为
是该反应的催化剂 D.加入催化剂后反应的活化能为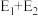
(2)一定条件下,将
 和
和 混合置于
混合置于 密闭容器中发生反应:
密闭容器中发生反应: ,当反应从开始进行到
,当反应从开始进行到 时达到平衡状态,测得此时的压强是反应开始时的0.8倍。
时达到平衡状态,测得此时的压强是反应开始时的0.8倍。①
 内用
内用 表示的平均反应速率为
表示的平均反应速率为②达到平衡时
 的转化率为
的转化率为③能说明该反应已达到平衡状态的是
A.
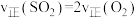 B.
B. 的生成速率等于
的生成速率等于 的生成速率
的生成速率C.容器内压强保持不变 D.混合气体的平均相对分子质量不变
E.容器内密度保持不变 F.
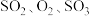 物质的量比为
物质的量比为
④该条件下的平衡常数K=
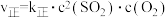 ,逆反应速率为
,逆反应速率为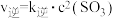 ,其中
,其中 为速率常数,则
为速率常数,则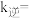
 。
。
您最近一年使用:0次
2021-03-18更新
|
146次组卷
|
2卷引用:山西省(晋中市)2020-2021学年高二上学期期末调研化学试题
名校
解题方法
7 .  是一种廉价的碳资源,其综合利用具有重要意义,用
是一种廉价的碳资源,其综合利用具有重要意义,用 与
与 为原料合成尿素
为原料合成尿素 是固定和利用
是固定和利用 的成功范例。
的成功范例。
已知:①
②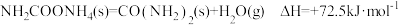
③
则:反应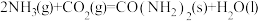 的
的 为
为
 是一种廉价的碳资源,其综合利用具有重要意义,用
是一种廉价的碳资源,其综合利用具有重要意义,用 与
与 为原料合成尿素
为原料合成尿素 是固定和利用
是固定和利用 的成功范例。
的成功范例。已知:①

②
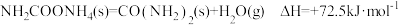
③

则:反应
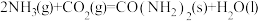 的
的 为
为A. | B.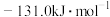 |
C.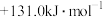 | D. |
您最近一年使用:0次
2021-03-18更新
|
1380次组卷
|
7卷引用:山西省(晋中市)2020-2021学年高二上学期期末调研化学试题



