2022年中国航天在诸多领域实现重大突破。空间站一种处理 的重要方法是对
的重要方法是对 进行收集和再生处理,重新生成可供人体呼吸的氧气。部分技术路线可分为:
进行收集和再生处理,重新生成可供人体呼吸的氧气。部分技术路线可分为:_______ 。
(2)Sabatier反应
已知:H2(g)、CH4(g)的燃烧热分别为285.8kJ•mol-1、890.3kJ•mol-1,H2O(l)=H2O(g) ΔH = +44kJ•mol-1。
①则反应Ⅰ:CO2(g) +4H2(g) CH4(g) +2H2O(g) 的ΔH =
CH4(g) +2H2O(g) 的ΔH =_____ kJ•mol-1。
②科学家研究Sabatier反应,部分历程如图所示,吸附在催化剂表面上的物种用“·”标注,Ts表示过渡态。下列说法中错误的是_______ 。
B.该转化反应的速率取决于Ts1的能垒
C.·HOCO转化为·CO和·OH的反应ΔH<0
D.催化剂能降低反应的活化能,提高反应物的平衡转化率
③空间站的反应器内,通常采用反应器前段加热,后段冷却的方法以提高CO2的转化效率,原因是_______ 。
④在CO2催化加氢制甲烷过程中存在竞争性的反应Ⅱ:CO2(g)+ H2(g) CO(g)+ H2O(g),一定温度下,向10L恒容密闭容器中充入1mol CO2和1mol H2,发生反应Ⅰ和反应Ⅱ,5min末达到平衡时测得CO2的转化率为50%,CH4与CO的分压之比为1∶4,H2O(g)的分压为p0.则0~5min内,平均反应速率v(H2)=
CO(g)+ H2O(g),一定温度下,向10L恒容密闭容器中充入1mol CO2和1mol H2,发生反应Ⅰ和反应Ⅱ,5min末达到平衡时测得CO2的转化率为50%,CH4与CO的分压之比为1∶4,H2O(g)的分压为p0.则0~5min内,平均反应速率v(H2)= ______ mol•L-1•min-1;反应Ⅱ的平衡常数Kp=______ (Kp是用分压表示的平衡常数,用各组分的分压代替浓度)。
 的重要方法是对
的重要方法是对 进行收集和再生处理,重新生成可供人体呼吸的氧气。部分技术路线可分为:
进行收集和再生处理,重新生成可供人体呼吸的氧气。部分技术路线可分为: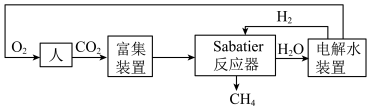
(2)Sabatier反应
已知:H2(g)、CH4(g)的燃烧热分别为285.8kJ•mol-1、890.3kJ•mol-1,H2O(l)=H2O(g) ΔH = +44kJ•mol-1。
①则反应Ⅰ:CO2(g) +4H2(g)
 CH4(g) +2H2O(g) 的ΔH =
CH4(g) +2H2O(g) 的ΔH =②科学家研究Sabatier反应,部分历程如图所示,吸附在催化剂表面上的物种用“·”标注,Ts表示过渡态。下列说法中错误的是

B.该转化反应的速率取决于Ts1的能垒
C.·HOCO转化为·CO和·OH的反应ΔH<0
D.催化剂能降低反应的活化能,提高反应物的平衡转化率
③空间站的反应器内,通常采用反应器前段加热,后段冷却的方法以提高CO2的转化效率,原因是
④在CO2催化加氢制甲烷过程中存在竞争性的反应Ⅱ:CO2(g)+ H2(g)
 CO(g)+ H2O(g),一定温度下,向10L恒容密闭容器中充入1mol CO2和1mol H2,发生反应Ⅰ和反应Ⅱ,5min末达到平衡时测得CO2的转化率为50%,CH4与CO的分压之比为1∶4,H2O(g)的分压为p0.则0~5min内,平均反应速率v(H2)=
CO(g)+ H2O(g),一定温度下,向10L恒容密闭容器中充入1mol CO2和1mol H2,发生反应Ⅰ和反应Ⅱ,5min末达到平衡时测得CO2的转化率为50%,CH4与CO的分压之比为1∶4,H2O(g)的分压为p0.则0~5min内,平均反应速率v(H2)=
更新时间:2024-01-22 21:13:48
|
相似题推荐
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐1】烯烃催化裂解是制备短链烯烃的重要途径。研究表明,1-丁烯[CH3CH2CH=CH2(g)]催化裂解时,发生两个平行竞争反应生成丙烯和乙烯,两反应的热化学方程式为:
①3CH3CH2CH=CH2(g)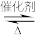 4CH3CH=CH2(g) △H=+579 kJ·mol-1
4CH3CH=CH2(g) △H=+579 kJ·mol-1
②CH3CH2CH=CH2(g)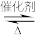 2CH2=CH2(g) △H=+283 kJ·mol-1
2CH2=CH2(g) △H=+283 kJ·mol-1
回答下列问题:
(1)若1-丁烯的燃烧热为2539 kJ·mol-1,则表示乙烯燃烧热的热化学方程式为____ ;1-丁烯转化为丙烯反应的化学平衡常数表达式为_____ 。
(2)有利于提高1-丁烯平衡转化率的措施有_______ 。
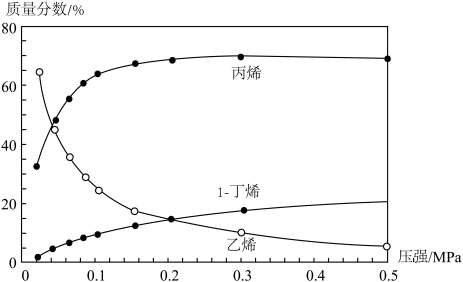
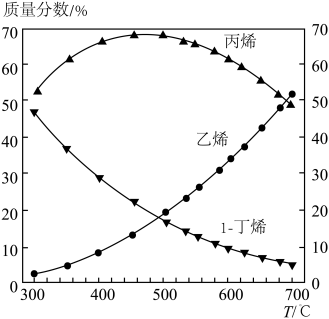
(3)550℃和0.02~0.5 MPa下,①②两个反应均建立平衡,测得平衡混合物里各组分的质量分数随压强变化的曲线如下图所示。由图可知,1-丁烯的质量分数随压强的增大而增大,主要原因是______ 。
(4)在1-丁烯裂解的实际生产中,为了提高产物中丙烯的含量,除了选择合适的温度和压强之外,还有一条关键措施是_____ 。0.1 MPa和300~700℃下,1-丁烯裂解产物中各组分比例变化的曲线如下图所示。由图可知,生产过程中提高丙烯质量分数的最佳温度为___ ℃,在该温度之前各温度对应的组成______ (填“一定是”、“可能是”或“一定不是”)平衡态,理由是____________ 。
①3CH3CH2CH=CH2(g)
 4CH3CH=CH2(g) △H=+579 kJ·mol-1
4CH3CH=CH2(g) △H=+579 kJ·mol-1②CH3CH2CH=CH2(g)
 2CH2=CH2(g) △H=+283 kJ·mol-1
2CH2=CH2(g) △H=+283 kJ·mol-1回答下列问题:
(1)若1-丁烯的燃烧热为2539 kJ·mol-1,则表示乙烯燃烧热的热化学方程式为
(2)有利于提高1-丁烯平衡转化率的措施有
(3)550℃和0.02~0.5 MPa下,①②两个反应均建立平衡,测得平衡混合物里各组分的质量分数随压强变化的曲线如下图所示。由图可知,1-丁烯的质量分数随压强的增大而增大,主要原因是

(4)在1-丁烯裂解的实际生产中,为了提高产物中丙烯的含量,除了选择合适的温度和压强之外,还有一条关键措施是

您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐2】在一定条件下,CO2可以合成一系列化工原料或燃料,在工农业生产中具有重大意义,根据以下合成过程,回答问题。
(1)目前工业上可用CO2生产甲醇燃料,反应的化学方程式为: CO2(g)+3H2(g) CH3OH(g)+H2O(g),△H。
CH3OH(g)+H2O(g),△H。
已知:
该反应△H=________ KJ/mol。
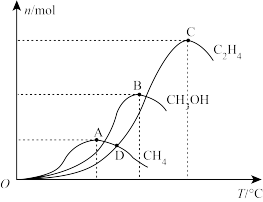
(2)研究证明。用二氧化碳催化加氢来合成低碳烯烃,起始时以0.1MPa,n(H2):n(CO2)=3:1的投料比充入反应器中,发生反应:2CO2(g)+6H2(g) C2H4(g)+4H2O(g)△H,不同温度下平衡时的四种气态物质的物质的量如图所示:
C2H4(g)+4H2O(g)△H,不同温度下平衡时的四种气态物质的物质的量如图所示:
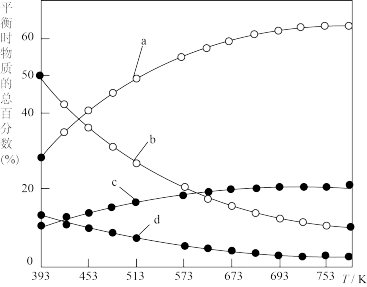
①对于气体反应,用某组分(B)的平衡压强(pB)代替物质的量浓度(cB)也可以表示平衡常数(记作KP),则该反应的KP=________ ;
②曲线a表示的物质为H2,理由是________ ;
③为提高CO2的平衡转化率,除改变温度外,还可采取的措施是________ (列举2项).
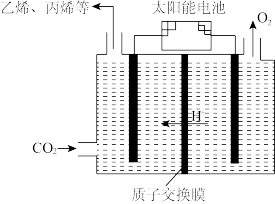
④在强酸性电解质水溶液中,以惰性电极电解CO2可得到多种燃料,其原理如图所示,电解时,生成乙烯的电极反应式________ 。
(3)工业上利用CO2和NH3反应来制取尿素,反应2NH3+CO2 CO(NH2)2+H2O,在合成塔中不同氮碳比a[n(NH3)/n(CO2)]和水碳比b[n(H2O)/n(CO2)]时二氧化碳转化率(x)如图:
CO(NH2)2+H2O,在合成塔中不同氮碳比a[n(NH3)/n(CO2)]和水碳比b[n(H2O)/n(CO2)]时二氧化碳转化率(x)如图:
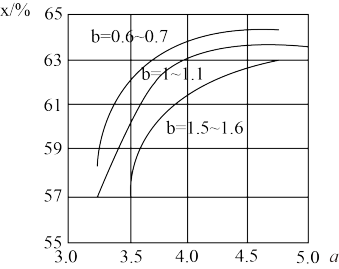
①b宜控制在________ (填序号)范围内
A. 0.6~0.7 B. 1~1.1 C. 1.5~1.61;
②a宜控制在4.0左右,理由是________ 。
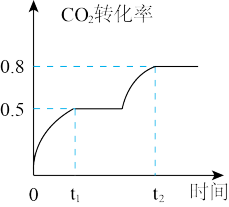
(4)工业上利用CO2和CH3OH反应制取碳酸二甲酯,反应:CO2(g)+2CH3OH(g) CH3OOCOOCH3(g)+H2O(g),在恒温、容积可变的密闭容器中加入1 molCO2, 2molCH3OH+CO2的转化率与反应时间关系如图所示,在反应过程中,若t1时容器体积为1000mL,则t2时容器体积V="
CH3OOCOOCH3(g)+H2O(g),在恒温、容积可变的密闭容器中加入1 molCO2, 2molCH3OH+CO2的转化率与反应时间关系如图所示,在反应过程中,若t1时容器体积为1000mL,则t2时容器体积V=" ________ " mL。
(1)目前工业上可用CO2生产甲醇燃料,反应的化学方程式为: CO2(g)+3H2(g)
 CH3OH(g)+H2O(g),△H。
CH3OH(g)+H2O(g),△H。已知:
| 共价键 | C=O | H—H | C—O | C—H | O—H |
| 键能(KJ·mol-1) | 750 | 436 | 358 | 413 | 463 |
(2)研究证明。用二氧化碳催化加氢来合成低碳烯烃,起始时以0.1MPa,n(H2):n(CO2)=3:1的投料比充入反应器中,发生反应:2CO2(g)+6H2(g)
 C2H4(g)+4H2O(g)△H,不同温度下平衡时的四种气态物质的物质的量如图所示:
C2H4(g)+4H2O(g)△H,不同温度下平衡时的四种气态物质的物质的量如图所示:
①对于气体反应,用某组分(B)的平衡压强(pB)代替物质的量浓度(cB)也可以表示平衡常数(记作KP),则该反应的KP=
②曲线a表示的物质为H2,理由是
③为提高CO2的平衡转化率,除改变温度外,还可采取的措施是
④在强酸性电解质水溶液中,以惰性电极电解CO2可得到多种燃料,其原理如图所示,电解时,生成乙烯的电极反应式

(3)工业上利用CO2和NH3反应来制取尿素,反应2NH3+CO2
 CO(NH2)2+H2O,在合成塔中不同氮碳比a[n(NH3)/n(CO2)]和水碳比b[n(H2O)/n(CO2)]时二氧化碳转化率(x)如图:
CO(NH2)2+H2O,在合成塔中不同氮碳比a[n(NH3)/n(CO2)]和水碳比b[n(H2O)/n(CO2)]时二氧化碳转化率(x)如图:
①b宜控制在
A. 0.6~0.7 B. 1~1.1 C. 1.5~1.61;
②a宜控制在4.0左右,理由是
(4)工业上利用CO2和CH3OH反应制取碳酸二甲酯,反应:CO2(g)+2CH3OH(g)
 CH3OOCOOCH3(g)+H2O(g),在恒温、容积可变的密闭容器中加入1 molCO2, 2molCH3OH+CO2的转化率与反应时间关系如图所示,在反应过程中,若t1时容器体积为1000mL,则t2时容器体积V="
CH3OOCOOCH3(g)+H2O(g),在恒温、容积可变的密闭容器中加入1 molCO2, 2molCH3OH+CO2的转化率与反应时间关系如图所示,在反应过程中,若t1时容器体积为1000mL,则t2时容器体积V=" 
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐3】碳排放问题是第26届联合国气候变化大会讨论的焦点。我国向国际社会承诺2030年“碳达峰”,2060年实现“碳中和”。为了实现这个目标,加强了对CO2转化的研究。下面是CO2转化为高附加值化学品的反应。相关反应的热化学方程式如下:
反应Ⅰ:CO2(g)+H2(g) H2O(g)+CO(g) △H1
H2O(g)+CO(g) △H1
反应Ⅱ:CO(g)+2H2(g) CH3OH(g) △H2=-90.0kJ·mol-1
CH3OH(g) △H2=-90.0kJ·mol-1
反应Ⅲ:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H3=-49.0kJ·mol-1
CH3OH(g)+H2O(g) △H3=-49.0kJ·mol-1
反应Ⅳ:CO2(g)+4H2(g) CH4(g)+2H2O(g) △H4=-165.0kJ·mol-1
CH4(g)+2H2O(g) △H4=-165.0kJ·mol-1
反应Ⅴ:2CO2g)+6H2(g) C2H4(g)+4H2O(g) △H5=-122.7kJ·mol-1
C2H4(g)+4H2O(g) △H5=-122.7kJ·mol-1
回答下列问题:
(1)反应Ⅲ一般认为通过反应Ⅰ、Ⅱ来实现,则反应Ⅰ的△H1=____ kJ·mol-1;已知:由实验测得反应Ⅰ的v正=k正c(CO2)·c(H2),v逆=k逆·c(H2O)·c(CO)(k正、k逆为速率常数,与温度、催化剂有关)。若平衡后升高温度,则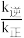 =
=____ (填“增大”、“不变”或“减小”)。
(2)在2L恒容密闭容器中充入总物质的量为8mol的CO2和H2发生反应Ⅲ,改变氢碳比 ,在不同温度下反应达到平衡状态,测得的实验数据如表:
,在不同温度下反应达到平衡状态,测得的实验数据如表:
①下列说法中正确的是____ (填英文字母)。
A.增大氢碳比,平衡正向移动,平衡常数增大
B.v(CH3OH)=v(CO2)时,反应达到平衡
C.当混合气体平均摩尔质量不变时,达到平衡
D.当混合气体密度不变时,达到平衡
②在700K、氢碳比为3.0的条件下,某时刻测得容器内CO2、H2、CH3OH、H2O的物质的量分别为2mol、2mol、1mol和1mol,则此时正反应速率和逆反应速率的关系是_____ (填英文字母)。
A.v(正)>v(逆) B.v(正)<v(逆) C.(正)=r(逆) D.无法判断
(3)CO2在一定条件下催化加氢生成CH3OH,主要发生三个竞争反应(即反应Ⅲ、Ⅳ、Ⅴ),为分析催化剂对反应的选择性,在1L恒容密闭容器中充入2.0molCO2和5.3molH2,测得反应进行相同时间后,有关物质的物质的量随温度变化如图所示:
①该催化剂在较低温度时主要选择反应____ (“Ⅲ”或“Ⅳ”或“Ⅴ”)。研究发现,若温度过高,三种含碳产物的物质的量会迅速降低,其主要原因可能是:____ 。
②在一定温度下达到平衡,此时测得容器中部分物质的含量为:n(CH4)=0.1mol,n(C2H4)=0.4mol,n(CH3OH)=0.5mol。则该温度下反应Ⅲ的平衡常数K(Ⅲ)=____ L2/mol2(保留两位小数)。
(4)常温下,用NaOH溶液作CO2捕捉剂不仅可以降低碳排放,而且可得到重要的化工产品Na2CO3。欲用1LNa2CO3溶液将2.33gBaSO4固体全都转化为BaCO3,则所用的Na2CO3溶液的物质的量浓度至少为____ mol/L(已知:常温下Ksp(BaSO4)=1×10-11,Ksp(BaCO3)=1×10-10。忽略溶液体积的变化,保留两位有效数字)。
(5)研究人员研究出一种方法,可实现水泥生产时CO2零排放,其基本原理如图所示。温度小于900℃时进行电解反应,碳酸钙先分解为CaO和CO2,电解质为熔融碳酸钠,阳极的电极反应式为2CO -4e-=2CO2↑+O2↑,则阴极的电极反应式为
-4e-=2CO2↑+O2↑,则阴极的电极反应式为____ 。

反应Ⅰ:CO2(g)+H2(g)
 H2O(g)+CO(g) △H1
H2O(g)+CO(g) △H1反应Ⅱ:CO(g)+2H2(g)
 CH3OH(g) △H2=-90.0kJ·mol-1
CH3OH(g) △H2=-90.0kJ·mol-1反应Ⅲ:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H3=-49.0kJ·mol-1
CH3OH(g)+H2O(g) △H3=-49.0kJ·mol-1反应Ⅳ:CO2(g)+4H2(g)
 CH4(g)+2H2O(g) △H4=-165.0kJ·mol-1
CH4(g)+2H2O(g) △H4=-165.0kJ·mol-1反应Ⅴ:2CO2g)+6H2(g)
 C2H4(g)+4H2O(g) △H5=-122.7kJ·mol-1
C2H4(g)+4H2O(g) △H5=-122.7kJ·mol-1回答下列问题:
(1)反应Ⅲ一般认为通过反应Ⅰ、Ⅱ来实现,则反应Ⅰ的△H1=
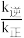 =
=(2)在2L恒容密闭容器中充入总物质的量为8mol的CO2和H2发生反应Ⅲ,改变氢碳比
 ,在不同温度下反应达到平衡状态,测得的实验数据如表:
,在不同温度下反应达到平衡状态,测得的实验数据如表:| 温度/K CO2转化率  | 500 | 600 | 700 | 800 |
| 1 | 45 | 33 | 20 | 12 |
| 2 | 60 | 43 | 28 | 15 |
| 3 | 83 | 62 | 40 | 22 |
A.增大氢碳比,平衡正向移动,平衡常数增大
B.v(CH3OH)=v(CO2)时,反应达到平衡
C.当混合气体平均摩尔质量不变时,达到平衡
D.当混合气体密度不变时,达到平衡
②在700K、氢碳比为3.0的条件下,某时刻测得容器内CO2、H2、CH3OH、H2O的物质的量分别为2mol、2mol、1mol和1mol,则此时正反应速率和逆反应速率的关系是
A.v(正)>v(逆) B.v(正)<v(逆) C.(正)=r(逆) D.无法判断
(3)CO2在一定条件下催化加氢生成CH3OH,主要发生三个竞争反应(即反应Ⅲ、Ⅳ、Ⅴ),为分析催化剂对反应的选择性,在1L恒容密闭容器中充入2.0molCO2和5.3molH2,测得反应进行相同时间后,有关物质的物质的量随温度变化如图所示:

①该催化剂在较低温度时主要选择反应
②在一定温度下达到平衡,此时测得容器中部分物质的含量为:n(CH4)=0.1mol,n(C2H4)=0.4mol,n(CH3OH)=0.5mol。则该温度下反应Ⅲ的平衡常数K(Ⅲ)=
(4)常温下,用NaOH溶液作CO2捕捉剂不仅可以降低碳排放,而且可得到重要的化工产品Na2CO3。欲用1LNa2CO3溶液将2.33gBaSO4固体全都转化为BaCO3,则所用的Na2CO3溶液的物质的量浓度至少为
(5)研究人员研究出一种方法,可实现水泥生产时CO2零排放,其基本原理如图所示。温度小于900℃时进行电解反应,碳酸钙先分解为CaO和CO2,电解质为熔融碳酸钠,阳极的电极反应式为2CO
 -4e-=2CO2↑+O2↑,则阴极的电极反应式为
-4e-=2CO2↑+O2↑,则阴极的电极反应式为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐1】氮和氮的化合物与人类关系密切。已知:
i.
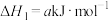
ii.
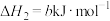
iii.

(1)

___________  (用含a、b、c的式子表示)。
(用含a、b、c的式子表示)。
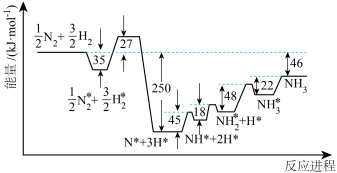
(2)T℃时,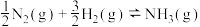
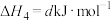 。各步反应的能量变化如图所示,其中吸附在催化剂表面上的物种用“*”标注。图中决速步骤的反应方程式为
。各步反应的能量变化如图所示,其中吸附在催化剂表面上的物种用“*”标注。图中决速步骤的反应方程式为___________ ;d=___________ 。
(3)某小组往一恒温恒压含有铁触媒的容器中充入1
 和3
和3
 ,模拟合成氨的反应,不同温度下达到平衡时混合物中氨气的体积分数与总压强(p)的关系如图。
,模拟合成氨的反应,不同温度下达到平衡时混合物中氨气的体积分数与总压强(p)的关系如图。
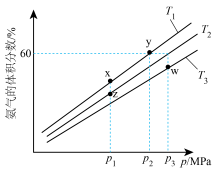
①图中温度 、
、 、
、 由大到小的顺序为
由大到小的顺序为___________ ,图中x、y、z、w四点中,化学反应速率最快的是___________ 点。
②y点时, 的平衡转化率为
的平衡转化率为___________ ;在温度 时,该反应的平衡常数
时,该反应的平衡常数
___________  (
( 为以分压表示的平衡常数,分压=总压×物质的量分数,用含
为以分压表示的平衡常数,分压=总压×物质的量分数,用含 的式子表示)。
的式子表示)。
③若在恒容条件下发生该反应,下列说法正确的是___________ (填标号)。
A.温度升高, 将增大
将增大
B.当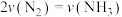 时,反应达到了平衡
时,反应达到了平衡
C.当 的体积分数不再改变时,反应达到了平衡
的体积分数不再改变时,反应达到了平衡
D.断裂1
 键的同时断裂6
键的同时断裂6
 键,说明反应达到了平衡
键,说明反应达到了平衡
(4)氨的催化氧化过程中同时发生的反应主要如下:
反应I.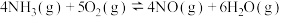
反应II.
测得相同时间内 、
、 的产率与温度的关系如图所示。
的产率与温度的关系如图所示。
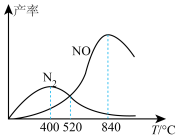
①反应II为___________ (填“放热”或“吸热”)反应。
②随着温度升高, 的产率先增大后减小的原因为
的产率先增大后减小的原因为___________ 。
i.

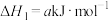
ii.

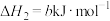
iii.


(1)


 (用含a、b、c的式子表示)。
(用含a、b、c的式子表示)。(2)T℃时,
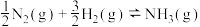
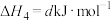 。各步反应的能量变化如图所示,其中吸附在催化剂表面上的物种用“*”标注。图中决速步骤的反应方程式为
。各步反应的能量变化如图所示,其中吸附在催化剂表面上的物种用“*”标注。图中决速步骤的反应方程式为
(3)某小组往一恒温恒压含有铁触媒的容器中充入1

 和3
和3
 ,模拟合成氨的反应,不同温度下达到平衡时混合物中氨气的体积分数与总压强(p)的关系如图。
,模拟合成氨的反应,不同温度下达到平衡时混合物中氨气的体积分数与总压强(p)的关系如图。
①图中温度
 、
、 、
、 由大到小的顺序为
由大到小的顺序为②y点时,
 的平衡转化率为
的平衡转化率为 时,该反应的平衡常数
时,该反应的平衡常数
 (
( 为以分压表示的平衡常数,分压=总压×物质的量分数,用含
为以分压表示的平衡常数,分压=总压×物质的量分数,用含 的式子表示)。
的式子表示)。③若在恒容条件下发生该反应,下列说法正确的是
A.温度升高,
 将增大
将增大B.当
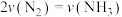 时,反应达到了平衡
时,反应达到了平衡C.当
 的体积分数不再改变时,反应达到了平衡
的体积分数不再改变时,反应达到了平衡D.断裂1

 键的同时断裂6
键的同时断裂6
 键,说明反应达到了平衡
键,说明反应达到了平衡(4)氨的催化氧化过程中同时发生的反应主要如下:
反应I.
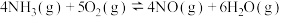
反应II.

测得相同时间内
 、
、 的产率与温度的关系如图所示。
的产率与温度的关系如图所示。
①反应II为
②随着温度升高,
 的产率先增大后减小的原因为
的产率先增大后减小的原因为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐2】(Ⅰ)铬及其化合物在催化、金属防腐等方面具有重要应用。 催化丙烷脱氢过程中,部分反应历程如图,
催化丙烷脱氢过程中,部分反应历程如图, 过程的焓变为
过程的焓变为___ (列式表示)。
(2)该反应
_______ 0(填“>”或“=”或“<”)。
(Ⅱ)2022年11月29日23时08分,我国在酒泉卫星发射中心使用长征二号F遥十五火箭,成功将神舟十五号载人飞船发射升空,是空间站建造阶段最后一次载人飞行任务。
(3)火箭发射时可以用肼( ,液态)作燃料,
,液态)作燃料, 作氧化剂,二者反应生成
作氧化剂,二者反应生成 和水蒸气。已知:①
和水蒸气。已知:①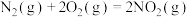
 kJ/mol②
kJ/mol②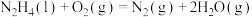
 kJ/mol请写出
kJ/mol请写出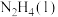 与
与 反应的热化学方程式
反应的热化学方程式_______ 。③
 ,
, 与
与 进行大小比较:
进行大小比较:
_______  (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
(4)二甲醚( )是一种新型能源,被誉为“21世纪的清洁燃料”。用CO和
)是一种新型能源,被誉为“21世纪的清洁燃料”。用CO和 合成二甲醚的反应为:
合成二甲醚的反应为:
 kJ/mol。
kJ/mol。
①改变下列“量”,一定会引起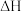 发生变化的是
发生变化的是_______ (填代号)。
a.化学计量数 b.反应物浓度 c.催化剂
②采用新型催化剂(主要成分是Cu-Mn的合金)制备二甲醚。催化剂中 对合成二甲醚的影响情况如下图所示。当
对合成二甲醚的影响情况如下图所示。当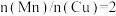 时,二甲醚的选择性(选择性
时,二甲醚的选择性(选择性 )为85.8%,此时二甲醚的产率为
)为85.8%,此时二甲醚的产率为_______ 。(保留3位有效数字)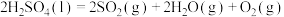
 kJ·mol
kJ·mol
反应III:
 kJ·mol
kJ·mol
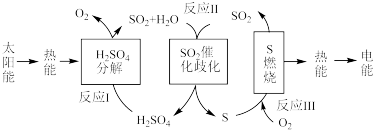
在反应Ⅱ中,若标准状况下有33.6 L 气体与水蒸气完全反应生成液态硫酸和固态硫单质,则放出的热量为
气体与水蒸气完全反应生成液态硫酸和固态硫单质,则放出的热量为______ kJ。
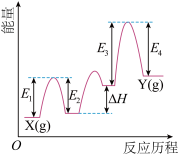
 催化丙烷脱氢过程中,部分反应历程如图,
催化丙烷脱氢过程中,部分反应历程如图, 过程的焓变为
过程的焓变为(2)该反应

(Ⅱ)2022年11月29日23时08分,我国在酒泉卫星发射中心使用长征二号F遥十五火箭,成功将神舟十五号载人飞船发射升空,是空间站建造阶段最后一次载人飞行任务。
(3)火箭发射时可以用肼(
 ,液态)作燃料,
,液态)作燃料, 作氧化剂,二者反应生成
作氧化剂,二者反应生成 和水蒸气。已知:①
和水蒸气。已知:①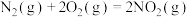
 kJ/mol②
kJ/mol②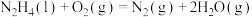
 kJ/mol请写出
kJ/mol请写出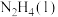 与
与 反应的热化学方程式
反应的热化学方程式
 ,
, 与
与 进行大小比较:
进行大小比较:
 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。(4)二甲醚(
 )是一种新型能源,被誉为“21世纪的清洁燃料”。用CO和
)是一种新型能源,被誉为“21世纪的清洁燃料”。用CO和 合成二甲醚的反应为:
合成二甲醚的反应为:
 kJ/mol。
kJ/mol。①改变下列“量”,一定会引起
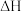 发生变化的是
发生变化的是a.化学计量数 b.反应物浓度 c.催化剂
②采用新型催化剂(主要成分是Cu-Mn的合金)制备二甲醚。催化剂中
 对合成二甲醚的影响情况如下图所示。当
对合成二甲醚的影响情况如下图所示。当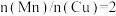 时,二甲醚的选择性(选择性
时,二甲醚的选择性(选择性 )为85.8%,此时二甲醚的产率为
)为85.8%,此时二甲醚的产率为 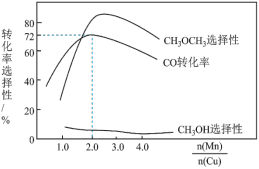
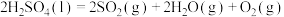
 kJ·mol
kJ·mol
反应III:

 kJ·mol
kJ·mol
在反应Ⅱ中,若标准状况下有33.6 L
 气体与水蒸气完全反应生成液态硫酸和固态硫单质,则放出的热量为
气体与水蒸气完全反应生成液态硫酸和固态硫单质,则放出的热量为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐3】利用太阳能等可再生能源,通过光催化、光电催化或电解水制氢来进行二氧化碳加氢制甲醇,发生的主要反应是 ,请回答下列有关问题。
,请回答下列有关问题。
(1)常压下,二氧化碳加氢制甲醇反应时的能量变化如图1所示,则该反应的反应热
___________ 。

(2)若二氧化碳加氢制甲醇反应在恒温恒容的密闭体系中进行,下列示意图正确且能说明该反应进行到 时刻达到平衡状态的是___________(填字母序号)。
时刻达到平衡状态的是___________(填字母序号)。
(3) ℃,在容积(均为2L)相同的a,b两个密闭容器中分别均投入
℃,在容积(均为2L)相同的a,b两个密闭容器中分别均投入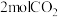 和
和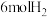 ,进行二氧化碳加氢制甲醇的反应。容器a中保持压强不变,容器b保持容积不变,容器b中甲醇的体积分数与时间关系如图2所示。
,进行二氧化碳加氢制甲醇的反应。容器a中保持压强不变,容器b保持容积不变,容器b中甲醇的体积分数与时间关系如图2所示。
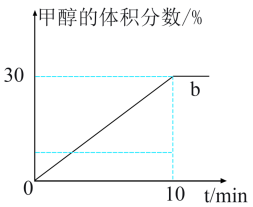
①容器b中0~10min氢气的平均反应速率
___________  ;
; ℃,反应的平衡常数为
℃,反应的平衡常数为___________ 。
②达到平衡后容器a中 的平衡转化率
的平衡转化率___________ 75%(填“>”“<”或“=”)。
③若起始时,容器b中其他条件不变,加入催化剂,则反应情况会由曲线b变为曲线c,则请在图2中画出曲线c的趋势___________ 。
(4)二氧化碳加氢制甲醇的反应历程如图3所示,方框内包含微粒种类及数目、微粒的相对总能量(括号里的数字或字母,单位:eV);其中,TS表示过渡态、*表示吸附在催化剂上的微粒。
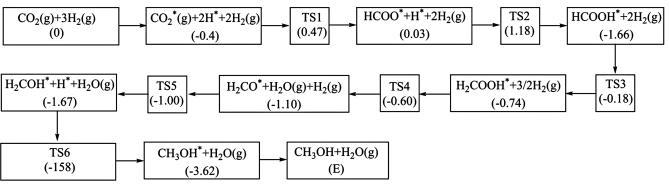
则生成甲醇的决速步骤的反应方程式为___________ 。
 ,请回答下列有关问题。
,请回答下列有关问题。(1)常压下,二氧化碳加氢制甲醇反应时的能量变化如图1所示,则该反应的反应热


(2)若二氧化碳加氢制甲醇反应在恒温恒容的密闭体系中进行,下列示意图正确且能说明该反应进行到
 时刻达到平衡状态的是___________(填字母序号)。
时刻达到平衡状态的是___________(填字母序号)。A.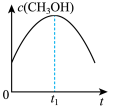 | B. | C.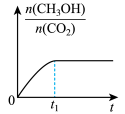 | D.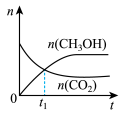 |
(3)
 ℃,在容积(均为2L)相同的a,b两个密闭容器中分别均投入
℃,在容积(均为2L)相同的a,b两个密闭容器中分别均投入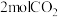 和
和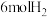 ,进行二氧化碳加氢制甲醇的反应。容器a中保持压强不变,容器b保持容积不变,容器b中甲醇的体积分数与时间关系如图2所示。
,进行二氧化碳加氢制甲醇的反应。容器a中保持压强不变,容器b保持容积不变,容器b中甲醇的体积分数与时间关系如图2所示。
①容器b中0~10min氢气的平均反应速率

 ;
; ℃,反应的平衡常数为
℃,反应的平衡常数为②达到平衡后容器a中
 的平衡转化率
的平衡转化率③若起始时,容器b中其他条件不变,加入催化剂,则反应情况会由曲线b变为曲线c,则请在图2中画出曲线c的趋势
(4)二氧化碳加氢制甲醇的反应历程如图3所示,方框内包含微粒种类及数目、微粒的相对总能量(括号里的数字或字母,单位:eV);其中,TS表示过渡态、*表示吸附在催化剂上的微粒。

则生成甲醇的决速步骤的反应方程式为
您最近一年使用:0次
【推荐1】氮的氧化物是造成大气污染的主要物质,研究氮氧化物间的相互转化及脱除具有重要意义。
I.氮氧化物间的相互转化
(1)已知2NO(g)+O2(g) 2NO2(g)的反应历程分两步:
2NO2(g)的反应历程分两步:
第一步2NO(g) N2O2(g)(快速平衡)
N2O2(g)(快速平衡)
第二步N2O2(g)+O2(g) 2NO2(g)(慢反应)
2NO2(g)(慢反应)
①用O2表示的速率方程为v(O2)=k1·c2(NO)·c(O2);NO2表示的速率方程为v(NO2)=k2·c2(NO)·c(O2),k1与k2分别表示速率常数,则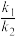 =
=___________ 。
②下列关于反应2NO(g)+O2(g)=2NO2(g)的说法正确的是___________ (填序号)。
A.增大压强,反应速率常数一定增大
B.第一步反应的活化能小于第二步反应的活化能
C.反应的总活化能等于第一步和第二步反应的活化能之和
(2)2NO2(g) N2O4(g) (△H<0),用分压(某组分的分压等于总压与其物质的量分数的积)表示的平衡常数KP与
N2O4(g) (△H<0),用分压(某组分的分压等于总压与其物质的量分数的积)表示的平衡常数KP与 (T为温度)的关系如图。
(T为温度)的关系如图。
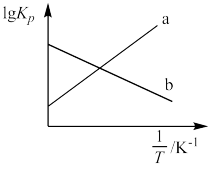
①能正确表示lgKP与 关系的曲线是
关系的曲线是___________ (填“a”或“b”)。
②298K时,在体积固定的密闭容器中充入一定量的NO2,平衡时NO2的分压为100kPa。已知KP=2.7×10-3kPa-1,则NO2的转化率为___________ 。
II.烟气中氮氧化物的脱除
(3)以NH3为还原剂在脱硝装置中消除烟气中的氮氧化物。
主反应:4NH3(g)+4NO(g)+O2(g)=4N2(g)+6H2O(g) △H1
副反应:4NH3(g)+3O2(g)=2N2(g)+6H2O(g) △H2=-1267.1kJ/mol
4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H3=-907.3kJ/mol
△H1=___________ 。
(4)以连二亚硫酸盐(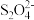 )为还原剂脱除烟气中的NO,并通过电解再生,装置如下图。
)为还原剂脱除烟气中的NO,并通过电解再生,装置如下图。
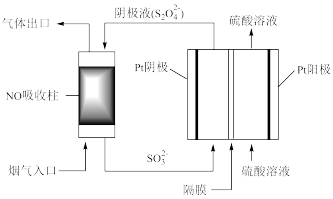
阴极的电极反应式为___________ ,电解槽中的隔膜为___________ (填“阳”或“阴”)离子交换膜。
I.氮氧化物间的相互转化
(1)已知2NO(g)+O2(g)
 2NO2(g)的反应历程分两步:
2NO2(g)的反应历程分两步:第一步2NO(g)
 N2O2(g)(快速平衡)
N2O2(g)(快速平衡)第二步N2O2(g)+O2(g)
 2NO2(g)(慢反应)
2NO2(g)(慢反应)①用O2表示的速率方程为v(O2)=k1·c2(NO)·c(O2);NO2表示的速率方程为v(NO2)=k2·c2(NO)·c(O2),k1与k2分别表示速率常数,则
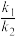 =
=②下列关于反应2NO(g)+O2(g)=2NO2(g)的说法正确的是
A.增大压强,反应速率常数一定增大
B.第一步反应的活化能小于第二步反应的活化能
C.反应的总活化能等于第一步和第二步反应的活化能之和
(2)2NO2(g)
 N2O4(g) (△H<0),用分压(某组分的分压等于总压与其物质的量分数的积)表示的平衡常数KP与
N2O4(g) (△H<0),用分压(某组分的分压等于总压与其物质的量分数的积)表示的平衡常数KP与 (T为温度)的关系如图。
(T为温度)的关系如图。
①能正确表示lgKP与
 关系的曲线是
关系的曲线是②298K时,在体积固定的密闭容器中充入一定量的NO2,平衡时NO2的分压为100kPa。已知KP=2.7×10-3kPa-1,则NO2的转化率为
II.烟气中氮氧化物的脱除
(3)以NH3为还原剂在脱硝装置中消除烟气中的氮氧化物。
主反应:4NH3(g)+4NO(g)+O2(g)=4N2(g)+6H2O(g) △H1
副反应:4NH3(g)+3O2(g)=2N2(g)+6H2O(g) △H2=-1267.1kJ/mol
4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H3=-907.3kJ/mol
△H1=
(4)以连二亚硫酸盐(
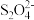 )为还原剂脱除烟气中的NO,并通过电解再生,装置如下图。
)为还原剂脱除烟气中的NO,并通过电解再生,装置如下图。
阴极的电极反应式为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐2】汽车尾气中含有氮氧化合物和CO,减少它们在大气中的排放是环境保护的重要内容之一。
(1)已知:N2(g)+O2(g)=2NO(g) ΔH1=+180kJ·mol−1
C(s)+O2(g)=CO2(g) ΔH2=−393kJ·mol−1
2C(s)+O2(g)=2CO(g) ΔH3=−221kJ·mol−1
若某反应的平衡常数表达式为 ,请写出此反应的热化学方程式:
,请写出此反应的热化学方程式:_______ 。
(2)一定条件下,反应2CO(g)+2NO(g) N2(g)+2CO2(g)的反应历程如图所示,该历程分步进行,其中第
N2(g)+2CO2(g)的反应历程如图所示,该历程分步进行,其中第_______ 步是决速步骤。 N2(g)+2CO2(g)的反应速率与温度的关系,在其他条件相同时,改变反应温度,测得经过相同时间时该反应的正反应速率如图所示,A、B两点对应温度下正反应速率变化的原因可能是
N2(g)+2CO2(g)的反应速率与温度的关系,在其他条件相同时,改变反应温度,测得经过相同时间时该反应的正反应速率如图所示,A、B两点对应温度下正反应速率变化的原因可能是_______ ,A、B两点对应温度下该反应的活化能Ea(A)_______ Ea(B)(填“>”或“<”)。 为相对压力平衡常数,其表达式写法:在浓度平衡常数表达式中,用相对分压代替浓度。气体的相对分压等于其分压(单位为kPa)除以p0(p0=100kPa)。在某温度下,原料组成n(CO):n(NO)=1:1,初始总压为100kPa的恒容密闭容器中进行上述反应,体系达到平衡时N2的分压为20kPa,则该反应的相对压力平衡常数
为相对压力平衡常数,其表达式写法:在浓度平衡常数表达式中,用相对分压代替浓度。气体的相对分压等于其分压(单位为kPa)除以p0(p0=100kPa)。在某温度下,原料组成n(CO):n(NO)=1:1,初始总压为100kPa的恒容密闭容器中进行上述反应,体系达到平衡时N2的分压为20kPa,则该反应的相对压力平衡常数
_______ 。
(5)用NH3可以消除NO污染:4NH3(g)+6NO(g) 5N2(g)+6H2O(l) ΔH
5N2(g)+6H2O(l) ΔH
①某条件下,该反应速率v正=k正·c4(NH3)·c6(NO),v逆=k逆·ca(N2)·cb(H2O),该反应的平衡常数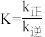 ,则b=
,则b=_______ 。
②若将9mol NH3和11molNO投入真空容器中恒温恒容(温度298K、体积为10L)进行反应,已知该条件下k正=6.4×102(mol/L)−9·s−1,当平衡时NH3转化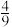 ,v逆=
,v逆=_______ mol·L−1·s−1。
(6)Na2FeO4是制造高铁电池的重要原料,同时也是一种新型的高效净水剂。在工业上通常利用如图所示装置制备Na2FeO4。_______ 。
②若b>a,图中右侧的离子交换膜为_______ (填“阴”或“阳”)离子交换膜。
(1)已知:N2(g)+O2(g)=2NO(g) ΔH1=+180kJ·mol−1
C(s)+O2(g)=CO2(g) ΔH2=−393kJ·mol−1
2C(s)+O2(g)=2CO(g) ΔH3=−221kJ·mol−1
若某反应的平衡常数表达式为
 ,请写出此反应的热化学方程式:
,请写出此反应的热化学方程式:(2)一定条件下,反应2CO(g)+2NO(g)
 N2(g)+2CO2(g)的反应历程如图所示,该历程分步进行,其中第
N2(g)+2CO2(g)的反应历程如图所示,该历程分步进行,其中第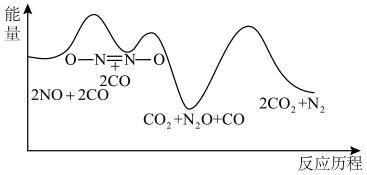
 N2(g)+2CO2(g)的反应速率与温度的关系,在其他条件相同时,改变反应温度,测得经过相同时间时该反应的正反应速率如图所示,A、B两点对应温度下正反应速率变化的原因可能是
N2(g)+2CO2(g)的反应速率与温度的关系,在其他条件相同时,改变反应温度,测得经过相同时间时该反应的正反应速率如图所示,A、B两点对应温度下正反应速率变化的原因可能是
 为相对压力平衡常数,其表达式写法:在浓度平衡常数表达式中,用相对分压代替浓度。气体的相对分压等于其分压(单位为kPa)除以p0(p0=100kPa)。在某温度下,原料组成n(CO):n(NO)=1:1,初始总压为100kPa的恒容密闭容器中进行上述反应,体系达到平衡时N2的分压为20kPa,则该反应的相对压力平衡常数
为相对压力平衡常数,其表达式写法:在浓度平衡常数表达式中,用相对分压代替浓度。气体的相对分压等于其分压(单位为kPa)除以p0(p0=100kPa)。在某温度下,原料组成n(CO):n(NO)=1:1,初始总压为100kPa的恒容密闭容器中进行上述反应,体系达到平衡时N2的分压为20kPa,则该反应的相对压力平衡常数
(5)用NH3可以消除NO污染:4NH3(g)+6NO(g)
 5N2(g)+6H2O(l) ΔH
5N2(g)+6H2O(l) ΔH①某条件下,该反应速率v正=k正·c4(NH3)·c6(NO),v逆=k逆·ca(N2)·cb(H2O),该反应的平衡常数
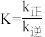 ,则b=
,则b=②若将9mol NH3和11molNO投入真空容器中恒温恒容(温度298K、体积为10L)进行反应,已知该条件下k正=6.4×102(mol/L)−9·s−1,当平衡时NH3转化
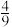 ,v逆=
,v逆=(6)Na2FeO4是制造高铁电池的重要原料,同时也是一种新型的高效净水剂。在工业上通常利用如图所示装置制备Na2FeO4。

②若b>a,图中右侧的离子交换膜为
您最近一年使用:0次
【推荐3】CO2—CH4催化重整是减缓温室效应、实现碳中和的重要方式,其主反应为:CO2(g)+CH4(g)⇌ 2CO(g)+2H2(g) △H,反应体系还涉及以下副反应:
i.CH4(g)⇌C(s)+2H2(g) △H1=+75.0kJ/mol
ii.CO2(g)+H2(g)⇌CO(g)+H2O(g) △H2=+41.0kJ/mol
iii.CO(g)+H2(g)⇌C(s)+H2O(g) △H3=-131.0kJ/mol
(1)主反应的△H=_______ kJ/mol。
(2)我国学者对催化重整的主反应进行理论研究,提出在Pt—Ni或Sn—Ni合金催化下,先发生甲烷逐级脱氢反应,其反应历程如图所示(*表示吸附在催化剂表面)。
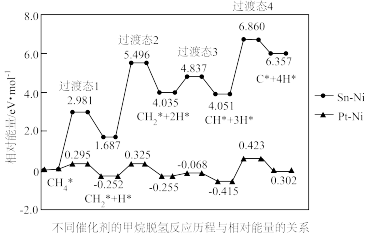
①该历程中最大能垒E(正)=_______ eV/mol;
②其它条件相同时,催化重整的主反应在不同催化剂下反应相同时间,CO的产率随反应温度的变化如图所示:

B是_______ 合金催化下CO的产率随温度的变化曲线,A、B曲线到达W点后重合,请解释原因_______ 。
(3)在1L恒容密闭容器中通入1molH2及一定量CO,反应ⅲ中CO的平衡转化率随n(CO)及温度变化如图:
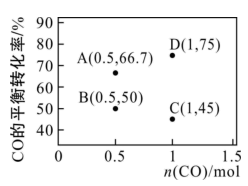
①A、B两点对应的CO正反应速率v正(A)_______ v正(B)(填“<”“=”或“>”,下同),B和C两点对应的反应温度TB_______ TC。
②已知反应速率v正=k正x(CO)x(H2),v逆=k逆x(H2O),k为反应速率常数,x为气体的体积分数,在达到平衡状态为D点的反应过程(此过程为恒温)中,当某时刻CO的转化率刚好达到60%时, =
=_______ 。(用含k正和k逆的式子表示)
i.CH4(g)⇌C(s)+2H2(g) △H1=+75.0kJ/mol
ii.CO2(g)+H2(g)⇌CO(g)+H2O(g) △H2=+41.0kJ/mol
iii.CO(g)+H2(g)⇌C(s)+H2O(g) △H3=-131.0kJ/mol
(1)主反应的△H=
(2)我国学者对催化重整的主反应进行理论研究,提出在Pt—Ni或Sn—Ni合金催化下,先发生甲烷逐级脱氢反应,其反应历程如图所示(*表示吸附在催化剂表面)。

①该历程中最大能垒E(正)=
②其它条件相同时,催化重整的主反应在不同催化剂下反应相同时间,CO的产率随反应温度的变化如图所示:

B是
(3)在1L恒容密闭容器中通入1molH2及一定量CO,反应ⅲ中CO的平衡转化率随n(CO)及温度变化如图:

①A、B两点对应的CO正反应速率v正(A)
②已知反应速率v正=k正x(CO)x(H2),v逆=k逆x(H2O),k为反应速率常数,x为气体的体积分数,在达到平衡状态为D点的反应过程(此过程为恒温)中,当某时刻CO的转化率刚好达到60%时,
 =
=
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐1】氟化学在现代无机化学中占有相当重要的地位。请回答下列问题:
(1)1886年法国化学家莫瓦桑首次通过电解熔融的氟氢化钾(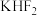 )制备
)制备 ,两极均有气体产生。装置如图所示,钢电极与电源的
,两极均有气体产生。装置如图所示,钢电极与电源的_____ (填“正极”或“负极”)相连,阳极反应式为______ ,两极产生的气体产物必须隔开的原因是________ 。
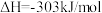 ;F-Cl(ClF中)的键能为248kJ/mol,F-Cl(
;F-Cl(ClF中)的键能为248kJ/mol,F-Cl( 中)的键能为172kJ/mol,F-F的键能为157kJ/mol。计算:Cl-Cl的键能为
中)的键能为172kJ/mol,F-F的键能为157kJ/mol。计算:Cl-Cl的键能为_______ kJ/mol。
(3)氟单质的氧化性很强,可与稀有气体氙(Xe)同时发生如下三个反应。
已知:分压=总压×该组分物质的量分数,对于反应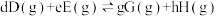 ,
,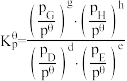 ,其中
,其中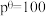 kPa,
kPa, 、
、 、
、 、
、 为各组分的平衡分压。
为各组分的平衡分压。
①在恒温、恒容条件下,向密闭容器中通入一定量的Xe和 ,下列有关说法不正确的是
,下列有关说法不正确的是_______ (填序号)。
A.当混合气体的密度不变时,体系达到平衡
B.当Xe与 的投料比为1∶1时,
的投料比为1∶1时, 的平衡转化率大于Xe
的平衡转化率大于Xe
C.达到平衡后将 从体系中移除,反应ⅰ、ⅱ、ⅲ均正向移动
从体系中移除,反应ⅰ、ⅱ、ⅲ均正向移动
D.反应ⅰ、ⅱ、ⅲ均为放热反应
②在600K条件下,向体积为2L的密闭容器中通入30.0mol Xe和60.0mol ,10min时,产物的物质的量(n)如表所示。10min内,Xe的平均反应速率为
,10min时,产物的物质的量(n)如表所示。10min内,Xe的平均反应速率为_____  ,
, 的转化率为
的转化率为______ 。
③523K时,以Xe和 制取
制取 。反应达到平衡时,欲使产物
。反应达到平衡时,欲使产物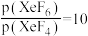 ,
, 的分压为
的分压为______ kPa。
(1)1886年法国化学家莫瓦桑首次通过电解熔融的氟氢化钾(
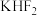 )制备
)制备 ,两极均有气体产生。装置如图所示,钢电极与电源的
,两极均有气体产生。装置如图所示,钢电极与电源的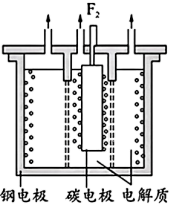
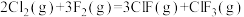
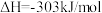 ;F-Cl(ClF中)的键能为248kJ/mol,F-Cl(
;F-Cl(ClF中)的键能为248kJ/mol,F-Cl( 中)的键能为172kJ/mol,F-F的键能为157kJ/mol。计算:Cl-Cl的键能为
中)的键能为172kJ/mol,F-F的键能为157kJ/mol。计算:Cl-Cl的键能为(3)氟单质的氧化性很强,可与稀有气体氙(Xe)同时发生如下三个反应。
| 标准平衡常数 | 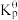 (523K) (523K) | 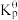 (673K) (673K) |
ⅰ.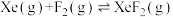 | 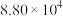 | 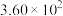 |
ⅱ. | 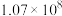 | 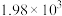 |
ⅲ. | 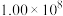 | 36 |
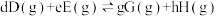 ,
,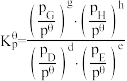 ,其中
,其中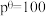 kPa,
kPa, 、
、 、
、 、
、 为各组分的平衡分压。
为各组分的平衡分压。①在恒温、恒容条件下,向密闭容器中通入一定量的Xe和
 ,下列有关说法不正确的是
,下列有关说法不正确的是A.当混合气体的密度不变时,体系达到平衡
B.当Xe与
 的投料比为1∶1时,
的投料比为1∶1时, 的平衡转化率大于Xe
的平衡转化率大于XeC.达到平衡后将
 从体系中移除,反应ⅰ、ⅱ、ⅲ均正向移动
从体系中移除,反应ⅰ、ⅱ、ⅲ均正向移动D.反应ⅰ、ⅱ、ⅲ均为放热反应
②在600K条件下,向体积为2L的密闭容器中通入30.0mol Xe和60.0mol
 ,10min时,产物的物质的量(n)如表所示。10min内,Xe的平均反应速率为
,10min时,产物的物质的量(n)如表所示。10min内,Xe的平均反应速率为 ,
, 的转化率为
的转化率为| 物质 |  |  |  |
| n/mol | 3.6 | 17.4 | 0.4 |
 制取
制取 。反应达到平衡时,欲使产物
。反应达到平衡时,欲使产物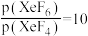 ,
, 的分压为
的分压为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐2】燃料气主要成分为CO和 ,利用燃料气合成甲烷反应原理为
,利用燃料气合成甲烷反应原理为 。回答下列问题:
。回答下列问题:
(1)已知: 、CO、
、CO、 的燃烧热分别为
的燃烧热分别为 、
、 、
、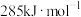 ,则反应
,则反应 的
的
_______ 。
(2)在恒容容器中充入 、2molCO,分别在催化剂M、N作用下发生反应
、2molCO,分别在催化剂M、N作用下发生反应 ,氢气体积分数与反应时间和温度变化关系如图所示:
,氢气体积分数与反应时间和温度变化关系如图所示:
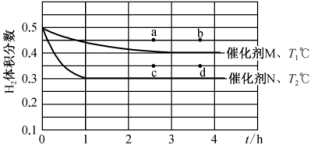
①据图判断,
_______ (填“>”“<”或“=”) ,催化剂催化效果:M
,催化剂催化效果:M_______ (填“强于”或“弱于”)N。
②在温度 ℃下,若在恒压容器中充入4mol
℃下,若在恒压容器中充入4mol 、4molCO,则刚达到平衡时
、4molCO,则刚达到平衡时 体积分数符合上图中的
体积分数符合上图中的_______ (填“a”“b”“c”或“d”)点。
(3)在温度T℃下,向恒容反应器中加入等物质的量的 和
和 发生反应
发生反应 ,开始时总压为72kPa,研究表明
,开始时总压为72kPa,研究表明 的生成速率
的生成速率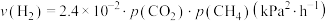 ,某时刻反应处于平衡状态,测得该温度下,
,某时刻反应处于平衡状态,测得该温度下, ,则该时刻
,则该时刻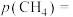
_______ kPa,
_______ 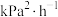 ;该温度下,该反应的化学平衡常数
;该温度下,该反应的化学平衡常数
_______  (列出表达式,平衡分压代替平衡浓度计算,分压-总压×物质的量分数),
(列出表达式,平衡分压代替平衡浓度计算,分压-总压×物质的量分数),
 ,利用燃料气合成甲烷反应原理为
,利用燃料气合成甲烷反应原理为 。回答下列问题:
。回答下列问题:(1)已知:
 、CO、
、CO、 的燃烧热分别为
的燃烧热分别为 、
、 、
、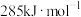 ,则反应
,则反应 的
的
(2)在恒容容器中充入
 、2molCO,分别在催化剂M、N作用下发生反应
、2molCO,分别在催化剂M、N作用下发生反应 ,氢气体积分数与反应时间和温度变化关系如图所示:
,氢气体积分数与反应时间和温度变化关系如图所示:
①据图判断,

 ,催化剂催化效果:M
,催化剂催化效果:M②在温度
 ℃下,若在恒压容器中充入4mol
℃下,若在恒压容器中充入4mol 、4molCO,则刚达到平衡时
、4molCO,则刚达到平衡时 体积分数符合上图中的
体积分数符合上图中的(3)在温度T℃下,向恒容反应器中加入等物质的量的
 和
和 发生反应
发生反应 ,开始时总压为72kPa,研究表明
,开始时总压为72kPa,研究表明 的生成速率
的生成速率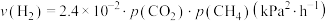 ,某时刻反应处于平衡状态,测得该温度下,
,某时刻反应处于平衡状态,测得该温度下, ,则该时刻
,则该时刻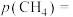

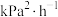 ;该温度下,该反应的化学平衡常数
;该温度下,该反应的化学平衡常数
 (列出表达式,平衡分压代替平衡浓度计算,分压-总压×物质的量分数),
(列出表达式,平衡分压代替平衡浓度计算,分压-总压×物质的量分数),
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐3】研究消除废气污染对建设美丽家乡,打造宜居环境有重要意义。
(1)已知:工业废气中的氮氧化物可用以下反应去除,常温常压下(298K,100kPa),以下反应的焓变和熵变如表1所示:
①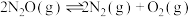
②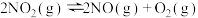
③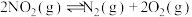
表1:
结合表1中的数据,工业上,反应___________ (填反应编号)不可用于常温常压下去除氮氧化物,请通过计算说明理由:___________ 。
(2)治理排出的尾气(含CO、 、NO)的方法可在密闭容器中发生如下反应:
、NO)的方法可在密闭容器中发生如下反应:
I.
Ⅱ.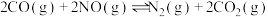
一定温度下,向体积为2L的恒容的密闭容器中,充入4molCO、2molNO、2mol 发生上述反应,达到平衡状态时,测得
发生上述反应,达到平衡状态时,测得 的物质的量为0.4mol,且体系中
的物质的量为0.4mol,且体系中 的物质的量比
的物质的量比 的多0.8mol,则该温度下达平衡时,反应Ⅱ的平衡常数K=
的多0.8mol,则该温度下达平衡时,反应Ⅱ的平衡常数K=___________ L/mol。
(3)原煤经热解、冷却得到的煤焦可用于NO的脱除。热解温度为500℃,900℃得到的煤焦分别用S-500、S-900表示,相关信息如下表:
将NO浓度恒定的废气以固定流速通过反应器(图1)。不同温度下,进行多组平行实验,测定相同时间内NO的出口浓度,可得NO的脱除率与温度的关系如图2所示。
[已知:NO的脱除主要包含吸附和化学还原( )两个过程]
)两个过程]
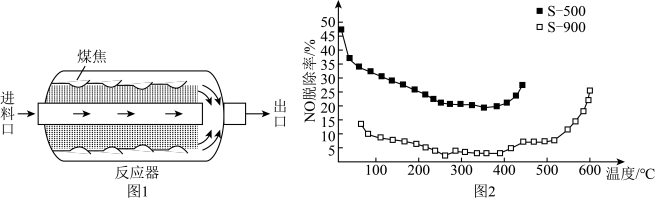
①已知煤焦表面存在的官能团有利于吸附NO,其数量与煤焦中氢碳质量比的值密切相关,比值小,表面官能团少。由图2可知,相同温度下,一单位时间内S-500对NO的脱除率比S-900的高,可能原因是___________ 。(答两条)。
②350℃后,随着温度升高,单位时间内NO的脱除率增大的原因是___________ 。
(4)电解氧化吸收法:其原理如图所示:

①从A口中出来的物质的是___________ 。
②写出电解池阴极的电极反应式___________ 。
(1)已知:工业废气中的氮氧化物可用以下反应去除,常温常压下(298K,100kPa),以下反应的焓变和熵变如表1所示:
①
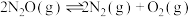
②
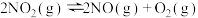
③
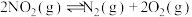
表1:
| 反应 | 焓变(kJ/mol) | 熵变(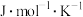 ) ) |
| ① | -163 | +22.6 |
| ② | +112.7 | +150 |
| ③ | -67.8 | +120 |
(2)治理排出的尾气(含CO、
 、NO)的方法可在密闭容器中发生如下反应:
、NO)的方法可在密闭容器中发生如下反应:I.

Ⅱ.
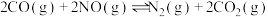
一定温度下,向体积为2L的恒容的密闭容器中,充入4molCO、2molNO、2mol
 发生上述反应,达到平衡状态时,测得
发生上述反应,达到平衡状态时,测得 的物质的量为0.4mol,且体系中
的物质的量为0.4mol,且体系中 的物质的量比
的物质的量比 的多0.8mol,则该温度下达平衡时,反应Ⅱ的平衡常数K=
的多0.8mol,则该温度下达平衡时,反应Ⅱ的平衡常数K=(3)原煤经热解、冷却得到的煤焦可用于NO的脱除。热解温度为500℃,900℃得到的煤焦分别用S-500、S-900表示,相关信息如下表:
| 煤焦 | 元素分析/% | 比表面积/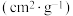 | |
| C | H | ||
| S-500 | 80.79 | 2.76 | 105.69 |
| S-900 | 84.26 | 0.82 | 8.98 |
[已知:NO的脱除主要包含吸附和化学还原(
 )两个过程]
)两个过程]
①已知煤焦表面存在的官能团有利于吸附NO,其数量与煤焦中氢碳质量比的值密切相关,比值小,表面官能团少。由图2可知,相同温度下,一单位时间内S-500对NO的脱除率比S-900的高,可能原因是
②350℃后,随着温度升高,单位时间内NO的脱除率增大的原因是
(4)电解氧化吸收法:其原理如图所示:

①从A口中出来的物质的是
②写出电解池阴极的电极反应式
您最近一年使用:0次



