在一定条件下,CO2可以合成一系列化工原料或燃料,在工农业生产中具有重大意义,根据以下合成过程,回答问题。
(1)目前工业上可用CO2生产甲醇燃料,反应的化学方程式为: CO2(g)+3H2(g) CH3OH(g)+H2O(g),△H。
CH3OH(g)+H2O(g),△H。
已知:
该反应△H=________ KJ/mol。
(2)研究证明。用二氧化碳催化加氢来合成低碳烯烃,起始时以0.1MPa,n(H2):n(CO2)=3:1的投料比充入反应器中,发生反应:2CO2(g)+6H2(g) C2H4(g)+4H2O(g)△H,不同温度下平衡时的四种气态物质的物质的量如图所示:
C2H4(g)+4H2O(g)△H,不同温度下平衡时的四种气态物质的物质的量如图所示:
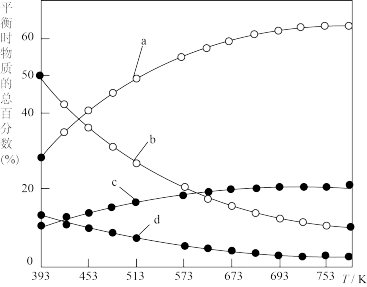
①对于气体反应,用某组分(B)的平衡压强(pB)代替物质的量浓度(cB)也可以表示平衡常数(记作KP),则该反应的KP=________ ;
②曲线a表示的物质为H2,理由是________ ;
③为提高CO2的平衡转化率,除改变温度外,还可采取的措施是________ (列举2项).
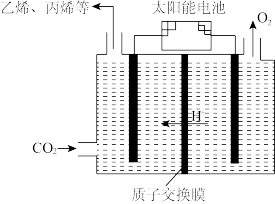
④在强酸性电解质水溶液中,以惰性电极电解CO2可得到多种燃料,其原理如图所示,电解时,生成乙烯的电极反应式________ 。
(3)工业上利用CO2和NH3反应来制取尿素,反应2NH3+CO2 CO(NH2)2+H2O,在合成塔中不同氮碳比a[n(NH3)/n(CO2)]和水碳比b[n(H2O)/n(CO2)]时二氧化碳转化率(x)如图:
CO(NH2)2+H2O,在合成塔中不同氮碳比a[n(NH3)/n(CO2)]和水碳比b[n(H2O)/n(CO2)]时二氧化碳转化率(x)如图:
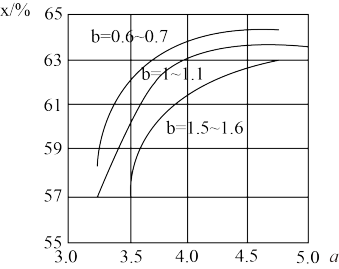
①b宜控制在________ (填序号)范围内
A. 0.6~0.7 B. 1~1.1 C. 1.5~1.61;
②a宜控制在4.0左右,理由是________ 。
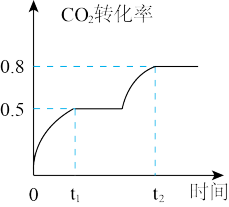
(4)工业上利用CO2和CH3OH反应制取碳酸二甲酯,反应:CO2(g)+2CH3OH(g) CH3OOCOOCH3(g)+H2O(g),在恒温、容积可变的密闭容器中加入1 molCO2, 2molCH3OH+CO2的转化率与反应时间关系如图所示,在反应过程中,若t1时容器体积为1000mL,则t2时容器体积V="
CH3OOCOOCH3(g)+H2O(g),在恒温、容积可变的密闭容器中加入1 molCO2, 2molCH3OH+CO2的转化率与反应时间关系如图所示,在反应过程中,若t1时容器体积为1000mL,则t2时容器体积V=" ________ " mL。
(1)目前工业上可用CO2生产甲醇燃料,反应的化学方程式为: CO2(g)+3H2(g)
 CH3OH(g)+H2O(g),△H。
CH3OH(g)+H2O(g),△H。已知:
| 共价键 | C=O | H—H | C—O | C—H | O—H |
| 键能(KJ·mol-1) | 750 | 436 | 358 | 413 | 463 |
(2)研究证明。用二氧化碳催化加氢来合成低碳烯烃,起始时以0.1MPa,n(H2):n(CO2)=3:1的投料比充入反应器中,发生反应:2CO2(g)+6H2(g)
 C2H4(g)+4H2O(g)△H,不同温度下平衡时的四种气态物质的物质的量如图所示:
C2H4(g)+4H2O(g)△H,不同温度下平衡时的四种气态物质的物质的量如图所示:
①对于气体反应,用某组分(B)的平衡压强(pB)代替物质的量浓度(cB)也可以表示平衡常数(记作KP),则该反应的KP=
②曲线a表示的物质为H2,理由是
③为提高CO2的平衡转化率,除改变温度外,还可采取的措施是
④在强酸性电解质水溶液中,以惰性电极电解CO2可得到多种燃料,其原理如图所示,电解时,生成乙烯的电极反应式

(3)工业上利用CO2和NH3反应来制取尿素,反应2NH3+CO2
 CO(NH2)2+H2O,在合成塔中不同氮碳比a[n(NH3)/n(CO2)]和水碳比b[n(H2O)/n(CO2)]时二氧化碳转化率(x)如图:
CO(NH2)2+H2O,在合成塔中不同氮碳比a[n(NH3)/n(CO2)]和水碳比b[n(H2O)/n(CO2)]时二氧化碳转化率(x)如图:
①b宜控制在
A. 0.6~0.7 B. 1~1.1 C. 1.5~1.61;
②a宜控制在4.0左右,理由是
(4)工业上利用CO2和CH3OH反应制取碳酸二甲酯,反应:CO2(g)+2CH3OH(g)
 CH3OOCOOCH3(g)+H2O(g),在恒温、容积可变的密闭容器中加入1 molCO2, 2molCH3OH+CO2的转化率与反应时间关系如图所示,在反应过程中,若t1时容器体积为1000mL,则t2时容器体积V="
CH3OOCOOCH3(g)+H2O(g),在恒温、容积可变的密闭容器中加入1 molCO2, 2molCH3OH+CO2的转化率与反应时间关系如图所示,在反应过程中,若t1时容器体积为1000mL,则t2时容器体积V=" 
更新时间:2016-12-09 14:51:22
|
相似题推荐
解答题-原理综合题
|
较难
(0.4)
【推荐1】近日,厦门大学固体表面物理化学国家重点实验室教授王野、傅钢和中国科学技术大学教授姜政等,创制出超高稳定性In/Rh@S-1催化剂,高选择性催化丙烷等低碳烷烃直接脱氢制取对应烯烃:C3H8(g) C3H6(g)+H2(g) △H。
C3H6(g)+H2(g) △H。
回答下列问题:
(1)已知:几种可燃物的燃烧热如表所示。
上述反应中,△H=______ kJ•mol-1。
(2)一定温度下,在恒容密闭容器中充入1mol丙烷发生上述反应。下列叙述中,正确的是______ (填标号)。
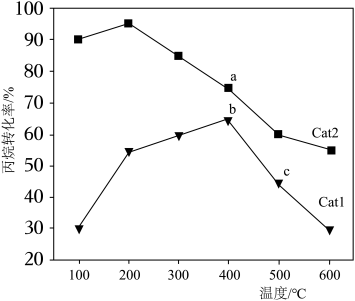
(3)单位时间内,丙烷在不同催化剂Cat1、Cat2作用下的转化率与温度关系如图所示。______ (填“Cat1”或“Cat2”);b点______ (填“是”或“不是”)平衡点;b→c变化的原因可能是______ 。
(4)保持总压强恒定为pkPa,向反应器充入丙烷和氩气(Ar)混合气体,仅发生上述反应,丙烷的平衡转化率与温度、起始投料比[η=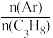 ]关系如图所示。
]关系如图所示。______ n(填“>”“<”或“=”);T1温度下,压强平衡常数Kp=______ kPa(用含p的代数式表示)。[提示:用分压计算的平衡常数叫做压强平衡常数(Kp),分压=总压×物质的量分数。]
(5)以熔融K2CO3(不含O2-和HCO )为电解质的丙烷-空气燃料电池的放电效率高,该电池放电时,负极反应式为
)为电解质的丙烷-空气燃料电池的放电效率高,该电池放电时,负极反应式为_______ 。为了使电池长时间稳定运行,必须确保电解质组成稳定,即在通入的空气中添加_______ (填化学式)。
 C3H6(g)+H2(g) △H。
C3H6(g)+H2(g) △H。回答下列问题:
(1)已知:几种可燃物的燃烧热如表所示。
| 可燃物 | C3H8(g) | C3H6(g) | H2(g) |
| 燃烧热△H/(kJ•mol-1) | -2220 | -2051 | -285.8 |
(2)一定温度下,在恒容密闭容器中充入1mol丙烷发生上述反应。下列叙述中,正确的是
| A.混合气体中H2体积分数最大值为50% |
| B.升高温度,丙烷脱氢反应的平衡常数增大 |
| C.混合气体密度不变时,反应一定达到平衡状态 |
| D.平衡时再充C3H8,丙烷平衡转化率减小 |
(3)单位时间内,丙烷在不同催化剂Cat1、Cat2作用下的转化率与温度关系如图所示。
(4)保持总压强恒定为pkPa,向反应器充入丙烷和氩气(Ar)混合气体,仅发生上述反应,丙烷的平衡转化率与温度、起始投料比[η=
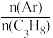 ]关系如图所示。
]关系如图所示。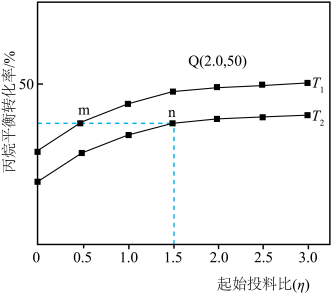
(5)以熔融K2CO3(不含O2-和HCO
 )为电解质的丙烷-空气燃料电池的放电效率高,该电池放电时,负极反应式为
)为电解质的丙烷-空气燃料电池的放电效率高,该电池放电时,负极反应式为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐2】乙烯是石油化工最基本原料之一。
I.乙烷在一定条件下可脱氢制得乙烯:C2H6(g) C2H4(g)+H2(g) △H1>0
C2H4(g)+H2(g) △H1>0
(1)提高乙烷平衡转化率的措施有____ 、____ 。
(2)一定温度下,向恒容密闭容器通入等物质的量的C2H6和H2,初始压强为100kPa,发生上述反应,乙烷的平衡转化率为20%。平衡时体系的压强为___ kPa,该反应的平衡常数Kp=___ kPa(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
II.在乙烷中引入O2可以降低反应温度,减少积碳。涉及如下反应:
a.2C2H6(g)+O2(g)=2C2H4(g)+2H2O(g) △H2<0
b.2C2H6(g)+5O2(g)=4CO(g)+6H2O(g) △H3<0
c.C2H4(g)+2O2(g)=2CO(g)+2H2O(g) △H4<0
(3)根据盖斯定律,反应a的△H2=____ (写出用含有△H3、△H4表示的代数式)。
(4)氧气的引入可能导致过度氧化。为减少过度氧化,需要寻找催化剂降低反应____ (选填“a”、“b”或“c”)的活化能。
(5)常压下,在某催化剂作用下按照n(C2H6):n(O2)=1:1投料制备乙烯,体系中C2H4和CO在含碳产物中的物质的量百分数及C2H6转化率随温度的变化如图所示。
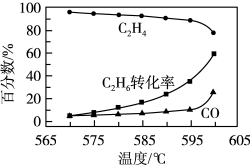
①乙烯的物质的量百分数随温度升高而降低的,原因是____ 。
②在570~600℃温度范围内,下列说法正确的有____ (填字母)。
A.H2O的含量随温度升高而增大.
B.C2H6在体系中的物质的量百分数随温度升高而增大
C.此催化剂的优点是在较低温度下能降低CO的平衡产率
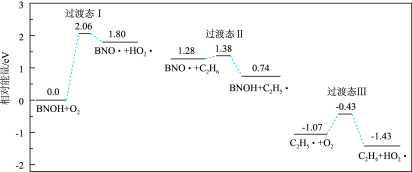
③某学者研究了生成C2H4的部分反应历程如图所示,写出该部分反应历程的总反应方程式____ 。该历程的催化剂是____ 。
I.乙烷在一定条件下可脱氢制得乙烯:C2H6(g)
 C2H4(g)+H2(g) △H1>0
C2H4(g)+H2(g) △H1>0(1)提高乙烷平衡转化率的措施有
(2)一定温度下,向恒容密闭容器通入等物质的量的C2H6和H2,初始压强为100kPa,发生上述反应,乙烷的平衡转化率为20%。平衡时体系的压强为
II.在乙烷中引入O2可以降低反应温度,减少积碳。涉及如下反应:
a.2C2H6(g)+O2(g)=2C2H4(g)+2H2O(g) △H2<0
b.2C2H6(g)+5O2(g)=4CO(g)+6H2O(g) △H3<0
c.C2H4(g)+2O2(g)=2CO(g)+2H2O(g) △H4<0
(3)根据盖斯定律,反应a的△H2=
(4)氧气的引入可能导致过度氧化。为减少过度氧化,需要寻找催化剂降低反应
(5)常压下,在某催化剂作用下按照n(C2H6):n(O2)=1:1投料制备乙烯,体系中C2H4和CO在含碳产物中的物质的量百分数及C2H6转化率随温度的变化如图所示。

①乙烯的物质的量百分数随温度升高而降低的,原因是
②在570~600℃温度范围内,下列说法正确的有
A.H2O的含量随温度升高而增大.
B.C2H6在体系中的物质的量百分数随温度升高而增大
C.此催化剂的优点是在较低温度下能降低CO的平衡产率
③某学者研究了生成C2H4的部分反应历程如图所示,写出该部分反应历程的总反应方程式

您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐3】氢气和碳氧化物反应生成甲烷,有利于实现碳循环利用。涉及反应如下:
反应Ⅰ: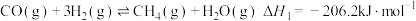
反应Ⅱ: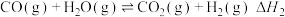
反应Ⅲ: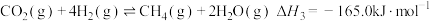
回答下列问题:
(1)
___________  。
。
(2)已知反应Ⅱ的速率方程为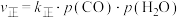 ,
, ,其中
,其中 、
、 分别为正、逆反应的速率常数。如图(lg k表示速率常数的对数,
分别为正、逆反应的速率常数。如图(lg k表示速率常数的对数, 表示温度的倒数)所示a、b、c、d四条斜线中,能表示
表示温度的倒数)所示a、b、c、d四条斜线中,能表示 随
随 变化关系的是斜线
变化关系的是斜线___________ (填标号)。___________ (填“氧离子导体”或“质子导体”)。
②阳极的电极反应式为___________ 。
(4)温度为 时,在固定容积的容器中充入一定量的
时,在固定容积的容器中充入一定量的 和1mol CO,平衡时
和1mol CO,平衡时 和CO的转化率(α)及
和CO的转化率(α)及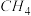 和
和 的物质的量(n)随
的物质的量(n)随 变化的情况如图所示。
变化的情况如图所示。___________ ;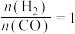 时,
时, 的选择性
的选择性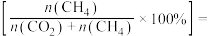
___________ 。
②已知起始充入1mol的CO和0.5mol的 进行上述反应时,起始压强为
进行上述反应时,起始压强为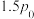 。反应Ⅰ的
。反应Ⅰ的
___________ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,用 表示);温度为
表示);温度为 ,
,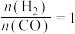 时,
时, 可能对应图中X、Y、Z、W四点中的
可能对应图中X、Y、Z、W四点中的___________ (填标号)。
反应Ⅰ:
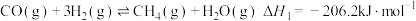
反应Ⅱ:
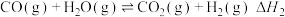
反应Ⅲ:
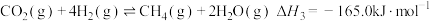
回答下列问题:
(1)

 。
。(2)已知反应Ⅱ的速率方程为
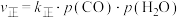 ,
, ,其中
,其中 、
、 分别为正、逆反应的速率常数。如图(lg k表示速率常数的对数,
分别为正、逆反应的速率常数。如图(lg k表示速率常数的对数, 表示温度的倒数)所示a、b、c、d四条斜线中,能表示
表示温度的倒数)所示a、b、c、d四条斜线中,能表示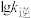 随
随 变化关系的是斜线
变化关系的是斜线
②阳极的电极反应式为
(4)温度为
 时,在固定容积的容器中充入一定量的
时,在固定容积的容器中充入一定量的 和1mol CO,平衡时
和1mol CO,平衡时 和CO的转化率(α)及
和CO的转化率(α)及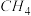 和
和 的物质的量(n)随
的物质的量(n)随 变化的情况如图所示。
变化的情况如图所示。
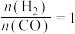 时,
时, 的选择性
的选择性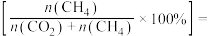
②已知起始充入1mol的CO和0.5mol的
 进行上述反应时,起始压强为
进行上述反应时,起始压强为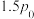 。反应Ⅰ的
。反应Ⅰ的
 表示);温度为
表示);温度为 ,
,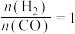 时,
时, 可能对应图中X、Y、Z、W四点中的
可能对应图中X、Y、Z、W四点中的
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐1】空气质量评价的主要污染物为PM10、PM2.5、SO2、NO2、O3、CO等物质。脱硝(除NOx)技术和脱硫(除SO2)技术都是环境科学研究的热点,对于消除环境污染有重要意义。
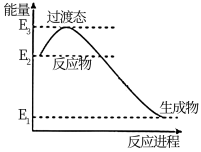
(1)已知在催化剂存在的条件下,H2可以将NO还原为N2。如图是一定条件下H2还原NO生成N2和1mol水蒸气的能量变化示意图。由图可看出此反应为:__________ 反应(填“放热”或“吸热”),写出该反应的热化学方程式:__________ (ΔH用E1、E2、E3表示)
(2)升高温度绝大多数反应的化学反应速率增大,但是2NO(g)+O2(g) 2NO2(g)的速率却随着温度的升高而减小。某化学小组为研究该特殊现象的实质原因,查阅资料知2NO(g)+O2(g)
2NO2(g)的速率却随着温度的升高而减小。某化学小组为研究该特殊现象的实质原因,查阅资料知2NO(g)+O2(g)  2NO2(g)的反应历程分两步:
2NO2(g)的反应历程分两步:
Ⅰ.2NO(g) N2O2(g)(快) ΔH1 < 0 ;v1正=k1正·c2(NO);v1逆=k1逆·c(N2O2)
N2O2(g)(快) ΔH1 < 0 ;v1正=k1正·c2(NO);v1逆=k1逆·c(N2O2)
Ⅱ.N2O2(g)+O2(g) 2NO2(g)(慢) ΔH2 < 0 ;v2正=k2正·c(N2O2)·c(O2); v2逆=k2逆·c2(NO2)
2NO2(g)(慢) ΔH2 < 0 ;v2正=k2正·c(N2O2)·c(O2); v2逆=k2逆·c2(NO2)
请回答下列问题:
① 一定温度下,反应2NO(g)+O2(g) 2NO2(g)达到平衡状态,请写出此反应的平衡常数表达式K=
2NO2(g)达到平衡状态,请写出此反应的平衡常数表达式K=__________ 。
② 决定2NO(g)+O2(g) 2NO2(g)反应速率的是反应Ⅱ,反应Ⅰ的活化能E1与反应Ⅱ的活化能E2的大小关系为E1
2NO2(g)反应速率的是反应Ⅱ,反应Ⅰ的活化能E1与反应Ⅱ的活化能E2的大小关系为E1__________ E2(填“ >”“<”或“=”)。根据速率方程分析,升高温度该反应速率减小的原因是__________ (填序号)。
A k2正增大,c(N2O2)增大 B k2正减小,c(N2O2)减小
C k2正增大,c(N2O2)减小 D k2正减小,c(N2O2)增大
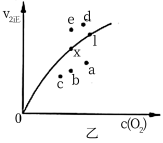
③ 由实验数据得到v2正~c(O2)的关系可如图表示。当X点升高到某一温度时,反应重新达到平衡,则变为相应的点为__________ (填字母)。
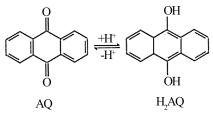
(3)我国科学家在天然气脱硫研究方面取得了新进展,利用如图装置可发生反应:H2S+O2=H2O2+S↓,已知甲池中发生的反应为:
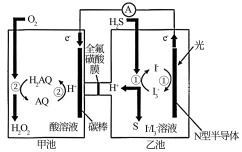
① 装置中H+从__________ 移向__________ (填“甲池”或“乙池”)。
(1)已知在催化剂存在的条件下,H2可以将NO还原为N2。如图是一定条件下H2还原NO生成N2和1mol水蒸气的能量变化示意图。由图可看出此反应为:

(2)升高温度绝大多数反应的化学反应速率增大,但是2NO(g)+O2(g)
 2NO2(g)的速率却随着温度的升高而减小。某化学小组为研究该特殊现象的实质原因,查阅资料知2NO(g)+O2(g)
2NO2(g)的速率却随着温度的升高而减小。某化学小组为研究该特殊现象的实质原因,查阅资料知2NO(g)+O2(g)  2NO2(g)的反应历程分两步:
2NO2(g)的反应历程分两步:Ⅰ.2NO(g)
 N2O2(g)(快) ΔH1 < 0 ;v1正=k1正·c2(NO);v1逆=k1逆·c(N2O2)
N2O2(g)(快) ΔH1 < 0 ;v1正=k1正·c2(NO);v1逆=k1逆·c(N2O2)Ⅱ.N2O2(g)+O2(g)
 2NO2(g)(慢) ΔH2 < 0 ;v2正=k2正·c(N2O2)·c(O2); v2逆=k2逆·c2(NO2)
2NO2(g)(慢) ΔH2 < 0 ;v2正=k2正·c(N2O2)·c(O2); v2逆=k2逆·c2(NO2)请回答下列问题:
① 一定温度下,反应2NO(g)+O2(g)
 2NO2(g)达到平衡状态,请写出此反应的平衡常数表达式K=
2NO2(g)达到平衡状态,请写出此反应的平衡常数表达式K=② 决定2NO(g)+O2(g)
 2NO2(g)反应速率的是反应Ⅱ,反应Ⅰ的活化能E1与反应Ⅱ的活化能E2的大小关系为E1
2NO2(g)反应速率的是反应Ⅱ,反应Ⅰ的活化能E1与反应Ⅱ的活化能E2的大小关系为E1A k2正增大,c(N2O2)增大 B k2正减小,c(N2O2)减小
C k2正增大,c(N2O2)减小 D k2正减小,c(N2O2)增大
③ 由实验数据得到v2正~c(O2)的关系可如图表示。当X点升高到某一温度时,反应重新达到平衡,则变为相应的点为

(3)我国科学家在天然气脱硫研究方面取得了新进展,利用如图装置可发生反应:H2S+O2=H2O2+S↓,已知甲池中发生的反应为:


① 装置中H+从
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐2】C2H4是现代工业的重要原料,工业上用CO2氧化C2H6制C2H4具有重要意义。
已知:CO2氧化C2H6制C2H4的主反应热化学方程式为:C2H6(g) + CO2(g)=C2H4(g) + CO(g) + H2O(g) ΔH=+177kJ·mol-1
(1)若主反应的反应历程分为如下两步:
I. C2H6(g)=C2H4(g) + H2(g) (快) ΔH1
Ⅱ. CO2(g) + H2(g)= CO(g) + H2O(g) (慢) ΔH2=+42kJ·mol-1
则:①反应I的ΔH1 =_______ kJ ·mol-1。
②已知:ΔG=ΔH- T·ΔS。当ΔG>0,反应非自发;当ΔG<0,反应自发。若反应I的ΔS=+120J·K-1·mol-1,反应I自发进行的最低温度T=_______ K。
③相比于提高c(C2H6) ,提高c(CO2)对主反应总速率影响更大,其原因是_______ 。
(2)某催化剂催化主反应的过程中,在催化剂表面发生了一系列反应:
①CH3- CH3→CH3- CH2·+ H++e-,
②CH3-CH2·→CH2=CH2+H++e-,
③CO2+e-→ ,
,
④ + H+→·COOH,
+ H+→·COOH,
⑤_______,
则:自由基CH3-CH2·的电子式为_______ ,⑤的反应式为_______ 。
(3)在C2H6与CO2反应制C2H4的过程中,还会发生副反应:C2H6(g)+ 2CO2(g) = 4CO(g)+ 3H2(g) ΔH> 0
①其他条件相同时, lmol C2H6与lmol CO2经相同反应时间测得如表实验数据:
在催化剂相同时,温度越高C2H4产率更高的原因是_______ ; 相同温度时,催化剂2催化下C2H4产率更高的原因是_______ 。
②在容器体积为1.0L,充入2 mol C2H6和3 mol CO2同时发生主、副反应,乙烷的平衡转化率、乙烯的选择性与温度、压强的关系如图所示。则:判断P1>P2的理由是_______ ;M点主反应的平衡常数为_______ (结果保留2 位有效数字)。

已知:CO2氧化C2H6制C2H4的主反应热化学方程式为:C2H6(g) + CO2(g)=C2H4(g) + CO(g) + H2O(g) ΔH=+177kJ·mol-1
(1)若主反应的反应历程分为如下两步:
I. C2H6(g)=C2H4(g) + H2(g) (快) ΔH1
Ⅱ. CO2(g) + H2(g)= CO(g) + H2O(g) (慢) ΔH2=+42kJ·mol-1
则:①反应I的ΔH1 =
②已知:ΔG=ΔH- T·ΔS。当ΔG>0,反应非自发;当ΔG<0,反应自发。若反应I的ΔS=+120J·K-1·mol-1,反应I自发进行的最低温度T=
③相比于提高c(C2H6) ,提高c(CO2)对主反应总速率影响更大,其原因是
(2)某催化剂催化主反应的过程中,在催化剂表面发生了一系列反应:
①CH3- CH3→CH3- CH2·+ H++e-,
②CH3-CH2·→CH2=CH2+H++e-,
③CO2+e-→
 ,
,④
 + H+→·COOH,
+ H+→·COOH,⑤_______,
则:自由基CH3-CH2·的电子式为
(3)在C2H6与CO2反应制C2H4的过程中,还会发生副反应:C2H6(g)+ 2CO2(g) = 4CO(g)+ 3H2(g) ΔH> 0
①其他条件相同时, lmol C2H6与lmol CO2经相同反应时间测得如表实验数据:
实验 | 温度/K | 催化剂 | C2H4的产率% |
实验1 | 400 | 催化剂1 | 55.0 |
400 | 催化剂2 | 62.3 | |
实验2 | 500 | 催化剂1 | 68.5 |
| 500 | 催化剂2 | 80.1 |
②在容器体积为1.0L,充入2 mol C2H6和3 mol CO2同时发生主、副反应,乙烷的平衡转化率、乙烯的选择性与温度、压强的关系如图所示。则:判断P1>P2的理由是

您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐3】工业合成氨是20世纪的伟大成就之一,但化肥的过度使用、硝酸工业废气和机动车尾气的排放,给水体和大气带来了一定程度的污染,需要进行综合处理。
Ⅰ.含氮污染处理
(1)水体中氨氮处理:在微生物作用下,废水中 经两步反应被氧化成
经两步反应被氧化成
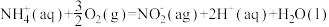 △H=-273kJ/mol
△H=-273kJ/mol
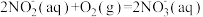 △H=-146kJ/mol
△H=-146kJ/mol
则 (aq)全部氧化成
(aq)全部氧化成 (aq)的热化学方程式是
(aq)的热化学方程式是_______ 。
(2)大气中NO处理:电解NaCl溶液(调节起始pH约为9)获得NaClO溶液,可用于去除大气中NO。其他条件相同,电解所得溶液中相关成分的浓度与电流强度的关系如图所示。

①用电解所得NaClO溶液氧化NO生成Cl-和 ,其离子方程式为:
,其离子方程式为:_______ 。
②电流强度大于4A,随着电流强度增大,电解所得溶液对NO去除率下降,其原因是:_______ 。
Ⅱ.合成氨:合成氨反应热化学方程式如下:N2(g)+3H2(g) 2NH3(g) △H=-92.4kJ/mol。
2NH3(g) △H=-92.4kJ/mol。
(3)关于合成氨的说法,正确的是_______ 。
A.合成氨反应的△H和△S都小于零
B.采用高温以提高反应的平衡转化率
C.将NH3液化后移去,利于反应速率提高和平衡正向移动
D.原料气须经过净化处理,以防止催化剂中毒和事故发生
E.采用高压以加快反应速率,提高的NH3产量
F.为提高H2转化率,可适当增大H2的浓度
(4)科学家发现,以H2O和N2为原料,熔融NaOH-KOH为电解质,纳米Fe2O3作催化剂,在250℃和常压下可实现电化学合成氨,阴极区发生的变化可按两步进行。已知第一步的反应为:Fe2O3+6e-+3H2O=2Fe+6OH-,则第二步的反应方程式为_______ 。
(5)若N2、H2 的初始投入量分别为0.1mol、0.3mol,在2L容器中反应,平衡后混合物中氨的体积分数(ψ)与温度、压强的关系如图所示。

①比较p2、p3的大小:p2_______ p3 (填“>”“<”或“=”),其原因是_______ 。
②比较平衡时A、B点对应的化学反应速率:vA(N2)_______ vB(N2) (填“>”“<”或“=”)。A、B点对应的化学平衡常数:KA_______ KB(填“>”“<”或“=”)。
③求出B点N2的转化率及KB的值(KB的值可以用分数表示),给出计算过程_______ 。
Ⅰ.含氮污染处理
(1)水体中氨氮处理:在微生物作用下,废水中
 经两步反应被氧化成
经两步反应被氧化成
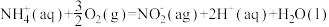 △H=-273kJ/mol
△H=-273kJ/mol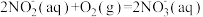 △H=-146kJ/mol
△H=-146kJ/mol则
 (aq)全部氧化成
(aq)全部氧化成 (aq)的热化学方程式是
(aq)的热化学方程式是(2)大气中NO处理:电解NaCl溶液(调节起始pH约为9)获得NaClO溶液,可用于去除大气中NO。其他条件相同,电解所得溶液中相关成分的浓度与电流强度的关系如图所示。

①用电解所得NaClO溶液氧化NO生成Cl-和
 ,其离子方程式为:
,其离子方程式为:②电流强度大于4A,随着电流强度增大,电解所得溶液对NO去除率下降,其原因是:
Ⅱ.合成氨:合成氨反应热化学方程式如下:N2(g)+3H2(g)
 2NH3(g) △H=-92.4kJ/mol。
2NH3(g) △H=-92.4kJ/mol。(3)关于合成氨的说法,正确的是
A.合成氨反应的△H和△S都小于零
B.采用高温以提高反应的平衡转化率
C.将NH3液化后移去,利于反应速率提高和平衡正向移动
D.原料气须经过净化处理,以防止催化剂中毒和事故发生
E.采用高压以加快反应速率,提高的NH3产量
F.为提高H2转化率,可适当增大H2的浓度
(4)科学家发现,以H2O和N2为原料,熔融NaOH-KOH为电解质,纳米Fe2O3作催化剂,在250℃和常压下可实现电化学合成氨,阴极区发生的变化可按两步进行。已知第一步的反应为:Fe2O3+6e-+3H2O=2Fe+6OH-,则第二步的反应方程式为
(5)若N2、H2 的初始投入量分别为0.1mol、0.3mol,在2L容器中反应,平衡后混合物中氨的体积分数(ψ)与温度、压强的关系如图所示。

①比较p2、p3的大小:p2
②比较平衡时A、B点对应的化学反应速率:vA(N2)
③求出B点N2的转化率及KB的值(KB的值可以用分数表示),给出计算过程
您最近一年使用:0次
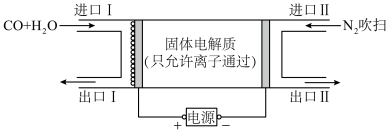
【推荐1】Ⅰ.页岩气中含有 、
、 、
、 等气体,是可供开采天然气资源。页岩气的有效利用需要处理其中所含的
等气体,是可供开采天然气资源。页岩气的有效利用需要处理其中所含的 和
和 。
。
(1) 和
和 在Cu/ZnO催化下发生反应可合成清洁能源甲醇:
在Cu/ZnO催化下发生反应可合成清洁能源甲醇: ,该反应实际上分两步进行。
,该反应实际上分两步进行。
断开(或形成)1mol化学键的能量变化数据如下表所示,利用下表中的数据可知,该反应每生成1mol甲醇,需要___________ (填“吸收”或“放出”)___________ kJ的热量。
(2)可利用 热分解制备
热分解制备 ,已知下列反应的热化学方程式:
,已知下列反应的热化学方程式:
①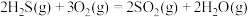
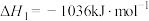
②
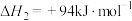
③
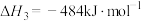
计算 热分解反应④
热分解反应④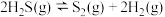

___________  。
。
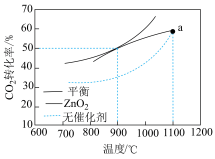
(3) 重整技术是实现“碳中和”的一种理想的
重整技术是实现“碳中和”的一种理想的 利用技术,反应为:
利用技术,反应为: 。在pMPa时,将
。在pMPa时,将 和
和 按物质的量之为1:1:充入密闭容器中,分别在无催化剂及
按物质的量之为1:1:充入密闭容器中,分别在无催化剂及 催化下反应相同时间,测得
催化下反应相同时间,测得 的转化率与温度的关系如图所示:
的转化率与温度的关系如图所示:
在pMPa、900℃、 催化条件下,将
催化条件下,将 、
、 、
、 按物质的量之比为
按物质的量之比为 充入密闭容器,
充入密闭容器, 的平衡转化率为
的平衡转化率为 ,此时平衡常数
,此时平衡常数
___________ (以分压表示,分压=总压×物质的量分数;写出含 、
、 、
、 的计算表达式)。
的计算表达式)。
Ⅱ.回收利用工业废气中的 和
和 ,实验原理示意图如下。
,实验原理示意图如下。
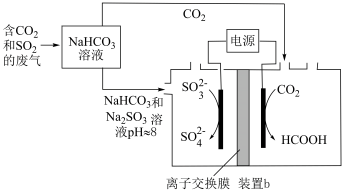
(4)①装置b中 参与反应的电极为
参与反应的电极为___________ 极(填“正”、“负”、“阴”或“阳”)
②反应后装置b中溶液pH变化___________ (填“增大”、“减小”或“不变”)
③装置b中的总反应的离子方程式为___________ 。
 、
、 、
、 等气体,是可供开采天然气资源。页岩气的有效利用需要处理其中所含的
等气体,是可供开采天然气资源。页岩气的有效利用需要处理其中所含的 和
和 。
。(1)
 和
和 在Cu/ZnO催化下发生反应可合成清洁能源甲醇:
在Cu/ZnO催化下发生反应可合成清洁能源甲醇: ,该反应实际上分两步进行。
,该反应实际上分两步进行。断开(或形成)1mol化学键的能量变化数据如下表所示,利用下表中的数据可知,该反应每生成1mol甲醇,需要
| 化学键 | H-H | C-O | C=O | O-H | C-H |
 | 436 | 326 | 803 | 464 | 414 |
(2)可利用
 热分解制备
热分解制备 ,已知下列反应的热化学方程式:
,已知下列反应的热化学方程式:①
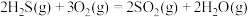
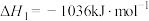
②

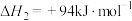
③

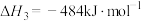
计算
 热分解反应④
热分解反应④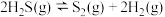

 。
。(3)
 重整技术是实现“碳中和”的一种理想的
重整技术是实现“碳中和”的一种理想的 利用技术,反应为:
利用技术,反应为: 。在pMPa时,将
。在pMPa时,将 和
和 按物质的量之为1:1:充入密闭容器中,分别在无催化剂及
按物质的量之为1:1:充入密闭容器中,分别在无催化剂及 催化下反应相同时间,测得
催化下反应相同时间,测得 的转化率与温度的关系如图所示:
的转化率与温度的关系如图所示:在pMPa、900℃、
 催化条件下,将
催化条件下,将 、
、 、
、 按物质的量之比为
按物质的量之比为 充入密闭容器,
充入密闭容器, 的平衡转化率为
的平衡转化率为 ,此时平衡常数
,此时平衡常数
 、
、 、
、 的计算表达式)。
的计算表达式)。
Ⅱ.回收利用工业废气中的
 和
和 ,实验原理示意图如下。
,实验原理示意图如下。
(4)①装置b中
 参与反应的电极为
参与反应的电极为②反应后装置b中溶液pH变化
③装置b中的总反应的离子方程式为
您最近一年使用:0次
【推荐2】甲烷是一种重要的清洁能源,也是一种重要的化工原料。我国西部和南海都有着丰富的甲烷资源。研究 的相关性质具有重要的现实意义,根据所学知识回答下列相关问题:
的相关性质具有重要的现实意义,根据所学知识回答下列相关问题:
(1)工业上可用甲烷裂解法制取乙炔,反应为 ,
,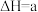
 。已知有关化学键的键能如表所示,则a=
。已知有关化学键的键能如表所示,则a=_________ 。
(2) 和
和 在一定条件下可以合成
在一定条件下可以合成 和
和 。
。
①已知:
反应Ⅰ: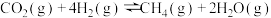

反应Ⅱ: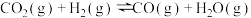

写出 和
和 在一定条件下反应生成CO(g)和
在一定条件下反应生成CO(g)和 的热化学方程式
的热化学方程式______ 。
②在刚性密闭容器中,加入等物质的量的 和
和 加入催化剂发生上述反应,起始总压
加入催化剂发生上述反应,起始总压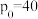
 ,测得
,测得 和
和 两种温度下
两种温度下 的转化率随反应时间(
的转化率随反应时间( )的变化如图所示。
)的变化如图所示。

则该反应的
_______ (填“>”或“<”)0,若 ,
, 时
时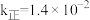
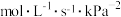 ,则A点时
,则A点时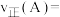
___________ 。计算 时平衡常数
时平衡常数
___________ ( 为以分压表示的平衡常数)。
为以分压表示的平衡常数)。
(3)沼气的主要成分是 ,还含有
,还含有 ,
,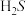 等。
等。
①Jo De Vrieze等设计利用膜电解法脱除沼气中的 和
和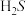 ,在酸性水溶液中,
,在酸性水溶液中,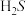 在阳极上转化为
在阳极上转化为 而除去,其电极反应式为
而除去,其电极反应式为___________ 。
②在以石墨烯为载体的催化剂作用下,25℃时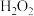 可将得到的纯净的
可将得到的纯净的 转化为含氧有机物,其主要原理如图所示,则步骤
转化为含氧有机物,其主要原理如图所示,则步骤 得到的有机物是
得到的有机物是______ ,步骤 的总反应的化学方程式为
的总反应的化学方程式为_____ 。

 的相关性质具有重要的现实意义,根据所学知识回答下列相关问题:
的相关性质具有重要的现实意义,根据所学知识回答下列相关问题:(1)工业上可用甲烷裂解法制取乙炔,反应为
 ,
,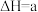
 。已知有关化学键的键能如表所示,则a=
。已知有关化学键的键能如表所示,则a=| 化学键 |  |  |  |
键能/( ) ) | 414 | 837 | 436 |
(2)
 和
和 在一定条件下可以合成
在一定条件下可以合成 和
和 。
。①已知:
反应Ⅰ:
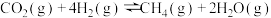

反应Ⅱ:
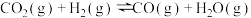

写出
 和
和 在一定条件下反应生成CO(g)和
在一定条件下反应生成CO(g)和 的热化学方程式
的热化学方程式②在刚性密闭容器中,加入等物质的量的
 和
和 加入催化剂发生上述反应,起始总压
加入催化剂发生上述反应,起始总压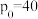
 ,测得
,测得 和
和 两种温度下
两种温度下 的转化率随反应时间(
的转化率随反应时间( )的变化如图所示。
)的变化如图所示。
则该反应的

 ,
, 时
时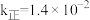
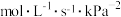 ,则A点时
,则A点时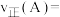
 时平衡常数
时平衡常数
 为以分压表示的平衡常数)。
为以分压表示的平衡常数)。(3)沼气的主要成分是
 ,还含有
,还含有 ,
,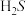 等。
等。①Jo De Vrieze等设计利用膜电解法脱除沼气中的
 和
和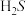 ,在酸性水溶液中,
,在酸性水溶液中,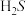 在阳极上转化为
在阳极上转化为 而除去,其电极反应式为
而除去,其电极反应式为②在以石墨烯为载体的催化剂作用下,25℃时
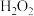 可将得到的纯净的
可将得到的纯净的 转化为含氧有机物,其主要原理如图所示,则步骤
转化为含氧有机物,其主要原理如图所示,则步骤 得到的有机物是
得到的有机物是 的总反应的化学方程式为
的总反应的化学方程式为
您最近一年使用:0次
【推荐3】以NOx为主要成分的雾霾的综合治理是当前重要的研究课题。
(1)N2O是一种强温室气体,且易形成颗粒性污染物,研究N2O的分解对环境保护有重要意义。碘蒸气存在能大幅度提高N2O的分解速率,反应历程为:
第一步: (快反应)
(快反应)
第二步: (慢反应)
(慢反应)
第三步: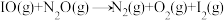 (快反应)
(快反应)
实验表明,含碘时N2O分解速率方程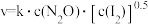 (k为速率常数)。下列表述正确的是___________
(k为速率常数)。下列表述正确的是___________
(2)汽车尾气中含有较多的氮氧化物和不完全燃烧的CO,汽车三元催化器可以实现降低氮氧化物的排放量。汽车尾气中的NO(g)和CO(g)在催化剂的作用下转化成两种无污染的气体: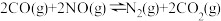
 。
。
①已知:反应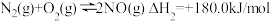 ,若CO的燃烧热
,若CO的燃烧热 为-283.5kJ/mol,则
为-283.5kJ/mol,则 =
=___________ 。
②若在恒容的密闭容器中,充入2molCO和1molNO,下列选项中不能说明该反应已经达到平衡状态的是___________ 。
A.CO和NO的物质的量之比不变 B.混合气体的密度保持不变
C.混合气体的压强保持不变 D.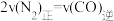
③研究表明氮氧化物的脱除率除了与还原剂、催化剂相关外,还取决于催化剂表面氧缺位的密集程度。以 (A、B均为过渡元素)为催化剂,用H2还原NO的机理如下:
(A、B均为过渡元素)为催化剂,用H2还原NO的机理如下:
第一阶段:B4+(不稳定)+H2→低价态的金属离子(还原前后催化剂中金属原子的个数不变)
第二阶段:Ⅰ. +□
+□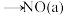
Ⅱ.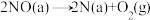
Ⅲ.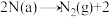 □
□
Ⅳ.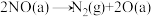
Ⅴ.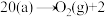 □
□
注:□表示催化剂表面的氧缺位,g表示气态,a表示吸附态
第一阶段用氢气还原B4+得到低价态的金属离子越多,第二阶段反应的速率越快,原因是___________ 。
(3) 与
与 之间存在反应
之间存在反应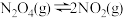 。将定量的
。将定量的 放入恒容密闭容器中,测得其平衡转化率[
放入恒容密闭容器中,测得其平衡转化率[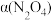 ]随温度的变化如图所示。
]随温度的变化如图所示。
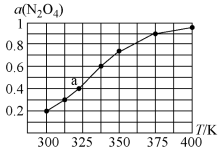
①图中a点对应温度下。已知N2O4的起始压强为108kPa,则该温度下反应的平衡常数Kp=___________ kPa(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
②在一定条件下,该反应N2O4、NO2的消耗速率与自身压强间存在关系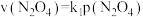 ,
,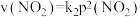 ,其中k1、k2是与反应温度有关的常数。相应的速率、压强关系如图所示,一定温度下,k1、k2与平衡常数Kp的关系是k1=
,其中k1、k2是与反应温度有关的常数。相应的速率、压强关系如图所示,一定温度下,k1、k2与平衡常数Kp的关系是k1=___________ ,在图上标出的点中,能表示反应达到平衡状态的点为___________ (填字母代号)。
(1)N2O是一种强温室气体,且易形成颗粒性污染物,研究N2O的分解对环境保护有重要意义。碘蒸气存在能大幅度提高N2O的分解速率,反应历程为:
第一步:
 (快反应)
(快反应)第二步:
 (慢反应)
(慢反应)第三步:
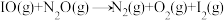 (快反应)
(快反应)实验表明,含碘时N2O分解速率方程
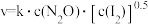 (k为速率常数)。下列表述正确的是___________
(k为速率常数)。下列表述正确的是___________| A.N2O分解反应中:k值与是否含碘蒸气有关 |
| B.第三步对总反应速率起决定作用 |
| C.第二步活化能比第三步小 |
| D.IO为反应的催化剂 |
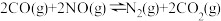
 。
。①已知:反应
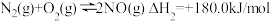 ,若CO的燃烧热
,若CO的燃烧热 为-283.5kJ/mol,则
为-283.5kJ/mol,则 =
=②若在恒容的密闭容器中,充入2molCO和1molNO,下列选项中不能说明该反应已经达到平衡状态的是
A.CO和NO的物质的量之比不变 B.混合气体的密度保持不变
C.混合气体的压强保持不变 D.
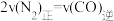
③研究表明氮氧化物的脱除率除了与还原剂、催化剂相关外,还取决于催化剂表面氧缺位的密集程度。以
 (A、B均为过渡元素)为催化剂,用H2还原NO的机理如下:
(A、B均为过渡元素)为催化剂,用H2还原NO的机理如下:第一阶段:B4+(不稳定)+H2→低价态的金属离子(还原前后催化剂中金属原子的个数不变)
第二阶段:Ⅰ.
 +□
+□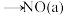
Ⅱ.
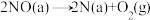
Ⅲ.
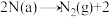 □
□Ⅳ.
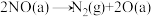
Ⅴ.
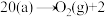 □
□注:□表示催化剂表面的氧缺位,g表示气态,a表示吸附态
第一阶段用氢气还原B4+得到低价态的金属离子越多,第二阶段反应的速率越快,原因是
(3)
 与
与 之间存在反应
之间存在反应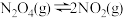 。将定量的
。将定量的 放入恒容密闭容器中,测得其平衡转化率[
放入恒容密闭容器中,测得其平衡转化率[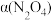 ]随温度的变化如图所示。
]随温度的变化如图所示。
①图中a点对应温度下。已知N2O4的起始压强为108kPa,则该温度下反应的平衡常数Kp=
②在一定条件下,该反应N2O4、NO2的消耗速率与自身压强间存在关系
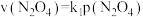 ,
,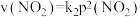 ,其中k1、k2是与反应温度有关的常数。相应的速率、压强关系如图所示,一定温度下,k1、k2与平衡常数Kp的关系是k1=
,其中k1、k2是与反应温度有关的常数。相应的速率、压强关系如图所示,一定温度下,k1、k2与平衡常数Kp的关系是k1=
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐1】锰是一种非常重要的金属元素,在很多领域有着广泛的应用。利用废铁屑还原浸出低品位软锰矿制备MnSO4,然后通过电解制备金属Mn,其工业流程图如图:
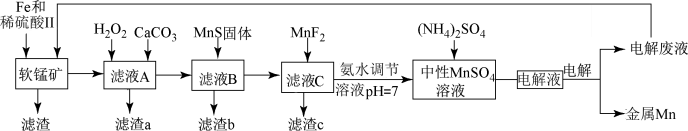
已知:i.低品位软锰矿主要成份有MnO2、Al2O3、Fe2O3、Cu2(OH)2CO3、CaCO3、SiO2等;
ii.常温下部分金属离子以氢氧化物沉淀时的pH;
iii.几种化合物的溶解性或溶度积数据(Ksp)
(1)研究表明,单质Fe和Fe2+都可以还原MnO2。在硫酸存在的条件下,MnO2将Fe氧化为Fe3+的离子方程式是________ 。
(2)滤液A先用H2O2处理,然后加入CaCO3,反应后溶液的pH约为5。滤渣a的主要成分中含有黄铵铁矾[NH4Fe3(SO4)2(OH)6]。
①H2O2的作用是______ (用离子方程式表示)。
②滤渣a中除了黄铵铁矾,主要成分还有X。用平衡移动原理解释产生X的原因_________ 。
(3)MnS固体的作用为_________ (用离子方程式表示)。
(4)滤渣c的成分是________ 。
(5)利用如图装置模拟工业流程图中的“电解”步骤制金属Mn。
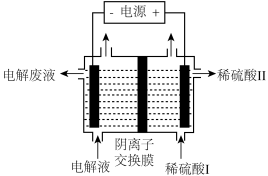
①阳极的电极反应式是_____ 。
②阴极的电极反应为Mn2++2e-=Mn和2H++2e-=H2↑。电极上H2的产生会引起制得的锰起壳开裂,降低产品质量。向滤液C中加入氨水调节溶液pH=7,除了考虑到物质循环利用、降低能耗以外,其他的原因是________ 。
③电解前,向中性MnSO4溶液中加入(NH4)2SO4的作用除了增大溶液导电性之外,还有____ (结合电极反应式和离子方程式解释)。

已知:i.低品位软锰矿主要成份有MnO2、Al2O3、Fe2O3、Cu2(OH)2CO3、CaCO3、SiO2等;
ii.常温下部分金属离子以氢氧化物沉淀时的pH;
| 金属离子 | Fe2+ | Fe3+ | Al3+ | Mn2+ | Cu2+ |
| 开始沉淀的pH | 6.8 | 1.8 | 3.7 | 8.6 | 5.2 |
| 沉淀完全的pH | 8.3 | 2.8 | 4.7 | 10.1 | 6.7 |
iii.几种化合物的溶解性或溶度积数据(Ksp)
| MnF2 | CaS | MnS | FeS | CuS |
| 溶于水 | 溶于水 | 2.5×10-13 | 6.3×10-18 | 6.3×10-36 |
(1)研究表明,单质Fe和Fe2+都可以还原MnO2。在硫酸存在的条件下,MnO2将Fe氧化为Fe3+的离子方程式是
(2)滤液A先用H2O2处理,然后加入CaCO3,反应后溶液的pH约为5。滤渣a的主要成分中含有黄铵铁矾[NH4Fe3(SO4)2(OH)6]。
①H2O2的作用是
②滤渣a中除了黄铵铁矾,主要成分还有X。用平衡移动原理解释产生X的原因
(3)MnS固体的作用为
(4)滤渣c的成分是
(5)利用如图装置模拟工业流程图中的“电解”步骤制金属Mn。

①阳极的电极反应式是
②阴极的电极反应为Mn2++2e-=Mn和2H++2e-=H2↑。电极上H2的产生会引起制得的锰起壳开裂,降低产品质量。向滤液C中加入氨水调节溶液pH=7,除了考虑到物质循环利用、降低能耗以外,其他的原因是
③电解前,向中性MnSO4溶液中加入(NH4)2SO4的作用除了增大溶液导电性之外,还有
您最近一年使用:0次
【推荐2】CoS2催化CO烟气脱硫具有广阔的工业化前景。回答下列问题:
(1)已知:
CoS2(s) +CO(g) CoS(s) +COS(g) ∆H1
CoS(s) +COS(g) ∆H1
2COS(g) +SO2(g) 3S(s) +2CO2(g) ∆H2
3S(s) +2CO2(g) ∆H2
S(s) +CoS(S) CoS2 (s) △H3
CoS2 (s) △H3
则2CO(g)+ SO2(g) 2CO2(g)+S(s) ∆H4=
2CO2(g)+S(s) ∆H4=____ 。 (用∆H1、 ∆H2、∆H3表示)
(2)在恒温、恒压的容器中模拟回收硫,加入SO2起始量均为1mol,测得CO2的平衡体积分数随CO和SO2的投料比变化如图:

①当投料比为2时,t min 时测得SO2转化率为50%,则用S的生成速率表示的反应速率v=______ g·min-1。
②当投料比为3时,CO2 的平衡体积分数对应的点是______________ 。
(3)向体积均为1L的恒温、恒客密闭容器通入2 mol CO和| mol SO2。反应体系总压强随时间的变化如图:
①相对于I,II改变的外界条件是____________________ 。
②SO2的平衡转化率为______ ,平衡常数Kp =________ (用平衡分压代替平衡浓度计算)。
(4)利用电解法处理SO2尾气可制备保险粉 (Na2S2O4).电解装置如图,则a____ b (填“>” “=”或“<”),生成S2O42-的电极反应式为____________________ 。

(1)已知:
CoS2(s) +CO(g)
 CoS(s) +COS(g) ∆H1
CoS(s) +COS(g) ∆H12COS(g) +SO2(g)
 3S(s) +2CO2(g) ∆H2
3S(s) +2CO2(g) ∆H2S(s) +CoS(S)
 CoS2 (s) △H3
CoS2 (s) △H3则2CO(g)+ SO2(g)
 2CO2(g)+S(s) ∆H4=
2CO2(g)+S(s) ∆H4=(2)在恒温、恒压的容器中模拟回收硫,加入SO2起始量均为1mol,测得CO2的平衡体积分数随CO和SO2的投料比变化如图:

①当投料比为2时,t min 时测得SO2转化率为50%,则用S的生成速率表示的反应速率v=
②当投料比为3时,CO2 的平衡体积分数对应的点是
(3)向体积均为1L的恒温、恒客密闭容器通入2 mol CO和| mol SO2。反应体系总压强随时间的变化如图:
①相对于I,II改变的外界条件是
②SO2的平衡转化率为
(4)利用电解法处理SO2尾气可制备保险粉 (Na2S2O4).电解装置如图,则a

您最近一年使用:0次
【推荐3】氢的热值高、无污染使其成为理想的能源。工业制取氢气的主要方法有煤转化、天然气转化等方法。
煤制取氢的主要原理可简化为如下反应:
反应①:C(s)+H2O(g)⇌CO(g)+H2(g) △H1=-131.5kJ·mol-1
反应②:CO(g)+H2O(g)⇌CO2(g)+H2(g) △H2=-41.2kJ·mol-1
反应③:CaO(s)+CO2(g)⇌CaCO3(s) △H3=-179.2kJ·mol-1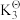
对于反应:aA(g)+bB(g)⇌cC(g)+dD(g)其标准平衡常数: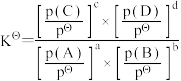
在温度恒定为1120K,压强恒定为16pΘ的反应炉内加入2molC(s)、2molH2O(g)、2molCaO(s),发生上述3个反应,平衡时CO的分压p(CO)=5pΘ。已知:PΘ=105Pa。该温度下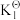 =20,
=20,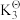 =1。
=1。
(1)写出反应③的标准平衡常数表达式: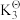 =
=___________ 。
(2)反应④:C(s)+CO2(g)⇌2CO(g) △H4=___________ 。
(3)求该温度下反应②的标准平衡常数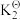 =
=___________ 。
(4)平衡时H2的分压p(H2)=___________ Pa,平衡时剩余C(s)的质量=___________ g。
(5)简述CaO(s)的作用___________ 。平衡后再加入2molCaO(s)对最终氢气的产率有何影响___________ 。
A.增大 B.减小 C.无影响 D.无法判断
(6)利用CO2作为生产各种燃料和化学物质的来源,是实现碳中和的有效策略之一、其中,电催化还原CO2具有易于直接控制、以可再生的电能驱动、能将CO2转化为多种碳产物、通常在室温常压下进行等优点,受到广泛的研究。在铜电极上将CO2还原为CO的机理如图所示:
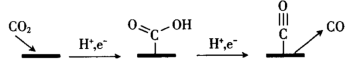
写出该机理过程总的电极方程式:___________ 。
煤制取氢的主要原理可简化为如下反应:
反应①:C(s)+H2O(g)⇌CO(g)+H2(g) △H1=-131.5kJ·mol-1
反应②:CO(g)+H2O(g)⇌CO2(g)+H2(g) △H2=-41.2kJ·mol-1
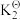
反应③:CaO(s)+CO2(g)⇌CaCO3(s) △H3=-179.2kJ·mol-1
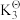
对于反应:aA(g)+bB(g)⇌cC(g)+dD(g)其标准平衡常数:
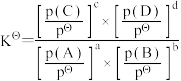
在温度恒定为1120K,压强恒定为16pΘ的反应炉内加入2molC(s)、2molH2O(g)、2molCaO(s),发生上述3个反应,平衡时CO的分压p(CO)=5pΘ。已知:PΘ=105Pa。该温度下
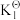 =20,
=20,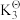 =1。
=1。(1)写出反应③的标准平衡常数表达式:
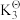 =
=(2)反应④:C(s)+CO2(g)⇌2CO(g) △H4=
(3)求该温度下反应②的标准平衡常数
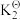 =
=(4)平衡时H2的分压p(H2)=
(5)简述CaO(s)的作用
A.增大 B.减小 C.无影响 D.无法判断
(6)利用CO2作为生产各种燃料和化学物质的来源,是实现碳中和的有效策略之一、其中,电催化还原CO2具有易于直接控制、以可再生的电能驱动、能将CO2转化为多种碳产物、通常在室温常压下进行等优点,受到广泛的研究。在铜电极上将CO2还原为CO的机理如图所示:

写出该机理过程总的电极方程式:
您最近一年使用:0次



