氮和氮的化合物与人类关系密切。已知:
i.
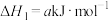
ii.
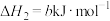
iii.

(1)

___________  (用含a、b、c的式子表示)。
(用含a、b、c的式子表示)。
(2)T℃时,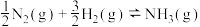
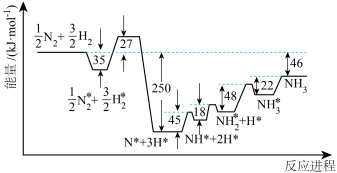
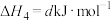 。各步反应的能量变化如图所示,其中吸附在催化剂表面上的物种用“*”标注。图中决速步骤的反应方程式为
。各步反应的能量变化如图所示,其中吸附在催化剂表面上的物种用“*”标注。图中决速步骤的反应方程式为___________ ;d=___________ 。
(3)某小组往一恒温恒压含有铁触媒的容器中充入1
 和3
和3
 ,模拟合成氨的反应,不同温度下达到平衡时混合物中氨气的体积分数与总压强(p)的关系如图。
,模拟合成氨的反应,不同温度下达到平衡时混合物中氨气的体积分数与总压强(p)的关系如图。
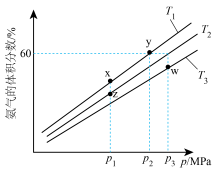
①图中温度 、
、 、
、 由大到小的顺序为
由大到小的顺序为___________ ,图中x、y、z、w四点中,化学反应速率最快的是___________ 点。
②y点时, 的平衡转化率为
的平衡转化率为___________ ;在温度 时,该反应的平衡常数
时,该反应的平衡常数
___________  (
( 为以分压表示的平衡常数,分压=总压×物质的量分数,用含
为以分压表示的平衡常数,分压=总压×物质的量分数,用含 的式子表示)。
的式子表示)。
③若在恒容条件下发生该反应,下列说法正确的是___________ (填标号)。
A.温度升高, 将增大
将增大
B.当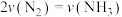 时,反应达到了平衡
时,反应达到了平衡
C.当 的体积分数不再改变时,反应达到了平衡
的体积分数不再改变时,反应达到了平衡
D.断裂1
 键的同时断裂6
键的同时断裂6
 键,说明反应达到了平衡
键,说明反应达到了平衡
(4)氨的催化氧化过程中同时发生的反应主要如下:
反应I.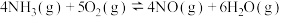
反应II.
测得相同时间内 、
、 的产率与温度的关系如图所示。
的产率与温度的关系如图所示。
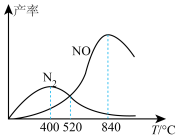
①反应II为___________ (填“放热”或“吸热”)反应。
②随着温度升高, 的产率先增大后减小的原因为
的产率先增大后减小的原因为___________ 。
i.

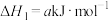
ii.

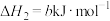
iii.


(1)


 (用含a、b、c的式子表示)。
(用含a、b、c的式子表示)。(2)T℃时,
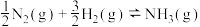
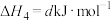 。各步反应的能量变化如图所示,其中吸附在催化剂表面上的物种用“*”标注。图中决速步骤的反应方程式为
。各步反应的能量变化如图所示,其中吸附在催化剂表面上的物种用“*”标注。图中决速步骤的反应方程式为
(3)某小组往一恒温恒压含有铁触媒的容器中充入1

 和3
和3
 ,模拟合成氨的反应,不同温度下达到平衡时混合物中氨气的体积分数与总压强(p)的关系如图。
,模拟合成氨的反应,不同温度下达到平衡时混合物中氨气的体积分数与总压强(p)的关系如图。
①图中温度
 、
、 、
、 由大到小的顺序为
由大到小的顺序为②y点时,
 的平衡转化率为
的平衡转化率为 时,该反应的平衡常数
时,该反应的平衡常数
 (
( 为以分压表示的平衡常数,分压=总压×物质的量分数,用含
为以分压表示的平衡常数,分压=总压×物质的量分数,用含 的式子表示)。
的式子表示)。③若在恒容条件下发生该反应,下列说法正确的是
A.温度升高,
 将增大
将增大B.当
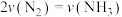 时,反应达到了平衡
时,反应达到了平衡C.当
 的体积分数不再改变时,反应达到了平衡
的体积分数不再改变时,反应达到了平衡D.断裂1

 键的同时断裂6
键的同时断裂6
 键,说明反应达到了平衡
键,说明反应达到了平衡(4)氨的催化氧化过程中同时发生的反应主要如下:
反应I.
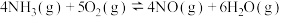
反应II.

测得相同时间内
 、
、 的产率与温度的关系如图所示。
的产率与温度的关系如图所示。
①反应II为
②随着温度升高,
 的产率先增大后减小的原因为
的产率先增大后减小的原因为
更新时间:2023-11-13 16:02:22
|
相似题推荐
【推荐1】锂电池有广阔的应用前景。用“循环电沉积”法处理某种锂电池,可使其中的Li电极表面生成只允许 通过的
通过的 和C保护层,工作原理如图1,具体操作如下。
和C保护层,工作原理如图1,具体操作如下。
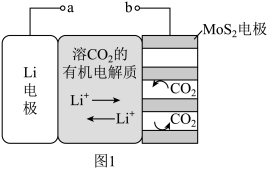
i.将表面洁净的Li电极和 电极浸在溶有
电极浸在溶有 的有机电解质溶液中。
的有机电解质溶液中。
ii.0-5min,a端连接电源正极,b端连接电源负极,电解, 电极上生成
电极上生成 和C。
和C。
iii.5-10min,a端连接电源负极,b端连接电源正极,电解, 电极上消耗
电极上消耗 和C,Li电极上生成
和C,Li电极上生成 和C,步骤ⅱ和步骤iii为1个电沉积循环。
和C,步骤ⅱ和步骤iii为1个电沉积循环。
iv.重复步骤ⅱ和步骤ⅲ的操作,继续完成9个电沉积循环。
(1)步骤ii内电路中的 由
由_______ 向_______ 迁移(填“Li电极”或“ 电极”)。
电极”)。
(2)已知下列反应的热化学方程式。
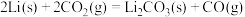


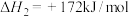
步骤ⅱ电解总反应的热化学方程式为_______ 。
(3)步骤ⅲ中,Li电极的电极反应式为_______ 。
(4) 和C只有在
和C只有在 的催化作用下才能发生步骤ⅲ的电极反应,反应历程中的能量变化如下图。下列说法正确的是
的催化作用下才能发生步骤ⅲ的电极反应,反应历程中的能量变化如下图。下列说法正确的是_______ (填字母序号)。
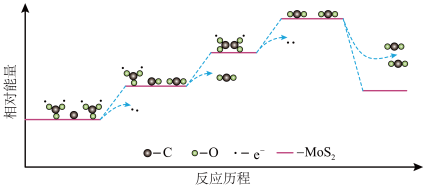
a.反应历程中存在碳氧键的断裂和形成
b.反应历程中涉及电子转移的变化均释放能量
c. 催化剂通过降低电极反应的活化能使反应速率加快
催化剂通过降低电极反应的活化能使反应速率加快
 通过的
通过的 和C保护层,工作原理如图1,具体操作如下。
和C保护层,工作原理如图1,具体操作如下。
i.将表面洁净的Li电极和
 电极浸在溶有
电极浸在溶有 的有机电解质溶液中。
的有机电解质溶液中。ii.0-5min,a端连接电源正极,b端连接电源负极,电解,
 电极上生成
电极上生成 和C。
和C。iii.5-10min,a端连接电源负极,b端连接电源正极,电解,
 电极上消耗
电极上消耗 和C,Li电极上生成
和C,Li电极上生成 和C,步骤ⅱ和步骤iii为1个电沉积循环。
和C,步骤ⅱ和步骤iii为1个电沉积循环。iv.重复步骤ⅱ和步骤ⅲ的操作,继续完成9个电沉积循环。
(1)步骤ii内电路中的
 由
由 电极”)。
电极”)。(2)已知下列反应的热化学方程式。
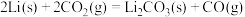


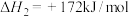
步骤ⅱ电解总反应的热化学方程式为
(3)步骤ⅲ中,Li电极的电极反应式为
(4)
 和C只有在
和C只有在 的催化作用下才能发生步骤ⅲ的电极反应,反应历程中的能量变化如下图。下列说法正确的是
的催化作用下才能发生步骤ⅲ的电极反应,反应历程中的能量变化如下图。下列说法正确的是
a.反应历程中存在碳氧键的断裂和形成
b.反应历程中涉及电子转移的变化均释放能量
c.
 催化剂通过降低电极反应的活化能使反应速率加快
催化剂通过降低电极反应的活化能使反应速率加快
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
解题方法
【推荐2】实验室利用下列装置模拟工业生产制备少量硝酸。
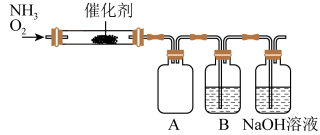
(1)实验结束时,两种反应气体中需要再持续通入_______ (填化学式)一段时间。
(2)B中反应的化学方程式为_______ 。
(3)实验时先用酒精喷灯预热催化剂,然后通入反应气体,当催化剂红热后撤离酒精喷灯,催化剂始终保持红热,温度可达到700℃以上。下列图示中,能够正确表示该反应过程能量变化的是_______
(4)已知:①2H2(g)+O2(g)=2H2O(1) △H=-571.5kJ/mol
②N2(g)+2O2(g)=2NO2(g) △H=+68.0kJ/mol
③N2(g)+3H2(g)=2NH3(g) △H=-92.5kJ/mol
则:8NH3(g)+6NO2(g)=7N2(g)+12H2O(l) △H=_______ kJ/mol
(5)控制氨气和氧气的比例是制备硝酸的关键。
①当比例不合适时,A中不仅有红棕色气体产生,还伴有白烟。白烟是_______ (填化学式)。
②理论上使氨气完全转化为硝酸,则NH3与O2(相同条件下)的体积比应满足V(NH3):V(O2)_____ 。

(1)实验结束时,两种反应气体中需要再持续通入
(2)B中反应的化学方程式为
(3)实验时先用酒精喷灯预热催化剂,然后通入反应气体,当催化剂红热后撤离酒精喷灯,催化剂始终保持红热,温度可达到700℃以上。下列图示中,能够正确表示该反应过程能量变化的是_______
A.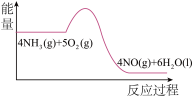 | B.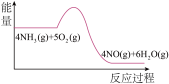 | C.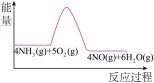 | D.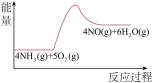 |
②N2(g)+2O2(g)=2NO2(g) △H=+68.0kJ/mol
③N2(g)+3H2(g)=2NH3(g) △H=-92.5kJ/mol
则:8NH3(g)+6NO2(g)=7N2(g)+12H2O(l) △H=
(5)控制氨气和氧气的比例是制备硝酸的关键。
①当比例不合适时,A中不仅有红棕色气体产生,还伴有白烟。白烟是
②理论上使氨气完全转化为硝酸,则NH3与O2(相同条件下)的体积比应满足V(NH3):V(O2)
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐3】用H2O2、KI 和洗洁精可完成“大象牙膏”实验(短时间内产生大量泡沫),某同学依据文献资料对该实验进行探究。
(1)资料1:KI 在该反应中的作用:H2O2 + I = H2O+ IO ;H2O2 + IO = H2O+ O2↑+ I 。总反应的化学方程式是________ 。
(2)资料 2:H2O2 分解反应过程中能量变化如图所示,其中①有 KI 加入,②无 KI 加入。下列 判断正确的是___________ (填字母)。

a.加入KI 后改变了反应的路径
b.加入KI 后改变了总反应的能量变化
c.H2O2 + I = H2O + IO 是放热反应
(3)实验中发现,H2O2与 KI 溶液混合后,产生大量气泡,溶液颜色变黄。再加入 CCl4,振荡、静置,气泡明显减少。
资料 3:I2 也可催化H2O2的分解反应。
① 加CCl4 并振荡、静置后还可观察到________ ,说明有 I2 生成。
② 气泡明显减少的原因可能是:ⅰ.H2O2 浓度降低;ⅱ.________ 。以下对照实验说明ⅰ不是主要原因:向H2O2溶液中加入 KI 溶液,待溶液变黄后,分成两等份于A、B 两试管中。A 试管加入 CCl4,B 试管不加CCl4,分别振荡、静置。观察到的现象是________ 。
(4)资料 4: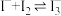 K= 640。
K= 640。
为了探究体系中含碘微粒的存在形式,进行实验:向 20 mL 一定浓度的H2O2溶液中加入10 mL 0.10 mol·L−1 KI 溶液,达平衡后,相关微粒浓度如下:
① a =___________ 。
② 该平衡体系中除了含有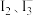 和
和 外,一定还含有其他含碘微粒,理由是
外,一定还含有其他含碘微粒,理由是___________ 。
(1)资料1:KI 在该反应中的作用:H2O2 + I = H2O+ IO ;H2O2 + IO = H2O+ O2↑+ I 。总反应的化学方程式是
(2)资料 2:H2O2 分解反应过程中能量变化如图所示,其中①有 KI 加入,②无 KI 加入。下列 判断正确的是

a.加入KI 后改变了反应的路径
b.加入KI 后改变了总反应的能量变化
c.H2O2 + I = H2O + IO 是放热反应
(3)实验中发现,H2O2与 KI 溶液混合后,产生大量气泡,溶液颜色变黄。再加入 CCl4,振荡、静置,气泡明显减少。
资料 3:I2 也可催化H2O2的分解反应。
① 加CCl4 并振荡、静置后还可观察到
② 气泡明显减少的原因可能是:ⅰ.H2O2 浓度降低;ⅱ.
(4)资料 4:
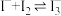 K= 640。
K= 640。为了探究体系中含碘微粒的存在形式,进行实验:向 20 mL 一定浓度的H2O2溶液中加入10 mL 0.10 mol·L−1 KI 溶液,达平衡后,相关微粒浓度如下:
| 微粒 |  |  |  |
| 浓度(mol·L−1) | 2.5×10−3 | a | 4.0×10−3 |
② 该平衡体系中除了含有
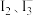 和
和 外,一定还含有其他含碘微粒,理由是
外,一定还含有其他含碘微粒,理由是
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐1】甲烷-CO2重整反应可以得到用途广泛的合成气,已知方程式如下。回答下列问题:
CH4(g)+CO2(g)=2H2(g)+2CO(g) ΔH>0
(1)相关物质的燃烧热数据如下表所示:
① ΔH=___________ kJ·mol-1
② 用Ni基双金属催化,反应的活化能降低,ΔH___________ (填“变大”、“变小”或者“不变”)
(2)控制其它条件不变,改变温度对合成气中甲烷质量分数的影响如图。

若充入a molCH4,经过2小时后达到如右图A点,2小时内用CH4表示的平均反应速率为___________ mol/h(用a表示);假设A为平衡态,此时压强为2MPa,平衡常数Kp=___________ (用平衡分压代替平衡浓度,分压=总压x物质的量分数,保留2位小数)。
(3)甲烷的重整反应速率可以表示为η=k·p(CH4) [p(CH4)是指甲烷的分压],其中k为速率常数。下列说法正确的是___________ 。
a.增加甲烷的浓度,η增大 b.增加CO2浓度,η增大
c.及时分离合成气,η增大 d.通过升高温度,提升k
(4)已知在高温的条件下,会发生如下副反应:CO2(g)+H2(g)=CO(g)+H2O(g) ΔH2=+41.0 kJ·mol-1,且温度越高副反应的转化率越高,化学上称之为“温度的选择性”。不同n(CO2)/n(CH4)配比随温度变化对平衡时n(H2)/n(CO)配比的影响如图所示。

按n(CO2)/n(CH4)=2.5的配比进料,随温度升高,合成气n(H2)/n(CO)配比“先增加后减小”。增加是因为高温有利甲烷分解的积碳反应,请解释“减小”的可能原因___________ 。
(5)一定温度下反应会出现积碳现象而降低催化剂活性。如图是Ni基双金属催化剂抗积碳的示意图。

结合图示:
①写出一个可能的积碳反应方程式___________ 。
② 金属钴能有效消碳的原因是___________ 。
CH4(g)+CO2(g)=2H2(g)+2CO(g) ΔH>0
(1)相关物质的燃烧热数据如下表所示:
| 物质 | CH4(g) | CO(g) | H2(g) |
| 燃烧热(kJ·mol-1) | 890.3 | 283.0 | 285.8 |
② 用Ni基双金属催化,反应的活化能降低,ΔH
(2)控制其它条件不变,改变温度对合成气中甲烷质量分数的影响如图。

若充入a molCH4,经过2小时后达到如右图A点,2小时内用CH4表示的平均反应速率为
(3)甲烷的重整反应速率可以表示为η=k·p(CH4) [p(CH4)是指甲烷的分压],其中k为速率常数。下列说法正确的是
a.增加甲烷的浓度,η增大 b.增加CO2浓度,η增大
c.及时分离合成气,η增大 d.通过升高温度,提升k
(4)已知在高温的条件下,会发生如下副反应:CO2(g)+H2(g)=CO(g)+H2O(g) ΔH2=+41.0 kJ·mol-1,且温度越高副反应的转化率越高,化学上称之为“温度的选择性”。不同n(CO2)/n(CH4)配比随温度变化对平衡时n(H2)/n(CO)配比的影响如图所示。

按n(CO2)/n(CH4)=2.5的配比进料,随温度升高,合成气n(H2)/n(CO)配比“先增加后减小”。增加是因为高温有利甲烷分解的积碳反应,请解释“减小”的可能原因
(5)一定温度下反应会出现积碳现象而降低催化剂活性。如图是Ni基双金属催化剂抗积碳的示意图。

结合图示:
①写出一个可能的积碳反应方程式
② 金属钴能有效消碳的原因是
您最近一年使用:0次
【推荐2】氨气和甲醇都是重要的工业产品,试运用必要的化学原理解决有关问题。
(1)在密闭容器中,使 和
和 在一定条件下发生反应:
在一定条件下发生反应: 。
。
①平衡后, 和
和 的转化率的比值
的转化率的比值_______ 1(填“>”“<”或“=”)。
②当达到平衡时,保持恒温,压缩容器体积,平衡_______ (填“正向”“逆向”或“不”)移动,化学平衡常数K_______ (填“增大”“减小”或“不变”)。
(2)水煤气在一定条件下可合成甲醇: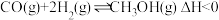 。将
。将 和
和 充入
充入 恒容密闭容器中,在一定条件下合成甲醇,反应相同时间(
恒容密闭容器中,在一定条件下合成甲醇,反应相同时间( )时测得不同温度下
)时测得不同温度下 的转化率如图所示:
的转化率如图所示:
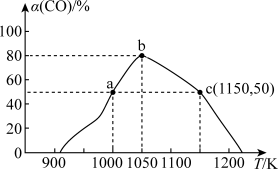
①温度在 下,从反应开始至
下,从反应开始至 末,这段时间内的反应速率
末,这段时间内的反应速率
_______ 。
②由图可知,在温度低于 时,
时, 的转化率随温度的升高而增大,原因是
的转化率随温度的升高而增大,原因是_______ 。
③已知c点时容器内气体的压强为P,则在 下该反应的压强平衡常数
下该反应的压强平衡常数 为
为_______ 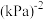 (用含p的代数式表示,
(用含p的代数式表示, 是用各气体的分压替代浓度来计算的平衡常数,分压=总压×物质的量分数)。
是用各气体的分压替代浓度来计算的平衡常数,分压=总压×物质的量分数)。
(3)探究 合成反应化学平衡的影响因素,有利于提高
合成反应化学平衡的影响因素,有利于提高 的产率。以
的产率。以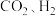 为原料合成
为原料合成 涉及的主要反应如下:
涉及的主要反应如下:
I.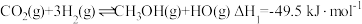
II.
III.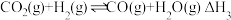
一定条件下,向体积为 的恒容密闭容器中通入
的恒容密闭容器中通入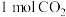 和
和 发生上述反应,达到平衡时,容器中
发生上述反应,达到平衡时,容器中 为
为 ,
, 为
为 ,此时
,此时 的浓度为
的浓度为_______  (用含a、b、V的代数式表示,可以不化简,下同),反应Ⅲ的平衡常数为
(用含a、b、V的代数式表示,可以不化简,下同),反应Ⅲ的平衡常数为_______ 。
(1)在密闭容器中,使
 和
和 在一定条件下发生反应:
在一定条件下发生反应: 。
。①平衡后,
 和
和 的转化率的比值
的转化率的比值②当达到平衡时,保持恒温,压缩容器体积,平衡
(2)水煤气在一定条件下可合成甲醇:
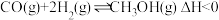 。将
。将 和
和 充入
充入 恒容密闭容器中,在一定条件下合成甲醇,反应相同时间(
恒容密闭容器中,在一定条件下合成甲醇,反应相同时间( )时测得不同温度下
)时测得不同温度下 的转化率如图所示:
的转化率如图所示:
①温度在
 下,从反应开始至
下,从反应开始至 末,这段时间内的反应速率
末,这段时间内的反应速率
②由图可知,在温度低于
 时,
时, 的转化率随温度的升高而增大,原因是
的转化率随温度的升高而增大,原因是③已知c点时容器内气体的压强为P,则在
 下该反应的压强平衡常数
下该反应的压强平衡常数 为
为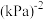 (用含p的代数式表示,
(用含p的代数式表示, 是用各气体的分压替代浓度来计算的平衡常数,分压=总压×物质的量分数)。
是用各气体的分压替代浓度来计算的平衡常数,分压=总压×物质的量分数)。(3)探究
 合成反应化学平衡的影响因素,有利于提高
合成反应化学平衡的影响因素,有利于提高 的产率。以
的产率。以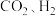 为原料合成
为原料合成 涉及的主要反应如下:
涉及的主要反应如下:I.
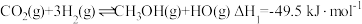
II.

III.
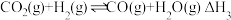
一定条件下,向体积为
 的恒容密闭容器中通入
的恒容密闭容器中通入 和
和 发生上述反应,达到平衡时,容器中
发生上述反应,达到平衡时,容器中 为
为 ,
, 为
为 ,此时
,此时 的浓度为
的浓度为 (用含a、b、V的代数式表示,可以不化简,下同),反应Ⅲ的平衡常数为
(用含a、b、V的代数式表示,可以不化简,下同),反应Ⅲ的平衡常数为
您最近一年使用:0次
【推荐3】在催化剂作用下H2(g)可将烟气中的SO2(g)还原成S(s)。回答下列问题:
(1)已知:
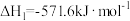

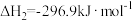
则H2(g)还原烟气中的SO2(g)的热化学方程式为___________ 。
(2)在容积为10L的容器中充入1mol SO2(g)与2mol H2(g)的混合气体,发生反应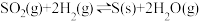
 。
。
①恒容时,反应经过4s后达到平衡,此时测得H2O(g)的物质的量为1.2mol。则0~4s内,v(H2)=___________ mol/(L·s),平衡时,c(SO2)=___________ mol/L;若平衡后升高温度,SO2的转化率将___________ (填“增 大”“减小”或“不变”)。
②恒温时,压强p与SO2的平衡转化率α如图所示,该温度下,该反应的平衡常数K=___________ L/mol;平衡状态由A变到B,平衡常数K(A) ___________ (填“>”“<”或“=”)K(B)。
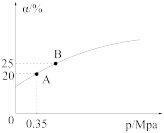
③若在恒温恒容密闭容器中发生上述反应,下列可作为该反应达到平衡状态的标志是___________ (填标号)。
A.压强不再变化
B.密度不再变化
C.气体的平均相对分子质量不再变化
D.SO2的消耗速率与H2的消耗速率之比为1∶2
(1)已知:

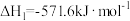

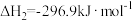
则H2(g)还原烟气中的SO2(g)的热化学方程式为
(2)在容积为10L的容器中充入1mol SO2(g)与2mol H2(g)的混合气体,发生反应
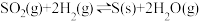
 。
。①恒容时,反应经过4s后达到平衡,此时测得H2O(g)的物质的量为1.2mol。则0~4s内,v(H2)=
②恒温时,压强p与SO2的平衡转化率α如图所示,该温度下,该反应的平衡常数K=

③若在恒温恒容密闭容器中发生上述反应,下列可作为该反应达到平衡状态的标志是
A.压强不再变化
B.密度不再变化
C.气体的平均相对分子质量不再变化
D.SO2的消耗速率与H2的消耗速率之比为1∶2
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐1】工业合成氨是人类科学技术的一项重大突破,目前已有三位科学家因其获得诺贝尔奖,其反应为: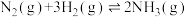
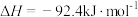 ,
,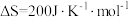 。回答下列问题:
。回答下列问题:
(1)合成氨反应在常温下___________ (填“能”或“不能”)自发。
(2)___________ 温(填“高”或“低”,下同)有利于提高反应速率,________ 温有利于提高平衡转化率,综合考虑催化剂(铁触媒)活性等因素,工业常采用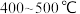 。
。
针对反应速率与平衡产率的矛盾,我国科学家提出了两种解决方案。
方案一:双温-双控-双催化剂。使用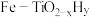 双催化剂,通过光辐射产生温差(如体系温度为495℃时, Fe的温度为:
双催化剂,通过光辐射产生温差(如体系温度为495℃时, Fe的温度为: 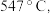 而
而 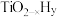 的温度为
的温度为 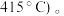
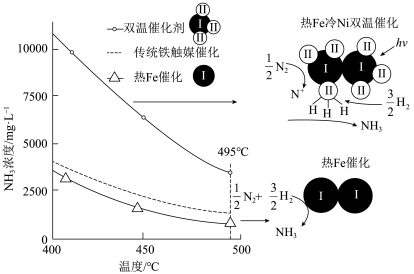
(3)下列说法正确的是___________ 。
a 氨气在“冷Ti”表面生成,有利于提高氨的平衡产率
b. N≡N在“热Fe”表面断裂,有利于提高合成氨反应速率
a.“热Fe”高于体系温度,有利于提高氨的平衡产率
d. “冷 Ti”低于体系温度,有利于提高合成氨反应速率
方案二: 复合催化剂。
复合催化剂。
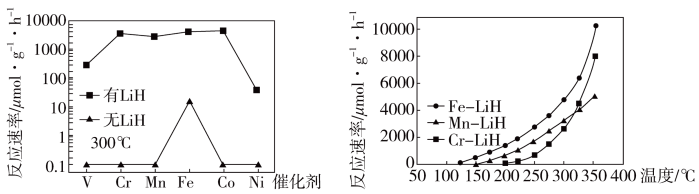
(4)下列说法正确的是___________ 。
a. 300℃时,复合催化剂比单一催化剂效率更高
b. 同温同压下,复合催化剂有利于提高氨的平衡产率
c. 温度越高,复合催化剂活性一定越高
(5)某合成氨速率方程为: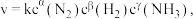 根据表中数据,
根据表中数据,
____________ 。
在合成氨过程中,需要不断分离出氨的原因为___________ 。
a. 有利于平衡正向移动 b. 防止催化剂中毒 c. 提高正反应速率
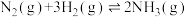
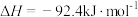 ,
,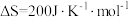 。回答下列问题:
。回答下列问题:(1)合成氨反应在常温下
(2)
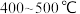 。
。针对反应速率与平衡产率的矛盾,我国科学家提出了两种解决方案。
方案一:双温-双控-双催化剂。使用
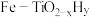 双催化剂,通过光辐射产生温差(如体系温度为495℃时, Fe的温度为:
双催化剂,通过光辐射产生温差(如体系温度为495℃时, Fe的温度为: 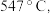 而
而 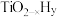 的温度为
的温度为 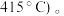

(3)下列说法正确的是
a 氨气在“冷Ti”表面生成,有利于提高氨的平衡产率
b. N≡N在“热Fe”表面断裂,有利于提高合成氨反应速率
a.“热Fe”高于体系温度,有利于提高氨的平衡产率
d. “冷 Ti”低于体系温度,有利于提高合成氨反应速率
方案二:
 复合催化剂。
复合催化剂。
(4)下列说法正确的是
a. 300℃时,复合催化剂比单一催化剂效率更高
b. 同温同压下,复合催化剂有利于提高氨的平衡产率
c. 温度越高,复合催化剂活性一定越高
(5)某合成氨速率方程为:
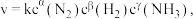 根据表中数据,
根据表中数据,
| 实验 | c(N2)/mol·L-1 | c(H2)/mol·L-1 | c(NH3)/mol·L-1 | v/mol·L-1·s-1 |
| 1 | m | n | p | q |
| 2 | 2m | n | p | 2q |
| 3 | m | n | 0.1p | 10q |
| 4 | m | 2n | p | 2.828q |
a. 有利于平衡正向移动 b. 防止催化剂中毒 c. 提高正反应速率
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
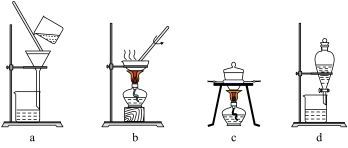
【推荐2】某矿样中含有大量的CuS及少量其他不含铜不溶于酸的杂质。实验室中以该矿样为原料制备CuCl2·2H2O晶体,流程如下:
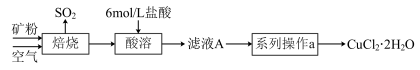
(1)①若在实验室中完成系列操作a。则下列实验操作中,不需要的是____________ (填字母)。
②CuCl2溶液中存在平衡:Cu(H2O)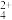 (蓝色)+4Cl-
(蓝色)+4Cl- CuCl
CuCl (黄色)+4H2O。欲用实验证明滤液A(绿色)中存在上述平衡,除滤液A外,下列试剂中还需要的是
(黄色)+4H2O。欲用实验证明滤液A(绿色)中存在上述平衡,除滤液A外,下列试剂中还需要的是_____ (填字母)。
a.FeCl3固体b.CuCl2固体c.蒸馏水
(2)某化学小组欲在实验室中研究CuS焙烧的反应过程,查阅资料得知在空气中焙烧CuS时,固体质量变化曲线及SO2生成曲线如图。
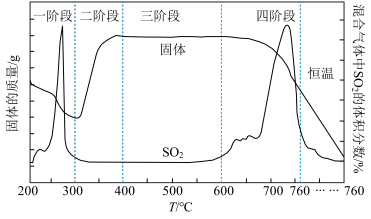
①CuS矿样在焙烧过程中,有Cu2S、CuO·CuSO4、CuSO4、CuO生成,转化顺序为CuS Cu2S
Cu2S CuO·CuSO4
CuO·CuSO4 CuSO4
CuSO4 CuO第①步转化主要在200~300℃内进行,该步转化的化学方程式
CuO第①步转化主要在200~300℃内进行,该步转化的化学方程式__________________ 。
②300~400℃内,固体质量明显增加的原因是_________________ .
③实验证明第四阶段所得混合气体所需试剂为________ 、________ 。
④若原CuS矿样的质量为10.0g,实验过程中,保持在760℃左右持续加热,待矿样充分反应后,所得固体的质量为8.4g,则原矿样中CuS的质量分数为_____ 。

(1)①若在实验室中完成系列操作a。则下列实验操作中,不需要的是

②CuCl2溶液中存在平衡:Cu(H2O)
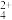 (蓝色)+4Cl-
(蓝色)+4Cl- CuCl
CuCl (黄色)+4H2O。欲用实验证明滤液A(绿色)中存在上述平衡,除滤液A外,下列试剂中还需要的是
(黄色)+4H2O。欲用实验证明滤液A(绿色)中存在上述平衡,除滤液A外,下列试剂中还需要的是a.FeCl3固体b.CuCl2固体c.蒸馏水
(2)某化学小组欲在实验室中研究CuS焙烧的反应过程,查阅资料得知在空气中焙烧CuS时,固体质量变化曲线及SO2生成曲线如图。

①CuS矿样在焙烧过程中,有Cu2S、CuO·CuSO4、CuSO4、CuO生成,转化顺序为CuS
 Cu2S
Cu2S CuO·CuSO4
CuO·CuSO4 CuSO4
CuSO4 CuO第①步转化主要在200~300℃内进行,该步转化的化学方程式
CuO第①步转化主要在200~300℃内进行,该步转化的化学方程式②300~400℃内,固体质量明显增加的原因是
③实验证明第四阶段所得混合气体所需试剂为
④若原CuS矿样的质量为10.0g,实验过程中,保持在760℃左右持续加热,待矿样充分反应后,所得固体的质量为8.4g,则原矿样中CuS的质量分数为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐3】氢能是一种极具发展潜力的清洁能源,目前有以下制取氢气的方法:
(1)水煤气变换制氢: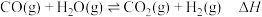
已知: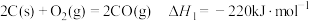
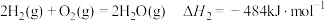
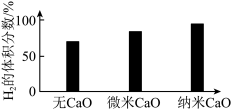
水煤气变换制氢体系中,一定时间内, 的添加情况与
的添加情况与 的体积分数关系如图。
的体积分数关系如图。
①水煤气变换制氢反应的
___________  。
。
②添加 后
后 的体积分数增大的原因是
的体积分数增大的原因是___________ (用化学方程式表达)。
③对比纳米 和微
和微 ,前者
,前者 的体积分数更大的原因是
的体积分数更大的原因是___________ 。
(2)甲醇水蒸气重整制氢: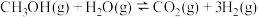 。控制原料气
。控制原料气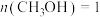 ,体系中甲醇的平衡转化率与温度和压强的关系如图。
,体系中甲醇的平衡转化率与温度和压强的关系如图。
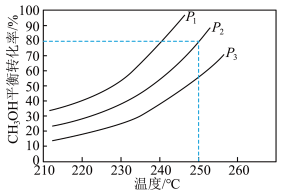
①甲醇水蒸气重整制氢反应在___________ 条件(填“高温”“低温”或“任意温度”)下能自发进行。
②图中的压强由小到大的顺序是___________ ,理由是___________ 。
③温度为250℃、压强为P2时,该反应的压力平衡常数Kp=___________ (列出算式)。
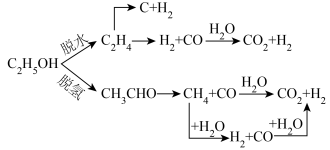
(3)乙醇重整制氢两条途径的机理如下图,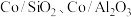 和
和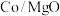 催化剂(酸性
催化剂(酸性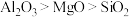 )在反应中表现出良好的催化活性和氢气选择性,但经长期反应后,催化剂表面均发现了积碳,积碳量
)在反应中表现出良好的催化活性和氢气选择性,但经长期反应后,催化剂表面均发现了积碳,积碳量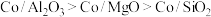 ,试分析
,试分析 表面的积碳量最大的原因
表面的积碳量最大的原因___________ 。
(1)水煤气变换制氢:
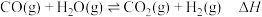
已知:
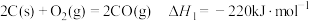
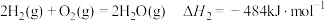
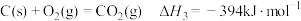
水煤气变换制氢体系中,一定时间内,
 的添加情况与
的添加情况与 的体积分数关系如图。
的体积分数关系如图。
①水煤气变换制氢反应的

 。
。②添加
 后
后 的体积分数增大的原因是
的体积分数增大的原因是③对比纳米
 和微
和微 ,前者
,前者 的体积分数更大的原因是
的体积分数更大的原因是(2)甲醇水蒸气重整制氢:
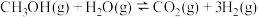 。控制原料气
。控制原料气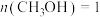 ,体系中甲醇的平衡转化率与温度和压强的关系如图。
,体系中甲醇的平衡转化率与温度和压强的关系如图。
①甲醇水蒸气重整制氢反应在
②图中的压强由小到大的顺序是
③温度为250℃、压强为P2时,该反应的压力平衡常数Kp=
(3)乙醇重整制氢两条途径的机理如下图,
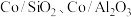 和
和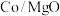 催化剂(酸性
催化剂(酸性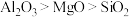 )在反应中表现出良好的催化活性和氢气选择性,但经长期反应后,催化剂表面均发现了积碳,积碳量
)在反应中表现出良好的催化活性和氢气选择性,但经长期反应后,催化剂表面均发现了积碳,积碳量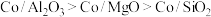 ,试分析
,试分析 表面的积碳量最大的原因
表面的积碳量最大的原因
您最近一年使用:0次
【推荐1】 可作大型船舶的绿色燃料,可由CO或
可作大型船舶的绿色燃料,可由CO或 制备。工业上用
制备。工业上用 制备
制备 的原理如下:
的原理如下:
反应1:
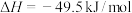
反应2:
 (副反应)
(副反应)
(1) ,该反应的ΔH=
,该反应的ΔH=___________ kJ/mol。
(2)将 和
和 按物质的量之比1∶3通入密闭容器中发生反应1和反应2,分别在1MPa、3MPa、5MPa下改变反应温度,测得
按物质的量之比1∶3通入密闭容器中发生反应1和反应2,分别在1MPa、3MPa、5MPa下改变反应温度,测得 的平衡转化率(
的平衡转化率( )以及生成
)以及生成 、CO选择性(S)的变化如图[选择性为目标产物在总产物(
、CO选择性(S)的变化如图[选择性为目标产物在总产物( 和CO)中的比率]。
和CO)中的比率]。 随温度变化趋势的是曲线
随温度变化趋势的是曲线___________ (填“a”、“b”或“c”)。
②随着温度升高,a、b、c三条曲线接近重合的原因是___________ 。
③P点对应的反应2的平衡常数
___________ (结果保留2位有效数字,已知:分压=总压×该组分物质的量分数,对于反应 的
的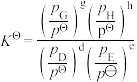 ,其中
,其中 ,
,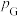 、
、 、
、 、
、 为各组分的平衡分压)。
为各组分的平衡分压)。
(3)最近,中科院研究出首例在室温条件超快传输的氢负离子导体 ,将带来系列技术变革。某小组据此设计了如图装置,以电化学方法进行反应1。
,将带来系列技术变革。某小组据此设计了如图装置,以电化学方法进行反应1。___________ (填“正极”或“负极”)。
②生成 的电极反应式为
的电极反应式为___________ 。
③若反应2(副反应)也同时发生,出口Ⅱ为CO、 、
、 的混合气,且
的混合气,且 ,则惰性电极2的电流效率
,则惰性电极2的电流效率 为
为___________ (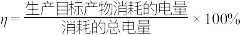 )。
)。
 可作大型船舶的绿色燃料,可由CO或
可作大型船舶的绿色燃料,可由CO或 制备。工业上用
制备。工业上用 制备
制备 的原理如下:
的原理如下:反应1:

反应2:

 (副反应)
(副反应)(1)
 ,该反应的ΔH=
,该反应的ΔH=(2)将
 和
和 按物质的量之比1∶3通入密闭容器中发生反应1和反应2,分别在1MPa、3MPa、5MPa下改变反应温度,测得
按物质的量之比1∶3通入密闭容器中发生反应1和反应2,分别在1MPa、3MPa、5MPa下改变反应温度,测得 的平衡转化率(
的平衡转化率( )以及生成
)以及生成 、CO选择性(S)的变化如图[选择性为目标产物在总产物(
、CO选择性(S)的变化如图[选择性为目标产物在总产物( 和CO)中的比率]。
和CO)中的比率]。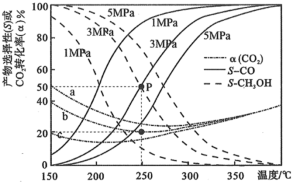
 随温度变化趋势的是曲线
随温度变化趋势的是曲线②随着温度升高,a、b、c三条曲线接近重合的原因是
③P点对应的反应2的平衡常数

 的
的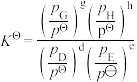 ,其中
,其中 ,
,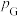 、
、 、
、 、
、 为各组分的平衡分压)。
为各组分的平衡分压)。(3)最近,中科院研究出首例在室温条件超快传输的氢负离子导体
 ,将带来系列技术变革。某小组据此设计了如图装置,以电化学方法进行反应1。
,将带来系列技术变革。某小组据此设计了如图装置,以电化学方法进行反应1。
②生成
 的电极反应式为
的电极反应式为③若反应2(副反应)也同时发生,出口Ⅱ为CO、
 、
、 的混合气,且
的混合气,且 ,则惰性电极2的电流效率
,则惰性电极2的电流效率 为
为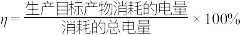 )。
)。
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐2】汽车尾气的污染不容忽视,对汽车尾气中污染气体NO和CO的转化是研究热点。
I.汽车尾气中的 对人体健康有严重危害,一种新技术用
对人体健康有严重危害,一种新技术用 还原
还原 的反应原理为:
的反应原理为:
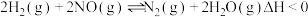 。该反应的能量变化过程如图:
。该反应的能量变化过程如图:
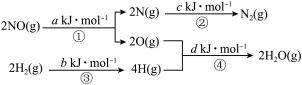
(1)△H=________ 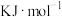 (用图中字母a、b、c、d表示) 。
(用图中字母a、b、c、d表示) 。
Ⅱ.已知反应: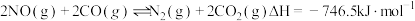 可以有效转化汽车尾气。在密闭容器中充入2molCO和2molNO,平衡时NO的体积分数与温度、压强的关系如图所示:
可以有效转化汽车尾气。在密闭容器中充入2molCO和2molNO,平衡时NO的体积分数与温度、压强的关系如图所示:

(2)充分反应达到平衡后,放出的热量Q______  (选填“大于”、“小于”、“等于”)
(选填“大于”、“小于”、“等于”)
(3)据图分析可知,
_______  (选填“大于”、“小于”、“等于”);反应平衡后,改变以下条件能使速率和两种污染气体转化率都增大的是
(选填“大于”、“小于”、“等于”);反应平衡后,改变以下条件能使速率和两种污染气体转化率都增大的是_____ (填标号)。
A.压缩容器体积 B.升高温度 C.恒压充入氦气 D.加入催化剂
(4)反应在D点达到平衡后,若此时降低温度,同时压缩容器体积,在重新达到平衡过程中,D点会向A~G点中的________ 点方向移动。
(5)某研究小组探究催化剂对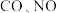 转化率的影响。将
转化率的影响。将 和
和 按物质的量1:1,以一定的流速通过两种不同的催化剂进行反应,相同时间内测量逸出气体中
按物质的量1:1,以一定的流速通过两种不同的催化剂进行反应,相同时间内测量逸出气体中 含量,从而确定尾气脱氮率(即
含量,从而确定尾气脱氮率(即 的转化率),结果如图所示:
的转化率),结果如图所示:

①温度低于200℃时,图中曲线I脱氮率随温度升高而变化不大的主要原因是____________ 。
②a点脱氮率小于对应温度下的平衡脱氮率,原因是_____________ 。
③450℃时,平衡脱氮率为50%,压强恒为P,则
_________ ( 为以分压表示的平衡常数,用含P的代数式表示)。
为以分压表示的平衡常数,用含P的代数式表示)。
I.汽车尾气中的
 对人体健康有严重危害,一种新技术用
对人体健康有严重危害,一种新技术用 还原
还原 的反应原理为:
的反应原理为: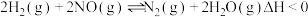 。该反应的能量变化过程如图:
。该反应的能量变化过程如图:
(1)△H=
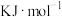 (用图中字母a、b、c、d表示) 。
(用图中字母a、b、c、d表示) 。Ⅱ.已知反应:
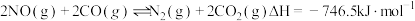 可以有效转化汽车尾气。在密闭容器中充入2molCO和2molNO,平衡时NO的体积分数与温度、压强的关系如图所示:
可以有效转化汽车尾气。在密闭容器中充入2molCO和2molNO,平衡时NO的体积分数与温度、压强的关系如图所示:
(2)充分反应达到平衡后,放出的热量Q
 (选填“大于”、“小于”、“等于”)
(选填“大于”、“小于”、“等于”)(3)据图分析可知,

 (选填“大于”、“小于”、“等于”);反应平衡后,改变以下条件能使速率和两种污染气体转化率都增大的是
(选填“大于”、“小于”、“等于”);反应平衡后,改变以下条件能使速率和两种污染气体转化率都增大的是A.压缩容器体积 B.升高温度 C.恒压充入氦气 D.加入催化剂
(4)反应在D点达到平衡后,若此时降低温度,同时压缩容器体积,在重新达到平衡过程中,D点会向A~G点中的
(5)某研究小组探究催化剂对
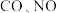 转化率的影响。将
转化率的影响。将 和
和 按物质的量1:1,以一定的流速通过两种不同的催化剂进行反应,相同时间内测量逸出气体中
按物质的量1:1,以一定的流速通过两种不同的催化剂进行反应,相同时间内测量逸出气体中 含量,从而确定尾气脱氮率(即
含量,从而确定尾气脱氮率(即 的转化率),结果如图所示:
的转化率),结果如图所示:
①温度低于200℃时,图中曲线I脱氮率随温度升高而变化不大的主要原因是
②a点脱氮率小于对应温度下的平衡脱氮率,原因是
③450℃时,平衡脱氮率为50%,压强恒为P,则

 为以分压表示的平衡常数,用含P的代数式表示)。
为以分压表示的平衡常数,用含P的代数式表示)。
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐3】石油产品中除含有H2S外,还含有各种形态的有机硫,如COS、CH3SH等。
回答下列问题:
(1)CH3SH(甲硫醇)的电子式为__________ 。
(2)CO和H2S反应可产生羰基硫( COS)。在一恒容密闭容器中发生反应:CO(g)+H2S(g) COS(g)+H2(g)并达到平衡,数据如下表所示:
COS(g)+H2(g)并达到平衡,数据如下表所示:
①该反应是________ 反应(填“吸热”或“放热”)。
②实验1达平衡时,CO的转化率为_______ 。
③实验2达到平衡时,a_______ 7.0(填“大于”“小于”或“等于”)。
④实验3达平衡后,再充入1.0 molH2,平衡常数值____ (填“增大”“减小”或“不变”)。
(3)COS是大气污染物。在酸性溶液中可用H2O2氧化COS生成一种强酸脱硫。该脱除反应的化学方程式为_______________ 。
(4)有一种脱硫工艺为:真空K2CO3一克劳斯法。
①K2CO3溶液吸收H2S的反应为K2CO3 +H2S =KHS +KHCO3,该反应的平衡常数的对数值为lgK=_____ (已知:H2CO3 lgK1=-6.4,lgK,2=- 10.3;H2S lgKl=-7.0,lgK2=- 19.0)。
②已知下列热化学方程式:
a. 2H2S(g)+3O2(g)=2SO2(g)+2H2O(1) △H1=-1172kJ/mol
b. 2H2S(g)+O2(g)=2S(s)+2H2O(1) △H2 = 632 kJ/mol
克劳斯法回收硫的反应为SO2和H2S气体反应生成S(s),则该反应的热化学方程式为_________ 。
回答下列问题:
(1)CH3SH(甲硫醇)的电子式为
(2)CO和H2S反应可产生羰基硫( COS)。在一恒容密闭容器中发生反应:CO(g)+H2S(g)
 COS(g)+H2(g)并达到平衡,数据如下表所示:
COS(g)+H2(g)并达到平衡,数据如下表所示:| 实验 | 温度/℃ | 起始时 | 平衡时 | |||
| n(CO)/mol | n(H2S)/mol | n(COS)/mol | n(H2)/mol | n(CO)/mol | ||
| 1 | 150 | 10.0 | 10.0 | 0 | 0 | 7.0 |
| 2 | 150 | 7.0 | 8.0 | 2.0 | 4.5 | a |
| 3 | 400 | 20.0 | 20.0 | 0 | 0 | 16.0 |
①该反应是
②实验1达平衡时,CO的转化率为
③实验2达到平衡时,a
④实验3达平衡后,再充入1.0 molH2,平衡常数值
(3)COS是大气污染物。在酸性溶液中可用H2O2氧化COS生成一种强酸脱硫。该脱除反应的化学方程式为
(4)有一种脱硫工艺为:真空K2CO3一克劳斯法。
①K2CO3溶液吸收H2S的反应为K2CO3 +H2S =KHS +KHCO3,该反应的平衡常数的对数值为lgK=
②已知下列热化学方程式:
a. 2H2S(g)+3O2(g)=2SO2(g)+2H2O(1) △H1=-1172kJ/mol
b. 2H2S(g)+O2(g)=2S(s)+2H2O(1) △H2 = 632 kJ/mol
克劳斯法回收硫的反应为SO2和H2S气体反应生成S(s),则该反应的热化学方程式为
您最近一年使用:0次



