工业合成氨是人类科学技术的一项重大突破,目前已有三位科学家因其获得诺贝尔奖,其反应为: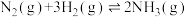
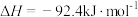 ,
,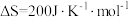 。回答下列问题:
。回答下列问题:
(1)合成氨反应在常温下___________ (填“能”或“不能”)自发。
(2)___________ 温(填“高”或“低”,下同)有利于提高反应速率,________ 温有利于提高平衡转化率,综合考虑催化剂(铁触媒)活性等因素,工业常采用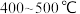 。
。
针对反应速率与平衡产率的矛盾,我国科学家提出了两种解决方案。
方案一:双温-双控-双催化剂。使用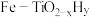 双催化剂,通过光辐射产生温差(如体系温度为495℃时, Fe的温度为:
双催化剂,通过光辐射产生温差(如体系温度为495℃时, Fe的温度为: 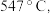 而
而 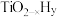 的温度为
的温度为 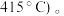
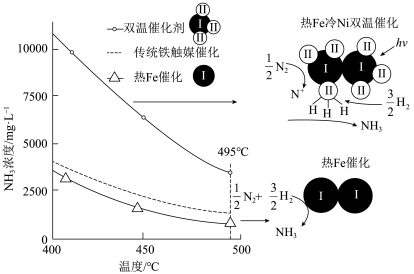
(3)下列说法正确的是___________ 。
a 氨气在“冷Ti”表面生成,有利于提高氨的平衡产率
b. N≡N在“热Fe”表面断裂,有利于提高合成氨反应速率
a.“热Fe”高于体系温度,有利于提高氨的平衡产率
d. “冷 Ti”低于体系温度,有利于提高合成氨反应速率
方案二: 复合催化剂。
复合催化剂。
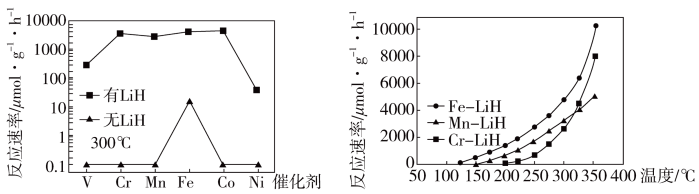
(4)下列说法正确的是___________ 。
a. 300℃时,复合催化剂比单一催化剂效率更高
b. 同温同压下,复合催化剂有利于提高氨的平衡产率
c. 温度越高,复合催化剂活性一定越高
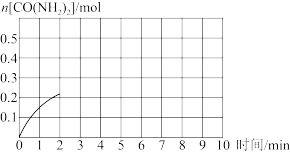
(5)某合成氨速率方程为: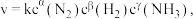 根据表中数据,
根据表中数据,
____________ 。
在合成氨过程中,需要不断分离出氨的原因为___________ 。
a. 有利于平衡正向移动 b. 防止催化剂中毒 c. 提高正反应速率
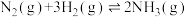
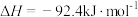 ,
,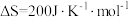 。回答下列问题:
。回答下列问题:(1)合成氨反应在常温下
(2)
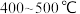 。
。针对反应速率与平衡产率的矛盾,我国科学家提出了两种解决方案。
方案一:双温-双控-双催化剂。使用
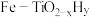 双催化剂,通过光辐射产生温差(如体系温度为495℃时, Fe的温度为:
双催化剂,通过光辐射产生温差(如体系温度为495℃时, Fe的温度为: 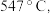 而
而 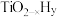 的温度为
的温度为 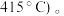

(3)下列说法正确的是
a 氨气在“冷Ti”表面生成,有利于提高氨的平衡产率
b. N≡N在“热Fe”表面断裂,有利于提高合成氨反应速率
a.“热Fe”高于体系温度,有利于提高氨的平衡产率
d. “冷 Ti”低于体系温度,有利于提高合成氨反应速率
方案二:
 复合催化剂。
复合催化剂。
(4)下列说法正确的是
a. 300℃时,复合催化剂比单一催化剂效率更高
b. 同温同压下,复合催化剂有利于提高氨的平衡产率
c. 温度越高,复合催化剂活性一定越高
(5)某合成氨速率方程为:
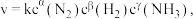 根据表中数据,
根据表中数据,
| 实验 | c(N2)/mol·L-1 | c(H2)/mol·L-1 | c(NH3)/mol·L-1 | v/mol·L-1·s-1 |
| 1 | m | n | p | q |
| 2 | 2m | n | p | 2q |
| 3 | m | n | 0.1p | 10q |
| 4 | m | 2n | p | 2.828q |
a. 有利于平衡正向移动 b. 防止催化剂中毒 c. 提高正反应速率
更新时间:2023-12-19 14:02:41
|
相似题推荐
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐1】完成下列问题
(1)如图为计算机模拟的甲醇(CH3OH)制氢的反应历程,其中吸附在催化剂表面上的物种用*标注。
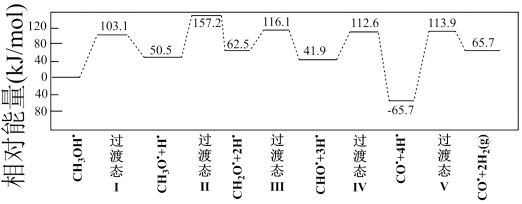
所有历程中最小能垒(活化能)E正=___________ ,决速步骤的化学方程式是___________ 。
(2)在容积可变的密闭容器中发生反应:mA (g)+nB (g) pC (g),在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表:
pC (g),在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表:
①当压强从2×105Pa增加到5×105Pa时,平衡 ___________ 移动(填:“向左”、“向右”或“不”)。
②当压强为1×106Pa时,平衡___________ 移动(域:“向左”、“向右”或“不”),写出此时反应的平衡常数表达或:K=___________ 。
(3)温度为T1时,在一个容积均为1L的密闭容器中仅发生反应:2NO(g)+O2(g)=2NO2(g) ΔH<0。实验测得:v正=v(NO)消耗=2v(O2)消耗=k正c2(NO)•c(O2),v逆=v(NO2)消耗=k逆c2(NO2),(k正,k逆为速率常数,受温度影响)。
①温度为T1时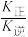 =
=___________ (填数据);当温度升高为T2时,k正、k逆分别增大m倍和n倍,则m ___________ n(填“>”“<”或“=”)。
②T1时,在1L密闭容器中按照一定比例充入NO(g)和O2(g),达到平衡时NO2(g)的体积分数Φ(NO2)随 的变化如图所示,当
的变化如图所示,当 =2.3时,达到平衡时Φ(NO2)可能是D、E、F三点中的
=2.3时,达到平衡时Φ(NO2)可能是D、E、F三点中的 ___________ 。
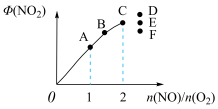
(1)如图为计算机模拟的甲醇(CH3OH)制氢的反应历程,其中吸附在催化剂表面上的物种用*标注。

所有历程中最小能垒(活化能)E正=
(2)在容积可变的密闭容器中发生反应:mA (g)+nB (g)
 pC (g),在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表:
pC (g),在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表:| 压强p/Pa | 2×105 | 5×105 | 1×106 |
| c(A)/mol•L﹣1 | 0.08 | 0.20 | 0.44 |
②当压强为1×106Pa时,平衡
(3)温度为T1时,在一个容积均为1L的密闭容器中仅发生反应:2NO(g)+O2(g)=2NO2(g) ΔH<0。实验测得:v正=v(NO)消耗=2v(O2)消耗=k正c2(NO)•c(O2),v逆=v(NO2)消耗=k逆c2(NO2),(k正,k逆为速率常数,受温度影响)。
| 物质的起始浓度/mol•L-1 | 物质的平衡浓度mol•L-1 | ||
| c(NO) | c(O2) | c(NO2) | c(O2) |
| 0.6 | 0.3 | 0 | 0.2 |
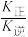 =
=②T1时,在1L密闭容器中按照一定比例充入NO(g)和O2(g),达到平衡时NO2(g)的体积分数Φ(NO2)随
 的变化如图所示,当
的变化如图所示,当 =2.3时,达到平衡时Φ(NO2)可能是D、E、F三点中的
=2.3时,达到平衡时Φ(NO2)可能是D、E、F三点中的 
您最近一年使用:0次
【推荐2】C、N的氧化物常会造成一些环境问题,科研工作者用各种化学方法来消除这些物质对环境的影响。回答下列问题:
(1)CO2的重整:用CO2和H2为原料可得到CH4燃料。
已知:①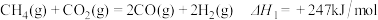
②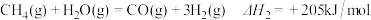
写出CO2重整的热化学方程式___________________________ 。
200℃时,向VL恒温密闭容器A(恒容)、B(恒压)中,均充入1molCO2和4molH2,两容器中反应达平衡时放出或吸收的热量较多的是_________________ (填“A”或“B”)。
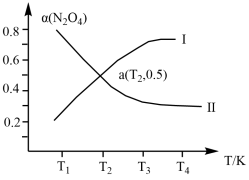
(2)在恒容密闭容器中充入一定量的N2O4,发生可逆反应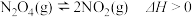 。则N2O4的平衡转化率随温度的变化曲线为右图中的
。则N2O4的平衡转化率随温度的变化曲线为右图中的______________ (填“Ⅰ”或“Ⅱ”)曲线。若T2K时容器的起始压强为102kPa,则该温度下反应的分压平衡常数Kp=_____________ kPa。
(3)反应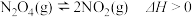 ,在一定条件下,N2O4与NO2的消耗速率与各自的分压有如下关系:v(N2O4)=k1p(N2O4),v(NO2)=k2p2(NO2),其中k1、k2是与温度有关的常数,相应的速率与N2O4或NO2的分压关系如右图所示。在T℃时,图中M,N点能表示该反应达到平衡状态,理由是
,在一定条件下,N2O4与NO2的消耗速率与各自的分压有如下关系:v(N2O4)=k1p(N2O4),v(NO2)=k2p2(NO2),其中k1、k2是与温度有关的常数,相应的速率与N2O4或NO2的分压关系如右图所示。在T℃时,图中M,N点能表示该反应达到平衡状态,理由是__________________________________ 。改变温度,v(NO2)会由M点变为A,B或C,v(N2O4)会由N点变为D,E或F,当升高到某一温度时,反应重新达到平衡,相应的点分别为____________ (填字母标号)。

(4)间接电化学法除NO,其原理如图所示。写出阴极的电极反应式(阴极室溶液呈酸性)_____________________ ,吸收池中除去NO的原理_______________ (用离子方程式表示)。

(1)CO2的重整:用CO2和H2为原料可得到CH4燃料。
已知:①
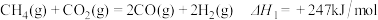
②
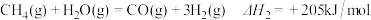
写出CO2重整的热化学方程式
200℃时,向VL恒温密闭容器A(恒容)、B(恒压)中,均充入1molCO2和4molH2,两容器中反应达平衡时放出或吸收的热量较多的是
(2)在恒容密闭容器中充入一定量的N2O4,发生可逆反应
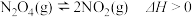 。则N2O4的平衡转化率随温度的变化曲线为右图中的
。则N2O4的平衡转化率随温度的变化曲线为右图中的
(3)反应
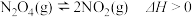 ,在一定条件下,N2O4与NO2的消耗速率与各自的分压有如下关系:v(N2O4)=k1p(N2O4),v(NO2)=k2p2(NO2),其中k1、k2是与温度有关的常数,相应的速率与N2O4或NO2的分压关系如右图所示。在T℃时,图中M,N点能表示该反应达到平衡状态,理由是
,在一定条件下,N2O4与NO2的消耗速率与各自的分压有如下关系:v(N2O4)=k1p(N2O4),v(NO2)=k2p2(NO2),其中k1、k2是与温度有关的常数,相应的速率与N2O4或NO2的分压关系如右图所示。在T℃时,图中M,N点能表示该反应达到平衡状态,理由是
(4)间接电化学法除NO,其原理如图所示。写出阴极的电极反应式(阴极室溶液呈酸性)

您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐3】含硫化合物在能源、材料及环境等工业领域均有广泛的应用。
Ⅰ.工业废气 分解可制取
分解可制取 。
。
(1)已知热化学方程式:
ⅰ.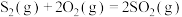

ⅱ.

ⅲ.

 热分解反应
热分解反应 的
的
___________ (用含 、
、 、
、 的式子表示)。
的式子表示)。
(2)一定温度下,2mol 在体积为VL的恒容密闭容器中发生上述分解反应,ts时
在体积为VL的恒容密闭容器中发生上述分解反应,ts时 的产率为40%,则0~ts内
的产率为40%,则0~ts内 的平均分解速率为
的平均分解速率为___________  ;
; 充分分解达到平衡时,容器中
充分分解达到平衡时,容器中 和
和 的分压相等,则该温度下的平衡常数
的分压相等,则该温度下的平衡常数
___________ 。
Ⅱ.KSCN可用于镀铬工业。常温下,用KSCN配制电镀液,溶液中 与
与 发生第一、二步络合的反应如下:
发生第一、二步络合的反应如下:
ⅳ.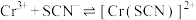
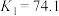
ⅴ.

(3)根据以上络合反应,下列说法正确的有___________(填字母)。
(4)常温下,某研究小组配制了起始浓度 、
、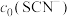 不同的系列溶液,测得平衡时
不同的系列溶液,测得平衡时 、
、 、
、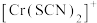 的浓度
的浓度 (含铬微粒)随
(含铬微粒)随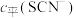 的变化曲线如图所示,平衡后其他含铬微粒
的变化曲线如图所示,平衡后其他含铬微粒 (3≤x≤6,图中未画出)总浓度为amol/L。
(3≤x≤6,图中未画出)总浓度为amol/L。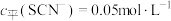 时,图中含铬微粒按浓度由大到小的顺序为
时,图中含铬微粒按浓度由大到小的顺序为___________ ;A点时,溶液中 的平衡浓度为
的平衡浓度为___________ (列出计算式即可)。
②在某电镀工艺中, 的浓度需要在
的浓度需要在 以上,结合计算判断C点所对应的溶液能否用于该电镀工艺
以上,结合计算判断C点所对应的溶液能否用于该电镀工艺________ (写出计算过程)。
Ⅰ.工业废气
 分解可制取
分解可制取 。
。(1)已知热化学方程式:
ⅰ.
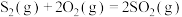

ⅱ.


ⅲ.


 热分解反应
热分解反应 的
的
 、
、 、
、 的式子表示)。
的式子表示)。(2)一定温度下,2mol
 在体积为VL的恒容密闭容器中发生上述分解反应,ts时
在体积为VL的恒容密闭容器中发生上述分解反应,ts时 的产率为40%,则0~ts内
的产率为40%,则0~ts内 的平均分解速率为
的平均分解速率为 ;
; 充分分解达到平衡时,容器中
充分分解达到平衡时,容器中 和
和 的分压相等,则该温度下的平衡常数
的分压相等,则该温度下的平衡常数
Ⅱ.KSCN可用于镀铬工业。常温下,用KSCN配制电镀液,溶液中
 与
与 发生第一、二步络合的反应如下:
发生第一、二步络合的反应如下:ⅳ.
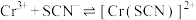
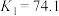
ⅴ.


(3)根据以上络合反应,下列说法正确的有___________(填字母)。
| A.加水稀释后,溶液中离子的总数减少 |
B.加入少量 固体,溶液中含铬微粒总数不变 固体,溶液中含铬微粒总数不变 |
C.反应 的平衡常数 的平衡常数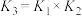 |
D.溶液中 减小, 减小, 与 与 浓度的比值减小 浓度的比值减小 |
(4)常温下,某研究小组配制了起始浓度
 、
、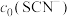 不同的系列溶液,测得平衡时
不同的系列溶液,测得平衡时 、
、 、
、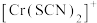 的浓度
的浓度 (含铬微粒)随
(含铬微粒)随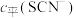 的变化曲线如图所示,平衡后其他含铬微粒
的变化曲线如图所示,平衡后其他含铬微粒 (3≤x≤6,图中未画出)总浓度为amol/L。
(3≤x≤6,图中未画出)总浓度为amol/L。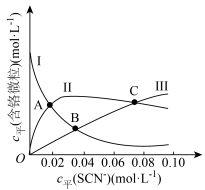
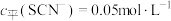 时,图中含铬微粒按浓度由大到小的顺序为
时,图中含铬微粒按浓度由大到小的顺序为 的平衡浓度为
的平衡浓度为②在某电镀工艺中,
 的浓度需要在
的浓度需要在 以上,结合计算判断C点所对应的溶液能否用于该电镀工艺
以上,结合计算判断C点所对应的溶液能否用于该电镀工艺
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐1】二甲醚(CH3OCH3)是优良的洁净燃料。
Ⅰ:工业上可用CO和 合成二甲醚,其反应为
合成二甲醚,其反应为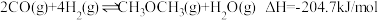 ,初始条件相同时,分别在A(恒温)、B(绝热)两个容器内反应。
,初始条件相同时,分别在A(恒温)、B(绝热)两个容器内反应。
(1)反应初始时两容器的反应速率A_______ (填“>”“<”或“=”,下同)B;平衡时CO的转化率A_______ B。
Ⅱ:利用 催化加氢制二甲醚过程中发生的化学反应如下:
催化加氢制二甲醚过程中发生的化学反应如下:
反应Ⅰ: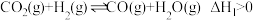
反应Ⅱ:
反应Ⅲ:
回答下列问题:
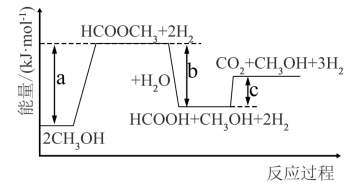
(2)甲醇水化制 的反应能量变化如图所示,则
的反应能量变化如图所示,则
_______ kJ/mol(用含有a、b、c的式子表示)。
(3)一定温度下,向体积为1L的恒容密闭容器中通入 和
和 进行上述反应,反应经10min达平衡,
进行上述反应,反应经10min达平衡, 的平衡转化率为30%,容器中CO(g)为0.05mol,
的平衡转化率为30%,容器中CO(g)为0.05mol, 为0.05mol。前
为0.05mol。前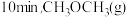 的反应速率为
的反应速率为_______ ,反应Ⅲ的平衡常数K=_______ 。继续向容器中加入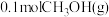 和
和 ,此时反应Ⅲ
,此时反应Ⅲ_______ (填“向正反应方向进行”“向逆反应方向进行”或“处于平衡状态”)。
(4)在一定条件下,在恒容密闭容器中按 投料进行上述反应,
投料进行上述反应, 的平衡转化率及
的平衡转化率及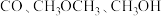 的平衡体积分数随温度变化如图所示。
的平衡体积分数随温度变化如图所示。
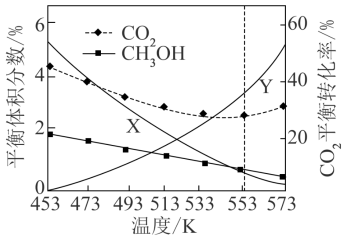
图中曲线X表示_______ 的平衡体积分数随温度的变化。
Ⅰ:工业上可用CO和
 合成二甲醚,其反应为
合成二甲醚,其反应为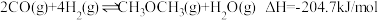 ,初始条件相同时,分别在A(恒温)、B(绝热)两个容器内反应。
,初始条件相同时,分别在A(恒温)、B(绝热)两个容器内反应。(1)反应初始时两容器的反应速率A
Ⅱ:利用
 催化加氢制二甲醚过程中发生的化学反应如下:
催化加氢制二甲醚过程中发生的化学反应如下:反应Ⅰ:
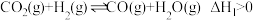
反应Ⅱ:

反应Ⅲ:

回答下列问题:
(2)甲醇水化制
 的反应能量变化如图所示,则
的反应能量变化如图所示,则

(3)一定温度下,向体积为1L的恒容密闭容器中通入
 和
和 进行上述反应,反应经10min达平衡,
进行上述反应,反应经10min达平衡, 的平衡转化率为30%,容器中CO(g)为0.05mol,
的平衡转化率为30%,容器中CO(g)为0.05mol, 为0.05mol。前
为0.05mol。前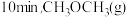 的反应速率为
的反应速率为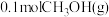 和
和 ,此时反应Ⅲ
,此时反应Ⅲ(4)在一定条件下,在恒容密闭容器中按
 投料进行上述反应,
投料进行上述反应, 的平衡转化率及
的平衡转化率及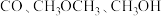 的平衡体积分数随温度变化如图所示。
的平衡体积分数随温度变化如图所示。
图中曲线X表示
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐2】研发二氧化碳利用技术、降低空气中二氧化碳含量一直是化学研究热点。
(1)减少碳排放的方法有很多, 转化成有机化合物可有效实现碳循环,如下反应:
转化成有机化合物可有效实现碳循环,如下反应:
a.
b.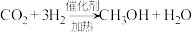
c.
上述反应中原子利用率最高的是______ (填编号)。
(2)工业上用 来生产燃料甲醇。某温度下,在容积为5L的密闭容器中,充入
来生产燃料甲醇。某温度下,在容积为5L的密闭容器中,充入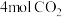 和
和 在一定条件下发生反应生成
在一定条件下发生反应生成 ,测得
,测得 和
和 的物质的量(n)随时间变化如图所示
的物质的量(n)随时间变化如图所示
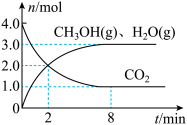
①0~2分钟,该反应中氢气的平均速率为______ 。
②该温度下,此反应的平衡常数
______ (保留一位小数)。
③保持温度和体积不变,向上述平衡体系中再同时充入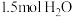 和
和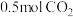 ,平衡将
,平衡将______ (填“正向”“逆向”或“不”)移动,理由是______ 。
④在恒温恒容条件下,能说明该反应已达平衡状态的是______ 。
A. 体积分数保持不变 B.容器中
体积分数保持不变 B.容器中 浓度与
浓度与 浓度之比为1:1
浓度之比为1:1
C.容器中气体压强保持不变 D.混合气体的密度保持不变
(3)二氧化碳也可用于尿素的制备: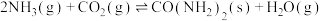
 一定条件下,向某恒容密闭容器中充入
一定条件下,向某恒容密闭容器中充入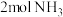 和
和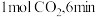 时达到平衡,测得容器中尿素的物质的量为
时达到平衡,测得容器中尿素的物质的量为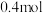 ,
,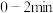 内尿素的物质的量随时间的变化趋势如图所示。若反应时间达到
内尿素的物质的量随时间的变化趋势如图所示。若反应时间达到 时,迅速将体系升温(仅发生上述反应),请在图中画出
时,迅速将体系升温(仅发生上述反应),请在图中画出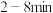 内容器中尿素的物质的量随时间的变化趋势曲线并说明画此图像的依据:
内容器中尿素的物质的量随时间的变化趋势曲线并说明画此图像的依据:______ 。
(1)减少碳排放的方法有很多,
 转化成有机化合物可有效实现碳循环,如下反应:
转化成有机化合物可有效实现碳循环,如下反应:a.

b.
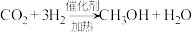
c.

上述反应中原子利用率最高的是
(2)工业上用
 来生产燃料甲醇。某温度下,在容积为5L的密闭容器中,充入
来生产燃料甲醇。某温度下,在容积为5L的密闭容器中,充入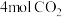 和
和 在一定条件下发生反应生成
在一定条件下发生反应生成 ,测得
,测得 和
和 的物质的量(n)随时间变化如图所示
的物质的量(n)随时间变化如图所示
①0~2分钟,该反应中氢气的平均速率为
②该温度下,此反应的平衡常数

③保持温度和体积不变,向上述平衡体系中再同时充入
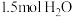 和
和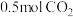 ,平衡将
,平衡将④在恒温恒容条件下,能说明该反应已达平衡状态的是
A.
 体积分数保持不变 B.容器中
体积分数保持不变 B.容器中 浓度与
浓度与 浓度之比为1:1
浓度之比为1:1C.容器中气体压强保持不变 D.混合气体的密度保持不变
(3)二氧化碳也可用于尿素的制备:
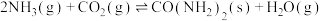
 一定条件下,向某恒容密闭容器中充入
一定条件下,向某恒容密闭容器中充入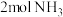 和
和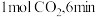 时达到平衡,测得容器中尿素的物质的量为
时达到平衡,测得容器中尿素的物质的量为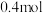 ,
,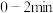 内尿素的物质的量随时间的变化趋势如图所示。若反应时间达到
内尿素的物质的量随时间的变化趋势如图所示。若反应时间达到 时,迅速将体系升温(仅发生上述反应),请在图中画出
时,迅速将体系升温(仅发生上述反应),请在图中画出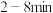 内容器中尿素的物质的量随时间的变化趋势曲线并说明画此图像的依据:
内容器中尿素的物质的量随时间的变化趋势曲线并说明画此图像的依据:
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐3】二氧化碳催化加氢合成乙烯是综合利用CO2的热点研究领域。回答下列问题:
(1)CO2催化加氢生成乙烯和水的反应中,产物的物质的量之比n(C2H4)∶n(H2O)=__________ 。当反应达到平衡时,若增大压强,则n(C2H4)___________ (填“变大”“变小”或“不变”)。
(2)理论计算表明,原料初始组成n(CO2)∶n(H2)=1∶3,在体系压强为0.1MPa,反应达到平衡时,四种组分的物质的量分数x随温度T的变化如图所示。
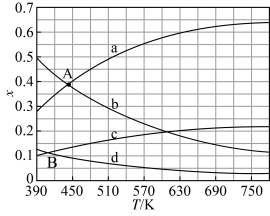
图中,表示C2H4、CO2变化的曲线分别是______ 、______ 。CO2催化加氢合成C2H4反应的ΔH______ 0(填“大于”或“小于”)。
(3)根据图中点A(440K,0.39),计算该温度时反应的平衡常数Kp=_________ (MPa)−3(列出计算式。以分压表示,分压=总压×物质的量分数)。
(4)二氧化碳催化加氢合成乙烯反应往往伴随副反应,生成C3H6、C3H8、C4H8等低碳烃。一定温度和压强条件下,为了提高反应速率和乙烯选择性,应当___________________ 。
(1)CO2催化加氢生成乙烯和水的反应中,产物的物质的量之比n(C2H4)∶n(H2O)=
(2)理论计算表明,原料初始组成n(CO2)∶n(H2)=1∶3,在体系压强为0.1MPa,反应达到平衡时,四种组分的物质的量分数x随温度T的变化如图所示。

图中,表示C2H4、CO2变化的曲线分别是
(3)根据图中点A(440K,0.39),计算该温度时反应的平衡常数Kp=
(4)二氧化碳催化加氢合成乙烯反应往往伴随副反应,生成C3H6、C3H8、C4H8等低碳烃。一定温度和压强条件下,为了提高反应速率和乙烯选择性,应当
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐1】(1)甲醇(CH3OH)是重要的溶剂和替代燃料,工业上用CO和H2在一定条件下制备CH3OH的反应为:CO(g)+2H2(g) CH3OH(g),在体积为1L的恒容密闭容器中,充入2molCO和4molH2,一定条件下发生上述反应,测得CO(g)和CH3OH(g)的浓度随时间变化如图一所示。
CH3OH(g),在体积为1L的恒容密闭容器中,充入2molCO和4molH2,一定条件下发生上述反应,测得CO(g)和CH3OH(g)的浓度随时间变化如图一所示。
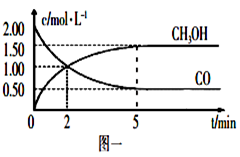
①从反应开始到5min,用CO表示的平均反应速率v(CO)=________ 。
②下列说法正确的是____________ (填字母序号)。
A.达到平衡时,H2的转化率为65%
B.5min后容器中混合气体的平均相对分子质量不再改变
C.达到平衡后,再充入氩气,反应速率减小
D.2min前v(正)>v(逆),2min后v(正)<v(逆)
(2)碳与水蒸气反应制取H2的相关反应如下:
Ⅰ:C(s)+H2O(g)=CO(g)+H2(g) △H=+131.0kJ/mol
Ⅱ:CO(g)+H2O(g)=CO2(g)+H2(g) △H= - 43kJ/mol
Ⅲ:CaO(s)+CO2(g)=CaCO3(S) △H= - 178.3kJ/mol
①计算反应ⅣC(s)+2H2O(g)+CaO(s) CaCO3(s)+2H2(g)的△H=
CaCO3(s)+2H2(g)的△H=_______ kJ/mol;
若K1、K2、K3分别为反应Ⅰ、Ⅱ、Ⅲ的平衡常数,则反应Ⅳ平衡常数K=__________ (用K1、K2、K3表示)。
②对于可逆反应C(s)+2H2O(g)+CaO(s) CaCO3(s)+2H2(g),采取以下措施可以提高H2产率的是
CaCO3(s)+2H2(g),采取以下措施可以提高H2产率的是________ 。(填字母)
A.降低体系的温度 B.压缩容器的体积 C.增加CaO的量 D.选用适当的催化剂
(3)对于可逆反应C(s)+2H2O(g)+CaO(s) CaCO3(s)+2H2(g),该反应
CaCO3(s)+2H2(g),该反应_______ (填“能”或“不能”)自发进行。
 CH3OH(g),在体积为1L的恒容密闭容器中,充入2molCO和4molH2,一定条件下发生上述反应,测得CO(g)和CH3OH(g)的浓度随时间变化如图一所示。
CH3OH(g),在体积为1L的恒容密闭容器中,充入2molCO和4molH2,一定条件下发生上述反应,测得CO(g)和CH3OH(g)的浓度随时间变化如图一所示。
①从反应开始到5min,用CO表示的平均反应速率v(CO)=
②下列说法正确的是
A.达到平衡时,H2的转化率为65%
B.5min后容器中混合气体的平均相对分子质量不再改变
C.达到平衡后,再充入氩气,反应速率减小
D.2min前v(正)>v(逆),2min后v(正)<v(逆)
(2)碳与水蒸气反应制取H2的相关反应如下:
Ⅰ:C(s)+H2O(g)=CO(g)+H2(g) △H=+131.0kJ/mol
Ⅱ:CO(g)+H2O(g)=CO2(g)+H2(g) △H= - 43kJ/mol
Ⅲ:CaO(s)+CO2(g)=CaCO3(S) △H= - 178.3kJ/mol
①计算反应ⅣC(s)+2H2O(g)+CaO(s)
 CaCO3(s)+2H2(g)的△H=
CaCO3(s)+2H2(g)的△H=若K1、K2、K3分别为反应Ⅰ、Ⅱ、Ⅲ的平衡常数,则反应Ⅳ平衡常数K=
②对于可逆反应C(s)+2H2O(g)+CaO(s)
 CaCO3(s)+2H2(g),采取以下措施可以提高H2产率的是
CaCO3(s)+2H2(g),采取以下措施可以提高H2产率的是A.降低体系的温度 B.压缩容器的体积 C.增加CaO的量 D.选用适当的催化剂
(3)对于可逆反应C(s)+2H2O(g)+CaO(s)
 CaCO3(s)+2H2(g),该反应
CaCO3(s)+2H2(g),该反应
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐2】乙醇是一种很有发展前景的能源替代品,通过CO和 催化加氢制乙醇的体系中涉及化学应为:
催化加氢制乙醇的体系中涉及化学应为:
Ⅰ.


Ⅱ.


Ⅲ.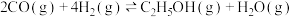


(1)则 加氢制
加氢制 的热化学方程式为
的热化学方程式为______ ;该反应的化学平衡常数
______ (用 、
、 或
或 表示)。
表示)。
(2)反应Ⅲ自发进行趋势很大的原因为______ ,已知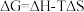 ,升高温度,该反应自发进行的程度将
,升高温度,该反应自发进行的程度将______ (填“增大”、“减少”或“不变”)。
(3)T℃时,向盛有催化剂的2L恒容密闭容器中充入2mol 和4mol
和4mol ,发生上述反应,10min末达到平衡,此时
,发生上述反应,10min末达到平衡,此时 的转化率为80%,
的转化率为80%, 和
和 的物质的量浓度分别为
的物质的量浓度分别为 和
和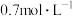 .则0~10min内,平均反应速率
.则0~10min内,平均反应速率
______  ;反应Ⅲ的平衡常数
;反应Ⅲ的平衡常数
______  (保留两位有效数字)。
(保留两位有效数字)。
(4)根据DFT计算和实验分析,在Ti掺杂 稳定的Rh单原子催化剂表面进行的
稳定的Rh单原子催化剂表面进行的 加氢制乙醇的反应历程如图所示(其中“*”表示吸附态;TS表示过渡态,对应的数值表示该步骤的活化能),
加氢制乙醇的反应历程如图所示(其中“*”表示吸附态;TS表示过渡态,对应的数值表示该步骤的活化能), 转化为
转化为 的路径有两条,其优势路径决速步骤的活化能为
的路径有两条,其优势路径决速步骤的活化能为______ ,劣势路径决速步骤的化学方程式为______ 。

 催化加氢制乙醇的体系中涉及化学应为:
催化加氢制乙醇的体系中涉及化学应为:Ⅰ.



Ⅱ.



Ⅲ.
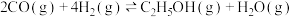


(1)则
 加氢制
加氢制 的热化学方程式为
的热化学方程式为
 、
、 或
或 表示)。
表示)。(2)反应Ⅲ自发进行趋势很大的原因为
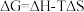 ,升高温度,该反应自发进行的程度将
,升高温度,该反应自发进行的程度将(3)T℃时,向盛有催化剂的2L恒容密闭容器中充入2mol
 和4mol
和4mol ,发生上述反应,10min末达到平衡,此时
,发生上述反应,10min末达到平衡,此时 的转化率为80%,
的转化率为80%, 和
和 的物质的量浓度分别为
的物质的量浓度分别为 和
和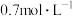 .则0~10min内,平均反应速率
.则0~10min内,平均反应速率
 ;反应Ⅲ的平衡常数
;反应Ⅲ的平衡常数
 (保留两位有效数字)。
(保留两位有效数字)。(4)根据DFT计算和实验分析,在Ti掺杂
 稳定的Rh单原子催化剂表面进行的
稳定的Rh单原子催化剂表面进行的 加氢制乙醇的反应历程如图所示(其中“*”表示吸附态;TS表示过渡态,对应的数值表示该步骤的活化能),
加氢制乙醇的反应历程如图所示(其中“*”表示吸附态;TS表示过渡态,对应的数值表示该步骤的活化能), 转化为
转化为 的路径有两条,其优势路径决速步骤的活化能为
的路径有两条,其优势路径决速步骤的活化能为
您最近一年使用:0次
【推荐3】为了实现“碳中和”,研发 的利用技术成为热点。
的利用技术成为热点。
反应I:
反应Ⅱ:
请回答:
(1)反应I能够自发进行的条件是__________ 。
(2)向 的恒容密闭容器中充入
的恒容密闭容器中充入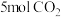 和
和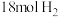 (起始压强为
(起始压强为 ),在不同温度下同时发生上述反应I和反应Ⅱ,得到平衡时各含碳物质的物质的量
),在不同温度下同时发生上述反应I和反应Ⅱ,得到平衡时各含碳物质的物质的量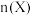 与温度
与温度 的关系如下图所示。
的关系如下图所示。
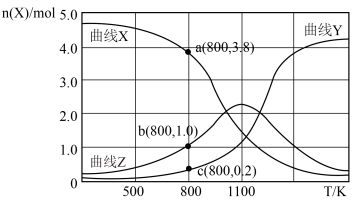
①写出曲线Y表示的含碳元素物质的化学式__________ 。
② 时,反应Ⅱ的平衡常数
时,反应Ⅱ的平衡常数
__________ [对于气相反应,用某组分 的平衡压强
的平衡压强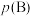 代替物质的量浓度
代替物质的量浓度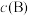 也可表示平衡常数,记作
也可表示平衡常数,记作 ,如
,如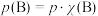 ,
, 为平衡总压强,
为平衡总压强,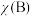 为平衡系统中
为平衡系统中 的物质的量分数]。
的物质的量分数]。
(3)可用 与
与 催化加氢制乙醇,反应原理为:
催化加氢制乙醇,反应原理为: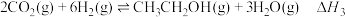 。经实验测定在不同投料比
。经实验测定在不同投料比 、
、 、
、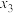 时
时 的平衡转化率与温度的关系如图所示
的平衡转化率与温度的关系如图所示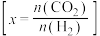 :
:

①上述反应的活化能 (正)
(正)__________  (逆)(填“
(逆)(填“ ”、“
”、“ ”或“
”或“ ”)。
”)。
② 、
、 、
、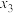 由大到小的顺序是
由大到小的顺序是__________ 。
③从平衡角度分析,随温度升高,不同投料比时 的平衡转化率趋于相近的原因
的平衡转化率趋于相近的原因__________ 。
(4)科学家提出由 制取
制取 的太阳能工艺如图。已知“重整系统”发生的反应中
的太阳能工艺如图。已知“重整系统”发生的反应中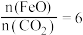 ,则
,则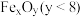 的化学式为
的化学式为__________ 。

(5)水系可逆 电池可吸收利用
电池可吸收利用 ,将两组阴离子、阳离子复合膜反向放置分隔两室电解液充、放电时,复合膜间的
,将两组阴离子、阳离子复合膜反向放置分隔两室电解液充、放电时,复合膜间的 解离成
解离成 和
和 ,工作原理如图所示:
,工作原理如图所示:

①放电时复合膜中向 极移动的离子是
极移动的离子是__________ 。
②充电时多孔 纳米片电极的电极反应式为
纳米片电极的电极反应式为__________ 。
 的利用技术成为热点。
的利用技术成为热点。反应I:

反应Ⅱ:

请回答:
(1)反应I能够自发进行的条件是
(2)向
 的恒容密闭容器中充入
的恒容密闭容器中充入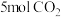 和
和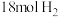 (起始压强为
(起始压强为 ),在不同温度下同时发生上述反应I和反应Ⅱ,得到平衡时各含碳物质的物质的量
),在不同温度下同时发生上述反应I和反应Ⅱ,得到平衡时各含碳物质的物质的量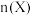 与温度
与温度 的关系如下图所示。
的关系如下图所示。
①写出曲线Y表示的含碳元素物质的化学式
②
 时,反应Ⅱ的平衡常数
时,反应Ⅱ的平衡常数
 的平衡压强
的平衡压强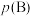 代替物质的量浓度
代替物质的量浓度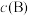 也可表示平衡常数,记作
也可表示平衡常数,记作 ,如
,如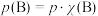 ,
, 为平衡总压强,
为平衡总压强,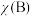 为平衡系统中
为平衡系统中 的物质的量分数]。
的物质的量分数]。(3)可用
 与
与 催化加氢制乙醇,反应原理为:
催化加氢制乙醇,反应原理为: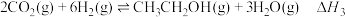 。经实验测定在不同投料比
。经实验测定在不同投料比 、
、 、
、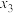 时
时 的平衡转化率与温度的关系如图所示
的平衡转化率与温度的关系如图所示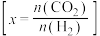 :
:
①上述反应的活化能
 (正)
(正) (逆)(填“
(逆)(填“ ”、“
”、“ ”或“
”或“ ”)。
”)。②
 、
、 、
、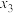 由大到小的顺序是
由大到小的顺序是③从平衡角度分析,随温度升高,不同投料比时
 的平衡转化率趋于相近的原因
的平衡转化率趋于相近的原因(4)科学家提出由
 制取
制取 的太阳能工艺如图。已知“重整系统”发生的反应中
的太阳能工艺如图。已知“重整系统”发生的反应中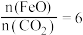 ,则
,则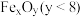 的化学式为
的化学式为
(5)水系可逆
 电池可吸收利用
电池可吸收利用 ,将两组阴离子、阳离子复合膜反向放置分隔两室电解液充、放电时,复合膜间的
,将两组阴离子、阳离子复合膜反向放置分隔两室电解液充、放电时,复合膜间的 解离成
解离成 和
和 ,工作原理如图所示:
,工作原理如图所示:
①放电时复合膜中向
 极移动的离子是
极移动的离子是②充电时多孔
 纳米片电极的电极反应式为
纳米片电极的电极反应式为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐1】合成氨是目前人工固氮最重要的途径,对人类生存具有重大意义,反应为:
(1)N2(g)+3H2(g) 2NH3(g) ∆H=-92.4kJ/mol。
2NH3(g) ∆H=-92.4kJ/mol。
①该反应在___________ (填“高温”“低温”或“任意温度”)下可自发进行。
我国科学家在合成氨反应机理研究中取得新进展,首次报道了LiH-3d过渡金属这一复合催化剂体系,并提出了“氮转移”催化机理。
i. 3LiH(s) + N2(g) =Li2NH(s) + LiNH2(g) ΔH1=+32.8kJ·mol-1
ii. Li2NH(s)+2H2(g)=2LiH(s)+NH3(g) ΔH2=-88kJ·mol-1
iii. LiNH2(g)+H2(g)=LiH(s)+NH3(g) ΔH3
②则ΔH3=___________ 。
(2)为了研究反应的热效应,我国的科研人员计算了在一定范围内下列反应的平衡常数 。
。
i.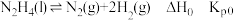
ii.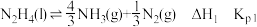
iii.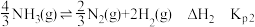
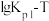 和
和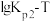 的线性关系图如下所示:
的线性关系图如下所示:

①由图可知ΔH1___________ 0(填“大于”或“小于”)。
②反应i的Kp0=______________ (用Kp1和Kp2表示)。
反应i的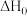
___________ 0(填“大于”或“小于”),写出推理过程_____________________ 。
(3)氨水可以吸收二氧化碳。已知常温下,Kb(NH3·H2O)=1.8×10-5,Ka1(H2CO3) =4.4×10-7,Ka2(H2CO3) =4.4×10-11,.此温度下某氨水的浓度为 2mol/L,则溶液中c(OH-)=____ mol/L,将CO2通入氨水中使溶液恰好呈中性,则此时 =
=______ (保留小数点后4位数字)
(1)N2(g)+3H2(g)
 2NH3(g) ∆H=-92.4kJ/mol。
2NH3(g) ∆H=-92.4kJ/mol。①该反应在
我国科学家在合成氨反应机理研究中取得新进展,首次报道了LiH-3d过渡金属这一复合催化剂体系,并提出了“氮转移”催化机理。
i. 3LiH(s) + N2(g) =Li2NH(s) + LiNH2(g) ΔH1=+32.8kJ·mol-1
ii. Li2NH(s)+2H2(g)=2LiH(s)+NH3(g) ΔH2=-88kJ·mol-1
iii. LiNH2(g)+H2(g)=LiH(s)+NH3(g) ΔH3
②则ΔH3=
(2)为了研究反应的热效应,我国的科研人员计算了在一定范围内下列反应的平衡常数
 。
。i.
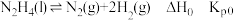
ii.
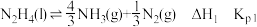
iii.
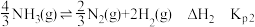
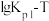 和
和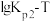 的线性关系图如下所示:
的线性关系图如下所示:
①由图可知ΔH1
②反应i的Kp0=
反应i的
(3)氨水可以吸收二氧化碳。已知常温下,Kb(NH3·H2O)=1.8×10-5,Ka1(H2CO3) =4.4×10-7,Ka2(H2CO3) =4.4×10-11,.此温度下某氨水的浓度为 2mol/L,则溶液中c(OH-)=
 =
=
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐2】煤炭是我国最主要能源。煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程。
(1)已知该产业链中,有炭参与的某反应平衡常数表达式为:K=c(H2)∙c(CO)/c(H2O),写出它所对应反应的化学方程式(含物质状态):_______ ,若该反应只有在持续高温下才能自发进行,则该反应为_______ (“吸热”或“放热”)反应。
(2)向2 L密闭容器中加入2 mol CO2和6 mol H2,在适当的催化剂作用下发生如下反应:CO2(g)+3H2(g) ⇌CH3OH(l)+H2O(l),下列条件可以判定该反应到达平衡状态的是_______ (填字母)。
A.混合气体的平均相对分子质量保持不变
B.CO2和H2的体积分数保持不变
C.CO2和H2的转化率相等
D.混合气体的密度保持不变
E.1 mol CO2生成的同时有3 mol H-H键断裂
(3)在四个不同容积的恒容密闭容器中按表充入相应的气体,发生反应:2N2O(g)⇌2N2(g)+O2(g),容器Ⅰ、Ⅱ、Ⅲ中N2O的平衡转化率如图所示:
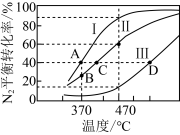
①若容器Ⅰ的体积为2 L,反应在370 ℃下进行,20 s后达到平衡,则0~20 s内容器Ⅰ中用O2表示的反应速率为_______ 。B点对应的平衡常数K=_______ (保留两位有效数字)。
②图中A、C、D三点容器内气体密度由大到小的顺序是_______ 。
③若容器Ⅳ体积为1 L,反应在370 ℃下进行,则起始时反应_______ 移动(填“向正反应方向”“向逆反应方向”或“不”)。
(4)以甲醇为燃料,氧气为氧化剂,KOH溶液为电解质溶液,可制成燃料电池(电极材料为惰性电极)。若产物只有H2O和一种酸式盐,则该电池的负极反应式为_______ 。
(1)已知该产业链中,有炭参与的某反应平衡常数表达式为:K=c(H2)∙c(CO)/c(H2O),写出它所对应反应的化学方程式(含物质状态):
(2)向2 L密闭容器中加入2 mol CO2和6 mol H2,在适当的催化剂作用下发生如下反应:CO2(g)+3H2(g) ⇌CH3OH(l)+H2O(l),下列条件可以判定该反应到达平衡状态的是
A.混合气体的平均相对分子质量保持不变
B.CO2和H2的体积分数保持不变
C.CO2和H2的转化率相等
D.混合气体的密度保持不变
E.1 mol CO2生成的同时有3 mol H-H键断裂
(3)在四个不同容积的恒容密闭容器中按表充入相应的气体,发生反应:2N2O(g)⇌2N2(g)+O2(g),容器Ⅰ、Ⅱ、Ⅲ中N2O的平衡转化率如图所示:
| 起始物质的量/mol | N2O | N2 | O2 |
| Ⅰ | 0.1 | 0 | 0 |
| Ⅱ | 0.1 | 0 | 0 |
| Ⅲ | 0.1 | 0 | 0 |
| Ⅳ | 0.06 | 0.06 | 0.04 |

①若容器Ⅰ的体积为2 L,反应在370 ℃下进行,20 s后达到平衡,则0~20 s内容器Ⅰ中用O2表示的反应速率为
②图中A、C、D三点容器内气体密度由大到小的顺序是
③若容器Ⅳ体积为1 L,反应在370 ℃下进行,则起始时反应
(4)以甲醇为燃料,氧气为氧化剂,KOH溶液为电解质溶液,可制成燃料电池(电极材料为惰性电极)。若产物只有H2O和一种酸式盐,则该电池的负极反应式为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐3】研究消除废气污染对建设美丽家乡,打造宜居环境有重要意义。
(1)已知:工业废气中的氮氧化物可用以下反应去除,常温常压下(298K,100kPa),以下反应的焓变和熵变如表1所示:
①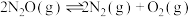
②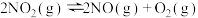
③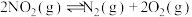
表1:
结合表1中的数据,工业上,反应___________ (填反应编号)不可用于常温常压下去除氮氧化物,请通过计算说明理由:___________ 。
(2)治理排出的尾气(含CO、 、NO)的方法可在密闭容器中发生如下反应:
、NO)的方法可在密闭容器中发生如下反应:
I.
Ⅱ.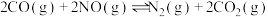
一定温度下,向体积为2L的恒容的密闭容器中,充入4molCO、2molNO、2mol 发生上述反应,达到平衡状态时,测得
发生上述反应,达到平衡状态时,测得 的物质的量为0.4mol,且体系中
的物质的量为0.4mol,且体系中 的物质的量比
的物质的量比 的多0.8mol,则该温度下达平衡时,反应Ⅱ的平衡常数K=
的多0.8mol,则该温度下达平衡时,反应Ⅱ的平衡常数K=___________ L/mol。
(3)原煤经热解、冷却得到的煤焦可用于NO的脱除。热解温度为500℃,900℃得到的煤焦分别用S-500、S-900表示,相关信息如下表:
将NO浓度恒定的废气以固定流速通过反应器(图1)。不同温度下,进行多组平行实验,测定相同时间内NO的出口浓度,可得NO的脱除率与温度的关系如图2所示。
[已知:NO的脱除主要包含吸附和化学还原( )两个过程]
)两个过程]
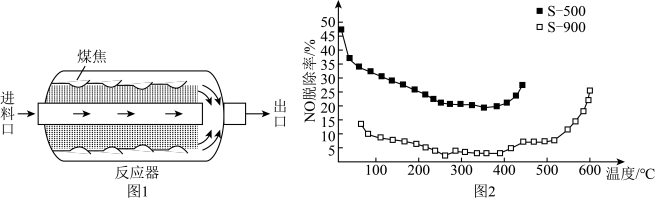
①已知煤焦表面存在的官能团有利于吸附NO,其数量与煤焦中氢碳质量比的值密切相关,比值小,表面官能团少。由图2可知,相同温度下,一单位时间内S-500对NO的脱除率比S-900的高,可能原因是___________ 。(答两条)。
②350℃后,随着温度升高,单位时间内NO的脱除率增大的原因是___________ 。
(4)电解氧化吸收法:其原理如图所示:

①从A口中出来的物质的是___________ 。
②写出电解池阴极的电极反应式___________ 。
(1)已知:工业废气中的氮氧化物可用以下反应去除,常温常压下(298K,100kPa),以下反应的焓变和熵变如表1所示:
①
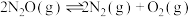
②
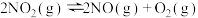
③
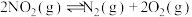
表1:
| 反应 | 焓变(kJ/mol) | 熵变(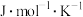 ) ) |
| ① | -163 | +22.6 |
| ② | +112.7 | +150 |
| ③ | -67.8 | +120 |
(2)治理排出的尾气(含CO、
 、NO)的方法可在密闭容器中发生如下反应:
、NO)的方法可在密闭容器中发生如下反应:I.

Ⅱ.
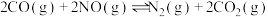
一定温度下,向体积为2L的恒容的密闭容器中,充入4molCO、2molNO、2mol
 发生上述反应,达到平衡状态时,测得
发生上述反应,达到平衡状态时,测得 的物质的量为0.4mol,且体系中
的物质的量为0.4mol,且体系中 的物质的量比
的物质的量比 的多0.8mol,则该温度下达平衡时,反应Ⅱ的平衡常数K=
的多0.8mol,则该温度下达平衡时,反应Ⅱ的平衡常数K=(3)原煤经热解、冷却得到的煤焦可用于NO的脱除。热解温度为500℃,900℃得到的煤焦分别用S-500、S-900表示,相关信息如下表:
| 煤焦 | 元素分析/% | 比表面积/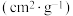 | |
| C | H | ||
| S-500 | 80.79 | 2.76 | 105.69 |
| S-900 | 84.26 | 0.82 | 8.98 |
[已知:NO的脱除主要包含吸附和化学还原(
 )两个过程]
)两个过程]
①已知煤焦表面存在的官能团有利于吸附NO,其数量与煤焦中氢碳质量比的值密切相关,比值小,表面官能团少。由图2可知,相同温度下,一单位时间内S-500对NO的脱除率比S-900的高,可能原因是
②350℃后,随着温度升高,单位时间内NO的脱除率增大的原因是
(4)电解氧化吸收法:其原理如图所示:

①从A口中出来的物质的是
②写出电解池阴极的电极反应式
您最近一年使用:0次



