解题方法
1 . 中国“长征二号F”遥八运载火箭于北京时间11月1日清晨5时58分07秒在酒泉卫星发射中心载人航天发射场点火发射,火箭的第三级使用的推进剂是液氢和液氧。
已知下面在298K时的热化学方程式:
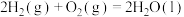
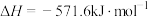
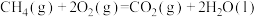

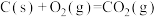
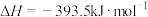
根据上面的热化学方程式完成下列问题;
(1)通过计算说明等质量的 、
、 、C完全燃烧时放出热量最多的是
、C完全燃烧时放出热量最多的是_______ ,等物质的量 、
、 、C完全燃烧时放出热量最多的是
、C完全燃烧时放出热量最多的是_______ 。
(2)根据以上反应,则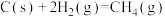 的焓变
的焓变
_______ 。
(3)已知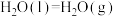
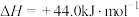 ,试写出甲烷燃烧生成二氧化碳和水蒸气的热化学方程式
,试写出甲烷燃烧生成二氧化碳和水蒸气的热化学方程式_______ 。
(4)若混合物 和
和 的总物质的量为3mol,且完全燃烧放出2066.4kJ的能量,则
的总物质的量为3mol,且完全燃烧放出2066.4kJ的能量,则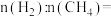
_______ 。
已知下面在298K时的热化学方程式:
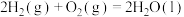
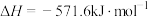
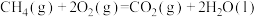

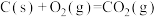
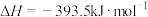
根据上面的热化学方程式完成下列问题;
(1)通过计算说明等质量的
 、
、 、C完全燃烧时放出热量最多的是
、C完全燃烧时放出热量最多的是 、
、 、C完全燃烧时放出热量最多的是
、C完全燃烧时放出热量最多的是(2)根据以上反应,则
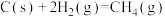 的焓变
的焓变
(3)已知
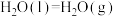
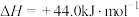 ,试写出甲烷燃烧生成二氧化碳和水蒸气的热化学方程式
,试写出甲烷燃烧生成二氧化碳和水蒸气的热化学方程式(4)若混合物
 和
和 的总物质的量为3mol,且完全燃烧放出2066.4kJ的能量,则
的总物质的量为3mol,且完全燃烧放出2066.4kJ的能量,则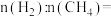
您最近一年使用:0次
名校
2 . 已知:①2H2(g)+O2(g)=2H2O(g) ΔH1;
②2Fe(s)+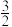 O2(g)=Fe2O3(s) ΔH2;
O2(g)=Fe2O3(s) ΔH2;
③2Al(s)+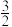 O2(g)=Al2O3(s) ΔH3;
O2(g)=Al2O3(s) ΔH3;
④2Al(s)+Fe2O3(s)=Al2O3(s)+2Fe(s) ΔH4。
下列关于反应焓变的判断正确的是
②2Fe(s)+
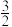 O2(g)=Fe2O3(s) ΔH2;
O2(g)=Fe2O3(s) ΔH2;③2Al(s)+
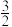 O2(g)=Al2O3(s) ΔH3;
O2(g)=Al2O3(s) ΔH3;④2Al(s)+Fe2O3(s)=Al2O3(s)+2Fe(s) ΔH4。
下列关于反应焓变的判断正确的是
A.H2的燃烧热为 ΔH1 ΔH1 | B.ΔH2=ΔH3+ΔH4 |
| C.增加氧气的量可改变ΔH2、ΔH3的值 | D.ΔH3<ΔH2 |
您最近一年使用:0次
2022-07-22更新
|
3076次组卷
|
14卷引用:山西省晋中市平遥县第二中学校2022-2023学年高二上学期8月质检化学试题
山西省晋中市平遥县第二中学校2022-2023学年高二上学期8月质检化学试题(已下线)1.3 燃料的合理利用-【帮课堂】2022-2023学年高二化学同步精品讲义(沪科版2020选择性必修第一册)(已下线)1.3 燃料的合理利用-【帮课堂】2022-2023学年高二化学同步精品讲义(沪科版2020选择性必修第一册)第一章化学反应的热效应上海市进才中学2022-2023学年高二上学期10月阶段测试化学试题福建省厦门集美中学2022-2023学年高二上学期第一次月考(10月)化学试题江苏省常熟中学2022-2023学年高二上学期10月份阳光调研化学(选修)试题江苏省常熟市王淦昌高级中学2022-2023学年高二上学期10月月考化学试卷福建省莆田第六中学2022-2023学年高二上学期第二次月考(A卷)化学试题福建省莆田第六中学2022-2023学年高二上学期第二次月考(B卷)化学试题福建省上杭县才溪中学2022-2023学年高二上学期10月月考化学试题四川省广元中学2022-2023学年高二下学期4月月考化学试题福建省福州市闽侯县第一中学2023-2024学年高二上学期10月月考化学试题上海市进才中学2023-2024学年高二上学期1月期末化学试题
解题方法
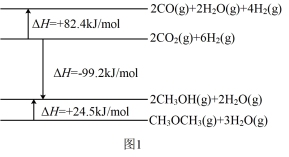
3 . 二甲醚又称甲醚,是一种十分重要的化工原料,在制药、燃料、农药等化学工业中有许多独特的用途。一定条件下,利用合成气(CO、H2)合成二甲醚,其中主要包括以下三个相互联系的反应:
i.合成气合成甲醇:CO(g) +2H2 (g) CH3OH(g);
CH3OH(g);
ii.甲醇脱水生成二甲醚:2CH3OH(g) CH3OCH3(g)+ H2O(g);
CH3OCH3(g)+ H2O(g);
iii.水煤气变换反应:CO(g)+ H2O(g) CO2(g)+ H2(g)。
CO2(g)+ H2(g)。
请回答下列问题:
(1)已知相关物质变化的焓变如图1所示,写出CO直接加氢合成二甲醚的热化学方程式:_______ 。
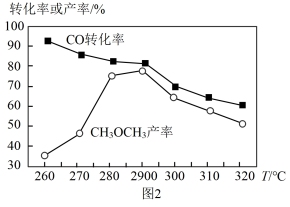
(2)有研究者在催化剂(CuO/ZnO/Al2O3)、压强为5.0 MPa的条件下,由CO和H2直接制备二甲醚,结果如图2所示,其中CO转化率随温度升高而降低的原因是_______ 。
(3)实验室模拟上述合成过程,在1 L恒容密闭容器中充入6 mol CO和6 mol H2,连续发生以上i、ii、iii反应,2 h后达到平衡,测得混合体系中各组分浓度如下表:
①平衡后,整个过程中CO的转化率为_______ ;v(CH3OCH3)=_______ mol· L-1· h-1。
②反应ii的K=_______ (保留两位小数)。
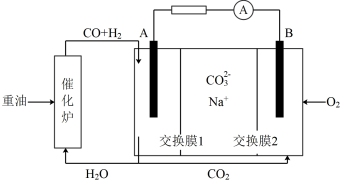
(4)合成气可做燃料电池的燃料。一种熔融盐燃料电池的工作原理如图所示,电极A上H2参与的电极反应为_______ ,假设催化炉产生的CO与H2的物质的量之比为2:1,电极A处产生的CO2有部分参与循环利用,其利用率为_______ 。
i.合成气合成甲醇:CO(g) +2H2 (g)
 CH3OH(g);
CH3OH(g);ii.甲醇脱水生成二甲醚:2CH3OH(g)
 CH3OCH3(g)+ H2O(g);
CH3OCH3(g)+ H2O(g);iii.水煤气变换反应:CO(g)+ H2O(g)
 CO2(g)+ H2(g)。
CO2(g)+ H2(g)。请回答下列问题:
(1)已知相关物质变化的焓变如图1所示,写出CO直接加氢合成二甲醚的热化学方程式:

(2)有研究者在催化剂(CuO/ZnO/Al2O3)、压强为5.0 MPa的条件下,由CO和H2直接制备二甲醚,结果如图2所示,其中CO转化率随温度升高而降低的原因是

(3)实验室模拟上述合成过程,在1 L恒容密闭容器中充入6 mol CO和6 mol H2,连续发生以上i、ii、iii反应,2 h后达到平衡,测得混合体系中各组分浓度如下表:
| 物质 | H2 | CH3OH | H2O | CO2 |
| 物质的量浓度/(mol·L-1) | l.44 | 0. 78 | 0. 12 | 0.84 |
②反应ii的K=
(4)合成气可做燃料电池的燃料。一种熔融盐燃料电池的工作原理如图所示,电极A上H2参与的电极反应为

您最近一年使用:0次
名校
4 . 清洁能源的综合利用可有效降低碳排放,是实现“碳中和、碳达峰”的重要途径。
(1)以环己烷为原料通过芳构化反应生产苯,同时可获取氢气。图甲是该反应过程中几种物质间的能量关系。
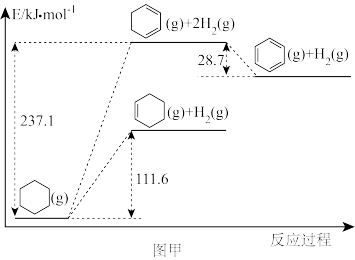
芳构化反应: (g)→
(g)→ (g)+3H2(g)
(g)+3H2(g) 
_______ kJ/mol。
(2) 和
和 合成乙醇反应为:
合成乙醇反应为: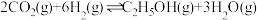 。将等物质的量的
。将等物质的量的 和
和 充入一刚性容器中,测得平衡时
充入一刚性容器中,测得平衡时 的体积分数随温度和压强的关系如图乙。
的体积分数随温度和压强的关系如图乙。
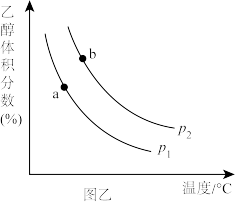
①压强P1_______ P2(填“>”“=”或“<”,下同),a、b两点的平衡常数Ka_______ Kb。
②已知Arrhenius经验公式为 (
( 为活化能,k为速率常数,R和C为常数),为探究m、n两种催化剂的催化效能,进行了实验探究,依据实验数据获得图丙曲线。
为活化能,k为速率常数,R和C为常数),为探究m、n两种催化剂的催化效能,进行了实验探究,依据实验数据获得图丙曲线。
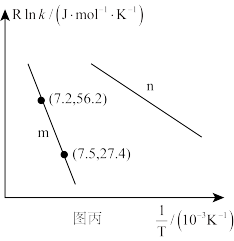
在m催化剂作用下,该反应的活化能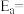
_______ J/mol。从图中信息获知催化效能较高的催化剂是_______ (填“m”或“n”),判断理由是_______ 。
(3) 和CO合成甲烷反应为:
和CO合成甲烷反应为: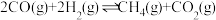 。T℃将等物质的量CO和H2充入恒压(200KPa)的密闭容器中。已知逆反应速率
。T℃将等物质的量CO和H2充入恒压(200KPa)的密闭容器中。已知逆反应速率 ,其中p为分压,该温度下
,其中p为分压,该温度下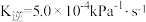 。反应达平衡时测得v正=
。反应达平衡时测得v正=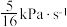 。CO的平衡转化率为
。CO的平衡转化率为_______ ,该温度下反应的Kp=_______ 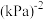 (用组分的分压计算的平衡常数)。
(用组分的分压计算的平衡常数)。
(1)以环己烷为原料通过芳构化反应生产苯,同时可获取氢气。图甲是该反应过程中几种物质间的能量关系。

芳构化反应:
 (g)→
(g)→ (g)+3H2(g)
(g)+3H2(g) 
(2)
 和
和 合成乙醇反应为:
合成乙醇反应为: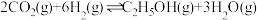 。将等物质的量的
。将等物质的量的 和
和 充入一刚性容器中,测得平衡时
充入一刚性容器中,测得平衡时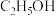 的体积分数随温度和压强的关系如图乙。
的体积分数随温度和压强的关系如图乙。
①压强P1
②已知Arrhenius经验公式为
 (
( 为活化能,k为速率常数,R和C为常数),为探究m、n两种催化剂的催化效能,进行了实验探究,依据实验数据获得图丙曲线。
为活化能,k为速率常数,R和C为常数),为探究m、n两种催化剂的催化效能,进行了实验探究,依据实验数据获得图丙曲线。
在m催化剂作用下,该反应的活化能
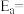
(3)
 和CO合成甲烷反应为:
和CO合成甲烷反应为: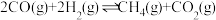 。T℃将等物质的量CO和H2充入恒压(200KPa)的密闭容器中。已知逆反应速率
。T℃将等物质的量CO和H2充入恒压(200KPa)的密闭容器中。已知逆反应速率 ,其中p为分压,该温度下
,其中p为分压,该温度下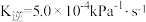 。反应达平衡时测得v正=
。反应达平衡时测得v正=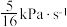 。CO的平衡转化率为
。CO的平衡转化率为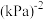 (用组分的分压计算的平衡常数)。
(用组分的分压计算的平衡常数)。
您最近一年使用:0次
2022-04-14更新
|
1510次组卷
|
10卷引用:山西省晋中市平遥县第二中学校2021-2022学年高二下学期升级化学试题
山西省晋中市平遥县第二中学校2021-2022学年高二下学期升级化学试题山东省青岛市2021-2022学年高三下学期第一次模拟考试化学试题(已下线)化学-2022年高考押题预测卷02(辽宁卷)(已下线)押江苏卷第18题 化学反应原理综合题 -备战2022年高考化学临考题号押题(江苏卷)山东省泰安市2022届高三下学期三轮验收考试化学试题(已下线)化学-2022年高考考前押题密卷(湖北卷)广东省珠海市实验中学、东莞市第六高级中学、河源高级中学、中山市实验中学2021-2022学年下学期高三第五次联考化学试题山东省滨州市2023届高三上学期期末综合测试化学试题(已下线)山东省济南市2022届高三3月高考模拟考试(一模)(原理综合题)湖南省醴陵市第一中学2023届高三下学期第七次月考化学试题
解题方法
5 . 碳中和目标背景下,我国加快低碳技术的发展和应用推广,其中二氧化碳碳捕集、利用与封存技术已经成为近期化学研究的热点,回答下列问题:
(1)已知常温常压下下列反应的能量变化如图所示:
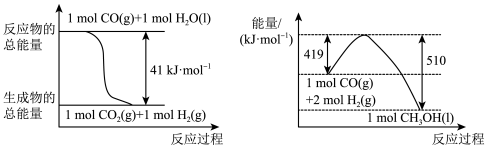
写出由二氧化碳和氢气制备甲醇的热化学方程式:_______ 。
(2)CO2催化加氢制取甲醇,反应如下:
主反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ∆H1=-49.5kJ·mol-1
CH3OH(g)+H2O(g) ∆H1=-49.5kJ·mol-1
副反应:CO2(g)+H2(g) CO(g)+H2O(g) △H2=+41.2kJ·mol-1
CO(g)+H2O(g) △H2=+41.2kJ·mol-1
①在一定条件下,向某1L恒容密闭容器中充入1molCO2和amolH2发生主反应。图中能表示该反应的平衡常数K与温度T之间的变化关系的是曲线_______ (填“m”或“n”),判断依据是_______ 。
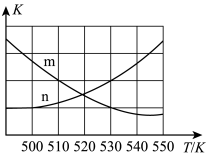
②副反应的反应速率v=v正-v逆=k正c(CO2)·c(H2)k逆cm(CO)·cn(H2O),其中k正、k逆分别为正、逆反应速率常数。该反应的平衡常数K=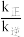 ,则m=
,则m=_______ ,升高温度时k正-k逆_______ (填“增大”减小”或“不变”)。
③在一定温度下,①中的起始总压强为21.2MPa。实验测得CO2的平衡转化率和平衡时CH3OH的选择性随温度变化如图所示:
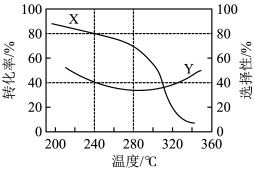
已知:CH3OH的选择性=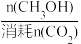 ×100%。图中表示平衡时CH3OH的选择性的曲线为
×100%。图中表示平衡时CH3OH的选择性的曲线为_______ (填“X”或“Y”),温度高于280°C时,曲线Y随温度升高而升高的原因是_______ 。240°C时,反应20min容器内达平衡状态,副反应的K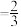 ,初始充入H2的物质的量a=
,初始充入H2的物质的量a=_______ mol,主反应的平衡常数Kp=_______ (MPa)-2(①用平衡分压代替平衡浓度,分压=总压×物质的量分数;②计算结果保留1位小数)。
(1)已知常温常压下下列反应的能量变化如图所示:

写出由二氧化碳和氢气制备甲醇的热化学方程式:
(2)CO2催化加氢制取甲醇,反应如下:
主反应:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ∆H1=-49.5kJ·mol-1
CH3OH(g)+H2O(g) ∆H1=-49.5kJ·mol-1副反应:CO2(g)+H2(g)
 CO(g)+H2O(g) △H2=+41.2kJ·mol-1
CO(g)+H2O(g) △H2=+41.2kJ·mol-1①在一定条件下,向某1L恒容密闭容器中充入1molCO2和amolH2发生主反应。图中能表示该反应的平衡常数K与温度T之间的变化关系的是曲线

②副反应的反应速率v=v正-v逆=k正c(CO2)·c(H2)k逆cm(CO)·cn(H2O),其中k正、k逆分别为正、逆反应速率常数。该反应的平衡常数K=
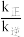 ,则m=
,则m=③在一定温度下,①中的起始总压强为21.2MPa。实验测得CO2的平衡转化率和平衡时CH3OH的选择性随温度变化如图所示:

已知:CH3OH的选择性=
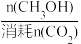 ×100%。图中表示平衡时CH3OH的选择性的曲线为
×100%。图中表示平衡时CH3OH的选择性的曲线为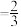 ,初始充入H2的物质的量a=
,初始充入H2的物质的量a=
您最近一年使用:0次
6 . 2021年11月2日,第四届世界顶尖科学家碳大会——通往“双碳目标”的科技之路论坛在上海召开。我国科学家刘科提到了绿色甲醇技术,将CO2转化为甲醇是实现碳达峰、碳中和的一种非常重要的路径。回答下列问题:
(1)已知H2(g)和CH3OH(l)的燃烧热分别为285.8kJ·mol-1、726.5kJ·mol-1,则CO2与H2反应生成液态甲醇和液态水的热化学方程式为_____ 。
(2)最近科学家采用真空封管法制备磷化硼纳米颗粒,在发展非金属催化剂实现CO2电催化还原制备甲醇方向取得重要进展,反应历程如图所示:
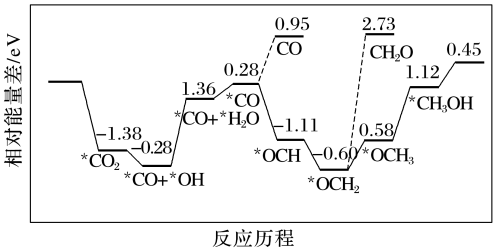
①反应容易得到的副产物有CO和CH2O,其中相对较少的副产物为_____ 。
②上述合成甲醇的反应速率较慢,要使反应速率加快,主要降低下列变化中_____ (填字母)的能量变化。
A.*CO+*OH→*CO+*H2O B.*CO+*H2O→*CO
C.*OCH2→*OCH3 D.*OCH3→*CH3OH
(3)一定条件下,在1L恒容密闭容器中充入1molCO2和3molH2发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),温度对CO2平衡转化率及催化剂的催化效率影响如图所示:
CH3OH(g)+H2O(g),温度对CO2平衡转化率及催化剂的催化效率影响如图所示:
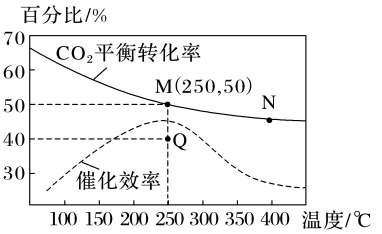
①下列说法能说明该反应达到化学平衡状态的是_____ (填字母)。
A.混合气体的密度不再变化
B.混合气体的平均相对分子质量不再变化
C.CO2、H2、CH3OH、H2O的物质的量之比为1∶3∶1∶1
D.H2O(g)和CO2(g)的生成速率之比为1∶1
②反应速率:v正(M)_____ (填“大于”“小于”“等于”或“无法判断”,下同)v逆(N),化学平衡常数:KM_____ KN。
③M点甲醇的体积分数为_____ ,该温度下,反应的平衡常数K=_____ 。
④已知:反应速率v=v正-v逆=k正c(CO2)·c3(H2)-k逆c(CH3OH)·c(H2O),k正、k逆分别为正、逆反应速率常数,则Q点时 =
=_____ (保留2位小数)。
(1)已知H2(g)和CH3OH(l)的燃烧热分别为285.8kJ·mol-1、726.5kJ·mol-1,则CO2与H2反应生成液态甲醇和液态水的热化学方程式为
(2)最近科学家采用真空封管法制备磷化硼纳米颗粒,在发展非金属催化剂实现CO2电催化还原制备甲醇方向取得重要进展,反应历程如图所示:

①反应容易得到的副产物有CO和CH2O,其中相对较少的副产物为
②上述合成甲醇的反应速率较慢,要使反应速率加快,主要降低下列变化中
A.*CO+*OH→*CO+*H2O B.*CO+*H2O→*CO
C.*OCH2→*OCH3 D.*OCH3→*CH3OH
(3)一定条件下,在1L恒容密闭容器中充入1molCO2和3molH2发生反应:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g),温度对CO2平衡转化率及催化剂的催化效率影响如图所示:
CH3OH(g)+H2O(g),温度对CO2平衡转化率及催化剂的催化效率影响如图所示:
①下列说法能说明该反应达到化学平衡状态的是
A.混合气体的密度不再变化
B.混合气体的平均相对分子质量不再变化
C.CO2、H2、CH3OH、H2O的物质的量之比为1∶3∶1∶1
D.H2O(g)和CO2(g)的生成速率之比为1∶1
②反应速率:v正(M)
③M点甲醇的体积分数为
④已知:反应速率v=v正-v逆=k正c(CO2)·c3(H2)-k逆c(CH3OH)·c(H2O),k正、k逆分别为正、逆反应速率常数,则Q点时
 =
=
您最近一年使用:0次
解题方法
7 . 我国提出争取在2030年前实现碳峰值,2060年实现碳中和,这对改善环境、实现绿色发展至关重要。以含碳物质为原料的“碳-化学”将处于化学产业的核心,成为科学家研究的重要课题。请回答下列问题:
(1)已知CO、H2、 的燃烧热分别为:
的燃烧热分别为: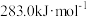 、
、 、
、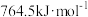 。则反应:
。则反应:
_______ 。
(2)在一容积可变的密闭容器中充入 和
和 ,发生反应
,发生反应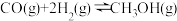 ,CO的平衡转化率(
,CO的平衡转化率( )与温度(T)、压强(p)的关系如图所示。
)与温度(T)、压强(p)的关系如图所示。
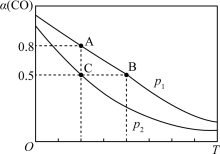
则压强
_______ (填“<”“=”或“>”) ;A、B、C三点的平衡常数
;A、B、C三点的平衡常数 、
、 、
、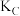 的大小关系为
的大小关系为_______ (用“<”“=”或“>”表示)。
(3) 经催化加氢可合成低碳烯烃:
经催化加氢可合成低碳烯烃: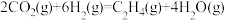 。在
。在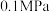 时,按
时,按 投料,如图所示为不同温度(T)下,平衡时四种气态物质的物质的量(n)关系。
投料,如图所示为不同温度(T)下,平衡时四种气态物质的物质的量(n)关系。
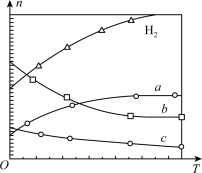
则:
①该反应的
_______ (填“>”或“<”)0。
②曲线c表示的物质为_______ 。
(4)在 、
、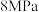 下,将
下,将 和
和 按物质的量之比1∶3通入一密闭容器中发生反应:
按物质的量之比1∶3通入一密闭容器中发生反应: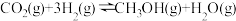 ,达到平衡时,测得
,达到平衡时,测得 的平衡转化率为50%,则该反应条件下的平衡常数
的平衡转化率为50%,则该反应条件下的平衡常数
_______ 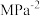 (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(1)已知CO、H2、
 的燃烧热分别为:
的燃烧热分别为: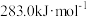 、
、 、
、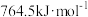 。则反应:
。则反应:
(2)在一容积可变的密闭容器中充入
 和
和 ,发生反应
,发生反应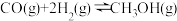 ,CO的平衡转化率(
,CO的平衡转化率( )与温度(T)、压强(p)的关系如图所示。
)与温度(T)、压强(p)的关系如图所示。
则压强

 ;A、B、C三点的平衡常数
;A、B、C三点的平衡常数 、
、 、
、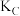 的大小关系为
的大小关系为(3)
 经催化加氢可合成低碳烯烃:
经催化加氢可合成低碳烯烃: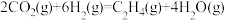 。在
。在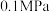 时,按
时,按 投料,如图所示为不同温度(T)下,平衡时四种气态物质的物质的量(n)关系。
投料,如图所示为不同温度(T)下,平衡时四种气态物质的物质的量(n)关系。
则:
①该反应的

②曲线c表示的物质为
(4)在
 、
、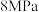 下,将
下,将 和
和 按物质的量之比1∶3通入一密闭容器中发生反应:
按物质的量之比1∶3通入一密闭容器中发生反应: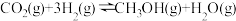 ,达到平衡时,测得
,达到平衡时,测得 的平衡转化率为50%,则该反应条件下的平衡常数
的平衡转化率为50%,则该反应条件下的平衡常数
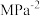 (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
您最近一年使用:0次
名校
解题方法
8 .  捕获技术用于去除气流中的
捕获技术用于去除气流中的 或者分离出
或者分离出 作为气体产物,其中
作为气体产物,其中 催化合成甲醇是一种很有前景的方法。如图所示为该反应在无催化剂及有正催化剂时的能量变化(该反应为可逆反应)。
催化合成甲醇是一种很有前景的方法。如图所示为该反应在无催化剂及有正催化剂时的能量变化(该反应为可逆反应)。
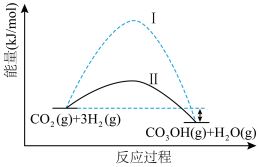
(1)温度为523 K时,测得上述反应中生成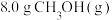 放出的热量为12.3 kJ。反应的热化学方程式为
放出的热量为12.3 kJ。反应的热化学方程式为___________ 。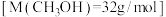
(2)从图可知,有催化剂存在的是过程___________ (填“Ⅰ”或“Ⅱ”)。
(3)一定温度下(各物质均为气态),向体积为2 L的恒容密闭容器中充入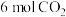 和
和 ,加入合适催化剂进行反应。某时刻测得
,加入合适催化剂进行反应。某时刻测得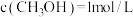 ,此时反应
,此时反应___________ (填“正向移动”、“逆向移动”或“达到平衡)。已知该温度下反应的化学平衡常数值为1/40.
(4)关于 催化合成甲醇的反应,下列说法中合理的是___________(填字母序号)。
催化合成甲醇的反应,下列说法中合理的是___________(填字母序号)。
(5)制备过程中存在副反应: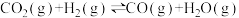
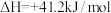 将混合气按进料比
将混合气按进料比 通入反应装置,选择合适催化剂发生反应。不同温度和压强下,
通入反应装置,选择合适催化剂发生反应。不同温度和压强下, 平衡产率和
平衡产率和 平衡转化率分别如图1、图2。
平衡转化率分别如图1、图2。
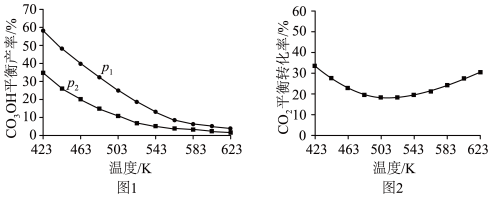
①图1中,压强
___________  (填“>”“=”或“<”),推断的依据是
(填“>”“=”或“<”),推断的依据是___________ 。
②图2中,压强为 ,温度高于503 K后,
,温度高于503 K后, 平衡转化率随温度升高而增大的原因是
平衡转化率随温度升高而增大的原因是___________ 。
 捕获技术用于去除气流中的
捕获技术用于去除气流中的 或者分离出
或者分离出 作为气体产物,其中
作为气体产物,其中 催化合成甲醇是一种很有前景的方法。如图所示为该反应在无催化剂及有正催化剂时的能量变化(该反应为可逆反应)。
催化合成甲醇是一种很有前景的方法。如图所示为该反应在无催化剂及有正催化剂时的能量变化(该反应为可逆反应)。
(1)温度为523 K时,测得上述反应中生成
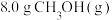 放出的热量为12.3 kJ。反应的热化学方程式为
放出的热量为12.3 kJ。反应的热化学方程式为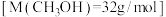
(2)从图可知,有催化剂存在的是过程
(3)一定温度下(各物质均为气态),向体积为2 L的恒容密闭容器中充入
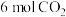 和
和 ,加入合适催化剂进行反应。某时刻测得
,加入合适催化剂进行反应。某时刻测得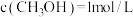 ,此时反应
,此时反应(4)关于
 催化合成甲醇的反应,下列说法中合理的是___________(填字母序号)。
催化合成甲醇的反应,下列说法中合理的是___________(填字母序号)。| A.该反应原子转化率为100% |
B.该反应可用于 的转化,有助于缓解温室效应 的转化,有助于缓解温室效应 |
C.使用催化剂可以降低该反应的 ,从而使反应放出更多热量 ,从而使反应放出更多热量 |
D.降温分离液态甲醇和水,将剩余气体重新通入反应器,可提高 与 与 的利用率 的利用率 |
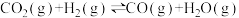
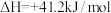 将混合气按进料比
将混合气按进料比 通入反应装置,选择合适催化剂发生反应。不同温度和压强下,
通入反应装置,选择合适催化剂发生反应。不同温度和压强下, 平衡产率和
平衡产率和 平衡转化率分别如图1、图2。
平衡转化率分别如图1、图2。
①图1中,压强

 (填“>”“=”或“<”),推断的依据是
(填“>”“=”或“<”),推断的依据是②图2中,压强为
 ,温度高于503 K后,
,温度高于503 K后, 平衡转化率随温度升高而增大的原因是
平衡转化率随温度升高而增大的原因是
您最近一年使用:0次
2021-11-15更新
|
181次组卷
|
2卷引用:山西省介休市第十中学2022-2023学年高二上学期 期中考试化学试题



