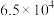1 . 氨是重要的化工原料,我国目前氨的生产能力居世界首位。随着科技的发展,氨的合成途径越来越多。回答下列问题:
(1)有一种新的以 载氮体的碳基化学链合成氨的方法,其原理为:
载氮体的碳基化学链合成氨的方法,其原理为:
①该反应分两步进行:
(Ⅰ)
(Ⅱ)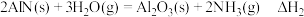
已知反应(Ⅰ):反应物总键能比生成物总键能多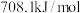 ;反应(Ⅱ):正反应活化能比逆反应活化能小
;反应(Ⅱ):正反应活化能比逆反应活化能小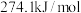 ,则
,则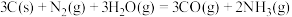 的
的
___________ 。
②反应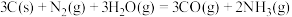 能自发进行的条件为:
能自发进行的条件为:___________ 。
A.高温 B.低温 C.任何温度
(2)传统的合成氨反应为: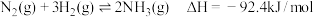 ,
,
①恒温条件下,将 和
和 按物质的量之比
按物质的量之比 投入到恒容密闭容器中发生反应:
投入到恒容密闭容器中发生反应: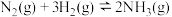 ,下列描述能说明达到化学平衡状态的有
,下列描述能说明达到化学平衡状态的有___________ (填序号)。
A. 和
和 的物质的量之比不变 B.容器的压强不再改变
的物质的量之比不变 B.容器的压强不再改变
C.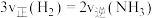 D.断裂3个
D.断裂3个 键的同时断裂6个
键的同时断裂6个 键
键
②合成氨速率方程为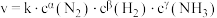 ,其中k为速率常数,根据表中数据分析:
,其中k为速率常数,根据表中数据分析:
则
___________ ,
___________ 。
③在恒温条件下,向 恒容密闭容器中充入
恒容密闭容器中充入 和
和 ,反应经过
,反应经过 后达到平衡,压强减小了
后达到平衡,压强减小了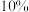 ,则从开始到平衡,
,则从开始到平衡,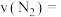
___________  后再向里面加入
后再向里面加入 和
和 各
各 ,正逆反应速率的大小关系为:
,正逆反应速率的大小关系为:
___________ (填“>”、“<”或“=”) 。
。
(1)有一种新的以
 载氮体的碳基化学链合成氨的方法,其原理为:
载氮体的碳基化学链合成氨的方法,其原理为:
①该反应分两步进行:
(Ⅰ)

(Ⅱ)
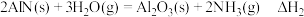
已知反应(Ⅰ):反应物总键能比生成物总键能多
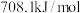 ;反应(Ⅱ):正反应活化能比逆反应活化能小
;反应(Ⅱ):正反应活化能比逆反应活化能小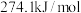 ,则
,则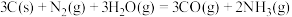 的
的
②反应
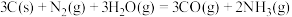 能自发进行的条件为:
能自发进行的条件为:A.高温 B.低温 C.任何温度
(2)传统的合成氨反应为:
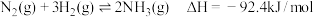 ,
,①恒温条件下,将
 和
和 按物质的量之比
按物质的量之比 投入到恒容密闭容器中发生反应:
投入到恒容密闭容器中发生反应: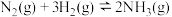 ,下列描述能说明达到化学平衡状态的有
,下列描述能说明达到化学平衡状态的有A.
 和
和 的物质的量之比不变 B.容器的压强不再改变
的物质的量之比不变 B.容器的压强不再改变C.
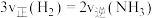 D.断裂3个
D.断裂3个 键的同时断裂6个
键的同时断裂6个 键
键②合成氨速率方程为
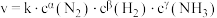 ,其中k为速率常数,根据表中数据分析:
,其中k为速率常数,根据表中数据分析:| 实验 | 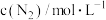 | 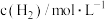 |  |
| 1 | m | n | q |
| 2 | 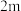 | n |  |
| 3 | m |  | 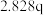 |


③在恒温条件下,向
 恒容密闭容器中充入
恒容密闭容器中充入 和
和 ,反应经过
,反应经过 后达到平衡,压强减小了
后达到平衡,压强减小了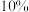 ,则从开始到平衡,
,则从开始到平衡,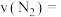
 后再向里面加入
后再向里面加入 和
和 各
各 ,正逆反应速率的大小关系为:
,正逆反应速率的大小关系为:
 。
。
您最近一年使用:0次
2 . 甲醇是一种可再生的清洁能源,二氧化碳催化加氢制甲醇,有利于实现“碳达峰”、“碳中和”。已知有关 的热化学方程式如下:
的热化学方程式如下:
Ⅰ. ,
,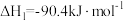 ;
;
Ⅱ. ,
, ;
;
Ⅲ. ,
,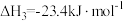 ;
;
Ⅳ. ,
,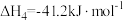 ;
;
请回答下列问题:
(1)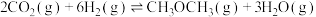

_______ 。
(2)在体积一定的密闭容器中按物质的量比1:2充入CO和 ,发生上述反应Ⅰ,充分反应达平衡后,如图是平衡混合物中
,发生上述反应Ⅰ,充分反应达平衡后,如图是平衡混合物中 的体积分数在不同压强下随温度变化的平衡曲线。
的体积分数在不同压强下随温度变化的平衡曲线。 ,温度为300℃时,反应Ⅰ的压强平衡常数
,温度为300℃时,反应Ⅰ的压强平衡常数
_______ 。(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
②反应Ⅰ达平衡后,下列措施能提高 产率的是
产率的是_______ (填字母)。
A.加入适量一氧化碳 B.升高温度 C.使用高效催化剂 D.增大压强
(3)一定温度下,向容积为1L的恒容密闭容器中,充入 和
和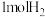 ,发生上述反应Ⅱ,测得各物质的物质的量浓度变化如图所示:
,发生上述反应Ⅱ,测得各物质的物质的量浓度变化如图所示:_______ 的浓度随时间的变化;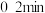 内,
内, 的平均反应速率为
的平均反应速率为_______  。
。
(4)对于反应Ⅲ,其速率方程式为 ,
, ,
, ,
, 为速率常数且只与温度有关,则该反应的平衡常数
为速率常数且只与温度有关,则该反应的平衡常数
_______ (用含 、
、 的代数式表示)。
的代数式表示)。
已知某温度下,上述反应平衡常数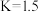 ,在密闭容器中充入一定物质的量的
,在密闭容器中充入一定物质的量的 ,反应到某时刻测得各组分的物质的量如下:
,反应到某时刻测得各组分的物质的量如下:
此时正、逆反应速率的大小:
_______  。
。
 的热化学方程式如下:
的热化学方程式如下:Ⅰ.
 ,
,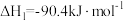 ;
;Ⅱ.
 ,
, ;
;Ⅲ.
 ,
,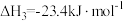 ;
;Ⅳ.
 ,
,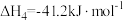 ;
;请回答下列问题:
(1)
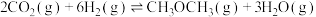

(2)在体积一定的密闭容器中按物质的量比1:2充入CO和
 ,发生上述反应Ⅰ,充分反应达平衡后,如图是平衡混合物中
,发生上述反应Ⅰ,充分反应达平衡后,如图是平衡混合物中 的体积分数在不同压强下随温度变化的平衡曲线。
的体积分数在不同压强下随温度变化的平衡曲线。
 ,温度为300℃时,反应Ⅰ的压强平衡常数
,温度为300℃时,反应Ⅰ的压强平衡常数
②反应Ⅰ达平衡后,下列措施能提高
 产率的是
产率的是A.加入适量一氧化碳 B.升高温度 C.使用高效催化剂 D.增大压强
(3)一定温度下,向容积为1L的恒容密闭容器中,充入
 和
和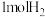 ,发生上述反应Ⅱ,测得各物质的物质的量浓度变化如图所示:
,发生上述反应Ⅱ,测得各物质的物质的量浓度变化如图所示: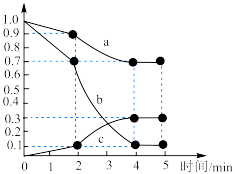
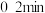 内,
内, 的平均反应速率为
的平均反应速率为 。
。(4)对于反应Ⅲ,其速率方程式为
 ,
, ,
, ,
, 为速率常数且只与温度有关,则该反应的平衡常数
为速率常数且只与温度有关,则该反应的平衡常数
 、
、 的代数式表示)。
的代数式表示)。已知某温度下,上述反应平衡常数
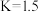 ,在密闭容器中充入一定物质的量的
,在密闭容器中充入一定物质的量的 ,反应到某时刻测得各组分的物质的量如下:
,反应到某时刻测得各组分的物质的量如下:| 物质 |  |  | 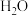 |
| 物质的量/mol | 0.2 | 0.2 | 0.2 |

 。
。
您最近一年使用:0次
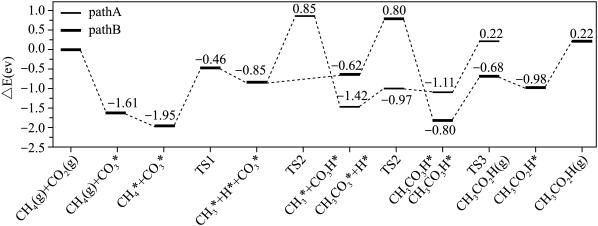
3 . CO2和CH4合成CH3COOH对实现“碳中和”目标具有重要意义。回答下列问题:
(1)25℃时,CH4和CH3COOH的燃烧热分别为890.3kJ·mol-1和873.7kJ·mol-1,写出CO2和CH4合成CH3COOH(l)的热化学方程式___________ 。
(2)在硫酸酸化的ZrO2催化剂表面发生反应时,涉及多个基元反应,反应经历pathA,pathB两个路径,其能量变化如下图所示。吸附在催化剂表面的物种用*标注,TS1、TS2、TS3表示过渡态。___________ (填“放出热量”或“吸收热量”)。
②上述基元反应pathA路径中,速率最慢的一步的反应方程式为___________ 。
③pathA和pathB路径相比,___________ 更容易进行。
(3)已知 能自发进行,
能自发进行,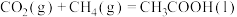
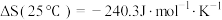 ,下列说法正确的是___________。
,下列说法正确的是___________。
(4)以CuO-ZrO2作催化剂,CO2、CH4投料比为1:1,300℃反应,平衡时CH4转化率为12%,CH3COOH选择性为95%,则CH3COOH的平衡产率为___________ 。(选择性指转化为目标产物的某反应物的质量与发生反应的该反应物的质量之比)
(5)立方ZrO2的晶胞如图,晶胞参数为apm,O2-和Zr4+间的最小距离为___________ pm,晶体密度为___________ g·cm-3。(列出计算式,阿伏加德罗常数的值用 表示)
表示)
(1)25℃时,CH4和CH3COOH的燃烧热分别为890.3kJ·mol-1和873.7kJ·mol-1,写出CO2和CH4合成CH3COOH(l)的热化学方程式
(2)在硫酸酸化的ZrO2催化剂表面发生反应时,涉及多个基元反应,反应经历pathA,pathB两个路径,其能量变化如下图所示。吸附在催化剂表面的物种用*标注,TS1、TS2、TS3表示过渡态。
②上述基元反应pathA路径中,速率最慢的一步的反应方程式为
③pathA和pathB路径相比,
(3)已知
 能自发进行,
能自发进行,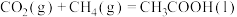
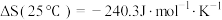 ,下列说法正确的是___________。
,下列说法正确的是___________。| A.25℃时,该反应能自发进行 |
| B.降低温度能提高CH4的平衡转化率 |
C. ,反应达平衡状态 ,反应达平衡状态 |
| D.温度越高反应速率越快 |
(4)以CuO-ZrO2作催化剂,CO2、CH4投料比为1:1,300℃反应,平衡时CH4转化率为12%,CH3COOH选择性为95%,则CH3COOH的平衡产率为
(5)立方ZrO2的晶胞如图,晶胞参数为apm,O2-和Zr4+间的最小距离为
 表示)
表示)
您最近一年使用:0次
2024-04-21更新
|
163次组卷
|
2卷引用:山西省平遥中学2023-2024学年高三二模考试化学试题
名校
解题方法
4 . 乙二醇是一种重要的化工原料,可用于生产聚酯纤维、防冻剂、增塑剂等。由合成气直接法制乙二醇的主要反应如下:
反应Ⅰ
反应Ⅱ
(1)已知298K、101kPa下, ,
, ,则
,则
_______  。
。
(2)在恒压密闭容器中充入合成气 ,仅考虑发生反应Ⅰ,维持10%转化率,所需反应条件(温度、压强)如表:
,仅考虑发生反应Ⅰ,维持10%转化率,所需反应条件(温度、压强)如表:
则
____________ (填“>”或“<”)0,随着温度升高所需压强增大的原因是_____________________ 。
(3)在2L刚性容器中充入合成气 ,总压
,总压 ,温度473K,催化剂
,温度473K,催化剂 (含
(含 )下进行反应。
)下进行反应。
①测得 和
和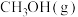 的时空收率分别为
的时空收率分别为 和
和 (时空收率是指催化剂中单位质量Rh在单位时间内所获得的产物量),则用
(时空收率是指催化剂中单位质量Rh在单位时间内所获得的产物量),则用 表示的反应速率为
表示的反应速率为_____________  。
。
②平衡时,若 和
和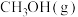 体积分数相等,
体积分数相等, 的分压为
的分压为 ,则
,则 的选择性为
的选择性为_______ ,反应Ⅰ的平衡常数
___________ (用含x的式子表示)。(已知: 的选择性
的选择性 ;分压=总压×物质的量分数。)
;分压=总压×物质的量分数。)
(4)合成气直接法制乙二醇的反应Ⅰ、反应Ⅱ的反应历程(部分)如图1,一定条件下CO分压对选择性影响如图2所示。
 图2
图2
结合图1,图2,从速率角度解释CO分压增大 选择性升高的原因
选择性升高的原因_________________ 。
反应Ⅰ

反应Ⅱ

(1)已知298K、101kPa下,
 ,
, ,则
,则
 。
。(2)在恒压密闭容器中充入合成气
 ,仅考虑发生反应Ⅰ,维持10%转化率,所需反应条件(温度、压强)如表:
,仅考虑发生反应Ⅰ,维持10%转化率,所需反应条件(温度、压强)如表:温度T/K | 298.15 | 300 | 354.7 | 400 |
压强P/kPa | 5.73 | 6.38 | 49.27 | 260.99 |
反应Ⅰ平衡常数K |
|
| 1 |
|

(3)在2L刚性容器中充入合成气
 ,总压
,总压 ,温度473K,催化剂
,温度473K,催化剂 (含
(含 )下进行反应。
)下进行反应。①测得
 和
和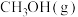 的时空收率分别为
的时空收率分别为 和
和 (时空收率是指催化剂中单位质量Rh在单位时间内所获得的产物量),则用
(时空收率是指催化剂中单位质量Rh在单位时间内所获得的产物量),则用 表示的反应速率为
表示的反应速率为 。
。②平衡时,若
 和
和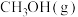 体积分数相等,
体积分数相等, 的分压为
的分压为 ,则
,则 的选择性为
的选择性为
 的选择性
的选择性 ;分压=总压×物质的量分数。)
;分压=总压×物质的量分数。)(4)合成气直接法制乙二醇的反应Ⅰ、反应Ⅱ的反应历程(部分)如图1,一定条件下CO分压对选择性影响如图2所示。

 图2
图2结合图1,图2,从速率角度解释CO分压增大
 选择性升高的原因
选择性升高的原因
您最近一年使用:0次
2023-05-05更新
|
420次组卷
|
4卷引用:2024届山西省介休市定阳高级中学高三下学期模拟考试(九)理综试题-高中化学