名校
解题方法
1 . (1)在一定条件下氨气和氧气能发生反应生成氮气和水蒸气:4NH3(g)+3O2(g)=2N2(g)+6H2O(g) △H
查阅资料可得有关的化学键键能数据如下:
由此计算上述反应的反应热△H=___________ kJ·mol-1。
(2)已知:N2(g)+O2(g)=2NO(g) K1
N2(g)+3H2(g)=2NH3(g) K2
2H2(g)+O2(g)=2H2O(g) K3
注:K1、K2、K3分别为上述三个反应的平衡常数
回答下列问题:
①氨催化氧化反应(生成气态水)的平衡常数K为___________ (用K1、K2、K3表示)。
②一定条件下,将4molNH3和5.2molO2混合于容积为4L的恒容密闭容器中发生催化氧化反应,经过10s后达到平衡,测得NO的浓度为0.4mol/L则0到10s内,用NH3表示该反应的平均反应速率为___________ ,O2的转化率为___________ (用百分数表示,且保留小数点后一位),该反应的平衡常数为___________ (列出计算式即可)。
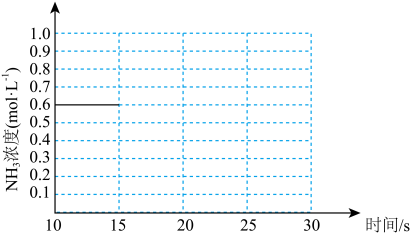
③若上述反应第一次达到平衡时,保持其他条件不变的情况下,只是将容器的体积扩大一倍,假定在25s后达到新的平衡。请在下图中用曲线表示15~30s这个阶段体系中NH3的浓度随时间变化的趋势。__________
(3)下列有关该反应的说法正确的是___________ (填字母)。
A.恒温恒容,再充入4molNH3和5.2molO2,再次达到平衡时,NH3的转化率增大
B.恒温恒容,当容器内的密度保持不变时,反应达到了平衡
C.当混合气体的平均摩尔质量不变时,反应达到了平衡
D.当2v正(NO)=3v逆(H2O)时,反应达到了平衡
(4)工业上常用氨水吸收SO2,可生成(NH4)2SO3,请判断常温下(NH4)2SO3溶液的酸碱性并通过计算说明判断依据:_______________________________________________________ 。(已知:NH3·H2O的Kb=1.8×10-5;H2SO3的Ka1=1.3×10-2,Ka2=6.3×10-8)
查阅资料可得有关的化学键键能数据如下:
| 化学键 | N≡N | H-O | N-H | O=O |
| E/ (kJ·mol-1) | 946 | 463 | 391 | 496 |
由此计算上述反应的反应热△H=
(2)已知:N2(g)+O2(g)=2NO(g) K1
N2(g)+3H2(g)=2NH3(g) K2
2H2(g)+O2(g)=2H2O(g) K3
注:K1、K2、K3分别为上述三个反应的平衡常数
回答下列问题:
①氨催化氧化反应(生成气态水)的平衡常数K为
②一定条件下,将4molNH3和5.2molO2混合于容积为4L的恒容密闭容器中发生催化氧化反应,经过10s后达到平衡,测得NO的浓度为0.4mol/L则0到10s内,用NH3表示该反应的平均反应速率为
③若上述反应第一次达到平衡时,保持其他条件不变的情况下,只是将容器的体积扩大一倍,假定在25s后达到新的平衡。请在下图中用曲线表示15~30s这个阶段体系中NH3的浓度随时间变化的趋势。

(3)下列有关该反应的说法正确的是
A.恒温恒容,再充入4molNH3和5.2molO2,再次达到平衡时,NH3的转化率增大
B.恒温恒容,当容器内的密度保持不变时,反应达到了平衡
C.当混合气体的平均摩尔质量不变时,反应达到了平衡
D.当2v正(NO)=3v逆(H2O)时,反应达到了平衡
(4)工业上常用氨水吸收SO2,可生成(NH4)2SO3,请判断常温下(NH4)2SO3溶液的酸碱性并通过计算说明判断依据:
您最近一年使用:0次
2019-02-07更新
|
472次组卷
|
3卷引用:【市级联考】山西省晋中市2019届高三上学期1月高考适应性考试理科综合化学试题
名校
解题方法
2 . 最新研究表明,有毒气体H2S具有参与调节神经信号传递、舒张血管减轻高血压的功能。
(1)下列事实中,可以用来比较H2S与H2SO3的酸性强弱的是______ (填标号)。
A.H2S的还原性强于H2SO3
B.0.10 mol·L-1的H2S和H2SO3的pH分别为4.5和2.1
C.H2S不能与NaHCO3溶液反应,而H2SO3可以
D.等浓度的两种溶液pH值: NaHS > NaHSO3
(2)下图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理。

通过计算,可知(1)式和(5)式的热化学方程式分别为___________ 、________________ ,制得等量H2所需能量系统I是系统II的_______ 倍。
(3)H2S与CO2在高温下发生反应: H2S(g)+CO2(g) COS(g) +H2O(g)△H >0;保持T1温度,将0.20mol CO2与0.80mol H2S充入2.5L的空钢瓶中,反应平衡后COS的物质的量分数为0.02
COS(g) +H2O(g)△H >0;保持T1温度,将0.20mol CO2与0.80mol H2S充入2.5L的空钢瓶中,反应平衡后COS的物质的量分数为0.02
①H2S的平衡转化率a1=_______ %,反应平衡常数K=______________ 。
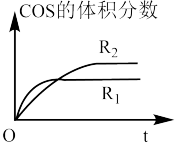
②在不同条件下发生上述反应,COS的体积分数随时间(t)的变化如图所示,根据图象可以判断曲线R1、R2对应的下列反应条件中不同的是____________ (填字母序号)CO2的转化率a2__ a1,(填”>”或“<”)
A.压强B.温度C.催化剂
(4)反应开始,保持T1温度,2L钢瓶中充入0.08molCO2、0.40molH2S、0.02molCOS和0.02molH2O,则此时V正___ V逆(填”>”或“<”)判断依据是___________________________ 。
(1)下列事实中,可以用来比较H2S与H2SO3的酸性强弱的是
A.H2S的还原性强于H2SO3
B.0.10 mol·L-1的H2S和H2SO3的pH分别为4.5和2.1
C.H2S不能与NaHCO3溶液反应,而H2SO3可以
D.等浓度的两种溶液pH值: NaHS > NaHSO3
(2)下图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理。

通过计算,可知(1)式和(5)式的热化学方程式分别为
(3)H2S与CO2在高温下发生反应: H2S(g)+CO2(g)
 COS(g) +H2O(g)△H >0;保持T1温度,将0.20mol CO2与0.80mol H2S充入2.5L的空钢瓶中,反应平衡后COS的物质的量分数为0.02
COS(g) +H2O(g)△H >0;保持T1温度,将0.20mol CO2与0.80mol H2S充入2.5L的空钢瓶中,反应平衡后COS的物质的量分数为0.02①H2S的平衡转化率a1=
②在不同条件下发生上述反应,COS的体积分数随时间(t)的变化如图所示,根据图象可以判断曲线R1、R2对应的下列反应条件中不同的是
A.压强B.温度C.催化剂

(4)反应开始,保持T1温度,2L钢瓶中充入0.08molCO2、0.40molH2S、0.02molCOS和0.02molH2O,则此时V正
您最近一年使用:0次
2017-12-31更新
|
196次组卷
|
2卷引用:山西省祁县中学2018届高三12月月考化学试题



