解题方法
1 . 二甲醚又称甲醚,是一种十分重要的化工原料,在制药、燃料、农药等化学工业中有许多独特的用途。一定条件下,利用合成气(CO、H2)合成二甲醚,其中主要包括以下三个相互联系的反应:
i.合成气合成甲醇:CO(g) +2H2 (g) CH3OH(g);
CH3OH(g);
ii.甲醇脱水生成二甲醚:2CH3OH(g) CH3OCH3(g)+ H2O(g);
CH3OCH3(g)+ H2O(g);
iii.水煤气变换反应:CO(g)+ H2O(g) CO2(g)+ H2(g)。
CO2(g)+ H2(g)。
请回答下列问题:
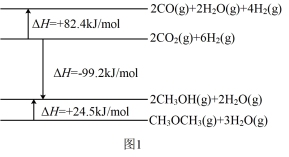
(1)已知相关物质变化的焓变如图1所示,写出CO直接加氢合成二甲醚的热化学方程式:_______ 。
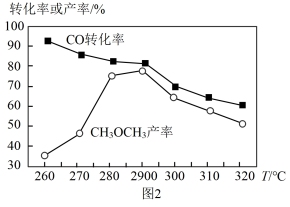
(2)有研究者在催化剂(CuO/ZnO/Al2O3)、压强为5.0 MPa的条件下,由CO和H2直接制备二甲醚,结果如图2所示,其中CO转化率随温度升高而降低的原因是_______ 。
(3)实验室模拟上述合成过程,在1 L恒容密闭容器中充入6 mol CO和6 mol H2,连续发生以上i、ii、iii反应,2 h后达到平衡,测得混合体系中各组分浓度如下表:
①平衡后,整个过程中CO的转化率为_______ ;v(CH3OCH3)=_______ mol· L-1· h-1。
②反应ii的K=_______ (保留两位小数)。
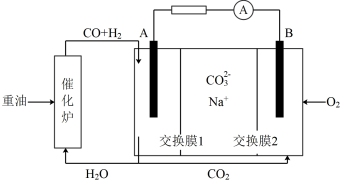
(4)合成气可做燃料电池的燃料。一种熔融盐燃料电池的工作原理如图所示,电极A上H2参与的电极反应为_______ ,假设催化炉产生的CO与H2的物质的量之比为2:1,电极A处产生的CO2有部分参与循环利用,其利用率为_______ 。
i.合成气合成甲醇:CO(g) +2H2 (g)
 CH3OH(g);
CH3OH(g);ii.甲醇脱水生成二甲醚:2CH3OH(g)
 CH3OCH3(g)+ H2O(g);
CH3OCH3(g)+ H2O(g);iii.水煤气变换反应:CO(g)+ H2O(g)
 CO2(g)+ H2(g)。
CO2(g)+ H2(g)。请回答下列问题:
(1)已知相关物质变化的焓变如图1所示,写出CO直接加氢合成二甲醚的热化学方程式:

(2)有研究者在催化剂(CuO/ZnO/Al2O3)、压强为5.0 MPa的条件下,由CO和H2直接制备二甲醚,结果如图2所示,其中CO转化率随温度升高而降低的原因是

(3)实验室模拟上述合成过程,在1 L恒容密闭容器中充入6 mol CO和6 mol H2,连续发生以上i、ii、iii反应,2 h后达到平衡,测得混合体系中各组分浓度如下表:
| 物质 | H2 | CH3OH | H2O | CO2 |
| 物质的量浓度/(mol·L-1) | l.44 | 0. 78 | 0. 12 | 0.84 |
②反应ii的K=
(4)合成气可做燃料电池的燃料。一种熔融盐燃料电池的工作原理如图所示,电极A上H2参与的电极反应为

您最近一年使用:0次
名校
2 . 清洁能源的综合利用可有效降低碳排放,是实现“碳中和、碳达峰”的重要途径。
(1)以环己烷为原料通过芳构化反应生产苯,同时可获取氢气。图甲是该反应过程中几种物质间的能量关系。
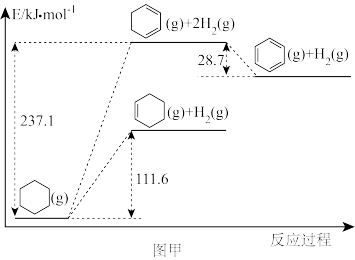
芳构化反应: (g)→
(g)→ (g)+3H2(g)
(g)+3H2(g) 
_______ kJ/mol。
(2) 和
和 合成乙醇反应为:
合成乙醇反应为: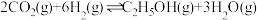 。将等物质的量的
。将等物质的量的 和
和 充入一刚性容器中,测得平衡时
充入一刚性容器中,测得平衡时 的体积分数随温度和压强的关系如图乙。
的体积分数随温度和压强的关系如图乙。
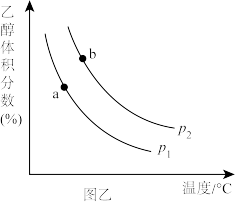
①压强P1_______ P2(填“>”“=”或“<”,下同),a、b两点的平衡常数Ka_______ Kb。
②已知Arrhenius经验公式为 (
( 为活化能,k为速率常数,R和C为常数),为探究m、n两种催化剂的催化效能,进行了实验探究,依据实验数据获得图丙曲线。
为活化能,k为速率常数,R和C为常数),为探究m、n两种催化剂的催化效能,进行了实验探究,依据实验数据获得图丙曲线。
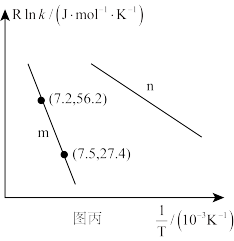
在m催化剂作用下,该反应的活化能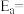
_______ J/mol。从图中信息获知催化效能较高的催化剂是_______ (填“m”或“n”),判断理由是_______ 。
(3) 和CO合成甲烷反应为:
和CO合成甲烷反应为: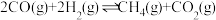 。T℃将等物质的量CO和H2充入恒压(200KPa)的密闭容器中。已知逆反应速率
。T℃将等物质的量CO和H2充入恒压(200KPa)的密闭容器中。已知逆反应速率 ,其中p为分压,该温度下
,其中p为分压,该温度下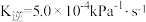 。反应达平衡时测得v正=
。反应达平衡时测得v正=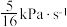 。CO的平衡转化率为
。CO的平衡转化率为_______ ,该温度下反应的Kp=_______ 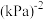 (用组分的分压计算的平衡常数)。
(用组分的分压计算的平衡常数)。
(1)以环己烷为原料通过芳构化反应生产苯,同时可获取氢气。图甲是该反应过程中几种物质间的能量关系。

芳构化反应:
 (g)→
(g)→ (g)+3H2(g)
(g)+3H2(g) 
(2)
 和
和 合成乙醇反应为:
合成乙醇反应为: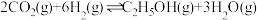 。将等物质的量的
。将等物质的量的 和
和 充入一刚性容器中,测得平衡时
充入一刚性容器中,测得平衡时 的体积分数随温度和压强的关系如图乙。
的体积分数随温度和压强的关系如图乙。
①压强P1
②已知Arrhenius经验公式为
 (
( 为活化能,k为速率常数,R和C为常数),为探究m、n两种催化剂的催化效能,进行了实验探究,依据实验数据获得图丙曲线。
为活化能,k为速率常数,R和C为常数),为探究m、n两种催化剂的催化效能,进行了实验探究,依据实验数据获得图丙曲线。
在m催化剂作用下,该反应的活化能
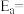
(3)
 和CO合成甲烷反应为:
和CO合成甲烷反应为: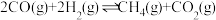 。T℃将等物质的量CO和H2充入恒压(200KPa)的密闭容器中。已知逆反应速率
。T℃将等物质的量CO和H2充入恒压(200KPa)的密闭容器中。已知逆反应速率 ,其中p为分压,该温度下
,其中p为分压,该温度下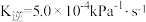 。反应达平衡时测得v正=
。反应达平衡时测得v正=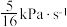 。CO的平衡转化率为
。CO的平衡转化率为 (用组分的分压计算的平衡常数)。
(用组分的分压计算的平衡常数)。
您最近一年使用:0次
2022-04-14更新
|
1510次组卷
|
10卷引用:山西省晋中市平遥县第二中学校2021-2022学年高二下学期升级化学试题
山西省晋中市平遥县第二中学校2021-2022学年高二下学期升级化学试题山东省青岛市2021-2022学年高三下学期第一次模拟考试化学试题(已下线)化学-2022年高考押题预测卷02(辽宁卷)(已下线)押江苏卷第18题 化学反应原理综合题 -备战2022年高考化学临考题号押题(江苏卷)山东省泰安市2022届高三下学期三轮验收考试化学试题(已下线)化学-2022年高考考前押题密卷(湖北卷)广东省珠海市实验中学、东莞市第六高级中学、河源高级中学、中山市实验中学2021-2022学年下学期高三第五次联考化学试题山东省滨州市2023届高三上学期期末综合测试化学试题(已下线)山东省济南市2022届高三3月高考模拟考试(一模)(原理综合题)湖南省醴陵市第一中学2023届高三下学期第七次月考化学试题
解题方法
3 . CO2的回收与利用是科学家研究的热点课题。
已知:反应ICO2(g)+3H2(g) CH3OH(g)+H2O(g)△H1=-58kJ·mol-1
CH3OH(g)+H2O(g)△H1=-58kJ·mol-1
反应ICO2(g)+H2(g) CO(g)+H2O(g)△H2=+41kJ·mol-1
CO(g)+H2O(g)△H2=+41kJ·mol-1
(1)CO(g)和H2(g)反应生成CH3OH(g)的热化学方程式为______________ 。
(2)某实验过程中,控制压强一定,将CO2和H2按一定的初始投料比、一定流速通过催化剂,经过相同时间测得如下实验数据(反应未达到平衡状态):
表中实验数据表明,升高温度,CO2实际转化率提高而甲醇的选择性降低。其原因是____________________________ 。
(3)在一定条件下,选择合适的催化剂只进行反应CO2(g)+H2(g) CO(g)+H2O(g)。调整CO2和H2初始投料比,测得在一定投料比和一定温度下,该反应CO2的平衡转化率如图(各点对应的反应温度可能相同,也可能不同)。
CO(g)+H2O(g)。调整CO2和H2初始投料比,测得在一定投料比和一定温度下,该反应CO2的平衡转化率如图(各点对应的反应温度可能相同,也可能不同)。
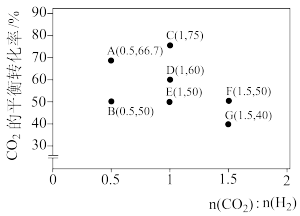
已知:Kx是以物质的量分数表示的化学平衡常数。
①经分析,A、E和G三点对应的反应温度相同,结合数据说明判断理由_______________ 。
②已知反应速率v=v正-v逆=k正x(CO2)x(H2)-k逆x(CO)x(H2O),k正、k逆分别为正、逆向反应速率常数,x为物质的量分数。C、D、E三点中k正-k逆最大的是___________ ,A、B、F三点中v逆最大的是___________ 。计算E点所示的投料比在从起始到平衡的过程中,当CO2转化率达到50%时, =
=___________ 。
(4)关于合成甲醇过程中用到的催化剂,下列说法错误的是___________ (填字母)。
A.参与了反应,改变了反应历程和△HB.使k正和k逆增大,但二者增大倍数不同
C.降低了反应的活化能D.提高了CO2的平衡转化率
已知:反应ICO2(g)+3H2(g)
 CH3OH(g)+H2O(g)△H1=-58kJ·mol-1
CH3OH(g)+H2O(g)△H1=-58kJ·mol-1反应ICO2(g)+H2(g)
 CO(g)+H2O(g)△H2=+41kJ·mol-1
CO(g)+H2O(g)△H2=+41kJ·mol-1(1)CO(g)和H2(g)反应生成CH3OH(g)的热化学方程式为
(2)某实验过程中,控制压强一定,将CO2和H2按一定的初始投料比、一定流速通过催化剂,经过相同时间测得如下实验数据(反应未达到平衡状态):
T/K | CO2实际转化率/% | 甲醇的选择性/% |
543 | 12.3 | 42.3 |
553 | 15.3 | 39.1 |
(3)在一定条件下,选择合适的催化剂只进行反应CO2(g)+H2(g)
 CO(g)+H2O(g)。调整CO2和H2初始投料比,测得在一定投料比和一定温度下,该反应CO2的平衡转化率如图(各点对应的反应温度可能相同,也可能不同)。
CO(g)+H2O(g)。调整CO2和H2初始投料比,测得在一定投料比和一定温度下,该反应CO2的平衡转化率如图(各点对应的反应温度可能相同,也可能不同)。
已知:Kx是以物质的量分数表示的化学平衡常数。
①经分析,A、E和G三点对应的反应温度相同,结合数据说明判断理由
②已知反应速率v=v正-v逆=k正x(CO2)x(H2)-k逆x(CO)x(H2O),k正、k逆分别为正、逆向反应速率常数,x为物质的量分数。C、D、E三点中k正-k逆最大的是
 =
=(4)关于合成甲醇过程中用到的催化剂,下列说法错误的是
A.参与了反应,改变了反应历程和△HB.使k正和k逆增大,但二者增大倍数不同
C.降低了反应的活化能D.提高了CO2的平衡转化率
您最近一年使用:0次
名校
解题方法
4 . (1)在一定条件下氨气和氧气能发生反应生成氮气和水蒸气:4NH3(g)+3O2(g)=2N2(g)+6H2O(g) △H
查阅资料可得有关的化学键键能数据如下:
由此计算上述反应的反应热△H=___________ kJ·mol-1。
(2)已知:N2(g)+O2(g)=2NO(g) K1
N2(g)+3H2(g)=2NH3(g) K2
2H2(g)+O2(g)=2H2O(g) K3
注:K1、K2、K3分别为上述三个反应的平衡常数
回答下列问题:
①氨催化氧化反应(生成气态水)的平衡常数K为___________ (用K1、K2、K3表示)。
②一定条件下,将4molNH3和5.2molO2混合于容积为4L的恒容密闭容器中发生催化氧化反应,经过10s后达到平衡,测得NO的浓度为0.4mol/L则0到10s内,用NH3表示该反应的平均反应速率为___________ ,O2的转化率为___________ (用百分数表示,且保留小数点后一位),该反应的平衡常数为___________ (列出计算式即可)。
③若上述反应第一次达到平衡时,保持其他条件不变的情况下,只是将容器的体积扩大一倍,假定在25s后达到新的平衡。请在下图中用曲线表示15~30s这个阶段体系中NH3的浓度随时间变化的趋势。__________
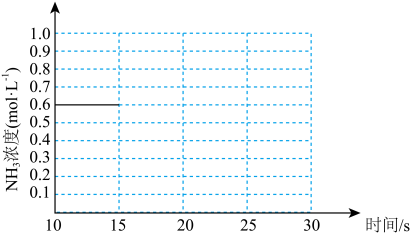
(3)下列有关该反应的说法正确的是___________ (填字母)。
A.恒温恒容,再充入4molNH3和5.2molO2,再次达到平衡时,NH3的转化率增大
B.恒温恒容,当容器内的密度保持不变时,反应达到了平衡
C.当混合气体的平均摩尔质量不变时,反应达到了平衡
D.当2v正(NO)=3v逆(H2O)时,反应达到了平衡
(4)工业上常用氨水吸收SO2,可生成(NH4)2SO3,请判断常温下(NH4)2SO3溶液的酸碱性并通过计算说明判断依据:_______________________________________________________ 。(已知:NH3·H2O的Kb=1.8×10-5;H2SO3的Ka1=1.3×10-2,Ka2=6.3×10-8)
查阅资料可得有关的化学键键能数据如下:
| 化学键 | N≡N | H-O | N-H | O=O |
| E/ (kJ·mol-1) | 946 | 463 | 391 | 496 |
由此计算上述反应的反应热△H=
(2)已知:N2(g)+O2(g)=2NO(g) K1
N2(g)+3H2(g)=2NH3(g) K2
2H2(g)+O2(g)=2H2O(g) K3
注:K1、K2、K3分别为上述三个反应的平衡常数
回答下列问题:
①氨催化氧化反应(生成气态水)的平衡常数K为
②一定条件下,将4molNH3和5.2molO2混合于容积为4L的恒容密闭容器中发生催化氧化反应,经过10s后达到平衡,测得NO的浓度为0.4mol/L则0到10s内,用NH3表示该反应的平均反应速率为
③若上述反应第一次达到平衡时,保持其他条件不变的情况下,只是将容器的体积扩大一倍,假定在25s后达到新的平衡。请在下图中用曲线表示15~30s这个阶段体系中NH3的浓度随时间变化的趋势。

(3)下列有关该反应的说法正确的是
A.恒温恒容,再充入4molNH3和5.2molO2,再次达到平衡时,NH3的转化率增大
B.恒温恒容,当容器内的密度保持不变时,反应达到了平衡
C.当混合气体的平均摩尔质量不变时,反应达到了平衡
D.当2v正(NO)=3v逆(H2O)时,反应达到了平衡
(4)工业上常用氨水吸收SO2,可生成(NH4)2SO3,请判断常温下(NH4)2SO3溶液的酸碱性并通过计算说明判断依据:
您最近一年使用:0次
2019-02-07更新
|
472次组卷
|
3卷引用:【市级联考】山西省晋中市2019届高三上学期1月高考适应性考试理科综合化学试题
5 . CH4-CO2催化重整不仅可以得到合成气(CO和H2),还对温室气体的减排具有重要意义。回答下列问题:
(1)CH4-CO2催化重整反应为:CH4(g)+CO2(g)=2CO(g)+2H2(g)。
已知:C(s)+2H2(g)=CH4(g) ΔH=-75 kJ·mol−1
C(s)+O2(g)=CO2(g) ΔH=-394 kJ·mol−1
C(s)+1/2O2(g)=CO(g) ΔH=-111 kJ·mol−1
该催化重整反应的ΔH=______ kJ·mol−1。有利于提高CH4平衡转化率的条件是____ (填标号)。
A.高温低压B.低温高压C.高温高压D.低温低压
某温度下,在体积为2 L的容器中加入2 mol CH4、1 mol CO2以及催化剂进行重整反应,达到平衡时CO2的转化率是50%,其平衡常数为_______ mol2·L−2。
(2)反应中催化剂活性会因积碳反应而降低,同时存在的消碳反应则使积碳量减少。
相关数据如下表:
①由上表判断,催化剂X____ Y(填“优于”或“劣于”),理由是_________________ 。在反应进料气组成、压强及反应时间相同的情况下,某催化剂表面的积碳量随温度的变化关系如图所示。升高温度时,下列关于积碳反应、消碳反应的平衡常数(K)和速率(v)的叙述正确的是________ 填标号)。

A.K积、K消均增加B.v积减小,v消增加
C.K积减小,K消增加D.v消增加的倍数比v积增加的倍数大
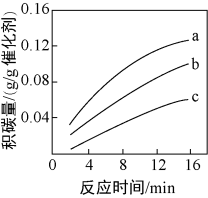
②在一定温度下,测得某催化剂上沉积碳的生成速率方程为v=k·p(CH4)·[p(CO2)]-0.5(k为速率常数)。在p(CH4)一定时,不同p(CO2)下积碳量随时间的变化趋势如图所示,则pa(CO2)、pb(CO2)、pc(CO2)从大到小的顺序为________________ 。
(1)CH4-CO2催化重整反应为:CH4(g)+CO2(g)=2CO(g)+2H2(g)。
已知:C(s)+2H2(g)=CH4(g) ΔH=-75 kJ·mol−1
C(s)+O2(g)=CO2(g) ΔH=-394 kJ·mol−1
C(s)+1/2O2(g)=CO(g) ΔH=-111 kJ·mol−1
该催化重整反应的ΔH=
A.高温低压B.低温高压C.高温高压D.低温低压
某温度下,在体积为2 L的容器中加入2 mol CH4、1 mol CO2以及催化剂进行重整反应,达到平衡时CO2的转化率是50%,其平衡常数为
(2)反应中催化剂活性会因积碳反应而降低,同时存在的消碳反应则使积碳量减少。
相关数据如下表:
| 积碳反应 CH4(g)=C(s)+2H2(g) | 消碳反应 CO2(g)+C(s)=2CO(g) | ||
| ΔH/(kJ·mol−1) | 75 | 172 | |
| 活化能/ (kJ·mol−1) | 催化剂X | 33 | 91 |
| 催化剂Y | 43 | 72 | |

A.K积、K消均增加B.v积减小,v消增加
C.K积减小,K消增加D.v消增加的倍数比v积增加的倍数大
②在一定温度下,测得某催化剂上沉积碳的生成速率方程为v=k·p(CH4)·[p(CO2)]-0.5(k为速率常数)。在p(CH4)一定时,不同p(CO2)下积碳量随时间的变化趋势如图所示,则pa(CO2)、pb(CO2)、pc(CO2)从大到小的顺序为

您最近一年使用:0次
2018-06-09更新
|
14117次组卷
|
23卷引用:【全国百强校】山西省平遥中学2018-2019学年高二上学期期中考试化学试题
【全国百强校】山西省平遥中学2018-2019学年高二上学期期中考试化学试题2018年全国普通高等学校招生统一考试化学(新课标II卷)(已下线)2018年高考题及模拟题汇编 专题14 化学反应原理综合(已下线)高考母题题源14 基本概念、基本理论综合二【全国百强校】西藏自治区拉萨中学2019届高三上学期第二次月考理科综合化学试题【校级联考】江西省上饶市“山江湖”协作体2018-2019学年高二上学期第三次月考化学试题(已下线)2019年高考总复习巅峰冲刺-专题06 化学反应速率、化学平衡问题应试策略【全国百强校】江西省南昌市第十中学2019届高三下学期期中考试(第二次模拟)理科综合化学试题辽宁省实验中学东戴河分校2019-2020学年高二10月月考化学试题四川省宜宾市叙州区第一中学2020届高三上学期开学考试理综化学试题四川省自贡市田家炳中学2020届高三上学期期中考试化学试题山东省2020届高三新高考仿真模拟化学试题(已下线)专题十一 化学反应速率和化学平衡(真题汇编)-2020年高考二轮模块化复习之《化学基本原理》名师讲案与提分特训安徽省淮南市第一中学2019-2020学年高一下学期期末考试化学试题鲁科版(2019)高二选择性必修第一册第2章 化学反应的方向、限度与速率 高考挑战区 过高考安徽省临泉第一中学2020-2021学年高二上学期第三次月考化学试题青海省湟川中学2020-2021学年高二上学期期中考试化学试题(已下线)专题14 化学反应原理综合-备战2021届高考化学二轮复习题型专练甘肃省临夏县中学2020-2021学年高二上学期期末考试化学试题贵州省遵义市务川县汇佳中学2020-2021学年高二下学期第三次月考化学试题(已下线)专题15化学反应原理综合-五年(2018~2022)高考真题汇编(全国卷)黑龙江省齐齐哈尔市恒昌中学校2021-2022学年高二上学期期中考试化学试题湖南省长沙县第九中学2021-2022学年高二上学期第二次月考化学试题



