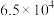1 . 氨是重要的化工原料,我国目前氨的生产能力居世界首位。随着科技的发展,氨的合成途径越来越多。回答下列问题:
(1)有一种新的以 载氮体的碳基化学链合成氨的方法,其原理为:
载氮体的碳基化学链合成氨的方法,其原理为:
①该反应分两步进行:
(Ⅰ)
(Ⅱ)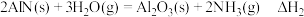
已知反应(Ⅰ):反应物总键能比生成物总键能多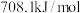 ;反应(Ⅱ):正反应活化能比逆反应活化能小
;反应(Ⅱ):正反应活化能比逆反应活化能小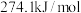 ,则
,则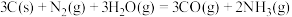 的
的
___________ 。
②反应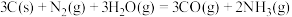 能自发进行的条件为:
能自发进行的条件为:___________ 。
A.高温 B.低温 C.任何温度
(2)传统的合成氨反应为: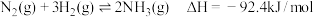 ,
,
①恒温条件下,将 和
和 按物质的量之比
按物质的量之比 投入到恒容密闭容器中发生反应:
投入到恒容密闭容器中发生反应: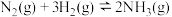 ,下列描述能说明达到化学平衡状态的有
,下列描述能说明达到化学平衡状态的有___________ (填序号)。
A. 和
和 的物质的量之比不变 B.容器的压强不再改变
的物质的量之比不变 B.容器的压强不再改变
C.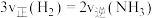 D.断裂3个
D.断裂3个 键的同时断裂6个
键的同时断裂6个 键
键
②合成氨速率方程为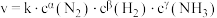 ,其中k为速率常数,根据表中数据分析:
,其中k为速率常数,根据表中数据分析:
则
___________ ,
___________ 。
③在恒温条件下,向 恒容密闭容器中充入
恒容密闭容器中充入 和
和 ,反应经过
,反应经过 后达到平衡,压强减小了
后达到平衡,压强减小了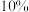 ,则从开始到平衡,
,则从开始到平衡,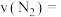
___________  后再向里面加入
后再向里面加入 和
和 各
各 ,正逆反应速率的大小关系为:
,正逆反应速率的大小关系为:
___________ (填“>”、“<”或“=”) 。
。
(1)有一种新的以
 载氮体的碳基化学链合成氨的方法,其原理为:
载氮体的碳基化学链合成氨的方法,其原理为:
①该反应分两步进行:
(Ⅰ)

(Ⅱ)
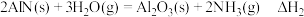
已知反应(Ⅰ):反应物总键能比生成物总键能多
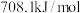 ;反应(Ⅱ):正反应活化能比逆反应活化能小
;反应(Ⅱ):正反应活化能比逆反应活化能小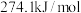 ,则
,则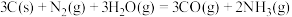 的
的
②反应
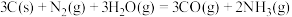 能自发进行的条件为:
能自发进行的条件为:A.高温 B.低温 C.任何温度
(2)传统的合成氨反应为:
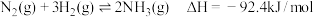 ,
,①恒温条件下,将
 和
和 按物质的量之比
按物质的量之比 投入到恒容密闭容器中发生反应:
投入到恒容密闭容器中发生反应: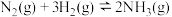 ,下列描述能说明达到化学平衡状态的有
,下列描述能说明达到化学平衡状态的有A.
 和
和 的物质的量之比不变 B.容器的压强不再改变
的物质的量之比不变 B.容器的压强不再改变C.
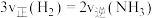 D.断裂3个
D.断裂3个 键的同时断裂6个
键的同时断裂6个 键
键②合成氨速率方程为
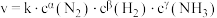 ,其中k为速率常数,根据表中数据分析:
,其中k为速率常数,根据表中数据分析:| 实验 | 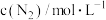 | 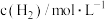 |  |
| 1 | m | n | q |
| 2 | 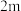 | n |  |
| 3 | m |  | 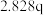 |


③在恒温条件下,向
 恒容密闭容器中充入
恒容密闭容器中充入 和
和 ,反应经过
,反应经过 后达到平衡,压强减小了
后达到平衡,压强减小了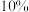 ,则从开始到平衡,
,则从开始到平衡,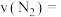
 后再向里面加入
后再向里面加入 和
和 各
各 ,正逆反应速率的大小关系为:
,正逆反应速率的大小关系为:
 。
。
您最近一年使用:0次
2 . 甲醇是一种可再生的清洁能源,二氧化碳催化加氢制甲醇,有利于实现“碳达峰”、“碳中和”。已知有关 的热化学方程式如下:
的热化学方程式如下:
Ⅰ. ,
,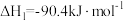 ;
;
Ⅱ. ,
, ;
;
Ⅲ. ,
,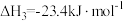 ;
;
Ⅳ. ,
,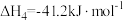 ;
;
请回答下列问题:
(1)

_______ 。
(2)在体积一定的密闭容器中按物质的量比1:2充入CO和 ,发生上述反应Ⅰ,充分反应达平衡后,如图是平衡混合物中
,发生上述反应Ⅰ,充分反应达平衡后,如图是平衡混合物中 的体积分数在不同压强下随温度变化的平衡曲线。
的体积分数在不同压强下随温度变化的平衡曲线。 ,温度为300℃时,反应Ⅰ的压强平衡常数
,温度为300℃时,反应Ⅰ的压强平衡常数
_______ 。(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
②反应Ⅰ达平衡后,下列措施能提高 产率的是
产率的是_______ (填字母)。
A.加入适量一氧化碳 B.升高温度 C.使用高效催化剂 D.增大压强
(3)一定温度下,向容积为1L的恒容密闭容器中,充入 和
和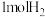 ,发生上述反应Ⅱ,测得各物质的物质的量浓度变化如图所示:
,发生上述反应Ⅱ,测得各物质的物质的量浓度变化如图所示:_______ 的浓度随时间的变化;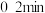 内,
内, 的平均反应速率为
的平均反应速率为_______  。
。
(4)对于反应Ⅲ,其速率方程式为 ,
, ,
, ,
, 为速率常数且只与温度有关,则该反应的平衡常数
为速率常数且只与温度有关,则该反应的平衡常数
_______ (用含 、
、 的代数式表示)。
的代数式表示)。
已知某温度下,上述反应平衡常数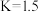 ,在密闭容器中充入一定物质的量的
,在密闭容器中充入一定物质的量的 ,反应到某时刻测得各组分的物质的量如下:
,反应到某时刻测得各组分的物质的量如下:
此时正、逆反应速率的大小:
_______  。
。
 的热化学方程式如下:
的热化学方程式如下:Ⅰ.
 ,
,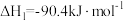 ;
;Ⅱ.
 ,
, ;
;Ⅲ.
 ,
,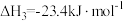 ;
;Ⅳ.
 ,
,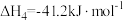 ;
;请回答下列问题:
(1)
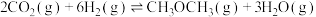

(2)在体积一定的密闭容器中按物质的量比1:2充入CO和
 ,发生上述反应Ⅰ,充分反应达平衡后,如图是平衡混合物中
,发生上述反应Ⅰ,充分反应达平衡后,如图是平衡混合物中 的体积分数在不同压强下随温度变化的平衡曲线。
的体积分数在不同压强下随温度变化的平衡曲线。
 ,温度为300℃时,反应Ⅰ的压强平衡常数
,温度为300℃时,反应Ⅰ的压强平衡常数
②反应Ⅰ达平衡后,下列措施能提高
 产率的是
产率的是A.加入适量一氧化碳 B.升高温度 C.使用高效催化剂 D.增大压强
(3)一定温度下,向容积为1L的恒容密闭容器中,充入
 和
和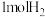 ,发生上述反应Ⅱ,测得各物质的物质的量浓度变化如图所示:
,发生上述反应Ⅱ,测得各物质的物质的量浓度变化如图所示: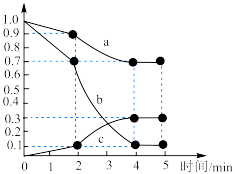
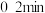 内,
内, 的平均反应速率为
的平均反应速率为 。
。(4)对于反应Ⅲ,其速率方程式为
 ,
, ,
, ,
, 为速率常数且只与温度有关,则该反应的平衡常数
为速率常数且只与温度有关,则该反应的平衡常数
 、
、 的代数式表示)。
的代数式表示)。已知某温度下,上述反应平衡常数
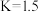 ,在密闭容器中充入一定物质的量的
,在密闭容器中充入一定物质的量的 ,反应到某时刻测得各组分的物质的量如下:
,反应到某时刻测得各组分的物质的量如下:| 物质 |  |  |  |
| 物质的量/mol | 0.2 | 0.2 | 0.2 |

 。
。
您最近一年使用:0次
3 . CO2和CH4合成CH3COOH对实现“碳中和”目标具有重要意义。回答下列问题:
(1)25℃时,CH4和CH3COOH的燃烧热分别为890.3kJ·mol-1和873.7kJ·mol-1,写出CO2和CH4合成CH3COOH(l)的热化学方程式___________ 。
(2)在硫酸酸化的ZrO2催化剂表面发生反应时,涉及多个基元反应,反应经历pathA,pathB两个路径,其能量变化如下图所示。吸附在催化剂表面的物种用*标注,TS1、TS2、TS3表示过渡态。___________ (填“放出热量”或“吸收热量”)。
②上述基元反应pathA路径中,速率最慢的一步的反应方程式为___________ 。
③pathA和pathB路径相比,___________ 更容易进行。
(3)已知 能自发进行,
能自发进行,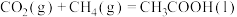
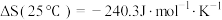 ,下列说法正确的是___________。
,下列说法正确的是___________。
(4)以CuO-ZrO2作催化剂,CO2、CH4投料比为1:1,300℃反应,平衡时CH4转化率为12%,CH3COOH选择性为95%,则CH3COOH的平衡产率为___________ 。(选择性指转化为目标产物的某反应物的质量与发生反应的该反应物的质量之比)
(5)立方ZrO2的晶胞如图,晶胞参数为apm,O2-和Zr4+间的最小距离为___________ pm,晶体密度为___________ g·cm-3。(列出计算式,阿伏加德罗常数的值用 表示)
表示)
(1)25℃时,CH4和CH3COOH的燃烧热分别为890.3kJ·mol-1和873.7kJ·mol-1,写出CO2和CH4合成CH3COOH(l)的热化学方程式
(2)在硫酸酸化的ZrO2催化剂表面发生反应时,涉及多个基元反应,反应经历pathA,pathB两个路径,其能量变化如下图所示。吸附在催化剂表面的物种用*标注,TS1、TS2、TS3表示过渡态。
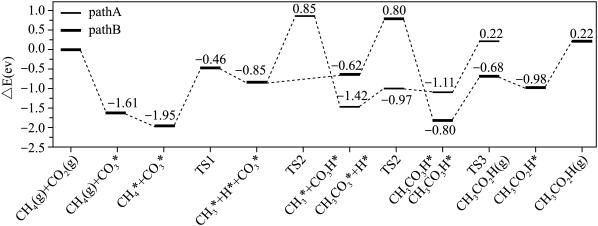
②上述基元反应pathA路径中,速率最慢的一步的反应方程式为
③pathA和pathB路径相比,
(3)已知
 能自发进行,
能自发进行,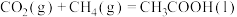
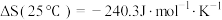 ,下列说法正确的是___________。
,下列说法正确的是___________。| A.25℃时,该反应能自发进行 |
| B.降低温度能提高CH4的平衡转化率 |
C. ,反应达平衡状态 ,反应达平衡状态 |
| D.温度越高反应速率越快 |
(4)以CuO-ZrO2作催化剂,CO2、CH4投料比为1:1,300℃反应,平衡时CH4转化率为12%,CH3COOH选择性为95%,则CH3COOH的平衡产率为
(5)立方ZrO2的晶胞如图,晶胞参数为apm,O2-和Zr4+间的最小距离为
 表示)
表示)
您最近一年使用:0次
2024-04-21更新
|
165次组卷
|
2卷引用:山西省平遥中学2023-2024学年高三二模考试化学试题
名校
解题方法
4 . 乙二醇是一种重要的化工原料,可用于生产聚酯纤维、防冻剂、增塑剂等。由合成气直接法制乙二醇的主要反应如下:
反应Ⅰ
反应Ⅱ
(1)已知298K、101kPa下, ,
, ,则
,则
_______  。
。
(2)在恒压密闭容器中充入合成气 ,仅考虑发生反应Ⅰ,维持10%转化率,所需反应条件(温度、压强)如表:
,仅考虑发生反应Ⅰ,维持10%转化率,所需反应条件(温度、压强)如表:
则
____________ (填“>”或“<”)0,随着温度升高所需压强增大的原因是_____________________ 。
(3)在2L刚性容器中充入合成气 ,总压
,总压 ,温度473K,催化剂
,温度473K,催化剂 (含
(含 )下进行反应。
)下进行反应。
①测得 和
和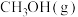 的时空收率分别为
的时空收率分别为 和
和 (时空收率是指催化剂中单位质量Rh在单位时间内所获得的产物量),则用
(时空收率是指催化剂中单位质量Rh在单位时间内所获得的产物量),则用 表示的反应速率为
表示的反应速率为_____________  。
。
②平衡时,若 和
和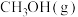 体积分数相等,
体积分数相等, 的分压为
的分压为 ,则
,则 的选择性为
的选择性为_______ ,反应Ⅰ的平衡常数
___________ (用含x的式子表示)。(已知: 的选择性
的选择性 ;分压=总压×物质的量分数。)
;分压=总压×物质的量分数。)
(4)合成气直接法制乙二醇的反应Ⅰ、反应Ⅱ的反应历程(部分)如图1,一定条件下CO分压对选择性影响如图2所示。
 图2
图2
结合图1,图2,从速率角度解释CO分压增大 选择性升高的原因
选择性升高的原因_________________ 。
反应Ⅰ

反应Ⅱ

(1)已知298K、101kPa下,
 ,
, ,则
,则
 。
。(2)在恒压密闭容器中充入合成气
 ,仅考虑发生反应Ⅰ,维持10%转化率,所需反应条件(温度、压强)如表:
,仅考虑发生反应Ⅰ,维持10%转化率,所需反应条件(温度、压强)如表:温度T/K | 298.15 | 300 | 354.7 | 400 |
压强P/kPa | 5.73 | 6.38 | 49.27 | 260.99 |
反应Ⅰ平衡常数K |
|
| 1 |
|

(3)在2L刚性容器中充入合成气
 ,总压
,总压 ,温度473K,催化剂
,温度473K,催化剂 (含
(含 )下进行反应。
)下进行反应。①测得
 和
和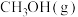 的时空收率分别为
的时空收率分别为 和
和 (时空收率是指催化剂中单位质量Rh在单位时间内所获得的产物量),则用
(时空收率是指催化剂中单位质量Rh在单位时间内所获得的产物量),则用 表示的反应速率为
表示的反应速率为 。
。②平衡时,若
 和
和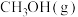 体积分数相等,
体积分数相等, 的分压为
的分压为 ,则
,则 的选择性为
的选择性为
 的选择性
的选择性 ;分压=总压×物质的量分数。)
;分压=总压×物质的量分数。)(4)合成气直接法制乙二醇的反应Ⅰ、反应Ⅱ的反应历程(部分)如图1,一定条件下CO分压对选择性影响如图2所示。

 图2
图2结合图1,图2,从速率角度解释CO分压增大
 选择性升高的原因
选择性升高的原因
您最近一年使用:0次
2023-05-05更新
|
421次组卷
|
4卷引用:2024届山西省介休市定阳高级中学高三下学期模拟考试(九)理综试题-高中化学
解题方法
5 . 尿素 是人体和动物的代谢产物之一,氨基甲酸铵(
是人体和动物的代谢产物之一,氨基甲酸铵(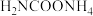 )是以氨气和二氧化碳为原料合成尿素的中间产物。
)是以氨气和二氧化碳为原料合成尿素的中间产物。
(1)合成尿素的总反应可表示为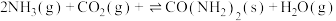 ,该反应一般认为通过如下步骤来实现:
,该反应一般认为通过如下步骤来实现:
I.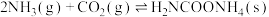
 kJ/mol
kJ/mol
II.
 kJ/mol
kJ/mol
①总反应的
______ 。
②若反应II为慢反应,下列示意图中能体现上述反应能量变化的是______ 。
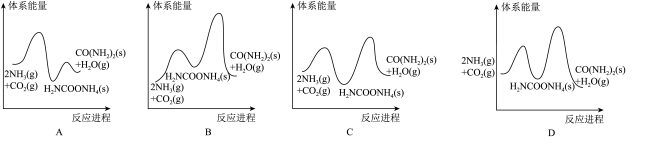
③能定性表示反应I的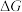 随温度变化的曲线是
随温度变化的曲线是______ (填“A”或“B”)。
④尿素中C原子的杂化方式为________________________ 。
(2)尿素废水使水体富营养化,通过电解法处理后可排放,其装置示意图如图所示。
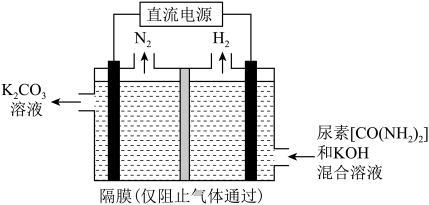
①该装置阳极的电极反应式为__________________ 。
 是人体和动物的代谢产物之一,氨基甲酸铵(
是人体和动物的代谢产物之一,氨基甲酸铵(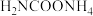 )是以氨气和二氧化碳为原料合成尿素的中间产物。
)是以氨气和二氧化碳为原料合成尿素的中间产物。(1)合成尿素的总反应可表示为
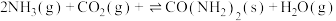 ,该反应一般认为通过如下步骤来实现:
,该反应一般认为通过如下步骤来实现:I.
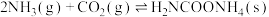
 kJ/mol
kJ/molII.

 kJ/mol
kJ/mol①总反应的

②若反应II为慢反应,下列示意图中能体现上述反应能量变化的是

③能定性表示反应I的
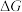 随温度变化的曲线是
随温度变化的曲线是
④尿素中C原子的杂化方式为
(2)尿素废水使水体富营养化,通过电解法处理后可排放,其装置示意图如图所示。

①该装置阳极的电极反应式为
您最近一年使用:0次
解题方法
6 . 中国“长征二号F”遥八运载火箭于北京时间11月1日清晨5时58分07秒在酒泉卫星发射中心载人航天发射场点火发射,火箭的第三级使用的推进剂是液氢和液氧。
已知下面在298K时的热化学方程式:
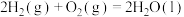
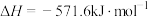
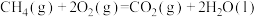

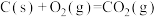
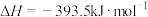
根据上面的热化学方程式完成下列问题;
(1)通过计算说明等质量的 、
、 、C完全燃烧时放出热量最多的是
、C完全燃烧时放出热量最多的是_______ ,等物质的量 、
、 、C完全燃烧时放出热量最多的是
、C完全燃烧时放出热量最多的是_______ 。
(2)根据以上反应,则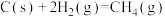 的焓变
的焓变
_______ 。
(3)已知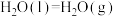
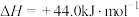 ,试写出甲烷燃烧生成二氧化碳和水蒸气的热化学方程式
,试写出甲烷燃烧生成二氧化碳和水蒸气的热化学方程式_______ 。
(4)若混合物 和
和 的总物质的量为3mol,且完全燃烧放出2066.4kJ的能量,则
的总物质的量为3mol,且完全燃烧放出2066.4kJ的能量,则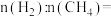
_______ 。
已知下面在298K时的热化学方程式:
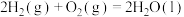
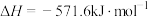
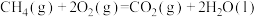

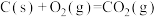
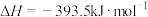
根据上面的热化学方程式完成下列问题;
(1)通过计算说明等质量的
 、
、 、C完全燃烧时放出热量最多的是
、C完全燃烧时放出热量最多的是 、
、 、C完全燃烧时放出热量最多的是
、C完全燃烧时放出热量最多的是(2)根据以上反应,则
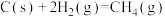 的焓变
的焓变
(3)已知
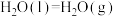
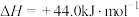 ,试写出甲烷燃烧生成二氧化碳和水蒸气的热化学方程式
,试写出甲烷燃烧生成二氧化碳和水蒸气的热化学方程式(4)若混合物
 和
和 的总物质的量为3mol,且完全燃烧放出2066.4kJ的能量,则
的总物质的量为3mol,且完全燃烧放出2066.4kJ的能量,则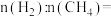
您最近一年使用:0次
解题方法
7 . 二甲醚又称甲醚,是一种十分重要的化工原料,在制药、燃料、农药等化学工业中有许多独特的用途。一定条件下,利用合成气(CO、H2)合成二甲醚,其中主要包括以下三个相互联系的反应:
i.合成气合成甲醇:CO(g) +2H2 (g) CH3OH(g);
CH3OH(g);
ii.甲醇脱水生成二甲醚:2CH3OH(g) CH3OCH3(g)+ H2O(g);
CH3OCH3(g)+ H2O(g);
iii.水煤气变换反应:CO(g)+ H2O(g) CO2(g)+ H2(g)。
CO2(g)+ H2(g)。
请回答下列问题:
(1)已知相关物质变化的焓变如图1所示,写出CO直接加氢合成二甲醚的热化学方程式:_______ 。
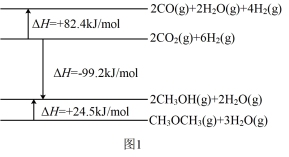
(2)有研究者在催化剂(CuO/ZnO/Al2O3)、压强为5.0 MPa的条件下,由CO和H2直接制备二甲醚,结果如图2所示,其中CO转化率随温度升高而降低的原因是_______ 。
(3)实验室模拟上述合成过程,在1 L恒容密闭容器中充入6 mol CO和6 mol H2,连续发生以上i、ii、iii反应,2 h后达到平衡,测得混合体系中各组分浓度如下表:
①平衡后,整个过程中CO的转化率为_______ ;v(CH3OCH3)=_______ mol· L-1· h-1。
②反应ii的K=_______ (保留两位小数)。
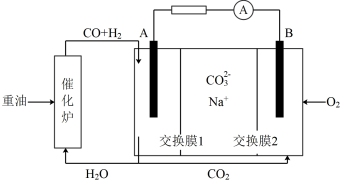
(4)合成气可做燃料电池的燃料。一种熔融盐燃料电池的工作原理如图所示,电极A上H2参与的电极反应为_______ ,假设催化炉产生的CO与H2的物质的量之比为2:1,电极A处产生的CO2有部分参与循环利用,其利用率为_______ 。
i.合成气合成甲醇:CO(g) +2H2 (g)
 CH3OH(g);
CH3OH(g);ii.甲醇脱水生成二甲醚:2CH3OH(g)
 CH3OCH3(g)+ H2O(g);
CH3OCH3(g)+ H2O(g);iii.水煤气变换反应:CO(g)+ H2O(g)
 CO2(g)+ H2(g)。
CO2(g)+ H2(g)。请回答下列问题:
(1)已知相关物质变化的焓变如图1所示,写出CO直接加氢合成二甲醚的热化学方程式:

(2)有研究者在催化剂(CuO/ZnO/Al2O3)、压强为5.0 MPa的条件下,由CO和H2直接制备二甲醚,结果如图2所示,其中CO转化率随温度升高而降低的原因是

(3)实验室模拟上述合成过程,在1 L恒容密闭容器中充入6 mol CO和6 mol H2,连续发生以上i、ii、iii反应,2 h后达到平衡,测得混合体系中各组分浓度如下表:
| 物质 | H2 | CH3OH | H2O | CO2 |
| 物质的量浓度/(mol·L-1) | l.44 | 0. 78 | 0. 12 | 0.84 |
②反应ii的K=
(4)合成气可做燃料电池的燃料。一种熔融盐燃料电池的工作原理如图所示,电极A上H2参与的电极反应为

您最近一年使用:0次
名校
解题方法
8 . 有效去除烟气中的 是环境保护的重要课题。
是环境保护的重要课题。
(1)O3能将NO和NO2转化成绿色硝化剂N2O5。已知下列热化学方程式:
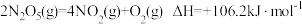
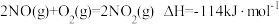

则反应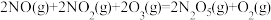 的
的
_______ 。
(2)一种通过 和
和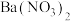 的相互转化脱除
的相互转化脱除 的原理如图1所示。脱除
的原理如图1所示。脱除 的总反应为
的总反应为_______ 。
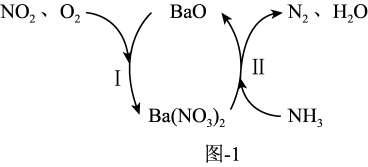
(3)NH3在催化剂作用下能与烟气(主要为空气,含少量NOx)中的NOx反应,实现NOx的脱除。常见的催化剂有V2O5等。反应的催化剂附在载体的表面,该载体为Ti的氧化物,其有两种晶体类型,分别如图2(a)、(b)所示,其中晶体a比表面积大,附着能力强,可用作载体,一定温度下可转化为晶体b。在V2O5催化下,NOx的脱除机理如图3所示。
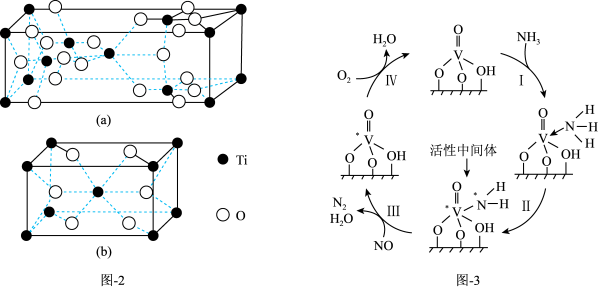
①晶体b的化学式为_______ 。
②转化IV中,V元素化合价的变化为_______ 。
③脱除NOx时须控制反应的温度,实验发现,其他条件一定,当温度过高时,NOx的脱除率会降低,原因除高温下不利于NH3的吸附、催化剂本身活性降低外,还可能的原因是_______ 和_______ 。
 是环境保护的重要课题。
是环境保护的重要课题。(1)O3能将NO和NO2转化成绿色硝化剂N2O5。已知下列热化学方程式:
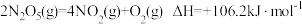
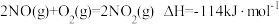

则反应
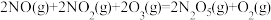 的
的
(2)一种通过
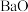 和
和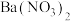 的相互转化脱除
的相互转化脱除 的原理如图1所示。脱除
的原理如图1所示。脱除 的总反应为
的总反应为
(3)NH3在催化剂作用下能与烟气(主要为空气,含少量NOx)中的NOx反应,实现NOx的脱除。常见的催化剂有V2O5等。反应的催化剂附在载体的表面,该载体为Ti的氧化物,其有两种晶体类型,分别如图2(a)、(b)所示,其中晶体a比表面积大,附着能力强,可用作载体,一定温度下可转化为晶体b。在V2O5催化下,NOx的脱除机理如图3所示。

①晶体b的化学式为
②转化IV中,V元素化合价的变化为
③脱除NOx时须控制反应的温度,实验发现,其他条件一定,当温度过高时,NOx的脱除率会降低,原因除高温下不利于NH3的吸附、催化剂本身活性降低外,还可能的原因是
您最近一年使用:0次
2022-04-21更新
|
947次组卷
|
6卷引用:山西省晋中市祁县中学2022-2023学年高三上学期10月月考化学试题
山西省晋中市祁县中学2022-2023学年高三上学期10月月考化学试题(已下线)江苏省南通市如皋市2021-2022学年高三下学期 4月适应性考试(二)化学试题(已下线)化学-2022年高考押题预测卷02(江苏卷)江苏省响水中学2021-2022学年高二下学期第二次学情分析考试化学试题(已下线)2022年江苏卷高考真题变式题14-17河南省周口恒大中学2023-2024学年高二下学期3月月考化学试题
名校
9 . 清洁能源的综合利用可有效降低碳排放,是实现“碳中和、碳达峰”的重要途径。
(1)以环己烷为原料通过芳构化反应生产苯,同时可获取氢气。图甲是该反应过程中几种物质间的能量关系。
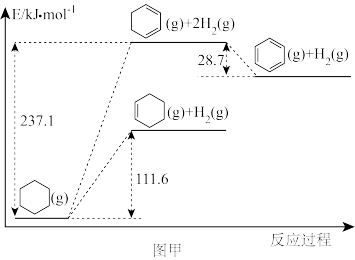
芳构化反应: (g)→
(g)→ (g)+3H2(g)
(g)+3H2(g) 
_______ kJ/mol。
(2) 和
和 合成乙醇反应为:
合成乙醇反应为: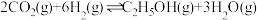 。将等物质的量的
。将等物质的量的 和
和 充入一刚性容器中,测得平衡时
充入一刚性容器中,测得平衡时 的体积分数随温度和压强的关系如图乙。
的体积分数随温度和压强的关系如图乙。
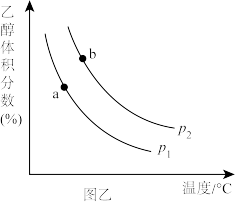
①压强P1_______ P2(填“>”“=”或“<”,下同),a、b两点的平衡常数Ka_______ Kb。
②已知Arrhenius经验公式为 (
( 为活化能,k为速率常数,R和C为常数),为探究m、n两种催化剂的催化效能,进行了实验探究,依据实验数据获得图丙曲线。
为活化能,k为速率常数,R和C为常数),为探究m、n两种催化剂的催化效能,进行了实验探究,依据实验数据获得图丙曲线。
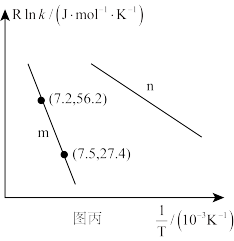
在m催化剂作用下,该反应的活化能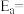
_______ J/mol。从图中信息获知催化效能较高的催化剂是_______ (填“m”或“n”),判断理由是_______ 。
(3) 和CO合成甲烷反应为:
和CO合成甲烷反应为: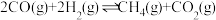 。T℃将等物质的量CO和H2充入恒压(200KPa)的密闭容器中。已知逆反应速率
。T℃将等物质的量CO和H2充入恒压(200KPa)的密闭容器中。已知逆反应速率 ,其中p为分压,该温度下
,其中p为分压,该温度下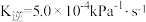 。反应达平衡时测得v正=
。反应达平衡时测得v正=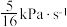 。CO的平衡转化率为
。CO的平衡转化率为_______ ,该温度下反应的Kp=_______ 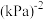 (用组分的分压计算的平衡常数)。
(用组分的分压计算的平衡常数)。
(1)以环己烷为原料通过芳构化反应生产苯,同时可获取氢气。图甲是该反应过程中几种物质间的能量关系。

芳构化反应:
 (g)→
(g)→ (g)+3H2(g)
(g)+3H2(g) 
(2)
 和
和 合成乙醇反应为:
合成乙醇反应为: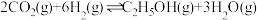 。将等物质的量的
。将等物质的量的 和
和 充入一刚性容器中,测得平衡时
充入一刚性容器中,测得平衡时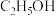 的体积分数随温度和压强的关系如图乙。
的体积分数随温度和压强的关系如图乙。
①压强P1
②已知Arrhenius经验公式为
 (
( 为活化能,k为速率常数,R和C为常数),为探究m、n两种催化剂的催化效能,进行了实验探究,依据实验数据获得图丙曲线。
为活化能,k为速率常数,R和C为常数),为探究m、n两种催化剂的催化效能,进行了实验探究,依据实验数据获得图丙曲线。
在m催化剂作用下,该反应的活化能
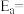
(3)
 和CO合成甲烷反应为:
和CO合成甲烷反应为: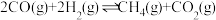 。T℃将等物质的量CO和H2充入恒压(200KPa)的密闭容器中。已知逆反应速率
。T℃将等物质的量CO和H2充入恒压(200KPa)的密闭容器中。已知逆反应速率 ,其中p为分压,该温度下
,其中p为分压,该温度下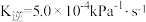 。反应达平衡时测得v正=
。反应达平衡时测得v正=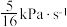 。CO的平衡转化率为
。CO的平衡转化率为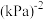 (用组分的分压计算的平衡常数)。
(用组分的分压计算的平衡常数)。
您最近一年使用:0次
2022-04-14更新
|
1510次组卷
|
10卷引用:山西省晋中市平遥县第二中学校2021-2022学年高二下学期升级化学试题
山西省晋中市平遥县第二中学校2021-2022学年高二下学期升级化学试题山东省青岛市2021-2022学年高三下学期第一次模拟考试化学试题(已下线)化学-2022年高考押题预测卷02(辽宁卷)(已下线)押江苏卷第18题 化学反应原理综合题 -备战2022年高考化学临考题号押题(江苏卷)山东省泰安市2022届高三下学期三轮验收考试化学试题(已下线)化学-2022年高考考前押题密卷(湖北卷)广东省珠海市实验中学、东莞市第六高级中学、河源高级中学、中山市实验中学2021-2022学年下学期高三第五次联考化学试题山东省滨州市2023届高三上学期期末综合测试化学试题(已下线)山东省济南市2022届高三3月高考模拟考试(一模)(原理综合题)湖南省醴陵市第一中学2023届高三下学期第七次月考化学试题
10 . 2021年11月2日,第四届世界顶尖科学家碳大会——通往“双碳目标”的科技之路论坛在上海召开。我国科学家刘科提到了绿色甲醇技术,将CO2转化为甲醇是实现碳达峰、碳中和的一种非常重要的路径。回答下列问题:
(1)已知H2(g)和CH3OH(l)的燃烧热分别为285.8kJ·mol-1、726.5kJ·mol-1,则CO2与H2反应生成液态甲醇和液态水的热化学方程式为_____ 。
(2)最近科学家采用真空封管法制备磷化硼纳米颗粒,在发展非金属催化剂实现CO2电催化还原制备甲醇方向取得重要进展,反应历程如图所示:
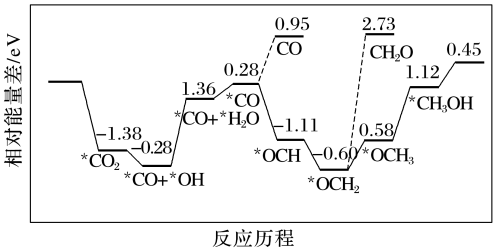
①反应容易得到的副产物有CO和CH2O,其中相对较少的副产物为_____ 。
②上述合成甲醇的反应速率较慢,要使反应速率加快,主要降低下列变化中_____ (填字母)的能量变化。
A.*CO+*OH→*CO+*H2O B.*CO+*H2O→*CO
C.*OCH2→*OCH3 D.*OCH3→*CH3OH
(3)一定条件下,在1L恒容密闭容器中充入1molCO2和3molH2发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),温度对CO2平衡转化率及催化剂的催化效率影响如图所示:
CH3OH(g)+H2O(g),温度对CO2平衡转化率及催化剂的催化效率影响如图所示:
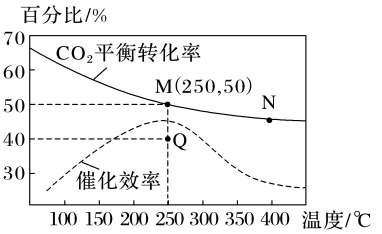
①下列说法能说明该反应达到化学平衡状态的是_____ (填字母)。
A.混合气体的密度不再变化
B.混合气体的平均相对分子质量不再变化
C.CO2、H2、CH3OH、H2O的物质的量之比为1∶3∶1∶1
D.H2O(g)和CO2(g)的生成速率之比为1∶1
②反应速率:v正(M)_____ (填“大于”“小于”“等于”或“无法判断”,下同)v逆(N),化学平衡常数:KM_____ KN。
③M点甲醇的体积分数为_____ ,该温度下,反应的平衡常数K=_____ 。
④已知:反应速率v=v正-v逆=k正c(CO2)·c3(H2)-k逆c(CH3OH)·c(H2O),k正、k逆分别为正、逆反应速率常数,则Q点时 =
=_____ (保留2位小数)。
(1)已知H2(g)和CH3OH(l)的燃烧热分别为285.8kJ·mol-1、726.5kJ·mol-1,则CO2与H2反应生成液态甲醇和液态水的热化学方程式为
(2)最近科学家采用真空封管法制备磷化硼纳米颗粒,在发展非金属催化剂实现CO2电催化还原制备甲醇方向取得重要进展,反应历程如图所示:

①反应容易得到的副产物有CO和CH2O,其中相对较少的副产物为
②上述合成甲醇的反应速率较慢,要使反应速率加快,主要降低下列变化中
A.*CO+*OH→*CO+*H2O B.*CO+*H2O→*CO
C.*OCH2→*OCH3 D.*OCH3→*CH3OH
(3)一定条件下,在1L恒容密闭容器中充入1molCO2和3molH2发生反应:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g),温度对CO2平衡转化率及催化剂的催化效率影响如图所示:
CH3OH(g)+H2O(g),温度对CO2平衡转化率及催化剂的催化效率影响如图所示:
①下列说法能说明该反应达到化学平衡状态的是
A.混合气体的密度不再变化
B.混合气体的平均相对分子质量不再变化
C.CO2、H2、CH3OH、H2O的物质的量之比为1∶3∶1∶1
D.H2O(g)和CO2(g)的生成速率之比为1∶1
②反应速率:v正(M)
③M点甲醇的体积分数为
④已知:反应速率v=v正-v逆=k正c(CO2)·c3(H2)-k逆c(CH3OH)·c(H2O),k正、k逆分别为正、逆反应速率常数,则Q点时
 =
=
您最近一年使用:0次