解题方法
1 . 利用反应A可将释放的CO2转化为具有工业利用价值的产品。
反应A:
已知:
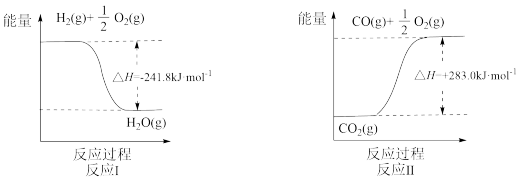
(1)反应Ⅱ是___________ 反应(填“吸热”或“放热”),其原因是___________ 。
(2)反应A的热化学方程式是___________ 。
反应A:

已知:

(1)反应Ⅱ是
(2)反应A的热化学方程式是
您最近一年使用:0次
2022-01-28更新
|
98次组卷
|
2卷引用:山西省晋中市平遥县第二中学2021-2022学年高二上学期12月考试化学试题
2 . 某反应在催化剂的作用下按以下两步进行:第一步为X+Y=Z;第二步为Y+Z=M+N+X。此反应的总的化学方程式是___ ,反应的催化剂是___ 。
您最近一年使用:0次
3 . 丙烷燃烧可以通过以下两种途径:
途径Ⅰ:C3H8(g)+5O2(g)=3CO2(g)+4H2O(l) ΔH=-a kJ/mol
途径Ⅱ:C3H8(g)=C3H6(g)+H2(g) ΔH=+b kJ/mol
2C3H6(g)+9O2(g)=6CO2(g)+6H2O(l) ΔH=-c kJ/mol
2H2(g)+O2(g)=2H2O(l) ΔH=-d kJ/mol (a、b、c、d 均为正值)
请回答下列问题:
(1)判断等量的丙烷通过两种途径放出的热量,途径Ⅰ放出的热量________ (填“大于 ”、“等于 ” 或“小于 ”)途径Ⅱ放出的热量。
(2)由于C3H8(g)=C3H6(g)+H2(g)的反应中,反应物具有的总能量_____ (填“大于”、“等 于”或“小于 ”)生成物具有的总能量,那么在化学反应时,反应物就需要_____ (填“放出 ” 或“吸收 ”)能量才能转化为生成物,因此其反应条件是____ ;
(3)b与a、c、d 的数学关系式是_____________________________________ 。
途径Ⅰ:C3H8(g)+5O2(g)=3CO2(g)+4H2O(l) ΔH=-a kJ/mol
途径Ⅱ:C3H8(g)=C3H6(g)+H2(g) ΔH=+b kJ/mol
2C3H6(g)+9O2(g)=6CO2(g)+6H2O(l) ΔH=-c kJ/mol
2H2(g)+O2(g)=2H2O(l) ΔH=-d kJ/mol (a、b、c、d 均为正值)
请回答下列问题:
(1)判断等量的丙烷通过两种途径放出的热量,途径Ⅰ放出的热量
(2)由于C3H8(g)=C3H6(g)+H2(g)的反应中,反应物具有的总能量
(3)b与a、c、d 的数学关系式是
您最近一年使用:0次
2020-04-30更新
|
145次组卷
|
13卷引用:山西省祁县第二中学2019-2020学年高二10月月考化学试题
山西省祁县第二中学2019-2020学年高二10月月考化学试题(已下线)2011-2012学年河南省焦作市修武一中分校高二上学期期中考试化学试卷(已下线)2012-2013学年吉林省松原市扶余县一中高二第一次月考化学试卷(已下线)2014—2015学年湖北武汉新洲三中高二10月月考化学(A卷)试卷2015-2016学年四川省新津中学高二10月月考化学试卷西藏日喀则市第二高级中学2017-2018学年高二上学期期中考试化学试题内蒙古巴彦淖尔市第一中学2017-2018学年高二9月月考化学试题B甘肃省临泽县第一中学2018-2019学年高二上学期期中考试化学试题山东省济宁市第二中学2019-2020学年高二上学期第一次月考化学试题陕西省宝鸡市金台区2019-2020学年高二上学期期中检测化学试题青海省西宁市海湖中学2020-2021学年高二上学期第一阶段测试化学试题福建省莆田第十五中学2018-2019学年高二上学期期中考试化学试题新疆岳普湖县2021-2022学年高二下学期第一次学情调研测试化学试题
名校
解题方法
4 . (1)在25 ℃、101 kPa的条件下,
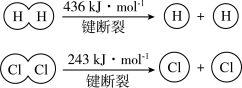
请回答下列有关问题:
①由H+H→H2,当生成1 mol H2时,要________ (填“吸收”或“放出”,下同)436 kJ的能量;由Cl2→Cl+Cl,当断裂1 mol Cl2中的共价键时,要________ 243 kJ的能量。
②对于反应H2(g)+Cl2(g)=2HCl(g),测得生成2 molHCl(g)时,反应过程中放出183 kJ的热量,则断开 1 mol H—Cl 键所需的能量是________ kJ。
③有两个反应:a.H2(g)+Cl2(g)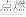 2HCl(g),b.H2(g)+Cl2(g)
2HCl(g),b.H2(g)+Cl2(g)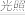 2HCl(g)。这两个反应中,相同物质的量的H2(g)、Cl2(g)反应生成相同质量的HCl(g)时,放出的能量
2HCl(g)。这两个反应中,相同物质的量的H2(g)、Cl2(g)反应生成相同质量的HCl(g)时,放出的能量________ (填“相等”或“不相等”)。
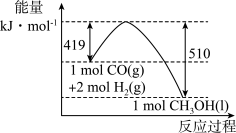
(2)根据图示的能量转化关系判断,生成16 g CH3OH(l)________ (填“吸收”或“放出”)________ kJ能量。

请回答下列有关问题:
①由H+H→H2,当生成1 mol H2时,要
②对于反应H2(g)+Cl2(g)=2HCl(g),测得生成2 molHCl(g)时,反应过程中放出183 kJ的热量,则断开 1 mol H—Cl 键所需的能量是
③有两个反应:a.H2(g)+Cl2(g)
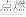 2HCl(g),b.H2(g)+Cl2(g)
2HCl(g),b.H2(g)+Cl2(g)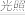 2HCl(g)。这两个反应中,相同物质的量的H2(g)、Cl2(g)反应生成相同质量的HCl(g)时,放出的能量
2HCl(g)。这两个反应中,相同物质的量的H2(g)、Cl2(g)反应生成相同质量的HCl(g)时,放出的能量
(2)根据图示的能量转化关系判断,生成16 g CH3OH(l)
您最近一年使用:0次
2020-04-15更新
|
761次组卷
|
5卷引用:山西省晋中市平遥中学2019-2020高一下学期在线学习质量检测化学试题
5 . I.可逆反应2Cl2(g)+2H2O(g) 4HCl(g)+O2(g)△H>0,在一定条件下达到平衡后,分别采取下列措施(填“增大”、“减小”或“不变”):
4HCl(g)+O2(g)△H>0,在一定条件下达到平衡后,分别采取下列措施(填“增大”、“减小”或“不变”):
(1)降低温度,Cl2的转化率________ ;v正 ________________ ;
(2)保持容器体积不变,加入He,则HCl的物质的量_______________________ .
(3)保持容器压强不变,加入He,则O2的体积分数______________________ ;
(4)若温度和体积不变,反应从Cl2和H2O开始至平衡,在这个变化过程中,容器内气体的密度____________ ,相对分子质量 ______________________ .
Ⅱ.已知CO(g)、H2(g)、CH3OH(l)的燃烧热分别为283kJ•mol-1、286kJ•mol-1、726kJ•mol-1.
利用CO、H2合成液态甲醇的热化学方程式为____________________________________
 4HCl(g)+O2(g)△H>0,在一定条件下达到平衡后,分别采取下列措施(填“增大”、“减小”或“不变”):
4HCl(g)+O2(g)△H>0,在一定条件下达到平衡后,分别采取下列措施(填“增大”、“减小”或“不变”):(1)降低温度,Cl2的转化率
(2)保持容器体积不变,加入He,则HCl的物质的量
(3)保持容器压强不变,加入He,则O2的体积分数
(4)若温度和体积不变,反应从Cl2和H2O开始至平衡,在这个变化过程中,容器内气体的密度
Ⅱ.已知CO(g)、H2(g)、CH3OH(l)的燃烧热分别为283kJ•mol-1、286kJ•mol-1、726kJ•mol-1.
利用CO、H2合成液态甲醇的热化学方程式为
您最近一年使用:0次
名校
6 . (1)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当它们混合反应时,即产生大量氮气和水蒸气,并放出大量的热。已知0.4mol液态肼与足量的液态双氧水反应,生成氮气和水蒸气,放出256.652kJ的热量。
反应的热化学方程式为___________________________________________ 。
又已知H2O(l)=H2O(g);ΔH=+44kJ/mol。则16g液态肼与液态双氧水反应生成液态水时放出热量是___________ kJ。
(2)已知: C(s)+ O2(g) = CO2(g) △H2=-393.5kJ/mol
H2(g)+1/2 O2(g) =H2O(g) △H3 = -241.8 kJ/mol
现有0.2mol的炭粉和氢气组成的悬浮气,且混合物在氧气中完全燃烧,共放出63.53kJ热量,则混合物中 C与 H2的物质的量之比为___________________ 。
(3)盖斯定律在生产和科学研究中有很重要的意义。现根据下列2个热化学方程式: Fe2O3(s)+3CO(g)=Fe(s)+3CO2(g) ΔH=-24.8kJ/mol
Fe2O3(s)+CO(g)=2FeO(s)+CO2(g) ΔH=+411.2kJ/mol
写出CO(g)还原FeO(s)得到Fe(s)和CO2(g)的热化学方程式:___________ 。
反应的热化学方程式为
又已知H2O(l)=H2O(g);ΔH=+44kJ/mol。则16g液态肼与液态双氧水反应生成液态水时放出热量是
(2)已知: C(s)+ O2(g) = CO2(g) △H2=-393.5kJ/mol
H2(g)+1/2 O2(g) =H2O(g) △H3 = -241.8 kJ/mol
现有0.2mol的炭粉和氢气组成的悬浮气,且混合物在氧气中完全燃烧,共放出63.53kJ热量,则混合物中 C与 H2的物质的量之比为
(3)盖斯定律在生产和科学研究中有很重要的意义。现根据下列2个热化学方程式: Fe2O3(s)+3CO(g)=Fe(s)+3CO2(g) ΔH=-24.8kJ/mol
Fe2O3(s)+CO(g)=2FeO(s)+CO2(g) ΔH=+411.2kJ/mol
写出CO(g)还原FeO(s)得到Fe(s)和CO2(g)的热化学方程式:
您最近一年使用:0次
2018-11-30更新
|
137次组卷
|
2卷引用:山西省晋中市平遥县第二中学2018-2019学年高二上学期期中考试化学试题
名校
7 . 羰基硫(COS)广泛存在于以煤为原料的各种化工原料气中,能引起催化剂中毒、化学产品质量下降和大气污染。
(1)羰基硫的水解反应和氢解反应是两种常用的脱硫方法:
水解反应:COS(g)+ H2O(g) H2S(g) +CO2(g) △H=-34 kJ·mol1
H2S(g) +CO2(g) △H=-34 kJ·mol1
氢解反应:COS(g) +H2(g) H2S(g)+CO(g) △H=+7 kJ·mol1。
H2S(g)+CO(g) △H=+7 kJ·mol1。
已知:2H2(g) +O2(g)=== 2H2O(g) △H=-484 kJ·mol1。
写出表示CO燃烧热的热化学方程式:______________ 。
(2)氢解反应达到平衡后,保持体系的温度和总压强不变,通入适量的He,正反应速率______ (填“增大”“减小”或“不变”,下同),COS 的转化率_______ 。
(3)某温度下,向体积为2L的恒容密闭容器中通入2molCOS(g)和4molH2O(g),发生水解反应,5 min后反应达到平衡,测得COS(g)的转化率为75%。
回答下列问题:
①反应从起始至5 min 内,v(H2S)=_______ mol·L-1·min-1。
②该温度下,上述水解反应的平衡常数K=____________ 。
(1)羰基硫的水解反应和氢解反应是两种常用的脱硫方法:
水解反应:COS(g)+ H2O(g)
 H2S(g) +CO2(g) △H=-34 kJ·mol1
H2S(g) +CO2(g) △H=-34 kJ·mol1氢解反应:COS(g) +H2(g)
 H2S(g)+CO(g) △H=+7 kJ·mol1。
H2S(g)+CO(g) △H=+7 kJ·mol1。已知:2H2(g) +O2(g)=== 2H2O(g) △H=-484 kJ·mol1。
写出表示CO燃烧热的热化学方程式:
(2)氢解反应达到平衡后,保持体系的温度和总压强不变,通入适量的He,正反应速率
(3)某温度下,向体积为2L的恒容密闭容器中通入2molCOS(g)和4molH2O(g),发生水解反应,5 min后反应达到平衡,测得COS(g)的转化率为75%。
回答下列问题:
①反应从起始至5 min 内,v(H2S)=
②该温度下,上述水解反应的平衡常数K=
您最近一年使用:0次
2017-11-19更新
|
315次组卷
|
5卷引用:山西省祁县第二中学2019-2020学年高二10月月考化学试题
8 . 为有效控制雾霾,各地积极采取措施改善大气质量,研究并有效控制空气中的氮氧化物、碳氧化物含量显得尤为重要。
(1)一定条件下,将2moLNO与2molO2置于恒容密闭容器中发生反应2NO(g)+O2(g)⇌2NO2(g),下列各项能说明反应达到平衡状态的是_____________ ;
a.体系压强保持不变
b.混合气体颜色保持不变
c.NO和O2的物质的量之比保持不变
d.每消耗1molO2同时生成2molNO2
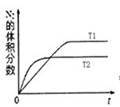
(2)汽车内燃机工作时会引起N2和O2的反应:N2+O2═2NO,是导致汽车尾气中含有NO的原因之一;在T1、T2温度下,一定量的NO发生分解反应时N2的体积分数随时间变化如图所示,根据图象判断反应N2(g)+O2(g)═2NO(g)的△H__________ 0(填>或<)。
(3)NOx是汽车尾气中的主要污染物之一。汽车发动机工作时会引起N2和O2反应,其能量变化如图所示,写出该反应的热化学方程式_____________________ ;
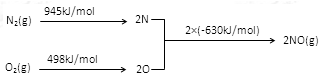
(1)一定条件下,将2moLNO与2molO2置于恒容密闭容器中发生反应2NO(g)+O2(g)⇌2NO2(g),下列各项能说明反应达到平衡状态的是
a.体系压强保持不变
b.混合气体颜色保持不变
c.NO和O2的物质的量之比保持不变
d.每消耗1molO2同时生成2molNO2
(2)汽车内燃机工作时会引起N2和O2的反应:N2+O2═2NO,是导致汽车尾气中含有NO的原因之一;在T1、T2温度下,一定量的NO发生分解反应时N2的体积分数随时间变化如图所示,根据图象判断反应N2(g)+O2(g)═2NO(g)的△H

(3)NOx是汽车尾气中的主要污染物之一。汽车发动机工作时会引起N2和O2反应,其能量变化如图所示,写出该反应的热化学方程式

您最近一年使用:0次



