解题方法
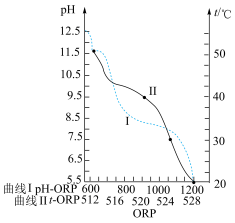
1 . 因“84消毒液”具有强氧化性,常用于环境和物体表面的杀菌、消毒。已知某“84消毒液”瓶体部分的标签如图1所示,图2是利用手持技术测定的“84消毒液”的ORP值(数值越大,氧化能力越强)随 和温度
和温度 的变化情况。请回答下列问题:
的变化情况。请回答下列问题:
(1)该“84消毒液”的物质的量浓度约为______________  (计算结果保留小数点后一位),若取出
(计算结果保留小数点后一位),若取出 该溶液稀释100倍后进行使用,则稀释后溶液中所含
该溶液稀释100倍后进行使用,则稀释后溶液中所含 的物质的量约为
的物质的量约为______________  。
。
(2)图2中“84消毒液”使用时的最佳 和温度依次是
和温度依次是______________ 。使用“84消毒液”时多数需浸泡一段时间消毒且保持较低温度的原因可能是______________ ,结合该分析,请补充“84消毒液”的标签中,[注意]③为______________ 。
(3)“84消毒液”“洁厕灵”(主要成分为盐酸)不能同时使用,请从 元素的化合价角度分析并结合离子方程式解释原因:
元素的化合价角度分析并结合离子方程式解释原因:______________ 。
(4)不能将“84消毒液”与双氧水两种消毒剂混用,否则会产生 ,写出反应的化学方程式:
,写出反应的化学方程式:______________ ,该反应说明氧化性:
______________  (填“>”或“<”)。
(填“>”或“<”)。
 和温度
和温度 的变化情况。请回答下列问题:
的变化情况。请回答下列问题:| 84消毒液 [有效成分  [规格] 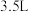 [质量分数]  [密度] 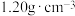 [注意]①外用消毒剂,需稀释后使用,勿口服; ②不能将本品与酸性产品(如洁厕类清洁产品)同时使用; ③______________。 |
图1

图2
(1)该“84消毒液”的物质的量浓度约为
 (计算结果保留小数点后一位),若取出
(计算结果保留小数点后一位),若取出 该溶液稀释100倍后进行使用,则稀释后溶液中所含
该溶液稀释100倍后进行使用,则稀释后溶液中所含 的物质的量约为
的物质的量约为 。
。(2)图2中“84消毒液”使用时的最佳
 和温度依次是
和温度依次是(3)“84消毒液”“洁厕灵”(主要成分为盐酸)不能同时使用,请从
 元素的化合价角度分析并结合离子方程式解释原因:
元素的化合价角度分析并结合离子方程式解释原因:(4)不能将“84消毒液”与双氧水两种消毒剂混用,否则会产生
 ,写出反应的化学方程式:
,写出反应的化学方程式:
 (填“>”或“<”)。
(填“>”或“<”)。
您最近一年使用:0次
2 . 某小组同学对比Na2CO3和NaHCO3的性质,进行了如下实验。
(1)向相同体积、相同浓度的Na2CO3和NaHCO3溶液中分别滴加0.1mol•L-1的盐酸,溶液pH变化如下。
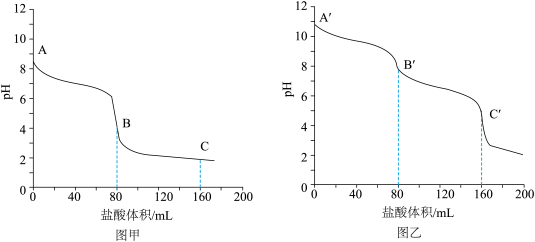
①图____ (填“甲”或“乙”)是NaHCO3的滴定曲线。
②A´—B´发生反应的离子方程式为___________ 。
③下列说法正确的是_________ (填序号)。
a.Na2CO3和NaHCO3溶液中加入饱和石灰水,均有沉淀生成
b.A和A´对应溶液中:c(Na+)+c(H+)=2c( )+c(
)+c( )+c(OH-)
)+c(OH-)
c.B和B´对应溶液中:水的电离程度前者大
d.C和C´对应溶液中:NaCl的物质的量相等
(2)向1mol•L-1的Na2CO3和NaHCO3溶液中分别滴加少量FeCl2溶液,均产生白色沉淀。
查阅资料:i.1mol•L-1的NaHCO3溶液中,c( )=1×10-2mol•L-1,c(OH-)=2×10-6mol•L-1
)=1×10-2mol•L-1,c(OH-)=2×10-6mol•L-1
ii.25℃时,Ksp(FeCO3)=3.2×10-11,Ksp[Fe(OH)2]=5.0×10-17
通过计算判断NaHCO3与FeCl2反应产生的沉淀是FeCO3,还是Fe(OH)2?_______ (要求有计算过程)。
(1)向相同体积、相同浓度的Na2CO3和NaHCO3溶液中分别滴加0.1mol•L-1的盐酸,溶液pH变化如下。

①图
②A´—B´发生反应的离子方程式为
③下列说法正确的是
a.Na2CO3和NaHCO3溶液中加入饱和石灰水,均有沉淀生成
b.A和A´对应溶液中:c(Na+)+c(H+)=2c(
 )+c(
)+c( )+c(OH-)
)+c(OH-)c.B和B´对应溶液中:水的电离程度前者大
d.C和C´对应溶液中:NaCl的物质的量相等
(2)向1mol•L-1的Na2CO3和NaHCO3溶液中分别滴加少量FeCl2溶液,均产生白色沉淀。
查阅资料:i.1mol•L-1的NaHCO3溶液中,c(
 )=1×10-2mol•L-1,c(OH-)=2×10-6mol•L-1
)=1×10-2mol•L-1,c(OH-)=2×10-6mol•L-1ii.25℃时,Ksp(FeCO3)=3.2×10-11,Ksp[Fe(OH)2]=5.0×10-17
通过计算判断NaHCO3与FeCl2反应产生的沉淀是FeCO3,还是Fe(OH)2?
您最近一年使用:0次
3 . 请回答下列问题:
(1)某浓度的氨水中存在平衡:NH3·H2O NH
NH +OH-。若增大NH
+OH-。若增大NH 的浓度而不增大OH-的浓度,应采取的措施是
的浓度而不增大OH-的浓度,应采取的措施是___________ (填字母)。
a.加入NH4Cl固体 b.适当升高温度 c.通入NH3 d.加入少量浓盐酸
(2)常温下,c(H+)相同、体积相同的醋酸和盐酸两种溶液,采取以下措施:
①加适量醋酸钠晶体后,醋酸溶液中c(H+)___________ (填“增大”、“减小”或“不变”,下同),盐酸中c(H+)___________ 。
②加水稀释10倍后,醋酸溶液中的c(H+)___________ (填“>”、“=”或“<”)盐酸中的c(H+)。
③加等浓度的NaOH溶液至恰好中和,所需NaOH溶液的体积:醋酸___________ (填“>”“=”或“<”)盐酸。
④分别与足量的锌粉发生反应,下列关于氢气体积(V)随时间(t)变化的示意图正确的是___________ (填字母)。(①表示盐酸,②表示醋酸)
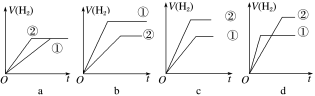
(3)将0.1mol·L-1的CH3COOH加水稀释,有关稀释后醋酸溶液的说法中,正确的是___________ (填字母)。
a.电离程度增大 b.溶液中离子浓度都增大 c.Ka(乙酸)不变 d.溶液中醋酸分子减少
(1)某浓度的氨水中存在平衡:NH3·H2O
 NH
NH +OH-。若增大NH
+OH-。若增大NH 的浓度而不增大OH-的浓度,应采取的措施是
的浓度而不增大OH-的浓度,应采取的措施是a.加入NH4Cl固体 b.适当升高温度 c.通入NH3 d.加入少量浓盐酸
(2)常温下,c(H+)相同、体积相同的醋酸和盐酸两种溶液,采取以下措施:
①加适量醋酸钠晶体后,醋酸溶液中c(H+)
②加水稀释10倍后,醋酸溶液中的c(H+)
③加等浓度的NaOH溶液至恰好中和,所需NaOH溶液的体积:醋酸
④分别与足量的锌粉发生反应,下列关于氢气体积(V)随时间(t)变化的示意图正确的是

(3)将0.1mol·L-1的CH3COOH加水稀释,有关稀释后醋酸溶液的说法中,正确的是
a.电离程度增大 b.溶液中离子浓度都增大 c.Ka(乙酸)不变 d.溶液中醋酸分子减少
您最近一年使用:0次
解题方法
4 . 高铁酸钠(Na2FeO4)是一种新型绿色消毒剂,主要用于饮用水处理,工业上有多种制备高铁酸钠的方法,其中一种方法的化学反应原理可用离子方程式表示为3ClO-+2Fe3++xOH-=2FeO +3Cl-+yH2O。
+3Cl-+yH2O。
(1)上述反应中的x =___________ ,y=___________ 。
(2)上述反应中氧化剂为___________ ;还原产物为___________ 。
(3)由上述反应可知,氧化性强弱:ClO-___________ (填“>”或“<”,下同)FeO ;还原性强弱:Cl-
;还原性强弱:Cl-___________ Fe3+。
(4)请用单线桥法表示该反应中电子的转移情况:___________ 。
(5)已知:Na2FeO4在处理饮用水的过程中铁元素会被转化为Fe3+,进而Fe3+在水中产生Fe(OH)3胶体,Fe(OH)3胶体具有吸附性。
①Na2FeO4在处理饮用水的过程中___________ (填“发生了”或“未发生”)氧化还原反应。
②Fe(OH)3胶体呈___________ 色,写出区分胶体与溶液的操作及现象:___________ 。
③已知胶体的分散质不能透过半透膜,但水分子等小分子或离子能透过半透膜。提纯明胶的方法是___________ ,装置是下列中的___________ (填序号)。
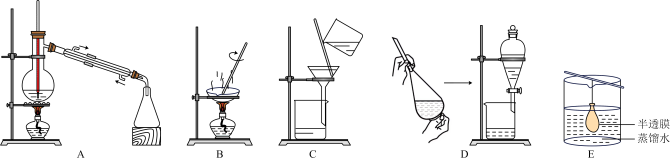
④现有10 mL明胶的水溶液与5mL Na2SO4溶液混合装入半透膜内,将此半透膜袋浸入盛蒸馏水的烧杯中,设计实验证明 能够透过半透膜
能够透过半透膜___________ 。
 +3Cl-+yH2O。
+3Cl-+yH2O。(1)上述反应中的x =
(2)上述反应中氧化剂为
(3)由上述反应可知,氧化性强弱:ClO-
 ;还原性强弱:Cl-
;还原性强弱:Cl-(4)请用单线桥法表示该反应中电子的转移情况:
(5)已知:Na2FeO4在处理饮用水的过程中铁元素会被转化为Fe3+,进而Fe3+在水中产生Fe(OH)3胶体,Fe(OH)3胶体具有吸附性。
①Na2FeO4在处理饮用水的过程中
②Fe(OH)3胶体呈
③已知胶体的分散质不能透过半透膜,但水分子等小分子或离子能透过半透膜。提纯明胶的方法是

④现有10 mL明胶的水溶液与5mL Na2SO4溶液混合装入半透膜内,将此半透膜袋浸入盛蒸馏水的烧杯中,设计实验证明
 能够透过半透膜
能够透过半透膜
您最近一年使用:0次
解题方法
5 . 在化学家的眼中,丰富多彩的化学物质可以按一定的标准进行分类。电解质和非电解质是中学化学中两个重要的概念,辨析清楚有利于我们对元素化合物知识的学习。
Ⅰ.现有下列几种物质:
①4%HCl溶液 ②CuSO4·5H2O ③纳米级氧化铁 ④苛性钾 ⑤SO2 ⑥Fe(OH)3胶体 ⑦CH3CH2OH ⑧氨水 ⑨硫酸铁溶液
(1)上述几种物质中属于电解质的有___________ (填序号)。
(2)有两种物质在水溶液中可发生反应,离子方程式为:Fe3++3OH-=Fe(OH)3↓,这两种物质的序号是___________ (填序号)。
Ⅱ.写出下列典型物质在水中的电离方程式。
(3)NaHSO4:___________ 。
(4)KAl(SO4)2:___________ 。
Ⅲ.写出下列典型反应的离子方程式:
(5)石灰石与足量盐酸溶液反应:___________ 。
(6)CuSO4溶液与Ba(OH)2溶液混合:___________ 。
(7)NaHCO3溶液与稀盐酸混合:___________ 。
(8)已知次磷酸(H3PO2)是一元中强酸,请写出其与足量氢氧化钠反应的离子方程式:___________ 。
Ⅰ.现有下列几种物质:
①4%HCl溶液 ②CuSO4·5H2O ③纳米级氧化铁 ④苛性钾 ⑤SO2 ⑥Fe(OH)3胶体 ⑦CH3CH2OH ⑧氨水 ⑨硫酸铁溶液
(1)上述几种物质中属于电解质的有
(2)有两种物质在水溶液中可发生反应,离子方程式为:Fe3++3OH-=Fe(OH)3↓,这两种物质的序号是
Ⅱ.写出下列典型物质在水中的电离方程式。
(3)NaHSO4:
(4)KAl(SO4)2:
Ⅲ.写出下列典型反应的离子方程式:
(5)石灰石与足量盐酸溶液反应:
(6)CuSO4溶液与Ba(OH)2溶液混合:
(7)NaHCO3溶液与稀盐酸混合:
(8)已知次磷酸(H3PO2)是一元中强酸,请写出其与足量氢氧化钠反应的离子方程式:
您最近一年使用:0次
解题方法
6 .  在一定条件下发生反应的能量变化如图所示,请根据所学知识回答下列问题:
在一定条件下发生反应的能量变化如图所示,请根据所学知识回答下列问题:
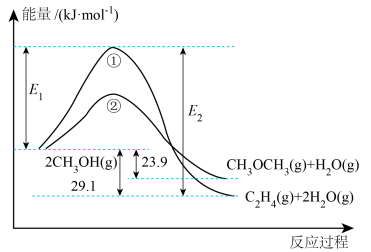
(1)写出图中所示反应①、反应②的热化学方程式:___________ 、___________ 。
(2) 为反应
为反应___________ (填“①”或“②”)___________ (填“正”或“逆”)反应的活化能。由图可知,若在一定条件下,某容器中同时发生反应①、反应②,则开始时,___________ [填“ ”或“
”或“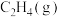 ”]的生成速率快。
”]的生成速率快。
(3) 与
与 为
为___________ (填“同素异形体”、“同分异构体”或“同系物”)。
(4)若 同时发生反应①、反应②,当
同时发生反应①、反应②,当 完全转化为
完全转化为 和
和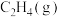 后,测得反应放出的总热量为
后,测得反应放出的总热量为 。则反应产物中
。则反应产物中 和
和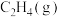 的物质的量分别为
的物质的量分别为___________ mol、___________ mol。
 在一定条件下发生反应的能量变化如图所示,请根据所学知识回答下列问题:
在一定条件下发生反应的能量变化如图所示,请根据所学知识回答下列问题:
(1)写出图中所示反应①、反应②的热化学方程式:
(2)
 为反应
为反应 ”或“
”或“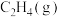 ”]的生成速率快。
”]的生成速率快。(3)
 与
与 为
为(4)若
 同时发生反应①、反应②,当
同时发生反应①、反应②,当 完全转化为
完全转化为 和
和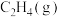 后,测得反应放出的总热量为
后,测得反应放出的总热量为 。则反应产物中
。则反应产物中 和
和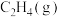 的物质的量分别为
的物质的量分别为
您最近一年使用:0次
2023-11-19更新
|
130次组卷
|
2卷引用:山西省晋中市平遥县第二中学校2023-2024学年高三上学期适应性训练四理科综合试题
名校
7 . 某无色透明溶液中可能大量存在Ag+、Ca2+、Cu2+、Fe3+、Na+中的几种。回答下列问题:
(1)不做任何实验就可以肯定原溶液中不存在的离子是___________ 。
(2)取少量原溶液,加入过量稀盐酸,有白色沉淀生成;再加入过量的稀硝酸,沉淀不消失。说明原溶液中肯定存在的离子是___________ 。
(3)取(2)中的滤液,加入过量的碳酸钠溶液,出现白色沉淀,说明原溶液中肯定有___________ ,有关的离子方程式为___________ 。
(4)原溶液可能大量共存的阴离子是___________(填字母)。
(1)不做任何实验就可以肯定原溶液中不存在的离子是
(2)取少量原溶液,加入过量稀盐酸,有白色沉淀生成;再加入过量的稀硝酸,沉淀不消失。说明原溶液中肯定存在的离子是
(3)取(2)中的滤液,加入过量的碳酸钠溶液,出现白色沉淀,说明原溶液中肯定有
(4)原溶液可能大量共存的阴离子是___________(填字母)。
| A.OH- | B.SO | C.NO | D.Cl- |
您最近一年使用:0次
2023-10-20更新
|
104次组卷
|
3卷引用:山西省晋中市介休市第十中学2023-2024学年高一上学期月考化学试题
名校
8 . 回答下列问题
(1)标准状况下,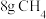 与
与___________ L的 气体含有相同的氢原子数。
气体含有相同的氢原子数。
(2)某气体氧化物的化学式为 ,在标准状况下,
,在标准状况下,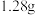 该氧化物的体积为
该氧化物的体积为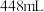 ,则该氧化物的摩尔质量为
,则该氧化物的摩尔质量为___________ 。
(3)在一定的温度和压强下,1体积气体 与3体积气体
与3体积气体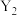 化合生成2体积气体化合物,则该化合物的化学式是
化合生成2体积气体化合物,则该化合物的化学式是___________ (用X、Y表示)。
(4)在150℃加热高氯酸铵发生分解反应;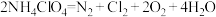 ,在150℃时其气态生成物组成的混合气的平均相对分子质量为
,在150℃时其气态生成物组成的混合气的平均相对分子质量为___________ (保留1位小数)。
(5)配制250mL0.1mol/L的 溶液,需5mol/LHAc溶液的体积为
溶液,需5mol/LHAc溶液的体积为___________ mL。
(6)下列关于 容量瓶的操作,正确的是___________。
容量瓶的操作,正确的是___________。
(7)古代青铜器的修复主旨是“修旧如旧”。
①铜锈为 ,俗称铜绿,可溶于酸。铜绿在一定程度上可以提升青铜器的艺术价值,推测参与形成铜绿的物质有Cu和
,俗称铜绿,可溶于酸。铜绿在一定程度上可以提升青铜器的艺术价值,推测参与形成铜绿的物质有Cu和___________ 。
②铜锈的成分非常复杂,主要成分有 和
和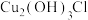 ,考古学家将铜锈分为无害锈和有害锈,结构如图所示:
,考古学家将铜锈分为无害锈和有害锈,结构如图所示:

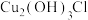 属于
属于___________ (填“无害”或“有害”)锈,请解释原因:___________ 。
(1)标准状况下,
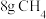 与
与 气体含有相同的氢原子数。
气体含有相同的氢原子数。(2)某气体氧化物的化学式为
 ,在标准状况下,
,在标准状况下,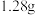 该氧化物的体积为
该氧化物的体积为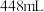 ,则该氧化物的摩尔质量为
,则该氧化物的摩尔质量为(3)在一定的温度和压强下,1体积气体
 与3体积气体
与3体积气体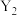 化合生成2体积气体化合物,则该化合物的化学式是
化合生成2体积气体化合物,则该化合物的化学式是(4)在150℃加热高氯酸铵发生分解反应;
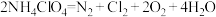 ,在150℃时其气态生成物组成的混合气的平均相对分子质量为
,在150℃时其气态生成物组成的混合气的平均相对分子质量为(5)配制250mL0.1mol/L的
 溶液,需5mol/LHAc溶液的体积为
溶液,需5mol/LHAc溶液的体积为(6)下列关于
 容量瓶的操作,正确的是___________。
容量瓶的操作,正确的是___________。A.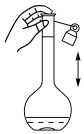 | B.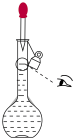 | C.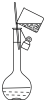 | D. |
①铜锈为
 ,俗称铜绿,可溶于酸。铜绿在一定程度上可以提升青铜器的艺术价值,推测参与形成铜绿的物质有Cu和
,俗称铜绿,可溶于酸。铜绿在一定程度上可以提升青铜器的艺术价值,推测参与形成铜绿的物质有Cu和②铜锈的成分非常复杂,主要成分有
 和
和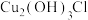 ,考古学家将铜锈分为无害锈和有害锈,结构如图所示:
,考古学家将铜锈分为无害锈和有害锈,结构如图所示:
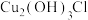 属于
属于
您最近一年使用:0次
2023-10-20更新
|
220次组卷
|
2卷引用:山西省晋中市博雅培文实验学校2023-2024学年高一上学期第三次月考(11月)化学试卷
名校
9 . 用化学知识解答问题:
(1)铜器在潮湿的空气中,表面会慢慢地生成一层铜锈(碱式碳酸铜),该反应的化学方程式为___________ 。
(2)在日常生活中常用一些铝制器皿,在清洗铝制器皿表面的污垢时,不能使用热的碱性溶液的原因时(用化学方程式解释)___________ 。
(3)发射卫星的火箭用联氨( )作燃料,以四氧化二氮作氧化剂,燃烧尾气由氮气与水蒸气组成,该反应的化学方程式为
)作燃料,以四氧化二氮作氧化剂,燃烧尾气由氮气与水蒸气组成,该反应的化学方程式为___________ 。
(4)比较甲酸、乙酸、丙酸的酸性大小,并解释原因___________
(5)Mn、Fe均为第四周期过渡金属元素,两元素的部分电离能数据如下表所示:
比较两元素的 、
、 可知,气态
可知,气态 再失去1个电子比气态
再失去1个电子比气态 再失去1个电子难,对此你的解释是
再失去1个电子难,对此你的解释是___________ 。
(1)铜器在潮湿的空气中,表面会慢慢地生成一层铜锈(碱式碳酸铜),该反应的化学方程式为
(2)在日常生活中常用一些铝制器皿,在清洗铝制器皿表面的污垢时,不能使用热的碱性溶液的原因时(用化学方程式解释)
(3)发射卫星的火箭用联氨(
 )作燃料,以四氧化二氮作氧化剂,燃烧尾气由氮气与水蒸气组成,该反应的化学方程式为
)作燃料,以四氧化二氮作氧化剂,燃烧尾气由氮气与水蒸气组成,该反应的化学方程式为(4)比较甲酸、乙酸、丙酸的酸性大小,并解释原因
(5)Mn、Fe均为第四周期过渡金属元素,两元素的部分电离能数据如下表所示:
| 元素 | Mn | Fe | |
电离能/ |  | 717 | 759 |
 | 1509 | 1561 | |
 | 3248 | 2957 | |
 、
、 可知,气态
可知,气态 再失去1个电子比气态
再失去1个电子比气态 再失去1个电子难,对此你的解释是
再失去1个电子难,对此你的解释是
您最近一年使用:0次
2023-08-19更新
|
129次组卷
|
2卷引用:山西省晋中市平遥县第二中学校2023-2024学年高三上学期适应性训练四理科综合试题
名校
10 . Ⅰ.钛及其合金具有密度小,强度高,耐腐蚀等优良性能,被广泛用于航天、航空、航海、石油化工、医药等部门,因此,钛被誉为第三金属和战略金属。从钛铁矿提取金属钛(海绵钛)的主要工艺过程如下:
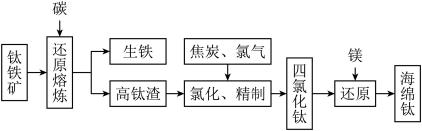
(1)钛铁矿的主要成分是 ,第一步发生的反应:
,第一步发生的反应: ,在钛酸亚铁中,钛的化合价为
,在钛酸亚铁中,钛的化合价为___________ 。
(2)第二步:二氧化钛在高温下与焦炭、氯气反应生成四氯化钛和一氧化碳,该反应的氧化产物是___________ ,氧化剂和还原剂的化学计量数之比是___________ 。
Ⅱ.高铁酸钾 是一种新型、高效、多功能绿色水处理剂,比
是一种新型、高效、多功能绿色水处理剂,比 、
、 、
、 、
、 氧化性更强,无二次污染,工业上先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入
氧化性更强,无二次污染,工业上先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入 至饱和,使高铁酸钾析出。
至饱和,使高铁酸钾析出。
(3)干法制备高铁酸钠的主要反应为: 该反应中还原剂是
该反应中还原剂是___________ (填化学式)。
(4)湿法制备高铁酸钾( )是在碱性环境中进行,反应体系中有六种反应微粒:
)是在碱性环境中进行,反应体系中有六种反应微粒: 、
、 、
、 、
、 、
、 、
、 。
。
①请依据上述信息,写出并配平湿法制高铁酸钾的离子方程式:___________ 。
②每生成 转移
转移___________  电子,若反应过程中转移了
电子,若反应过程中转移了 电子,则还原产物的物质的量为
电子,则还原产物的物质的量为___________ mol。

(1)钛铁矿的主要成分是
 ,第一步发生的反应:
,第一步发生的反应: ,在钛酸亚铁中,钛的化合价为
,在钛酸亚铁中,钛的化合价为(2)第二步:二氧化钛在高温下与焦炭、氯气反应生成四氯化钛和一氧化碳,该反应的氧化产物是
Ⅱ.高铁酸钾
 是一种新型、高效、多功能绿色水处理剂,比
是一种新型、高效、多功能绿色水处理剂,比 、
、 、
、 、
、 氧化性更强,无二次污染,工业上先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入
氧化性更强,无二次污染,工业上先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入 至饱和,使高铁酸钾析出。
至饱和,使高铁酸钾析出。(3)干法制备高铁酸钠的主要反应为:
 该反应中还原剂是
该反应中还原剂是(4)湿法制备高铁酸钾(
 )是在碱性环境中进行,反应体系中有六种反应微粒:
)是在碱性环境中进行,反应体系中有六种反应微粒: 、
、 、
、 、
、 、
、 、
、 。
。①请依据上述信息,写出并配平湿法制高铁酸钾的离子方程式:
②每生成
 转移
转移 电子,若反应过程中转移了
电子,若反应过程中转移了 电子,则还原产物的物质的量为
电子,则还原产物的物质的量为
您最近一年使用:0次
2023-07-17更新
|
339次组卷
|
3卷引用:山西省晋中市平遥县第二中学校2023-2024学年高三上学期适应性训练四理科综合试题



