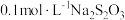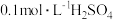1 . 在下列各组物质中,找出合适的序号填在对应的横线上。_____________ 。
(2)互为同分异构体的是____________ 。
(3)互为同系物的是________________ 。
(4)互为同素异形体的是___________ 。
(5)为同一种物质的是______________ 。
①12C和14C ② 和 CH3CH(CH3)2 ③
和 CH3CH(CH3)2 ③ 和 CH3CH2CH2CH3 ④红磷和白磷 ⑤
和 CH3CH2CH2CH3 ④红磷和白磷 ⑤  和
和 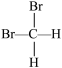 ⑥CH3CH2CH2CH3和 CH3CH(CH3)2 ⑦
⑥CH3CH2CH2CH3和 CH3CH(CH3)2 ⑦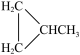 和CH2=C(CH3)2
和CH2=C(CH3)2
(2)互为同分异构体的是
(3)互为同系物的是
(4)互为同素异形体的是
(5)为同一种物质的是
您最近一年使用:0次
名校
解题方法
2 . 某化学兴趣小组设计了硫代硫酸钠溶液和硫酸反应的系列实验,实验过程记录如下表。(已知: )
)
回答下列问题:
(1)实验过程,反应速率最慢的是_______ (填实验序号);
(2)实验设计需遵循单一变量原则:
①实验A和D比较,研究的问题是_______ ;
②实验A和B比较,可探究其他条件相同时 浓度对该反应速率影响,
浓度对该反应速率影响,
_______ ;
③实验A反应到5min时,测得 溶液无剩余,则用
溶液无剩余,则用 表示实验A的速率为
表示实验A的速率为__________ ;
(3)上述实验采用比较溶液出现浑浊所用时间的方法来比较反应速率的快慢,请分析为何不采用比较单位时间内生成气体体积大小(排水法收集)的方法进行速率比较:_______ ;
(4)为节省实验药品,某同学设计了D组实验,预测溶液出现浑浊所需时间为 ,与C组实验比较,理论上
,与C组实验比较,理论上
_______  (填“>”、“<”、“=”)。
(填“>”、“<”、“=”)。
 )
)实验 序号 | 温度 /℃ |
溶液的体积/ |
溶液的体积/ | 加入水的 体积/ | 溶液出现浑浊 所用的时间/s |
A | 10 | 10 | 10 | 0 |
|
B | 10 | 6 | 10 |
|
|
C | 40 | 10 | 10 | 0 |
|
D | 40 | 5 | 5 | 0 |
|
(1)实验过程,反应速率最慢的是
(2)实验设计需遵循单一变量原则:
①实验A和D比较,研究的问题是
②实验A和B比较,可探究其他条件相同时
 浓度对该反应速率影响,
浓度对该反应速率影响,
③实验A反应到5min时,测得
 溶液无剩余,则用
溶液无剩余,则用 表示实验A的速率为
表示实验A的速率为(3)上述实验采用比较溶液出现浑浊所用时间的方法来比较反应速率的快慢,请分析为何不采用比较单位时间内生成气体体积大小(排水法收集)的方法进行速率比较:
(4)为节省实验药品,某同学设计了D组实验,预测溶液出现浑浊所需时间为
 ,与C组实验比较,理论上
,与C组实验比较,理论上
 (填“>”、“<”、“=”)。
(填“>”、“<”、“=”)。
您最近一年使用:0次
名校
解题方法
3 . 下列各组物质:
① 和
和
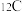 和
和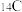
④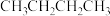 和
和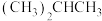
⑤癸烷和十六烷
⑥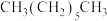 和
和
(1)互为同位素的是___________ 。
(2)互为同分异构体的是___________ 。
(3)互为同素异形体的是___________ 。
(4)互为同系物的是___________ 。
(5)同一种物质的是___________ 。
①
 和
和
②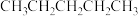 和
和
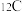 和
和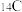
④
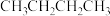 和
和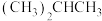
⑤癸烷和十六烷
⑥
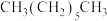 和
和
⑦ 和
和
(1)互为同位素的是
(2)互为同分异构体的是
(3)互为同素异形体的是
(4)互为同系物的是
(5)同一种物质的是
您最近一年使用:0次
名校
解题方法
4 . 科学家从延胡索中提取出一种有机物M,可用作染料的媒染剂或食品调味料。某小组展开对其分子组成的研究:
(1)经燃烧分析实验测定,M完全燃烧的产物仅有 和
和 ,分子中碳元素的质量分数为41.38%,氢元素的质量分数为3.45%,由此可知M实验式为
,分子中碳元素的质量分数为41.38%,氢元素的质量分数为3.45%,由此可知M实验式为___________ 。
(2)小组成员利用质谱法测定M的相对分子质量为116,则其分子式为___________ 。
(3)M的红外光谱图如下,若M中仅含有2种官能团,则官能团的名称是___________ 、___________ 。___________ 。___________ (填选项序号)。
a.与丙烯互为同系物
b.其存在顺反异构体
c.分子中的碳原子的杂化方式均为sp2
d.分子中所有的碳原子处于同一平面内
(1)经燃烧分析实验测定,M完全燃烧的产物仅有
 和
和 ,分子中碳元素的质量分数为41.38%,氢元素的质量分数为3.45%,由此可知M实验式为
,分子中碳元素的质量分数为41.38%,氢元素的质量分数为3.45%,由此可知M实验式为(2)小组成员利用质谱法测定M的相对分子质量为116,则其分子式为
(3)M的红外光谱图如下,若M中仅含有2种官能团,则官能团的名称是


a.与丙烯互为同系物
b.其存在顺反异构体
c.分子中的碳原子的杂化方式均为sp2
d.分子中所有的碳原子处于同一平面内
您最近一年使用:0次
名校
5 . 理论上讲,任何自发的氧化还原反应都可以设计成原电池。某同学利用“Cu+2Ag+=2Ag+Cu2+”反应设计一个化学电池,如图所示,已知该电池在外电路中,电流从a极流向b极。请回答下列问题:___________ 极,写出该电极的反应式___________ 。
(2)c溶液是___________ 。
A.CuSO4溶液 B.AgNO3溶液 C.酒精溶液
(3)若该反应过程中有0.2mol电子发生转移,则生成Ag为___________ 克。
(4)已知12g石墨转变为12g金刚石需吸收能量。常温常压下,石墨与金刚石更稳定的是___________ 。
(5)已知某反应的能量变化图如下图所示,下列化学反应过程中的能量变化能用下图表示的有___________ 。
b.Ba(OH)2·8H2O+2NH4Cl=BaCl2+10H2O+2NH3↑
c.氢气在氧气中燃烧生成水
d.高温煅烧石灰石使其分解
e.铝和盐酸反应
f.二氧化碳通过炽热的碳
(6)从断键和成键的角度分析2H2(g)+O2(g)=2H2O(g)反应中能量的变化,则生成1molH2O(g)可以放出热量___________ kJ。

(2)c溶液是
A.CuSO4溶液 B.AgNO3溶液 C.酒精溶液
(3)若该反应过程中有0.2mol电子发生转移,则生成Ag为
(4)已知12g石墨转变为12g金刚石需吸收能量。常温常压下,石墨与金刚石更稳定的是
(5)已知某反应的能量变化图如下图所示,下列化学反应过程中的能量变化能用下图表示的有

b.Ba(OH)2·8H2O+2NH4Cl=BaCl2+10H2O+2NH3↑
c.氢气在氧气中燃烧生成水
d.高温煅烧石灰石使其分解
e.铝和盐酸反应
f.二氧化碳通过炽热的碳
(6)从断键和成键的角度分析2H2(g)+O2(g)=2H2O(g)反应中能量的变化,则生成1molH2O(g)可以放出热量
| 化学键 | H-H | O=O | H-O |
| 键能(kJ·mol-1) | 436 | 496 | 463 |
您最近一年使用:0次
名校
6 . 硫及其化合物的“价-类”二维图体现了化学变化之美。___________ (用化学式表示,下同),从硫元素的化合价角度分析,图中所示物质既有氧化性又有还原性的物质有___________ 。
(2)将X与H2S混合,反应的化学方程式为___________ ,其中氧化产物与还原产物的物质的量之比为___________ 。
(3)Z的稀溶液可与Ba(OH)2溶液发生反应,其离子方程式为___________ ;
(4)Na2S2O3是重要的化工原料。从氧化还原反应的角度分析,下列制备Na2S2O3的方案理论上可行的是___________;
(5)某小组实验室用除去表面氧化物的铁钉(碳素钢)与浓硫酸共热制取SO2,有同学认为制得的SO2中可能混有杂质(不考虑水蒸气),其杂质气体的化学式为___________ 。
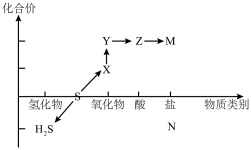
(2)将X与H2S混合,反应的化学方程式为
(3)Z的稀溶液可与Ba(OH)2溶液发生反应,其离子方程式为
(4)Na2S2O3是重要的化工原料。从氧化还原反应的角度分析,下列制备Na2S2O3的方案理论上可行的是___________;
| A.Na2S+S | B.Na2SO3+S | C.SO2+Na2SO4 | D.Na2SO3+Na2SO4 |
(5)某小组实验室用除去表面氧化物的铁钉(碳素钢)与浓硫酸共热制取SO2,有同学认为制得的SO2中可能混有杂质(不考虑水蒸气),其杂质气体的化学式为
您最近一年使用:0次
解题方法
7 . 氯及其化合物有重要用途,以下是氯元素的“价类二维图”的部分信息。请回答下列问题:
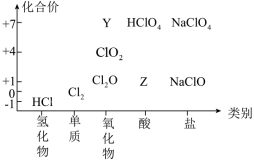
(1)根据图中信息写出Y、Z的化学式分别为:___________ 、___________ 。
(2)已知高氯酸( )是强酸,写出高氯酸与氢氧化钠溶液反应的离子方程式:
)是强酸,写出高氯酸与氢氧化钠溶液反应的离子方程式:___________ 。
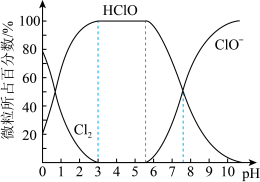
(3) 常用于饮用水消毒。
常用于饮用水消毒。 溶于水得到氯水,氯水中HClO的浓度越大杀菌能力越强。已知25℃时,氯水中
溶于水得到氯水,氯水中HClO的浓度越大杀菌能力越强。已知25℃时,氯水中 (溶于水的氯气分子)、HClO、
(溶于水的氯气分子)、HClO、 三种微粒所占百分数与pH的关系如图所示。则用
三种微粒所占百分数与pH的关系如图所示。则用 处理饮用水时,溶液的pH最佳控制范围是
处理饮用水时,溶液的pH最佳控制范围是___________ 。
(4)久置的氯水会失去漂白性,溶液由黄绿色变为无色。为探究氯水失效的原因,进行实验:用强光照射盛有氯水的密闭广口瓶,并用传感器测定广口瓶中数据,得到如下曲线。
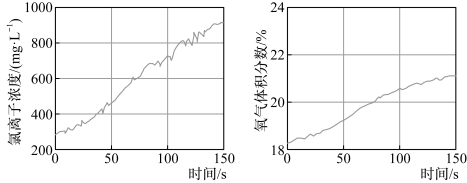
结合化学方程式解释以上两图中曲线变化的原因:___________ 。
(5)2016年巴西奥运会期间,由于工作人员误将“84”消毒液与双氧水两种消毒剂混用,导致游泳池藻类快速生长,池水变绿。其原理为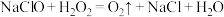 ,反应产生的
,反应产生的 促进了藻类快速生长。
促进了藻类快速生长。
①该反应中 表现
表现___________ 性(填“氧化”或“还原”)。
②当有标准状况下5.6L 生成时,消耗NaClO的质量为
生成时,消耗NaClO的质量为___________ g。

(1)根据图中信息写出Y、Z的化学式分别为:
(2)已知高氯酸(
 )是强酸,写出高氯酸与氢氧化钠溶液反应的离子方程式:
)是强酸,写出高氯酸与氢氧化钠溶液反应的离子方程式:(3)
 常用于饮用水消毒。
常用于饮用水消毒。 溶于水得到氯水,氯水中HClO的浓度越大杀菌能力越强。已知25℃时,氯水中
溶于水得到氯水,氯水中HClO的浓度越大杀菌能力越强。已知25℃时,氯水中 (溶于水的氯气分子)、HClO、
(溶于水的氯气分子)、HClO、 三种微粒所占百分数与pH的关系如图所示。则用
三种微粒所占百分数与pH的关系如图所示。则用 处理饮用水时,溶液的pH最佳控制范围是
处理饮用水时,溶液的pH最佳控制范围是
(4)久置的氯水会失去漂白性,溶液由黄绿色变为无色。为探究氯水失效的原因,进行实验:用强光照射盛有氯水的密闭广口瓶,并用传感器测定广口瓶中数据,得到如下曲线。

结合化学方程式解释以上两图中曲线变化的原因:
(5)2016年巴西奥运会期间,由于工作人员误将“84”消毒液与双氧水两种消毒剂混用,导致游泳池藻类快速生长,池水变绿。其原理为
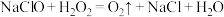 ,反应产生的
,反应产生的 促进了藻类快速生长。
促进了藻类快速生长。①该反应中
 表现
表现②当有标准状况下5.6L
 生成时,消耗NaClO的质量为
生成时,消耗NaClO的质量为
您最近一年使用:0次
解题方法
8 . 请阅读以下科普短文:
纯碱是基础化工原料。工业上获得纯碱的方法主要为:将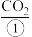 通入
通入 和
和 饱和溶液中,使溶解度小的
饱和溶液中,使溶解度小的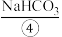 从溶液中析出,加热
从溶液中析出,加热 晶体即可获得
晶体即可获得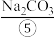 。我国化学家侯德榜于1943年提出了著名的“侯氏制碱法”,此法将
。我国化学家侯德榜于1943年提出了著名的“侯氏制碱法”,此法将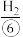 与
与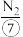 合成氨法、氨碱法工艺联合,同时得到了纯碱和
合成氨法、氨碱法工艺联合,同时得到了纯碱和 两种产品,大大缩短了生产流程,降低了成本,实现了中国人自己制碱的梦想。
两种产品,大大缩短了生产流程,降低了成本,实现了中国人自己制碱的梦想。
回答下列问题:
(1)在上述短文标有序号的物质中,空气中含量最多的是___________ (填序号,下同),属于酸性氧化物的是___________ ,属于铵盐的是__________ ,属于非电解质的是___________ 。
(2)常温下溶解度:
___________  (填“>”或“<”)。“加热
(填“>”或“<”)。“加热 晶体即可获得
晶体即可获得 ”,写出该反应的化学方程式:
”,写出该反应的化学方程式:___________ ;从基本反应角度看,该过程属于___________ 反应。
(3)“侯氏制碱法”的主要流程如图所示:
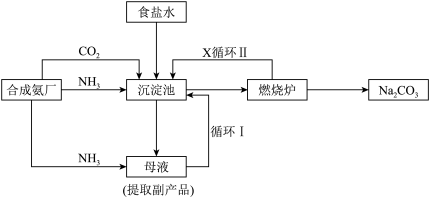
已知沉淀池中发生反应: 。
。
①“侯氏制碱法”使原料的利用率从70%提高到90%以上,主要是设计了多个循环过程,其中循环过程II中物质X的化学式为___________ 。
②验证主产品中含有 的方法:取少量主产品试样溶于水后,
的方法:取少量主产品试样溶于水后,___________ (请补充完整实验操作及现象)。
纯碱是基础化工原料。工业上获得纯碱的方法主要为:将
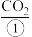 通入
通入 和
和 饱和溶液中,使溶解度小的
饱和溶液中,使溶解度小的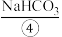 从溶液中析出,加热
从溶液中析出,加热 晶体即可获得
晶体即可获得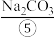 。我国化学家侯德榜于1943年提出了著名的“侯氏制碱法”,此法将
。我国化学家侯德榜于1943年提出了著名的“侯氏制碱法”,此法将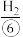 与
与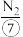 合成氨法、氨碱法工艺联合,同时得到了纯碱和
合成氨法、氨碱法工艺联合,同时得到了纯碱和 两种产品,大大缩短了生产流程,降低了成本,实现了中国人自己制碱的梦想。
两种产品,大大缩短了生产流程,降低了成本,实现了中国人自己制碱的梦想。回答下列问题:
(1)在上述短文标有序号的物质中,空气中含量最多的是
(2)常温下溶解度:

 (填“>”或“<”)。“加热
(填“>”或“<”)。“加热 晶体即可获得
晶体即可获得 ”,写出该反应的化学方程式:
”,写出该反应的化学方程式:(3)“侯氏制碱法”的主要流程如图所示:

已知沉淀池中发生反应:
 。
。①“侯氏制碱法”使原料的利用率从70%提高到90%以上,主要是设计了多个循环过程,其中循环过程II中物质X的化学式为
②验证主产品中含有
 的方法:取少量主产品试样溶于水后,
的方法:取少量主产品试样溶于水后,
您最近一年使用:0次
9 . 为了探究同周期、同主族元素性质的递变规律,某小组同学设计并实施了如下实验,并在此基础上进行推测。
(1)①同学甲取一小段镁条,用砂纸打磨后,放到试管中,再加入2 mL水,滴入2滴酚酞溶液,加热试管,可以观察到的现象是_________________________ 。对比金属钠与水的反应,该同学由此得出实验结论为金属性:Na________ (填“大于”或“小于”)Mg。
②向两支试管分别加入 溶液和
溶液和 溶液,然后滴加氨水,直到不再产生白色沉淀为止。再分别将沉淀取出,分别装在两支试管中滴加2 mol/L NaOH溶液,边滴边振荡,观察到的现象是
溶液,然后滴加氨水,直到不再产生白色沉淀为止。再分别将沉淀取出,分别装在两支试管中滴加2 mol/L NaOH溶液,边滴边振荡,观察到的现象是__________________ ,写出该现象中发生反应的离子方程式:____________________ 。
(2)①同学乙在点滴板的3个孔穴中分别滴入3滴NaBr溶液、NaI溶液和水,然后向NaBr溶液和NaI溶液各滴入3滴新制的氯水(如图所示),能说明非金属性Cl大于Br的实验现象是_________________________ 。
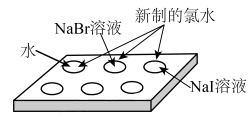
②写出少量新制氯水与NaI溶液反应的离子方程式:____________________ 。
③以上实验________ (填“能”或“不能”)证明氧化性: 。
。
(3)二硫化硒洗剂具有抗皮脂溢出作用,还具有一定的抗真菌作用。已知元素硒(Se)位于周期表第四周期,且与氧、硫位于同一主族。同学丙根据单质S在空气中燃烧生成 ,推测单质Se在空气中燃烧可生成
,推测单质Se在空气中燃烧可生成______ 。(填化学式)
(4)碳酸铯常温常压下为白色固体,极易溶于水,在空气中放置迅速吸湿,水溶液呈强碱性。已知元素铯(Cs)位于周期表中第六周期、第ⅠA族,碳酸铯的化学式是________ 。
(1)①同学甲取一小段镁条,用砂纸打磨后,放到试管中,再加入2 mL水,滴入2滴酚酞溶液,加热试管,可以观察到的现象是
②向两支试管分别加入
 溶液和
溶液和 溶液,然后滴加氨水,直到不再产生白色沉淀为止。再分别将沉淀取出,分别装在两支试管中滴加2 mol/L NaOH溶液,边滴边振荡,观察到的现象是
溶液,然后滴加氨水,直到不再产生白色沉淀为止。再分别将沉淀取出,分别装在两支试管中滴加2 mol/L NaOH溶液,边滴边振荡,观察到的现象是(2)①同学乙在点滴板的3个孔穴中分别滴入3滴NaBr溶液、NaI溶液和水,然后向NaBr溶液和NaI溶液各滴入3滴新制的氯水(如图所示),能说明非金属性Cl大于Br的实验现象是

②写出少量新制氯水与NaI溶液反应的离子方程式:
③以上实验
 。
。(3)二硫化硒洗剂具有抗皮脂溢出作用,还具有一定的抗真菌作用。已知元素硒(Se)位于周期表第四周期,且与氧、硫位于同一主族。同学丙根据单质S在空气中燃烧生成
 ,推测单质Se在空气中燃烧可生成
,推测单质Se在空气中燃烧可生成(4)碳酸铯常温常压下为白色固体,极易溶于水,在空气中放置迅速吸湿,水溶液呈强碱性。已知元素铯(Cs)位于周期表中第六周期、第ⅠA族,碳酸铯的化学式是
您最近一年使用:0次
解题方法
10 . 作为元素周期律表现形式的元素周期表,反映了元素之间的内在联系,是学习、研究和应用化学的一种重要工具。下表是元素周期表中的一部分,请参照以下六种元素(每种字母分别代表一种元素)在表中的位置,回答下列问题:
回答下列问题:
(1)M的原子结构示意图为________ 。
(2)M与Z可形成一种离子化合物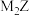 ,其电子式为
,其电子式为________ 。
(3)原子半径:X________ Z(填“大于”或“小于”,下同);简单氢化物的稳定性:Z________ N。
(4)X、Y的最高价氧化物对应水化物的酸性:________ 
________ (填化学式)。
(5)由M和Z组成的一种化合物可用作核潜艇中氧气的来源,该化合物的名称是________ ,其中含有的化学键类型是________ 、________ 。
| 族 周期 | ⅠA | 0 | ||||||
1 | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | ||
2 | X | Y | Z | |||||
3 | M | N | W |
(1)M的原子结构示意图为
(2)M与Z可形成一种离子化合物
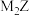 ,其电子式为
,其电子式为(3)原子半径:X
(4)X、Y的最高价氧化物对应水化物的酸性:

(5)由M和Z组成的一种化合物可用作核潜艇中氧气的来源,该化合物的名称是
您最近一年使用:0次