1 . [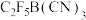 ]是可以用来合成稳定的全氟硼烷室温离子液体的阴离子(结构如图所示),具有良好的热稳定性及电化学稳定性。下列说法错误的是
]是可以用来合成稳定的全氟硼烷室温离子液体的阴离子(结构如图所示),具有良好的热稳定性及电化学稳定性。下列说法错误的是
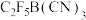 ]是可以用来合成稳定的全氟硼烷室温离子液体的阴离子(结构如图所示),具有良好的热稳定性及电化学稳定性。下列说法错误的是
]是可以用来合成稳定的全氟硼烷室温离子液体的阴离子(结构如图所示),具有良好的热稳定性及电化学稳定性。下列说法错误的是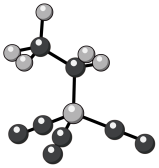
A.酸性: | B.该阴离子中C原子有两种杂化轨道类型 |
| C.基态原子的未成对电子数:N>C>B>F | D.该阴离子中所有原子均满足8电子稳定结构 |
您最近一年使用:0次
2 . 一种从分银渣(含CuO、 、
、 、
、 、
、 、Ag、
、Ag、 等)回收金属资源的工艺流程如下:
等)回收金属资源的工艺流程如下:
Ⅰ.CuCl难溶于水,但溶于浓盐酸。
Ⅱ.“富锑铋铜液”中含 (铋离子)、
(铋离子)、 (锑离子)、
(锑离子)、 、
、 。
。
Ⅲ.该工艺条件下,有关金属离子沉淀时的相关pH见下表:
回答下列问题:
(1)写出分银渣中的Ag与盐酸、溶解氧反应的离子方程式:___________________ 。
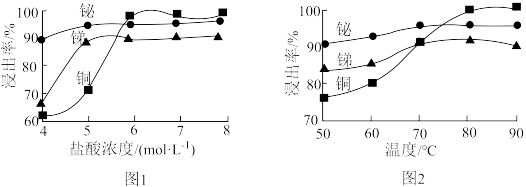
(2)“酸浸”时,盐酸浓度对锑、铋、铜浸出率的影响如图1所示,温度对锑、铋、铜浸出率的影响如图2所示。______ ;浸出时温度以80℃为宜,其原因是_____________________ 。
(3)①已知“滤渣2”的主要成分是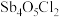 ,则“一次水解”时主要发生反应的化学方程式为
,则“一次水解”时主要发生反应的化学方程式为________ 。
②已知“滤渣3”的主要成分是BiOCl和 ,则“二次水解”时调节pH的范围应该是
,则“二次水解”时调节pH的范围应该是______ 。
(4)“滤渣1”中的AgCl可用硫酸-硫脲(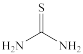 )浸出,生成配合物
)浸出,生成配合物 ,写出该反应的化学方程式:
,写出该反应的化学方程式:________________ ;该配合物中不存在__________ (填标号)。
A.离子键 B.极性共价键 C.配位键 D.范德华力 E.非极性共价键
(5)写出一种从“富铜溶液”中回收金属资源的方法:_________________ 。
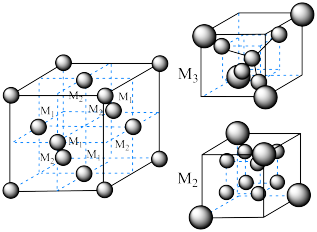
(6)尖晶石属于立方晶系,其晶胞可视为 、
、 两种结构交替无隙并置而成(如图所示),其中
两种结构交替无隙并置而成(如图所示),其中 可以为
可以为 、
、 、
、 、
、 等,
等, 可以为
可以为 、
、 、
、 等。已知尖晶石型
等。已知尖晶石型 的晶胞参数为842pm,则该晶体的密度为
的晶胞参数为842pm,则该晶体的密度为________  。(列出计算式,阿伏加德罗常数的值为
。(列出计算式,阿伏加德罗常数的值为 )
)
 、
、 、
、 、
、 、Ag、
、Ag、 等)回收金属资源的工艺流程如下:
等)回收金属资源的工艺流程如下: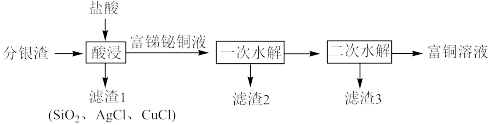
Ⅰ.CuCl难溶于水,但溶于浓盐酸。
Ⅱ.“富锑铋铜液”中含
 (铋离子)、
(铋离子)、 (锑离子)、
(锑离子)、 、
、 。
。Ⅲ.该工艺条件下,有关金属离子沉淀时的相关pH见下表:
金属离子 |
|
|
|
|
开始沉淀时( | 0.5 | 1.5 | 4.7 | 1.5 |
完全沉淀时( | 1.4 | 2.5 | 6.7 | 3.2 |
(1)写出分银渣中的Ag与盐酸、溶解氧反应的离子方程式:
(2)“酸浸”时,盐酸浓度对锑、铋、铜浸出率的影响如图1所示,温度对锑、铋、铜浸出率的影响如图2所示。
(3)①已知“滤渣2”的主要成分是
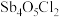 ,则“一次水解”时主要发生反应的化学方程式为
,则“一次水解”时主要发生反应的化学方程式为②已知“滤渣3”的主要成分是BiOCl和
 ,则“二次水解”时调节pH的范围应该是
,则“二次水解”时调节pH的范围应该是(4)“滤渣1”中的AgCl可用硫酸-硫脲(
 )浸出,生成配合物
)浸出,生成配合物 ,写出该反应的化学方程式:
,写出该反应的化学方程式:A.离子键 B.极性共价键 C.配位键 D.范德华力 E.非极性共价键
(5)写出一种从“富铜溶液”中回收金属资源的方法:
(6)尖晶石属于立方晶系,其晶胞可视为
 、
、 两种结构交替无隙并置而成(如图所示),其中
两种结构交替无隙并置而成(如图所示),其中 可以为
可以为 、
、 、
、 、
、 等,
等, 可以为
可以为 、
、 、
、 等。已知尖晶石型
等。已知尖晶石型 的晶胞参数为842pm,则该晶体的密度为
的晶胞参数为842pm,则该晶体的密度为 。(列出计算式,阿伏加德罗常数的值为
。(列出计算式,阿伏加德罗常数的值为 )
)
您最近一年使用:0次
解题方法
3 . 镍铁氰化物作为一种典型的普鲁士蓝衍生物材料,可选作水系PBA- 充电电池的正极材料,工作原理如图所示。已知放电时的总反应:
充电电池的正极材料,工作原理如图所示。已知放电时的总反应:
 (0<x≤1,Ⅱ、Ⅲ代表Fe的价态)。下列说法错误的是
(0<x≤1,Ⅱ、Ⅲ代表Fe的价态)。下列说法错误的是
 充电电池的正极材料,工作原理如图所示。已知放电时的总反应:
充电电池的正极材料,工作原理如图所示。已知放电时的总反应:
 (0<x≤1,Ⅱ、Ⅲ代表Fe的价态)。下列说法错误的是
(0<x≤1,Ⅱ、Ⅲ代表Fe的价态)。下列说法错误的是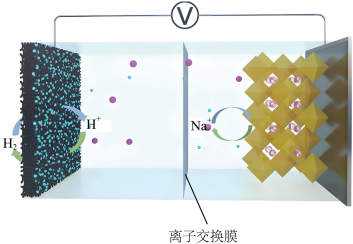
A.充电时,阳极反应: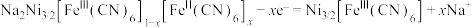 |
B.充电时,正极端存储的 脱出 脱出 |
| C.放电时,负极区溶液的pH变小 |
D.向少量 稀溶液中滴加2滴KSCN溶液,溶液变红 稀溶液中滴加2滴KSCN溶液,溶液变红 |
您最近一年使用:0次
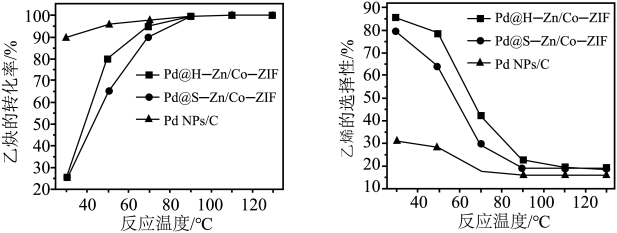
4 . 石油裂解产生的乙烯含有0.5%~3%乙炔,乙炔在Ziegler-Natta催化剂中会使乙烯聚合失活。乙炔选择性加氢已经被证明是提纯乙烯最有效的技术之一。回答下列问题:
(1)已知25℃、101kPa下,相关物质的燃烧热数据如下表:
乙炔半氢化反应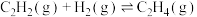 的
的 =
=_____________ 。
(2)在其他条件相同时,在不同的Pd基催化剂作用下,乙炔的转化率及乙烯的选择性随反应温度的变化如图a、b所示。已知:乙烯的选择性=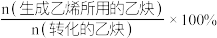 。
。______________ 。
②为保证该转化过程,需要过量的氢气,缺点是________________ 。
③某温度下,在刚性容器中发生乙炔半氢化反应,已知 与
与 的初始投料比[
的初始投料比[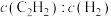 ]为1∶10,
]为1∶10, 的平衡转化率为90%(忽略其他副反应的发生)。若初始的总压强为
的平衡转化率为90%(忽略其他副反应的发生)。若初始的总压强为 ;则平衡时体系的压强=
;则平衡时体系的压强=___________ (用 列出计算式即可,下同);该反应的平衡常数
列出计算式即可,下同);该反应的平衡常数
___________ 。(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
④制备基于MOFs(金属有机框架)薄膜材料为 /
/ 混合气体分离提供了一种经济高效的技术。该材料孔径大小和形状恰好将
混合气体分离提供了一种经济高效的技术。该材料孔径大小和形状恰好将 “固定”,能高效选择性吸附
“固定”,能高效选择性吸附 ,原理示意如图。
,原理示意如图。 最接近的是
最接近的是__________ 。(填标号)
A.利用 萃取碘水
萃取碘水
B.利用“杯酚”分离 和
和
C.利用饱和碳酸钠溶液除去乙酸乙酯中的少量乙酸
(3)在工业领域也可用N,N-二甲基甲酰胺(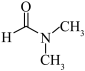 )粗乙烯中回收乙炔。N,N-二甲基甲酰胺是极性亲水性溶剂,其可与水任意比互溶的原因是
)粗乙烯中回收乙炔。N,N-二甲基甲酰胺是极性亲水性溶剂,其可与水任意比互溶的原因是__________________________ 。
(1)已知25℃、101kPa下,相关物质的燃烧热数据如下表:
物质 |
|
|
|
燃烧热(△H)/ | -1299.6 | -285.8 | -1411.0 |
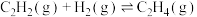 的
的 =
=(2)在其他条件相同时,在不同的Pd基催化剂作用下,乙炔的转化率及乙烯的选择性随反应温度的变化如图a、b所示。已知:乙烯的选择性=
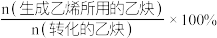 。
。
图a 图b
①若在实际生产中,选择Pd@H-Zn/Co-ZIF催化剂、50~60℃的反应条件,其依据是:②为保证该转化过程,需要过量的氢气,缺点是
③某温度下,在刚性容器中发生乙炔半氢化反应,已知
 与
与 的初始投料比[
的初始投料比[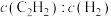 ]为1∶10,
]为1∶10, 的平衡转化率为90%(忽略其他副反应的发生)。若初始的总压强为
的平衡转化率为90%(忽略其他副反应的发生)。若初始的总压强为 ;则平衡时体系的压强=
;则平衡时体系的压强= 列出计算式即可,下同);该反应的平衡常数
列出计算式即可,下同);该反应的平衡常数
④制备基于MOFs(金属有机框架)薄膜材料为
 /
/ 混合气体分离提供了一种经济高效的技术。该材料孔径大小和形状恰好将
混合气体分离提供了一种经济高效的技术。该材料孔径大小和形状恰好将 “固定”,能高效选择性吸附
“固定”,能高效选择性吸附 ,原理示意如图。
,原理示意如图。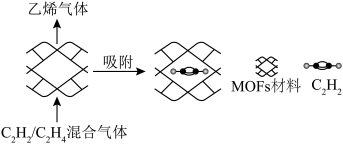
 最接近的是
最接近的是A.利用
 萃取碘水
萃取碘水B.利用“杯酚”分离
 和
和
C.利用饱和碳酸钠溶液除去乙酸乙酯中的少量乙酸
(3)在工业领域也可用N,N-二甲基甲酰胺(
 )粗乙烯中回收乙炔。N,N-二甲基甲酰胺是极性亲水性溶剂,其可与水任意比互溶的原因是
)粗乙烯中回收乙炔。N,N-二甲基甲酰胺是极性亲水性溶剂,其可与水任意比互溶的原因是
您最近一年使用:0次
名校
解题方法
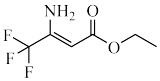
5 . BAY-069是目前体外活性最强的支链氨基酸转氨酶抑制剂,对治疗肺癌有关键作用,下面是合成它的路线。
(1)A→B的化学方程式为_______ 。
(2)B中官能团名称是_______ 、_______ 。
(3)NBS中氮原子的杂化轨道类型为_______ 。
(4)D的名称是_______ 。
(5)G的结构简式为_______ 。
(6)F→G、G→H的反应类型分别为_______ 、_______ 。
(7)B的含有萘环结构,官能团也相同的同分异构体有_______ 种。
(8) 中有
中有_______ 种核磁共振氢谱峰,该物质存在顺反异构体,写出其异构体的结构简式_______ 。
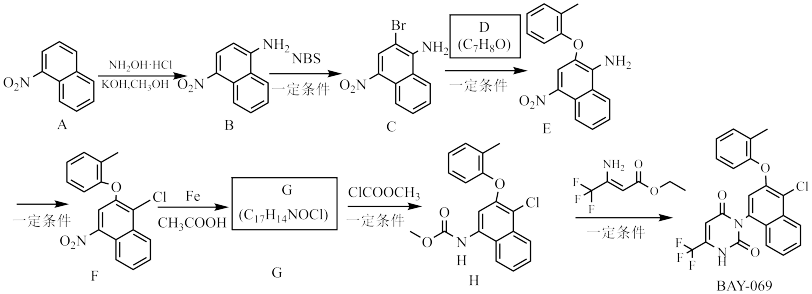
已知:NBS为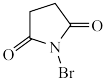 。
。
(1)A→B的化学方程式为
(2)B中官能团名称是
(3)NBS中氮原子的杂化轨道类型为
(4)D的名称是
(5)G的结构简式为
(6)F→G、G→H的反应类型分别为
(7)B的含有萘环结构,官能团也相同的同分异构体有
(8)
 中有
中有
您最近一年使用:0次
名校
6 . 以湿法炼锌厂所产的钴锰渣(主要成分为 、
、 、
、 、
、 ,含少量
,含少量 、
、 、
、 、
、 等)为原料回收制备
等)为原料回收制备 的工艺如下:
的工艺如下: ,
, ,
,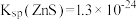 。
。
回答下列问题:
(1)“酸浸”时可能产生有毒气体_______ ,说出该气体的一种用途_______ 。
(2)“氧化调pH”过程中得到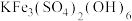 沉淀的离子方程式为
沉淀的离子方程式为_______ 。
(3)若 溶液的
溶液的 ,试分析
,试分析 主要以
主要以______ [填“ ”或“
”或“ ”]形式除去,通过计算说明你的理由
”]形式除去,通过计算说明你的理由______ 。
(4)“滤渣3”中含有S、 ,写出得到
,写出得到 的化学方程式
的化学方程式______ 。
(5)P5O4、P5O7对金属离子的萃取率与pH的关系如图所示。______ 。
②“萃余液2”中的主要成分为______ (填化学式),指出分离钴镍的合适pH范围为______ (填标号)。
A.3~4 B.4~5 C.5~6 D.6~7
 、
、 、
、 、
、 ,含少量
,含少量 、
、 、
、 、
、 等)为原料回收制备
等)为原料回收制备 的工艺如下:
的工艺如下: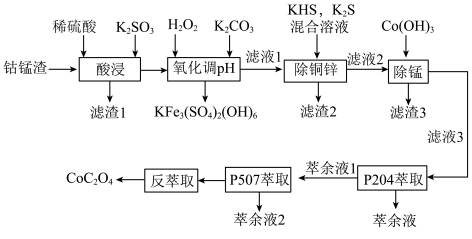
 ,
,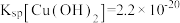 ,
,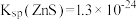 。
。回答下列问题:
(1)“酸浸”时可能产生有毒气体
(2)“氧化调pH”过程中得到
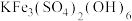 沉淀的离子方程式为
沉淀的离子方程式为(3)若
 溶液的
溶液的 ,试分析
,试分析 主要以
主要以 ”或“
”或“ ”]形式除去,通过计算说明你的理由
”]形式除去,通过计算说明你的理由(4)“滤渣3”中含有S、
 ,写出得到
,写出得到 的化学方程式
的化学方程式(5)P5O4、P5O7对金属离子的萃取率与pH的关系如图所示。
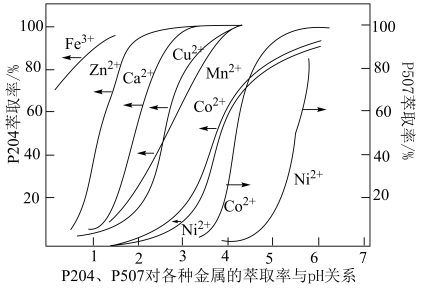
②“萃余液2”中的主要成分为
A.3~4 B.4~5 C.5~6 D.6~7
您最近一年使用:0次
名校
7 . 氧钒(Ⅳ)碱式碳酸铵是制备热敏材料VO2的原料,其化学式为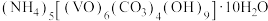 ,制备的实验流程如下:
,制备的实验流程如下:
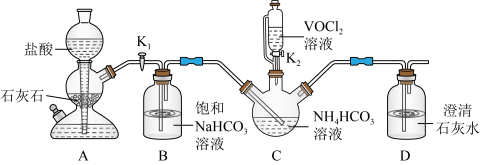
步骤一:实验装置如图所示(夹持及加热装置略去,下同)。_______ ,仪器c的作用为_______ 。
(2)HCl不宜过量,其可能原因是_______ 、_______ ,生成VOCl2的同时,还生成一种无色无污染的气体,则仪器a中反应的化学方程式为_______ 。
步骤二:实验装置如图所示。_______ 。
(4)测定产品纯度:称取mg样品用稀硫酸溶解后,加入 酸性
酸性 溶液将
溶液将 转化成
转化成 (在溶液中呈浅黄色),向反应后溶液中滴加
(在溶液中呈浅黄色),向反应后溶液中滴加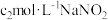 标准溶液,至剩余酸性
标准溶液,至剩余酸性 溶液恰好完全反应[
溶液恰好完全反应[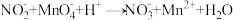 (未配平)],重复实验3次,平均消耗
(未配平)],重复实验3次,平均消耗 标准溶液
标准溶液 。
。
①滴定至终点的现象为_______ 。
②样品中氧钒(Ⅳ)碱式碳酸铵(摩尔质量为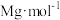 )的质量分数为
)的质量分数为_______ ×100%。
③下列情况会导致测得的产品纯度偏小的是_______ (填序号)。
a.配制NaNO2标准溶液时,称量固体中含少量NaNO3
b.达到滴定终点时,俯视读数
c.达到滴定终点时,发现滴定管尖嘴内有气泡
(5)一种钒的硫化物的晶体结构(图a)及其俯视图(图b)如图所示:_______ 。
②该钒的硫化物晶体中,与每个V原子最近且等距的S原子个数是_______ 。
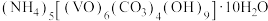 ,制备的实验流程如下:
,制备的实验流程如下: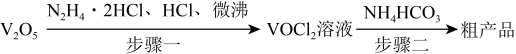
步骤一:实验装置如图所示(夹持及加热装置略去,下同)。
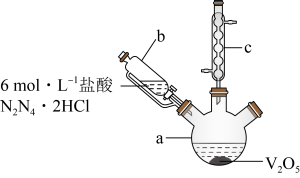
(2)HCl不宜过量,其可能原因是
步骤二:实验装置如图所示。
(4)测定产品纯度:称取mg样品用稀硫酸溶解后,加入
 酸性
酸性 溶液将
溶液将 转化成
转化成 (在溶液中呈浅黄色),向反应后溶液中滴加
(在溶液中呈浅黄色),向反应后溶液中滴加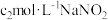 标准溶液,至剩余酸性
标准溶液,至剩余酸性 溶液恰好完全反应[
溶液恰好完全反应[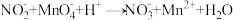 (未配平)],重复实验3次,平均消耗
(未配平)],重复实验3次,平均消耗 标准溶液
标准溶液 。
。①滴定至终点的现象为
②样品中氧钒(Ⅳ)碱式碳酸铵(摩尔质量为
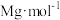 )的质量分数为
)的质量分数为③下列情况会导致测得的产品纯度偏小的是
a.配制NaNO2标准溶液时,称量固体中含少量NaNO3
b.达到滴定终点时,俯视读数
c.达到滴定终点时,发现滴定管尖嘴内有气泡
(5)一种钒的硫化物的晶体结构(图a)及其俯视图(图b)如图所示:
②该钒的硫化物晶体中,与每个V原子最近且等距的S原子个数是
您最近一年使用:0次
名校
8 . 清洁能源的综合利用有效降低碳排放,是实现“碳中和碳达峰”的重要途径。
(1)以环己烷为原料生产苯,同时得氢气。下图是该反应过程中几种物质间的能量关系。
 ,利用该反应可减少
,利用该反应可减少 排放,合成清洁能源。
排放,合成清洁能源。
①下列能说明反应达到平衡状态的是_______ (填字母)。
A.单位时间内生成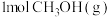 的同时消耗了
的同时消耗了
B.在绝热恒容的容器中,反应的平衡常数不再变化
C.容器内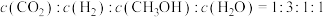
D.在恒温恒压的容器中,混合气体的密度不再变化
②一定条件下,在一密闭容器中充入 和
和 发生反应,下图表示压强为
发生反应,下图表示压强为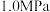 和
和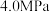 下
下 的平衡转化率随温度的变化关系。
的平衡转化率随温度的变化关系。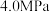 下
下 的平衡转化率随温度的变化曲线为
的平衡转化率随温度的变化曲线为_______ (填“Ⅰ”或“Ⅱ”),a点对应的平衡常数
_______  。(列出计算式即可,
。(列出计算式即可, 为以平衡分压代替平衡浓度表示的平衡常数,分压=总压×物质的量分数)
为以平衡分压代替平衡浓度表示的平衡常数,分压=总压×物质的量分数)
③利用制备的甲醇可以催化制取丙烯,过程中发生如下反应: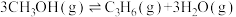 ,为探究M、N两种催化剂的催化效能,进行相关实验,依据实验数据获得如图所示曲线。
,为探究M、N两种催化剂的催化效能,进行相关实验,依据实验数据获得如图所示曲线。 (
( 为活化能,假设受温度影响忽略不计,k为速率常数,R和C为常数)。在M催化剂作用下,该反应的活化能
为活化能,假设受温度影响忽略不计,k为速率常数,R和C为常数)。在M催化剂作用下,该反应的活化能
_______  ,从图中信息获知催化效能较低的催化剂是
,从图中信息获知催化效能较低的催化剂是_______ (“M”或“N”),判断理由是_______ 。
(1)以环己烷为原料生产苯,同时得氢气。下图是该反应过程中几种物质间的能量关系。
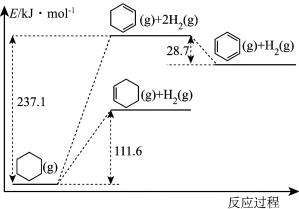
反应:
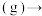
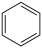
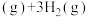

 。
。

 ,利用该反应可减少
,利用该反应可减少 排放,合成清洁能源。
排放,合成清洁能源。①下列能说明反应达到平衡状态的是
A.单位时间内生成
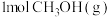 的同时消耗了
的同时消耗了
B.在绝热恒容的容器中,反应的平衡常数不再变化
C.容器内
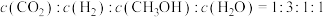
D.在恒温恒压的容器中,混合气体的密度不再变化
②一定条件下,在一密闭容器中充入
 和
和 发生反应,下图表示压强为
发生反应,下图表示压强为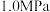 和
和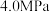 下
下 的平衡转化率随温度的变化关系。
的平衡转化率随温度的变化关系。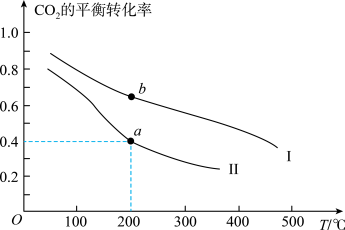
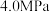 下
下 的平衡转化率随温度的变化曲线为
的平衡转化率随温度的变化曲线为
 。(列出计算式即可,
。(列出计算式即可, 为以平衡分压代替平衡浓度表示的平衡常数,分压=总压×物质的量分数)
为以平衡分压代替平衡浓度表示的平衡常数,分压=总压×物质的量分数)③利用制备的甲醇可以催化制取丙烯,过程中发生如下反应:
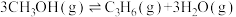 ,为探究M、N两种催化剂的催化效能,进行相关实验,依据实验数据获得如图所示曲线。
,为探究M、N两种催化剂的催化效能,进行相关实验,依据实验数据获得如图所示曲线。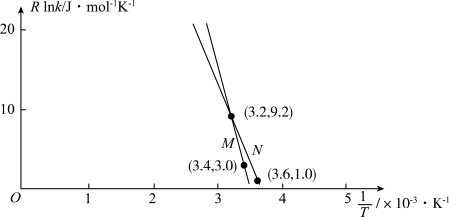
 (
( 为活化能,假设受温度影响忽略不计,k为速率常数,R和C为常数)。在M催化剂作用下,该反应的活化能
为活化能,假设受温度影响忽略不计,k为速率常数,R和C为常数)。在M催化剂作用下,该反应的活化能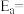
 ,从图中信息获知催化效能较低的催化剂是
,从图中信息获知催化效能较低的催化剂是
您最近一年使用:0次
名校
9 . 工业上主要采用如图甲所示的方法制备盐酸羟胺 ,含Fe的催化电极反应机理如图乙所示,不考虑溶液体积变化,下列说法正确的是
,含Fe的催化电极反应机理如图乙所示,不考虑溶液体积变化,下列说法正确的是
 ,含Fe的催化电极反应机理如图乙所示,不考虑溶液体积变化,下列说法正确的是
,含Fe的催化电极反应机理如图乙所示,不考虑溶液体积变化,下列说法正确的是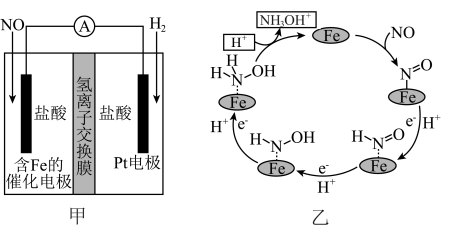
| A.Pt电极的电势高于含Fe的催化电极 |
B.基元反应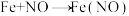  |
C.NO参与的电极反应式为: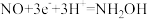 |
D.若外电路中通过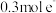 ,则左侧电解质溶液质量增加 ,则左侧电解质溶液质量增加 |
您最近一年使用:0次
10 . 某催化剂催化烯烃醛基化的过程如图。下列说法正确的是
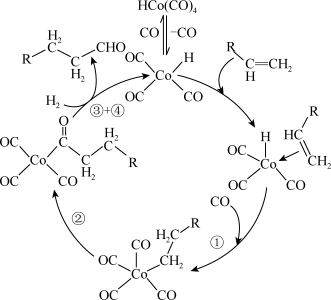
A.配合物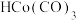 的配体CO中提供孤对电子的是O原子 的配体CO中提供孤对电子的是O原子 |
| B.如图循环转化过程中既存在σ、π键的断裂,也存在σ、π键的形成 |
C.烯制备醛的总反应: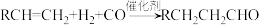 |
| D.用酸性KMnO4溶液鉴别产物RCH2CH2CHO中是否含有未完全转化的RCH=CH2 |
您最近一年使用:0次

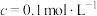 )的pH
)的pH )的pH
)的pH


