1 . 一种从分银渣(含CuO、 、
、 、
、 、
、 、Ag、
、Ag、 等)回收金属资源的工艺流程如下:
等)回收金属资源的工艺流程如下:
Ⅰ.CuCl难溶于水,但溶于浓盐酸。
Ⅱ.“富锑铋铜液”中含 (铋离子)、
(铋离子)、 (锑离子)、
(锑离子)、 、
、 。
。
Ⅲ.该工艺条件下,有关金属离子沉淀时的相关pH见下表:
回答下列问题:
(1)写出分银渣中的Ag与盐酸、溶解氧反应的离子方程式:___________________ 。
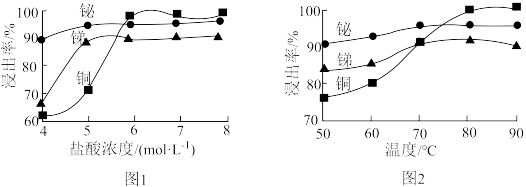
(2)“酸浸”时,盐酸浓度对锑、铋、铜浸出率的影响如图1所示,温度对锑、铋、铜浸出率的影响如图2所示。______ ;浸出时温度以80℃为宜,其原因是_____________________ 。
(3)①已知“滤渣2”的主要成分是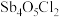 ,则“一次水解”时主要发生反应的化学方程式为
,则“一次水解”时主要发生反应的化学方程式为________ 。
②已知“滤渣3”的主要成分是BiOCl和 ,则“二次水解”时调节pH的范围应该是
,则“二次水解”时调节pH的范围应该是______ 。
(4)“滤渣1”中的AgCl可用硫酸-硫脲(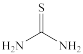 )浸出,生成配合物
)浸出,生成配合物 ,写出该反应的化学方程式:
,写出该反应的化学方程式:________________ ;该配合物中不存在__________ (填标号)。
A.离子键 B.极性共价键 C.配位键 D.范德华力 E.非极性共价键
(5)写出一种从“富铜溶液”中回收金属资源的方法:_________________ 。
(6)尖晶石属于立方晶系,其晶胞可视为 、
、 两种结构交替无隙并置而成(如图所示),其中
两种结构交替无隙并置而成(如图所示),其中 可以为
可以为 、
、 、
、 、
、 等,
等, 可以为
可以为 、
、 、
、 等。已知尖晶石型
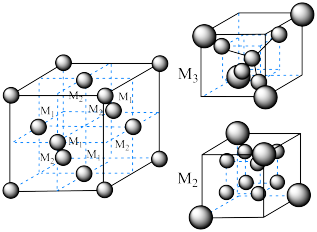
等。已知尖晶石型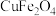 的晶胞参数为842pm,则该晶体的密度为
的晶胞参数为842pm,则该晶体的密度为________  。(列出计算式,阿伏加德罗常数的值为
。(列出计算式,阿伏加德罗常数的值为 )
)
 、
、 、
、 、
、 、Ag、
、Ag、 等)回收金属资源的工艺流程如下:
等)回收金属资源的工艺流程如下: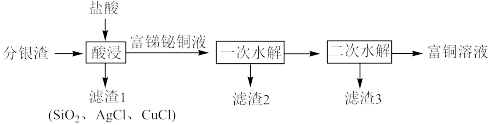
Ⅰ.CuCl难溶于水,但溶于浓盐酸。
Ⅱ.“富锑铋铜液”中含
 (铋离子)、
(铋离子)、 (锑离子)、
(锑离子)、 、
、 。
。Ⅲ.该工艺条件下,有关金属离子沉淀时的相关pH见下表:
金属离子 |
|
|
|
|
开始沉淀时( | 0.5 | 1.5 | 4.7 | 1.5 |
完全沉淀时( | 1.4 | 2.5 | 6.7 | 3.2 |
(1)写出分银渣中的Ag与盐酸、溶解氧反应的离子方程式:
(2)“酸浸”时,盐酸浓度对锑、铋、铜浸出率的影响如图1所示,温度对锑、铋、铜浸出率的影响如图2所示。
(3)①已知“滤渣2”的主要成分是
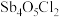 ,则“一次水解”时主要发生反应的化学方程式为
,则“一次水解”时主要发生反应的化学方程式为②已知“滤渣3”的主要成分是BiOCl和
 ,则“二次水解”时调节pH的范围应该是
,则“二次水解”时调节pH的范围应该是(4)“滤渣1”中的AgCl可用硫酸-硫脲(
 )浸出,生成配合物
)浸出,生成配合物 ,写出该反应的化学方程式:
,写出该反应的化学方程式:A.离子键 B.极性共价键 C.配位键 D.范德华力 E.非极性共价键
(5)写出一种从“富铜溶液”中回收金属资源的方法:
(6)尖晶石属于立方晶系,其晶胞可视为
 、
、 两种结构交替无隙并置而成(如图所示),其中
两种结构交替无隙并置而成(如图所示),其中 可以为
可以为 、
、 、
、 、
、 等,
等, 可以为
可以为 、
、 、
、 等。已知尖晶石型
等。已知尖晶石型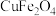 的晶胞参数为842pm,则该晶体的密度为
的晶胞参数为842pm,则该晶体的密度为 。(列出计算式,阿伏加德罗常数的值为
。(列出计算式,阿伏加德罗常数的值为 )
)
您最近一年使用:0次
解题方法
2 . 常温下,分别在 、
、 、
、 溶液中滴加NaOH溶液,溶液中
溶液中滴加NaOH溶液,溶液中 与pH关系如图所示。已知:X代表
与pH关系如图所示。已知:X代表 、
、 、
、 、
、 ;
;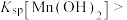
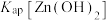 。下列叙述正确的是
。下列叙述正确的是
 、
、 、
、 溶液中滴加NaOH溶液,溶液中
溶液中滴加NaOH溶液,溶液中 与pH关系如图所示。已知:X代表
与pH关系如图所示。已知:X代表 、
、 、
、 、
、 ;
;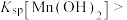
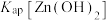 。下列叙述正确的是
。下列叙述正确的是
A.图中曲线 代表 代表 , , 代表 代表 |
B.室温下,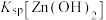 的数量级为 的数量级为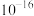 |
C.a点对应的溶液中: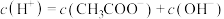 |
D.反应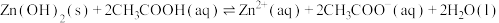 的平衡常数K的值为 的平衡常数K的值为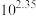 |
您最近一年使用:0次
名校
解题方法
3 . 硫代硫酸盐是一类具有应用前景的浸金试剂。硫代硫酸根 可看作是
可看作是 中的一个O原子被S原子取代的产物。
中的一个O原子被S原子取代的产物。
(1)基态S原子价层电子排布图是__________ 。
(2)比较S原子和O原子的第一电离能大小,从原子结构的角度说明理由:____________ 。
(3) 的空间结构是
的空间结构是__________ 。
(4)同位素示踪实验可证实 中两个S原子的化学环境不同,实验过程为
中两个S原子的化学环境不同,实验过程为 。过程ⅱ中,
。过程ⅱ中, 断裂的只有硫硫键,若过程ⅰ所用试剂是Na232SO3和35S,过程ⅱ含硫产物是
断裂的只有硫硫键,若过程ⅰ所用试剂是Na232SO3和35S,过程ⅱ含硫产物是__________ 。
(5)MgS2O3·6H2O的晶胞形状为长方体,边长分别为anm、bnm、cnm,结构如图所示。
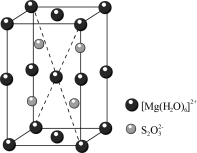
已知MgS2O3·6H2O的摩尔质量是Mg·mol-1,阿伏加德罗常数为 ,该晶体的密度为
,该晶体的密度为___________ g·cm-3。(1nm=10-7cm)
(6)浸金时, 作为配体可提供孤电子对与Au+形成
作为配体可提供孤电子对与Au+形成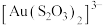 。分别判断
。分别判断 中的中心S原子和端基S原子能否做配位原子并说明理由:
中的中心S原子和端基S原子能否做配位原子并说明理由:___________ 。
 可看作是
可看作是 中的一个O原子被S原子取代的产物。
中的一个O原子被S原子取代的产物。(1)基态S原子价层电子排布图是
(2)比较S原子和O原子的第一电离能大小,从原子结构的角度说明理由:
(3)
 的空间结构是
的空间结构是(4)同位素示踪实验可证实
 中两个S原子的化学环境不同,实验过程为
中两个S原子的化学环境不同,实验过程为 。过程ⅱ中,
。过程ⅱ中, 断裂的只有硫硫键,若过程ⅰ所用试剂是Na232SO3和35S,过程ⅱ含硫产物是
断裂的只有硫硫键,若过程ⅰ所用试剂是Na232SO3和35S,过程ⅱ含硫产物是(5)MgS2O3·6H2O的晶胞形状为长方体,边长分别为anm、bnm、cnm,结构如图所示。

已知MgS2O3·6H2O的摩尔质量是Mg·mol-1,阿伏加德罗常数为
 ,该晶体的密度为
,该晶体的密度为(6)浸金时,
 作为配体可提供孤电子对与Au+形成
作为配体可提供孤电子对与Au+形成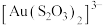 。分别判断
。分别判断 中的中心S原子和端基S原子能否做配位原子并说明理由:
中的中心S原子和端基S原子能否做配位原子并说明理由:
您最近一年使用:0次
名校
4 . 铁及其化合物有着极其广泛的用途。回答下列问题:
(1)基态铁原子的核外电子中有________ 对成对电子。
(2)基态铁原子的五级电离能数据如图1所示,其中 到
到 的电离能差值较大,其主要原因是
的电离能差值较大,其主要原因是____________ 。

(3)甘氨酸亚铁是一种具有口服活性的铁强化剂和补充剂。其制备反应如下:

甘氨酸亚铁分子中Fe2+的配体的化学式是__________ ,分子中碳原子的杂化类型是__________ 。
(4)氯化亚铁的熔点为674℃,而氯化铁的熔点仅为282℃,二者熔点存在差异的原因是____________ 。
(5)磁性氮化铁的晶胞结构如图2所示,沿z轴方向的投影如图3所示,则该化合物的化学式为____________ 。

(1)基态铁原子的核外电子中有
(2)基态铁原子的五级电离能数据如图1所示,其中
 到
到 的电离能差值较大,其主要原因是
的电离能差值较大,其主要原因是
(3)甘氨酸亚铁是一种具有口服活性的铁强化剂和补充剂。其制备反应如下:

甘氨酸亚铁分子中Fe2+的配体的化学式是
(4)氯化亚铁的熔点为674℃,而氯化铁的熔点仅为282℃,二者熔点存在差异的原因是
(5)磁性氮化铁的晶胞结构如图2所示,沿z轴方向的投影如图3所示,则该化合物的化学式为

您最近一年使用:0次
解题方法
5 . 四氧化三锰( )是一种可用于生产锂离子电池正极材料的原料。以天然二氧化锰粉与硫化锰矿(还含
)是一种可用于生产锂离子电池正极材料的原料。以天然二氧化锰粉与硫化锰矿(还含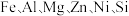 等元素)为原料制备高纯
等元素)为原料制备高纯 的工艺流程如下图所示。
的工艺流程如下图所示。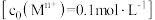 形成氢氧化物沉淀的
形成氢氧化物沉淀的 范围如下表:
范围如下表:
回答下列问题:
(1)“氧化”中添加适量的 的作用是
的作用是___________ 。(用离子方程式表示)
(2)“滤渣2”中主要有___________ ,“调 ”时溶液的
”时溶液的 范围应调节为
范围应调节为___________ ~6.2之间。
(3)“除杂2”的目的是生成 ,沉淀除去
,沉淀除去 。若溶液酸度过高,会导致
。若溶液酸度过高,会导致___________ 。
(4)常温下,利用表格中的数据,计算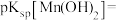
___________ 。(已知 )
)
(5) 和氨水混合在
和氨水混合在 下得到的
下得到的 的产率最高。若继续升高温度,会导致产率降低,原因可能是
的产率最高。若继续升高温度,会导致产率降低,原因可能是___________ 。
(6)在“沉锰”时,可用尿素 代替
代替 ,同时控制温度在
,同时控制温度在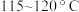 ,写出尿素“沉锰”反应的离子方程式:
,写出尿素“沉锰”反应的离子方程式:___________ 。
(7)金属 晶体中的原子堆积方式如图所示,六棱柱底边边长为
晶体中的原子堆积方式如图所示,六棱柱底边边长为 ,高为
,高为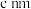 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,
, 的相对原子质量为M,则
的相对原子质量为M,则 晶体的密度为
晶体的密度为___________  (已知
(已知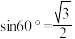 ,列出计算式即可)。
,列出计算式即可)。
 )是一种可用于生产锂离子电池正极材料的原料。以天然二氧化锰粉与硫化锰矿(还含
)是一种可用于生产锂离子电池正极材料的原料。以天然二氧化锰粉与硫化锰矿(还含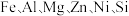 等元素)为原料制备高纯
等元素)为原料制备高纯 的工艺流程如下图所示。
的工艺流程如下图所示。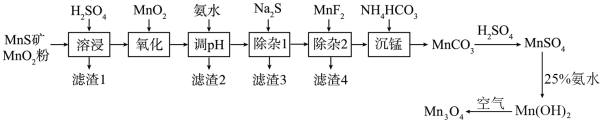
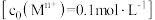 形成氢氧化物沉淀的
形成氢氧化物沉淀的 范围如下表:
范围如下表:| 金属离子 |  |  |  |  |  |  |  |
开始沉淀的 | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
沉淀完全的 | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
(1)“氧化”中添加适量的
 的作用是
的作用是(2)“滤渣2”中主要有
 ”时溶液的
”时溶液的 范围应调节为
范围应调节为(3)“除杂2”的目的是生成
 ,沉淀除去
,沉淀除去 。若溶液酸度过高,会导致
。若溶液酸度过高,会导致(4)常温下,利用表格中的数据,计算
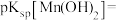
 )
)(5)
 和氨水混合在
和氨水混合在 下得到的
下得到的 的产率最高。若继续升高温度,会导致产率降低,原因可能是
的产率最高。若继续升高温度,会导致产率降低,原因可能是(6)在“沉锰”时,可用尿素
 代替
代替 ,同时控制温度在
,同时控制温度在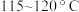 ,写出尿素“沉锰”反应的离子方程式:
,写出尿素“沉锰”反应的离子方程式:(7)金属
 晶体中的原子堆积方式如图所示,六棱柱底边边长为
晶体中的原子堆积方式如图所示,六棱柱底边边长为 ,高为
,高为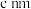 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,
, 的相对原子质量为M,则
的相对原子质量为M,则 晶体的密度为
晶体的密度为 (已知
(已知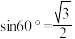 ,列出计算式即可)。
,列出计算式即可)。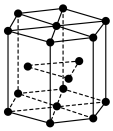
您最近一年使用:0次
名校
解题方法
6 . 为充分利用资源,变废为宝,可从废旧CPU[含Au(金)、Ag、Cu和Pt(铂)]中回收Au,其化工流程如图:
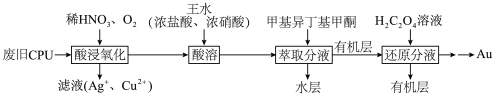
回答下列问题
(1)“酸浸氧化”中,为了提高反应速率,可以采取的措施是___________ (写出一种即可)。
(2)“酸浸氧化”中,通入氧气的目的是___________ 。
(3)“酸溶”时,Pt、Au分别转化为H2PtCl6和HAuCl4,同时有NO生成。Pt溶解的化学方程式是___________ 。
(4)“萃取分液”后的“水层”中可回收的金属是___________ 。
(5)从“还原分液”后的“有机层”中回收甲基异丁基甲酮,采用的方法是___________ 。
(6)理论上消耗1mol草酸(H2C2O4)可得到Au的质量为___________ g(结果保留一位小数)。
(7)提取“滤液”中的Ag+会涉及反应AgCl(s)+2NH3 [Ag(NH3)2]++Cl-,则该反应的平衡常数K的值为
[Ag(NH3)2]++Cl-,则该反应的平衡常数K的值为 ___________ 。已知:①[Ag(NH3)2]+ Ag++2NH3 K1=6×10-8;②Ksp(AgCl)=1.8×10-10。
Ag++2NH3 K1=6×10-8;②Ksp(AgCl)=1.8×10-10。

回答下列问题
(1)“酸浸氧化”中,为了提高反应速率,可以采取的措施是
(2)“酸浸氧化”中,通入氧气的目的是
(3)“酸溶”时,Pt、Au分别转化为H2PtCl6和HAuCl4,同时有NO生成。Pt溶解的化学方程式是
(4)“萃取分液”后的“水层”中可回收的金属是
(5)从“还原分液”后的“有机层”中回收甲基异丁基甲酮,采用的方法是
(6)理论上消耗1mol草酸(H2C2O4)可得到Au的质量为
(7)提取“滤液”中的Ag+会涉及反应AgCl(s)+2NH3
 [Ag(NH3)2]++Cl-,则该反应的平衡常数K的值为
[Ag(NH3)2]++Cl-,则该反应的平衡常数K的值为  Ag++2NH3 K1=6×10-8;②Ksp(AgCl)=1.8×10-10。
Ag++2NH3 K1=6×10-8;②Ksp(AgCl)=1.8×10-10。
您最近一年使用:0次
名校
7 . 向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化情况如图所示。则下列说法中不正确的是(已知:还原性:I->Fe2+>Br-)
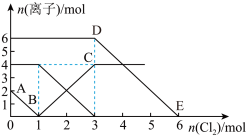

| A.DE线段的反应方程式:2Br-+Cl2=Br2+2Cl- |
| B.原混合溶液中FeBr2的物质的量为3mol |
| C.线段AB表示Fe2+被氯气氧化 |
| D.原溶液中:n(Fe2+):n (I-):n (Br-)=2:1:3 |
您最近一年使用:0次
2023-11-26更新
|
545次组卷
|
3卷引用:山西省实验中学2023-2024学年高一上学期期中考试化学试题
山西省实验中学2023-2024学年高一上学期期中考试化学试题山西省实验中学2023-2024学年高一上学期期中考试化学试题(已下线)寒假作业05 氯及其化合物-【寒假分层作业】2024年高一化学寒假培优练(人教版2019必修第一册)
名校
解题方法
8 . 利用1—甲基萘(1— )制备四氢萘类物质(
)制备四氢萘类物质( ,包括1—
,包括1— 和5—
和5— )。反应过程中伴有生成十氢茶(1—
)。反应过程中伴有生成十氢茶(1— )的副反应,涉及反应如图:
)的副反应,涉及反应如图:

回答下列问题:
(1)已知一定条件下反应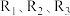 的焓变分别为
的焓变分别为 ,则反应
,则反应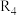 的焓变为
的焓变为_____ (用含 的代数式表示)。
的代数式表示)。
(2)四个平衡体系的平衡常数与温度的关系如图甲所示。
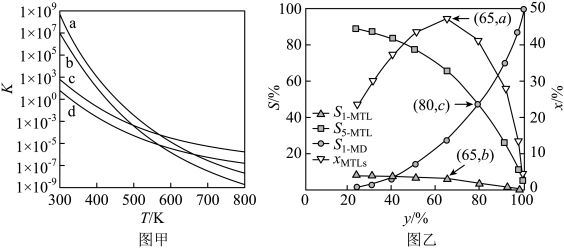
①c、d分别为反应 和
和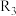 的平衡常数随温度变化的曲线,则表示反应
的平衡常数随温度变化的曲线,则表示反应 的平衡常数随温度变化曲线为
的平衡常数随温度变化曲线为_____ 。
②已知反应 的速率方程
的速率方程 (
( 分别为正、逆反应速率常数,只与温度、催化剂有关)。温度
分别为正、逆反应速率常数,只与温度、催化剂有关)。温度 下反应达到平衡时
下反应达到平衡时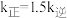 ,温度
,温度 下反应达到平衡时
下反应达到平衡时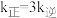 。由此推知,
。由此推知,
_____  。(填“>”,“<”或“=”)。
。(填“>”,“<”或“=”)。
③下列说法错误的是_____ 。
A.四个反应均为放热反应
B.压强越大,温度越低越有利于生成四氢萘类物质
C.反应体系中1—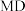 最稳定
最稳定
D.由上述信息可知, 时反应
时反应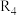 速率最快
速率最快
(3)1— 在
在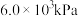 的高压
的高压 氛围下反应(
氛围下反应( 压强近似等于总压)。不同温度下达平衡时各产物的选择性
压强近似等于总压)。不同温度下达平衡时各产物的选择性 (某生成物i的物质的量与消耗1—
(某生成物i的物质的量与消耗1— 的物质的量之比)和物质的量分数
的物质的量之比)和物质的量分数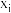 (
(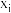 表示物种i与除
表示物种i与除 外其他各物种总物质的量之比)随1—
外其他各物种总物质的量之比)随1— 平衡转化率y的变化关系如图乙所示,1—
平衡转化率y的变化关系如图乙所示,1— 平衡转化率y为80%时,1—
平衡转化率y为80%时,1— 的产率=
的产率=_____ ;y为65%时反应 的平衡常数
的平衡常数
_____  。四氢萘类物质的物质的量分数
。四氢萘类物质的物质的量分数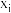 随1—
随1— 平衡转化率先增大后减小,结合平衡移动原理解释原因
平衡转化率先增大后减小,结合平衡移动原理解释原因_____ 。
 )制备四氢萘类物质(
)制备四氢萘类物质( ,包括1—
,包括1— 和5—
和5— )。反应过程中伴有生成十氢茶(1—
)。反应过程中伴有生成十氢茶(1— )的副反应,涉及反应如图:
)的副反应,涉及反应如图:
回答下列问题:
(1)已知一定条件下反应
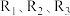 的焓变分别为
的焓变分别为 ,则反应
,则反应 的焓变为
的焓变为 的代数式表示)。
的代数式表示)。(2)四个平衡体系的平衡常数与温度的关系如图甲所示。

①c、d分别为反应
 和
和 的平衡常数随温度变化的曲线,则表示反应
的平衡常数随温度变化的曲线,则表示反应 的平衡常数随温度变化曲线为
的平衡常数随温度变化曲线为②已知反应
 的速率方程
的速率方程 (
( 分别为正、逆反应速率常数,只与温度、催化剂有关)。温度
分别为正、逆反应速率常数,只与温度、催化剂有关)。温度 下反应达到平衡时
下反应达到平衡时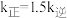 ,温度
,温度 下反应达到平衡时
下反应达到平衡时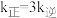 。由此推知,
。由此推知,
 。(填“>”,“<”或“=”)。
。(填“>”,“<”或“=”)。③下列说法错误的是
A.四个反应均为放热反应
B.压强越大,温度越低越有利于生成四氢萘类物质
C.反应体系中1—
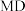 最稳定
最稳定D.由上述信息可知,
 时反应
时反应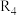 速率最快
速率最快(3)1—
 在
在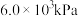 的高压
的高压 氛围下反应(
氛围下反应( 压强近似等于总压)。不同温度下达平衡时各产物的选择性
压强近似等于总压)。不同温度下达平衡时各产物的选择性 (某生成物i的物质的量与消耗1—
(某生成物i的物质的量与消耗1— 的物质的量之比)和物质的量分数
的物质的量之比)和物质的量分数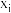 (
(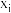 表示物种i与除
表示物种i与除 外其他各物种总物质的量之比)随1—
外其他各物种总物质的量之比)随1— 平衡转化率y的变化关系如图乙所示,1—
平衡转化率y的变化关系如图乙所示,1— 平衡转化率y为80%时,1—
平衡转化率y为80%时,1— 的产率=
的产率= 的平衡常数
的平衡常数
 。四氢萘类物质的物质的量分数
。四氢萘类物质的物质的量分数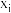 随1—
随1— 平衡转化率先增大后减小,结合平衡移动原理解释原因
平衡转化率先增大后减小,结合平衡移动原理解释原因
您最近一年使用:0次
名校
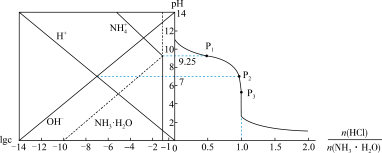
9 .  时,将
时,将 气体缓慢通入
气体缓慢通入 的氨水中,溶液的
的氨水中,溶液的 、体系中粒子浓度的对数值(lgc)与反应物的物质的量之比 [
、体系中粒子浓度的对数值(lgc)与反应物的物质的量之比 [ ]的关系如下图所示。若忽略溶液体积变化,下列错误的是
]的关系如下图所示。若忽略溶液体积变化,下列错误的是
 时,将
时,将 气体缓慢通入
气体缓慢通入 的氨水中,溶液的
的氨水中,溶液的 、体系中粒子浓度的对数值(lgc)与反应物的物质的量之比 [
、体系中粒子浓度的对数值(lgc)与反应物的物质的量之比 [ ]的关系如下图所示。若忽略溶液体积变化,下列错误的是
]的关系如下图所示。若忽略溶液体积变化,下列错误的是
A. 时, 时, 的电离平衡常数为 的电离平衡常数为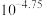 |
B. 时, 时,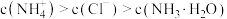 |
C. 所示溶液: 所示溶液: |
D.水的电离程度: |
您最近一年使用:0次
名校
10 . I.HI分解曲线和液相法制备HI反应曲线分别如图1和图2所示:
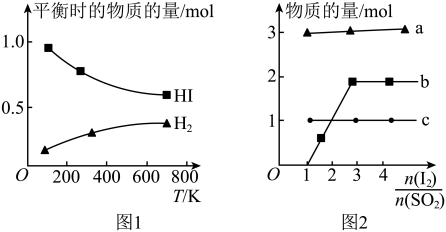
(1)反应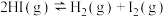 的
的
___________ (填“大于”或“小于”)0。
(2)Bodensteins研究了该反应在 时,气体混合物中碘化氢的物质的量分数
时,气体混合物中碘化氢的物质的量分数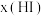 与反应时间t的关系如下表:
与反应时间t的关系如下表:
上述反应中,正反应速率为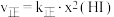 ,逆反应速率为
,逆反应速率为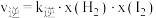 ,其中
,其中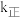 、k逆为速率常数,则k逆为
、k逆为速率常数,则k逆为___________ (以K和k正表示)。若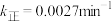 ,在t=40min时
,在t=40min时
___________ 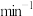 (保留三位有效数字)。
(保留三位有效数字)。
(3)将二氧化硫通入碘水中会发生反应: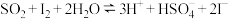 ,
, ,图2中曲线a、b分别代表的产物微粒是
,图2中曲线a、b分别代表的产物微粒是___________ (填微粒符号);由图2知要提高碘的还原率,除控制温度外,还可以采取的措施是___________ 。
II. 的排放主要来自于汽车尾气,包含
的排放主要来自于汽车尾气,包含 和
和 ,有人提出用活性炭对
,有人提出用活性炭对 进行吸附,发生反应如下:
进行吸附,发生反应如下:
反应a: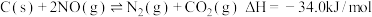
反应b: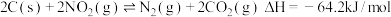
(4)对于密闭容器中反应a,在T1℃时,借助传感器测得反应在不同时间点上各物质的浓度如下:
30min后,只改变某一条件,反应重新达到平衡;根据上表中的数据判断改变的条件可能是___________(填字母代号)。
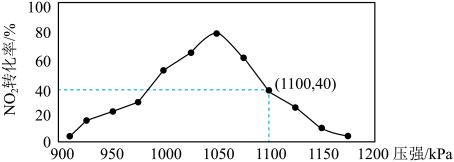
(5)某实验室模拟反应b,在密用容器中加入足量的C和一定量的 气体,维持温度为T2℃,如图为不同压强下反应b经过相同时间
气体,维持温度为T2℃,如图为不同压强下反应b经过相同时间 的转化率随着压强变化的示意图。请分析,
的转化率随着压强变化的示意图。请分析, 前,反应b中
前,反应b中 转化率随着压强增大而增大的原因是
转化率随着压强增大而增大的原因是___________ 。
用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作 );在T2℃、
);在T2℃、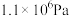 时,该反应的化学平衡常数
时,该反应的化学平衡常数
___________ Pa;已知:气体分压(p分)气体总压(p总)×体积分数。

(1)反应
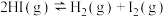 的
的
(2)Bodensteins研究了该反应在
 时,气体混合物中碘化氢的物质的量分数
时,气体混合物中碘化氢的物质的量分数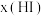 与反应时间t的关系如下表:
与反应时间t的关系如下表:| t/min | 0 | 20 | 40 | 60 | 80 | 120 |
 | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
 | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
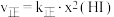 ,逆反应速率为
,逆反应速率为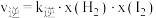 ,其中
,其中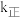 、k逆为速率常数,则k逆为
、k逆为速率常数,则k逆为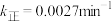 ,在t=40min时
,在t=40min时
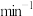 (保留三位有效数字)。
(保留三位有效数字)。(3)将二氧化硫通入碘水中会发生反应:
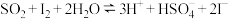 ,
, ,图2中曲线a、b分别代表的产物微粒是
,图2中曲线a、b分别代表的产物微粒是II.
 的排放主要来自于汽车尾气,包含
的排放主要来自于汽车尾气,包含 和
和 ,有人提出用活性炭对
,有人提出用活性炭对 进行吸附,发生反应如下:
进行吸附,发生反应如下:反应a:
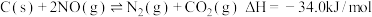
反应b:
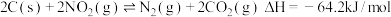
(4)对于密闭容器中反应a,在T1℃时,借助传感器测得反应在不同时间点上各物质的浓度如下:
| 0 | 10 | 20 | 30 | 40 | 50 | |
| NO | 1.00 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
| A.加入一定量的活性炭 | B.通入一定量的NO |
| C.适当缩小容器的体积 | D.加入合适的催化剂 |
 气体,维持温度为T2℃,如图为不同压强下反应b经过相同时间
气体,维持温度为T2℃,如图为不同压强下反应b经过相同时间 的转化率随着压强变化的示意图。请分析,
的转化率随着压强变化的示意图。请分析, 前,反应b中
前,反应b中 转化率随着压强增大而增大的原因是
转化率随着压强增大而增大的原因是
用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作
 );在T2℃、
);在T2℃、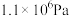 时,该反应的化学平衡常数
时,该反应的化学平衡常数
您最近一年使用:0次

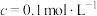 )的pH
)的pH )的pH
)的pH

