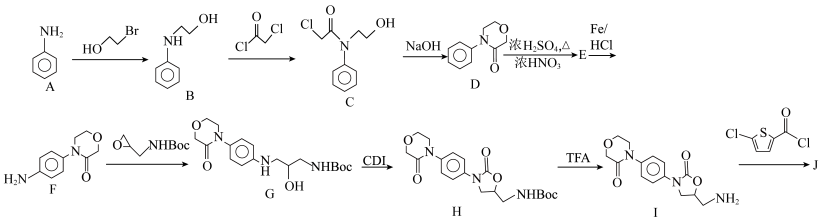
1 . 利伐沙班(J)是一种新型抗凝药物,可用于治疗下肢静脉血栓,合成路线如下:
(1)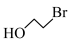 的名称为
的名称为_________________ ;
(2)有机物C中的含氧官能团名称为____________________ ;
(3)D→E的化学方程式为_____________________ ;
(4)E→F的反应类型为________________ ;
(5)合成G时, 中引入—Boc(叔丁氧炭基)的作用是
中引入—Boc(叔丁氧炭基)的作用是_______________ ;
(6)化合物J的结构简式为_____________ ;
(7)化合物X为B的同分异构体,则符合下列条件的X的结构共有_______ 种
①遇 溶液显紫色
溶液显紫色
②分子中存在 结构,但不与苯环直接相连
结构,但不与苯环直接相连
其中,核磁共振氢谱含有6组吸收峰,且峰面积比为1∶2∶2∶2∶2∶2的是______________________ 。
已知: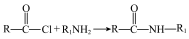
(1)
 的名称为
的名称为(2)有机物C中的含氧官能团名称为
(3)D→E的化学方程式为
(4)E→F的反应类型为
(5)合成G时,
 中引入—Boc(叔丁氧炭基)的作用是
中引入—Boc(叔丁氧炭基)的作用是(6)化合物J的结构简式为
(7)化合物X为B的同分异构体,则符合下列条件的X的结构共有
①遇
 溶液显紫色
溶液显紫色②分子中存在
 结构,但不与苯环直接相连
结构,但不与苯环直接相连其中,核磁共振氢谱含有6组吸收峰,且峰面积比为1∶2∶2∶2∶2∶2的是
您最近一年使用:0次
解题方法
2 . 亚硝酸HONO是天气中的一种污染物,在人体中会发生度应产生毒性更强的亚硝酸胺[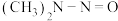 ],反应机理为
],反应机理为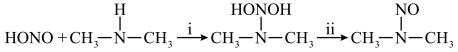 ,该反应机理对应的能量变化关系如图,已知反应中所涉及物质的分子中各原子最外层电子均达到稳定结构。下列说法不正确的是
,该反应机理对应的能量变化关系如图,已知反应中所涉及物质的分子中各原子最外层电子均达到稳定结构。下列说法不正确的是
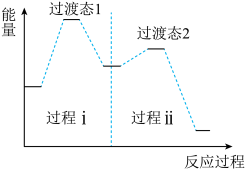
| A.过程ⅰ为决速步骤 |
B.亚硝酸的电子式为 |
| C.过程ⅰ与ⅱ活化能的差值等于总反应的焓变 |
| D.过程ⅰ、ⅱ分别属于加成反应与消去反应 |
您最近一年使用:0次
3 . 下列实验操作及现象所得结论正确的是
| 选项 | 实验操作及现象 | 结论 |
| A | 向碳酸钙的悬浊液中通入NO2,悬浊液逐渐变澄清 |  酸性强于 酸性强于 |
| B | 向新制的Cu(OH)2中滴入用碱中和后的蔗糖水解液,加热,产生砖红色沉淀 | 蔗糖已完全水解 |
| C | 取某补铁剂溶于硝酸,向所得溶液中滴加KSCN溶液,溶液变红色 | 该补铁剂中铁元素的化合价为+3价 |
| D | 向CuCl2、MgCl2的混合溶液中滴加NaOH溶液,溶液中先生成蓝色沉淀 |  |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
4 . 化合物G是合成抗HIV药物福沙那韦的关键中间体,其一种合成路线如下:___________ 。D→E的反应类型是___________ 。
(2)化合物B分子式为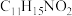 ,B的结构简式是
,B的结构简式是___________ ;化合物X分子式为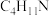 ,X的结构简式是
,X的结构简式是___________ 。
(3)满足下列条件的A的同分异构体有___________ 种。
①比A少一个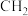 ;
;
②能发生银镜反应;
③与 溶液不能发生显色反应,但能发生水解反应,且水解反应的产物之一可以与
溶液不能发生显色反应,但能发生水解反应,且水解反应的产物之一可以与 溶液发生显色反应。
溶液发生显色反应。
请写出其中核磁共振氢谱图峰面积之比为1∶2∶2∶2∶2的M的结构简式___________ 。
(4)写出以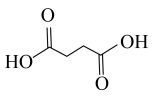 为原料制备
为原料制备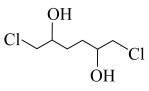 的合成路线流程图(无机试剂和流程中的有机试剂任用,合成路线流程图示例见本题题干)
的合成路线流程图(无机试剂和流程中的有机试剂任用,合成路线流程图示例见本题题干)___________ 。

已知:①―Boc为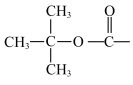 的简写;②
的简写;②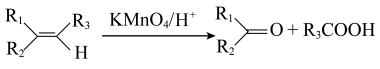
(2)化合物B分子式为
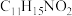 ,B的结构简式是
,B的结构简式是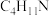 ,X的结构简式是
,X的结构简式是(3)满足下列条件的A的同分异构体有
①比A少一个
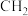 ;
;②能发生银镜反应;
③与
 溶液不能发生显色反应,但能发生水解反应,且水解反应的产物之一可以与
溶液不能发生显色反应,但能发生水解反应,且水解反应的产物之一可以与 溶液发生显色反应。
溶液发生显色反应。请写出其中核磁共振氢谱图峰面积之比为1∶2∶2∶2∶2的M的结构简式
(4)写出以
 为原料制备
为原料制备 的合成路线流程图(无机试剂和流程中的有机试剂任用,合成路线流程图示例见本题题干)
的合成路线流程图(无机试剂和流程中的有机试剂任用,合成路线流程图示例见本题题干)
您最近一年使用:0次
5 . 将CO或CO2转化为高附加值化学品是颇具前景的合成路线。
(1)工业上用CO2和H2反应合成二甲醚。
已知:
 ;
;

 。
。
写出 和
和 转化为
转化为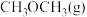 和
和 的热化学方程式:
的热化学方程式:_______________ ,该反应在________ (填“高温”或“低温”)条件下能自发进行。
(2)CO2催化加氢合成乙醇的反应原理为
 ,设m为起始时的投料比,即
,设m为起始时的投料比,即 。
。________________ 。
②图1右图表示在总压为5MPa的恒压条件下,且m=3时,平衡状态下各物质的物质的量分数与温度的关系,则曲线d代表的物质为________ (填化学式)。
(3)一种利用焦炉气中的H2和工业废气捕获的CO2生产绿色燃料甲醇的原理为 、
、 。
。
在研究该反应历程时发现,反应气中水蒸气含量会影响CH3OH的产率。为了研究水分子对该反应机制的内在影响,科学家利用计算机模拟,研究添加适量水蒸气前后对能垒较大的反应历程能量变化的影响,如图3所示(吸附在催化剂表面上的物种用*标注)。________________ 。
②资料显示:水也可以使催化剂活化点位减少。结合资料、上图及学过的知识推测,在反应气中添加水蒸气将如何影响甲醇产率及产生这种影响的原因:________________ (任答两点)。
(4)一定条件下,利用CO2和H2还可制得甲烷: ,主要副反应为
,主要副反应为 。一定温度下,向恒容密闭容器中充入CO2和H2(物质的量之比为1:4)发生反应,容器内气体的压强随时间的变化如表所示:
。一定温度下,向恒容密闭容器中充入CO2和H2(物质的量之比为1:4)发生反应,容器内气体的压强随时间的变化如表所示:
①用单位时间内气体分压的变化表示反应 的速率,则前120min内CH4的平均反应速率
的速率,则前120min内CH4的平均反应速率
________ 。
②该温度下,平衡时CO的体积分数为8%,反应 的平衡常数
的平衡常数
________ ( 为以分压表示的平衡常数,保留小数点后2位)。
为以分压表示的平衡常数,保留小数点后2位)。
(1)工业上用CO2和H2反应合成二甲醚。
已知:

 ;
;
 。
。写出
 和
和 转化为
转化为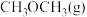 和
和 的热化学方程式:
的热化学方程式:(2)CO2催化加氢合成乙醇的反应原理为

 ,设m为起始时的投料比,即
,设m为起始时的投料比,即 。
。
②图1右图表示在总压为5MPa的恒压条件下,且m=3时,平衡状态下各物质的物质的量分数与温度的关系,则曲线d代表的物质为
(3)一种利用焦炉气中的H2和工业废气捕获的CO2生产绿色燃料甲醇的原理为
 、
、 。
。在研究该反应历程时发现,反应气中水蒸气含量会影响CH3OH的产率。为了研究水分子对该反应机制的内在影响,科学家利用计算机模拟,研究添加适量水蒸气前后对能垒较大的反应历程能量变化的影响,如图3所示(吸附在催化剂表面上的物种用*标注)。
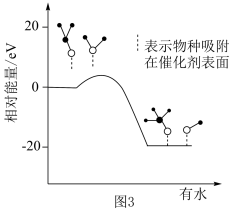
②资料显示:水也可以使催化剂活化点位减少。结合资料、上图及学过的知识推测,在反应气中添加水蒸气将如何影响甲醇产率及产生这种影响的原因:
(4)一定条件下,利用CO2和H2还可制得甲烷:
 ,主要副反应为
,主要副反应为 。一定温度下,向恒容密闭容器中充入CO2和H2(物质的量之比为1:4)发生反应,容器内气体的压强随时间的变化如表所示:
。一定温度下,向恒容密闭容器中充入CO2和H2(物质的量之比为1:4)发生反应,容器内气体的压强随时间的变化如表所示:时间/min | 0 | 60 | 120 | 180 | 240 | 300 | 360 |
压强/kPa | 100 | 93.8 | 88.0 | 83.4 | 79.4 | 75.0 | 75.0 |
 的速率,则前120min内CH4的平均反应速率
的速率,则前120min内CH4的平均反应速率
②该温度下,平衡时CO的体积分数为8%,反应
 的平衡常数
的平衡常数
 为以分压表示的平衡常数,保留小数点后2位)。
为以分压表示的平衡常数,保留小数点后2位)。
您最近一年使用:0次
2024-06-04更新
|
125次组卷
|
3卷引用:2024届山西省晋中市和诚高中高三下学期理综冲刺卷(二)-高中化学
6 .  链烷烃来源于天然气、油田伴生气等,价格低廉,合理利用该资源开发化工产品具有十分重要的意义。回答下列问题:
链烷烃来源于天然气、油田伴生气等,价格低廉,合理利用该资源开发化工产品具有十分重要的意义。回答下列问题:
(1)已知;完全燃烧正丁烷生成5mol (l)和完全燃烧异丁烷生成5mol
(l)和完全燃烧异丁烷生成5mol  (l)放出热量分别为2878kJ、2869kJ,则正丁烷转化为异丁烷的热化学方程式为
(l)放出热量分别为2878kJ、2869kJ,则正丁烷转化为异丁烷的热化学方程式为_____________________ 。
(2)控制适当的反应条件,发生反应: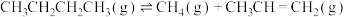 △H>0。实验测得
△H>0。实验测得 ;
;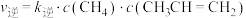 ,其中
,其中 、
、 为速率常数。在两种压强(分别为
为速率常数。在两种压强(分别为 、
、 且
且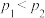 )下,分别测得
)下,分别测得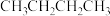 (g)与
(g)与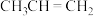 (g)平衡时的体积分数随温度的变化趋势如图所示。
(g)平衡时的体积分数随温度的变化趋势如图所示。__________ (用速率常数表示),速率常数与温度________ (填“有关”或“无关”)。
② 、
、 、
、 的相对大小关系是
的相对大小关系是______________ (用“>”“<”或“=”连接)。
③线Ⅱ、线Ⅲ的含义分别表示_____________________ 。
(3)若不加控制,通常同时存在反应: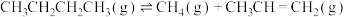 和
和
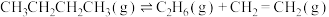 。T℃时,向恒容密闭容器中投入
。T℃时,向恒容密闭容器中投入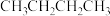 (g)发生前述反应,部分物质的浓度随时间变化如图所示,平衡时压强为17pPa。
(g)发生前述反应,部分物质的浓度随时间变化如图所示,平衡时压强为17pPa。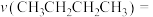
_________  (保留三位有效数字,各组分分压=总压×
(保留三位有效数字,各组分分压=总压×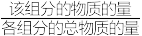 );6min时,增大正丁烷浓度,
);6min时,增大正丁烷浓度,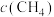 的变化对应图中线
的变化对应图中线___________ (填字母序号)。
②T℃时,反应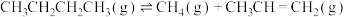 用分压表示的平衡常数
用分压表示的平衡常数
________ Pa。
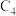 链烷烃来源于天然气、油田伴生气等,价格低廉,合理利用该资源开发化工产品具有十分重要的意义。回答下列问题:
链烷烃来源于天然气、油田伴生气等,价格低廉,合理利用该资源开发化工产品具有十分重要的意义。回答下列问题:(1)已知;完全燃烧正丁烷生成5mol
 (l)和完全燃烧异丁烷生成5mol
(l)和完全燃烧异丁烷生成5mol  (l)放出热量分别为2878kJ、2869kJ,则正丁烷转化为异丁烷的热化学方程式为
(l)放出热量分别为2878kJ、2869kJ,则正丁烷转化为异丁烷的热化学方程式为(2)控制适当的反应条件,发生反应:
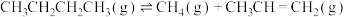 △H>0。实验测得
△H>0。实验测得 ;
;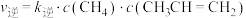 ,其中
,其中 、
、 为速率常数。在两种压强(分别为
为速率常数。在两种压强(分别为 、
、 且
且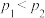 )下,分别测得
)下,分别测得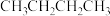 (g)与
(g)与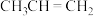 (g)平衡时的体积分数随温度的变化趋势如图所示。
(g)平衡时的体积分数随温度的变化趋势如图所示。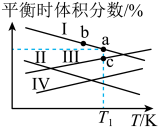
②
 、
、 、
、 的相对大小关系是
的相对大小关系是③线Ⅱ、线Ⅲ的含义分别表示
(3)若不加控制,通常同时存在反应:
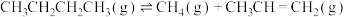 和
和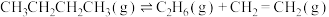 。T℃时,向恒容密闭容器中投入
。T℃时,向恒容密闭容器中投入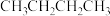 (g)发生前述反应,部分物质的浓度随时间变化如图所示,平衡时压强为17pPa。
(g)发生前述反应,部分物质的浓度随时间变化如图所示,平衡时压强为17pPa。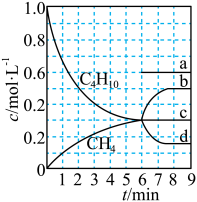
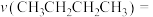
 (保留三位有效数字,各组分分压=总压×
(保留三位有效数字,各组分分压=总压×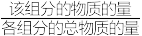 );6min时,增大正丁烷浓度,
);6min时,增大正丁烷浓度,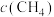 的变化对应图中线
的变化对应图中线②T℃时,反应
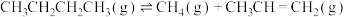 用分压表示的平衡常数
用分压表示的平衡常数
您最近一年使用:0次
解题方法
7 . 铬酰氯是一种无机化合物,化学式为 ,熔点:
,熔点: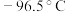 ,沸点:
,沸点: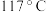 ,常温下为深红棕色液体,遇水剧烈反应产生大量白雾(铬酸、氯化氢)。在实验室中可由重铬酸钾、浓硫酸与氯化钾反应得到铬酰氯,反应机理为:浓硫酸先分别与重铬酸钾和氯化钾反应生成
,常温下为深红棕色液体,遇水剧烈反应产生大量白雾(铬酸、氯化氢)。在实验室中可由重铬酸钾、浓硫酸与氯化钾反应得到铬酰氯,反应机理为:浓硫酸先分别与重铬酸钾和氯化钾反应生成 和氯化氢气体两种中间产物,然后
和氯化氢气体两种中间产物,然后 迅速与氯化氢气体反应生成铬酰氯,实验装置如图(夹持装置略):
迅速与氯化氢气体反应生成铬酰氯,实验装置如图(夹持装置略):
(1)铬酰氯中 元素的化合价为
元素的化合价为___________ 。
(2)装置图中,仪器 的名称分别是
的名称分别是___________ 、___________ 。
(3)有人建议将仪器B换成如图仪器D,效果会更好,你同意此观点吗?___________ (填“是”或“否”),若不同意,请说出原因:___________ 。 总反应方程式为
总反应方程式为___________ 。
(5)反应结束后,用电热套加热反应装置,收集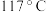 左右的馏分,收集装置选用冰水浴的目的是
左右的馏分,收集装置选用冰水浴的目的是___________ 。
(6)铬酰氯遇水反应的化学方程式为___________ ,据此可知C中应选用下图装置中的___________ (填“甲”或“乙”),不用另一个的主要原因是___________ 。
 ,熔点:
,熔点: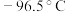 ,沸点:
,沸点: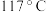 ,常温下为深红棕色液体,遇水剧烈反应产生大量白雾(铬酸、氯化氢)。在实验室中可由重铬酸钾、浓硫酸与氯化钾反应得到铬酰氯,反应机理为:浓硫酸先分别与重铬酸钾和氯化钾反应生成
,常温下为深红棕色液体,遇水剧烈反应产生大量白雾(铬酸、氯化氢)。在实验室中可由重铬酸钾、浓硫酸与氯化钾反应得到铬酰氯,反应机理为:浓硫酸先分别与重铬酸钾和氯化钾反应生成 和氯化氢气体两种中间产物,然后
和氯化氢气体两种中间产物,然后 迅速与氯化氢气体反应生成铬酰氯,实验装置如图(夹持装置略):
迅速与氯化氢气体反应生成铬酰氯,实验装置如图(夹持装置略):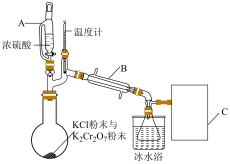
(1)铬酰氯中
 元素的化合价为
元素的化合价为(2)装置图中,仪器
 的名称分别是
的名称分别是(3)有人建议将仪器B换成如图仪器D,效果会更好,你同意此观点吗?
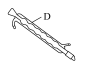
 总反应方程式为
总反应方程式为(5)反应结束后,用电热套加热反应装置,收集
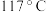 左右的馏分,收集装置选用冰水浴的目的是
左右的馏分,收集装置选用冰水浴的目的是(6)铬酰氯遇水反应的化学方程式为
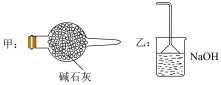
您最近一年使用:0次
解题方法
8 .  是大气污染物,其主要来源途径为工业上含硫矿物煅烧,可以按如下流程脱除或利用。
是大气污染物,其主要来源途径为工业上含硫矿物煅烧,可以按如下流程脱除或利用。
(1)富氧煅烧燃煤产生的低浓度的 可以在炉内添加
可以在炉内添加 通过途径Ⅱ脱除,写出反应方程式
通过途径Ⅱ脱除,写出反应方程式___________ ;若反应Ⅳ中 与
与 等物质的量反应,则得到的无机酯结构简式为:
等物质的量反应,则得到的无机酯结构简式为:___________ 。
(2)反应Ⅲ为: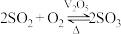 ,催化氧化过程中钒元素的变化如图所示,则过程c发生反应的化学方程式为
,催化氧化过程中钒元素的变化如图所示,则过程c发生反应的化学方程式为___________ 。 及
及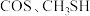 等多种有机硫,其中
等多种有机硫,其中 的电子式为
的电子式为___________ ; (沸点为
(沸点为 )的燃烧热为
)的燃烧热为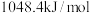 ,则体现其燃烧热的热化学方程式为:
,则体现其燃烧热的热化学方程式为:___________ 。
(4)工业生产中利用 浓硫酸代替水吸收
浓硫酸代替水吸收 ,主要原因是:
,主要原因是:___________ 。 也可用
也可用 表示,其对应的盐
表示,其对应的盐 是重要的化工试剂,其一种工业生产和应用如图所示:
是重要的化工试剂,其一种工业生产和应用如图所示:___________ (填“酸性”、“中性”或“碱性”),用离子方程式表明原因___________ ; 与磁铁矿发生反应产生的
与磁铁矿发生反应产生的 的化学方程式为
的化学方程式为___________ 。
 是大气污染物,其主要来源途径为工业上含硫矿物煅烧,可以按如下流程脱除或利用。
是大气污染物,其主要来源途径为工业上含硫矿物煅烧,可以按如下流程脱除或利用。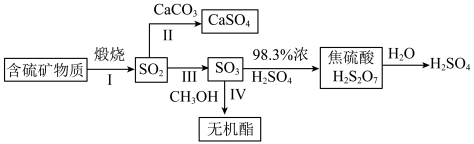
已知: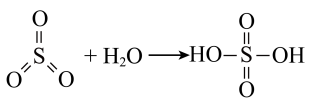
(1)富氧煅烧燃煤产生的低浓度的
 可以在炉内添加
可以在炉内添加 通过途径Ⅱ脱除,写出反应方程式
通过途径Ⅱ脱除,写出反应方程式 与
与 等物质的量反应,则得到的无机酯结构简式为:
等物质的量反应,则得到的无机酯结构简式为:(2)反应Ⅲ为:
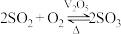 ,催化氧化过程中钒元素的变化如图所示,则过程c发生反应的化学方程式为
,催化氧化过程中钒元素的变化如图所示,则过程c发生反应的化学方程式为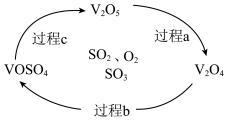
 及
及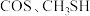 等多种有机硫,其中
等多种有机硫,其中 的电子式为
的电子式为 (沸点为
(沸点为 )的燃烧热为
)的燃烧热为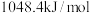 ,则体现其燃烧热的热化学方程式为:
,则体现其燃烧热的热化学方程式为:(4)工业生产中利用
 浓硫酸代替水吸收
浓硫酸代替水吸收 ,主要原因是:
,主要原因是: 也可用
也可用 表示,其对应的盐
表示,其对应的盐 是重要的化工试剂,其一种工业生产和应用如图所示:
是重要的化工试剂,其一种工业生产和应用如图所示: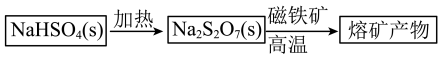
 与磁铁矿发生反应产生的
与磁铁矿发生反应产生的 的化学方程式为
的化学方程式为
您最近一年使用:0次
9 . 锰可用于制造特种钢材,在汽车电池、高端装备制造、新材料等领域有广泛应用。二氧化锰广泛应用于电池、电子工业。以主要成分为 的某锰矿(杂质为
的某锰矿(杂质为 、
、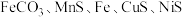 等)为原料制备单质锰的一种流程如图所示:
等)为原料制备单质锰的一种流程如图所示: 与溶液
与溶液 的关系如图所示:
的关系如图所示:
(1)滤液中的溶质为 、
、___________ (填化学式),“氧化除硫”过程中有红褐色固体生成,则 参与反应的化学方程式为
参与反应的化学方程式为___________ 。
(2)“酸浸氧化”过程 被氧化的离子方程式为
被氧化的离子方程式为___________ 。
(3)为何不通过调 的方法将
的方法将 除去:
除去: ___________ ;已知若溶液中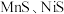 同时沉淀完全时,溶液中
同时沉淀完全时,溶液中 ,则相同温度下,
,则相同温度下,
___________ 。
(4)通过控制适当的反应条件,电解 溶液时,既可得到
溶液时,既可得到 也可得到
也可得到 ,则生成单质时,
,则生成单质时, 应在
应在___________ (填“阳极”或“阴极”)上放电;写出生成 时的电极反应式:
时的电极反应式:___________ 。
(5)已知单质锰的立方晶胞结构如图所示:___________ ;若锰原子半径为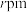 ,阿伏加德罗常数值为
,阿伏加德罗常数值为 ,则单质锰的密度为
,则单质锰的密度为___________  (用含
(用含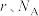 的代数式表示)。
的代数式表示)。
 的某锰矿(杂质为
的某锰矿(杂质为 、
、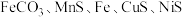 等)为原料制备单质锰的一种流程如图所示:
等)为原料制备单质锰的一种流程如图所示:
 与溶液
与溶液 的关系如图所示:
的关系如图所示: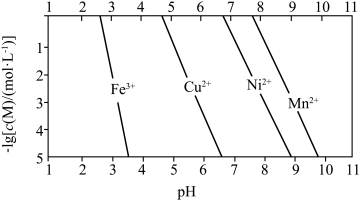
(1)滤液中的溶质为
 、
、 参与反应的化学方程式为
参与反应的化学方程式为(2)“酸浸氧化”过程
 被氧化的离子方程式为
被氧化的离子方程式为(3)为何不通过调
 的方法将
的方法将 除去:
除去: 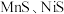 同时沉淀完全时,溶液中
同时沉淀完全时,溶液中 ,则相同温度下,
,则相同温度下,
(4)通过控制适当的反应条件,电解
 溶液时,既可得到
溶液时,既可得到 也可得到
也可得到 ,则生成单质时,
,则生成单质时, 应在
应在 时的电极反应式:
时的电极反应式:(5)已知单质锰的立方晶胞结构如图所示:

 ,阿伏加德罗常数值为
,阿伏加德罗常数值为 ,则单质锰的密度为
,则单质锰的密度为 (用含
(用含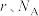 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
10 . 亚氯酸钠( )主要用作漂白剂、脱色剂、消毒剂、拔染剂及某些工业废气的处理等。某课题小组设计如下实验制备亚氯酸钠晶体。
)主要用作漂白剂、脱色剂、消毒剂、拔染剂及某些工业废气的处理等。某课题小组设计如下实验制备亚氯酸钠晶体。
已知:① 浓度较大时,容易发生爆炸;
浓度较大时,容易发生爆炸; 极易溶于水并放出热量,但不与水反应,沸点11℃,难溶于乙醇、乙醚等有机溶剂。
极易溶于水并放出热量,但不与水反应,沸点11℃,难溶于乙醇、乙醚等有机溶剂。
② 饱和溶液在低于38℃时析出
饱和溶液在低于38℃时析出 ,高于38℃时析出
,高于38℃时析出 ,高于60℃时分解。
,高于60℃时分解。
(1)装有 和
和 固体的仪器名称为
固体的仪器名称为_______ 。
(2)在A装置中, 、
、 和浓硫酸反应生成
和浓硫酸反应生成 气体,写出该反应的化学方程式
气体,写出该反应的化学方程式_______ ;反应过程中需要持续不断的通入N2的目的是_______ 。
(3) 气体与装置C中混合溶液反应生成
气体与装置C中混合溶液反应生成 ,写出该反应的离子方程式
,写出该反应的离子方程式_______ ,该反应需要用冷水浴控制反应温度在38℃∼60℃,原因是_______ 。
(4)反应结束后,经以下步骤可从装置C的溶液中提纯 晶体:50℃蒸发结晶→趁热过滤→洗涤干燥。准确称取0.5000g样品,加入适量蒸馏水、过量的KI晶体和稀硫酸,在酸性条件下发生反应
晶体:50℃蒸发结晶→趁热过滤→洗涤干燥。准确称取0.5000g样品,加入适量蒸馏水、过量的KI晶体和稀硫酸,在酸性条件下发生反应 ,将所得混合溶液稀释成
,将所得混合溶液稀释成 待测溶液,取10.00mL待测溶液,加入
待测溶液,取10.00mL待测溶液,加入_______ 溶液作指示剂,用 标准溶液滴定至终点,测得平均消耗标准溶液的体积为21.00mL(已知:
标准溶液滴定至终点,测得平均消耗标准溶液的体积为21.00mL(已知: )。
)。
①滴定终点的现象是_______ 。
②所称取样品中 的质量分数为
的质量分数为_______ (保留两位有效数字)。
 )主要用作漂白剂、脱色剂、消毒剂、拔染剂及某些工业废气的处理等。某课题小组设计如下实验制备亚氯酸钠晶体。
)主要用作漂白剂、脱色剂、消毒剂、拔染剂及某些工业废气的处理等。某课题小组设计如下实验制备亚氯酸钠晶体。已知:①
 浓度较大时,容易发生爆炸;
浓度较大时,容易发生爆炸; 极易溶于水并放出热量,但不与水反应,沸点11℃,难溶于乙醇、乙醚等有机溶剂。
极易溶于水并放出热量,但不与水反应,沸点11℃,难溶于乙醇、乙醚等有机溶剂。②
 饱和溶液在低于38℃时析出
饱和溶液在低于38℃时析出 ,高于38℃时析出
,高于38℃时析出 ,高于60℃时分解。
,高于60℃时分解。
(1)装有
 和
和 固体的仪器名称为
固体的仪器名称为(2)在A装置中,
 、
、 和浓硫酸反应生成
和浓硫酸反应生成 气体,写出该反应的化学方程式
气体,写出该反应的化学方程式(3)
 气体与装置C中混合溶液反应生成
气体与装置C中混合溶液反应生成 ,写出该反应的离子方程式
,写出该反应的离子方程式(4)反应结束后,经以下步骤可从装置C的溶液中提纯
 晶体:50℃蒸发结晶→趁热过滤→洗涤干燥。准确称取0.5000g样品,加入适量蒸馏水、过量的KI晶体和稀硫酸,在酸性条件下发生反应
晶体:50℃蒸发结晶→趁热过滤→洗涤干燥。准确称取0.5000g样品,加入适量蒸馏水、过量的KI晶体和稀硫酸,在酸性条件下发生反应 ,将所得混合溶液稀释成
,将所得混合溶液稀释成 待测溶液,取10.00mL待测溶液,加入
待测溶液,取10.00mL待测溶液,加入 标准溶液滴定至终点,测得平均消耗标准溶液的体积为21.00mL(已知:
标准溶液滴定至终点,测得平均消耗标准溶液的体积为21.00mL(已知: )。
)。①滴定终点的现象是
②所称取样品中
 的质量分数为
的质量分数为
您最近一年使用:0次



