1 . 常温下,用KOH溶液分别滴定 、
、 溶液、
溶液、 溶液,
溶液,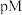 [
[ 表示负对数,
表示负对数, 表示
表示 、
、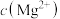 、
、 ]随pH变化的关系图,已知
]随pH变化的关系图,已知 ,下列说法正确的是
,下列说法正确的是
 、
、 溶液、
溶液、 溶液,
溶液,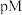 [
[ 表示负对数,
表示负对数, 表示
表示 、
、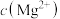 、
、 ]随pH变化的关系图,已知
]随pH变化的关系图,已知 ,下列说法正确的是
,下列说法正确的是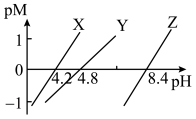
A. 的电离平衡常数 的电离平衡常数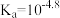 |
B.直线X代表滴定 溶液的变化关系 溶液的变化关系 |
C.将物质的量均为0.1mol的 、 、 溶于 溶于 水中快速搅拌均匀,该分散系中 水中快速搅拌均匀,该分散系中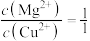 |
D. 易溶于 易溶于 |
您最近一年使用:0次
名校
解题方法
2 . 高纯四氧化三锰是电子工业生产锰锌氧软磁材料重要原料之一、以菱锰矿(主要成分为 ,含
,含 和少量Fe、Cu、Ni、Ca、Mg等元素)为原料制备四氧化三锰工艺流程如下图所示。
和少量Fe、Cu、Ni、Ca、Mg等元素)为原料制备四氧化三锰工艺流程如下图所示。
(1)酸浸时 发生反应的离子方程式为
发生反应的离子方程式为___________ 。
(2)“滤渣1”的主要成分为 、
、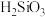 ,还含有
,还含有___________ (填化学式)。
(3)福美钠的化学式为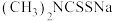 。生成福美镍沉淀的结构为
。生成福美镍沉淀的结构为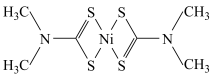 ,其中硫与镍之间的结合方式为下列中的
,其中硫与镍之间的结合方式为下列中的___________ (填标号);
A.离子键 B.金属键 C.氢键 D.配位键
25℃,电离常数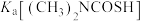
___________  (填“大于”“小于”或“等于”),其判断理由是
(填“大于”“小于”或“等于”),其判断理由是___________ 。
(4)除钙镁时, 、
、 沉淀后溶液中
沉淀后溶液中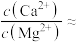
___________ [已知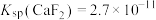 、
、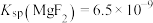 ]
]
(5)除硅时,絮凝剂为阳离子型聚丙烯酰胺,可通过“吸附—电中和—架桥”使硅酸胶体絮凝沉淀,硅酸胶体粒子带___________ 电荷(填“正”或“负”)。
(6) 在空气中被氧化生成
在空气中被氧化生成 反应的化学方程式为
反应的化学方程式为___________ 。
(7) 可表示为
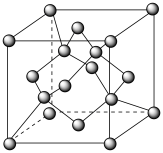
可表示为 ,温度高于1170℃时属于立方晶体,其中
,温度高于1170℃时属于立方晶体,其中 和Mn3+占据晶胞的顶点、面心及内部交错的4个小立方体的体心,与金刚石晶胞中碳原子占据的位置相似(金刚石晶胞如图所示)。若
和Mn3+占据晶胞的顶点、面心及内部交错的4个小立方体的体心,与金刚石晶胞中碳原子占据的位置相似(金刚石晶胞如图所示)。若 晶体的密度为
晶体的密度为 ,则晶胞参数
,则晶胞参数
___________ pm(列出计算式,阿伏加德罗常数的值为 )。
)。
 ,含
,含 和少量Fe、Cu、Ni、Ca、Mg等元素)为原料制备四氧化三锰工艺流程如下图所示。
和少量Fe、Cu、Ni、Ca、Mg等元素)为原料制备四氧化三锰工艺流程如下图所示。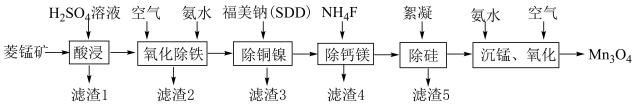
(1)酸浸时
 发生反应的离子方程式为
发生反应的离子方程式为(2)“滤渣1”的主要成分为
 、
、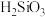 ,还含有
,还含有(3)福美钠的化学式为
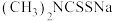 。生成福美镍沉淀的结构为
。生成福美镍沉淀的结构为 ,其中硫与镍之间的结合方式为下列中的
,其中硫与镍之间的结合方式为下列中的A.离子键 B.金属键 C.氢键 D.配位键
25℃,电离常数
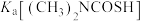
 (填“大于”“小于”或“等于”),其判断理由是
(填“大于”“小于”或“等于”),其判断理由是(4)除钙镁时,
 、
、 沉淀后溶液中
沉淀后溶液中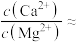
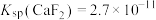 、
、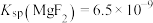 ]
](5)除硅时,絮凝剂为阳离子型聚丙烯酰胺,可通过“吸附—电中和—架桥”使硅酸胶体絮凝沉淀,硅酸胶体粒子带
(6)
 在空气中被氧化生成
在空气中被氧化生成 反应的化学方程式为
反应的化学方程式为(7)
 可表示为
可表示为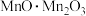 ,温度高于1170℃时属于立方晶体,其中
,温度高于1170℃时属于立方晶体,其中 和Mn3+占据晶胞的顶点、面心及内部交错的4个小立方体的体心,与金刚石晶胞中碳原子占据的位置相似(金刚石晶胞如图所示)。若
和Mn3+占据晶胞的顶点、面心及内部交错的4个小立方体的体心,与金刚石晶胞中碳原子占据的位置相似(金刚石晶胞如图所示)。若 晶体的密度为
晶体的密度为 ,则晶胞参数
,则晶胞参数
 )。
)。
您最近一年使用:0次
2024-01-06更新
|
646次组卷
|
3卷引用:2024届山西省介休市定阳高级中学高三下学期模拟考试(九)理综试题-高中化学
解题方法
3 . 1-丁烯是仅次于乙烯和丙烯的重要石油化工基本原料,可以利用正丁烷催化脱氢制备,催化脱氢又分为无氧催化脱氢和有氧催化脱氢。实际化工生产中需对反应条件(催化剂、温度等)进行探究,以获取最佳效益。
已知:I.温度过高会引发正丁烷裂解生成低碳烃类的副反应。
II.产物收率=生成某产物的原料量/投入的原料量×100%。
(1)利用正丁烷无氧催化脱氢制备1-丁烯反应原理如下:
CH3CH2CH2CH3 H2C=CHCH2CH3+H2 ΔH
H2C=CHCH2CH3+H2 ΔH
已知CH3 CH2CH2CH3、CH2 =CHCH2CH3、H2的燃烧热分别为2 878 kJ/mol、2 720 kJ/mol、286 kJ/mol,计算ΔH=___________ 。
(2)无氧催化脱氢用Pt系催化剂时,正丁烷单位时间转化率和1-丁烯选择性如表所示。
①仅从1-丁烯选择性的角度考虑,应选择的催化剂为___________ (填催化剂序号,下同)。
②工业上,从1-丁烯单位时间收率的角度考虑,应选择的最佳催化剂为___________ 。
(3)其他条件相同,30 min时测得正丁烷转化率、1-丁烯收率随温度的变化关系如图所示。
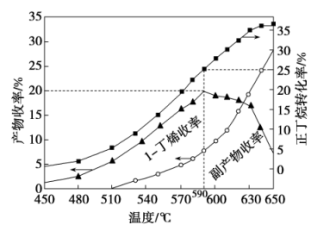
温度高于590 ℃时1-丁烯收率降低的原因是_________________ 。
(4)有氧催化脱氢通常选择O2或CO2为氧化剂,VOx-MgO为催化剂,反应原理如下:
2CH3CH2CH2CH3+O2 2CH2 =CHCH2CH3 +2H2O i
2CH2 =CHCH2CH3 +2H2O i
CH3 CH2CH2CH3+CO2 H2C=CHCH2CH3+H2O+CO ii
H2C=CHCH2CH3+H2O+CO ii
一定温度下,在体积为10 L的恒容密闭容器中,加入10 mol CH3CH2CH2CH3、7 mol O2、3 mol CO2进行反应i和ii.测得初始压强为20kPa,经过10h,反应达到平衡,此时压强变成25kPa,其中O2的体积分数为16%。回答下列问题:
①v(O2)=___________ kPa/h (用O2分压表示速率)。
②该温度下,反应ii的平衡常数Kp=___________ kPa。
③O2为氧化剂时,1-丁烯的选择性明显低于CO2为氧化剂时的选择性,分析可能原因:______________ 。
已知:I.温度过高会引发正丁烷裂解生成低碳烃类的副反应。
II.产物收率=生成某产物的原料量/投入的原料量×100%。
(1)利用正丁烷无氧催化脱氢制备1-丁烯反应原理如下:
CH3CH2CH2CH3
 H2C=CHCH2CH3+H2 ΔH
H2C=CHCH2CH3+H2 ΔH已知CH3 CH2CH2CH3、CH2 =CHCH2CH3、H2的燃烧热分别为2 878 kJ/mol、2 720 kJ/mol、286 kJ/mol,计算ΔH=
(2)无氧催化脱氢用Pt系催化剂时,正丁烷单位时间转化率和1-丁烯选择性如表所示。
| 催化剂 | 单位时间转化率/% | 1-丁烯选择性/% |
| 催化剂1:PtSn/γ-Al2O3 | 23.0 | 92.0 |
| 催化剂2:PtSnSr0.2/γ-Al2O3 | 38.5 | 88.1 |
| 催化剂3:PtSn(0.3%)/MgAl2O4 | 27.0 | 98.9 |
②工业上,从1-丁烯单位时间收率的角度考虑,应选择的最佳催化剂为
(3)其他条件相同,30 min时测得正丁烷转化率、1-丁烯收率随温度的变化关系如图所示。

温度高于590 ℃时1-丁烯收率降低的原因是
(4)有氧催化脱氢通常选择O2或CO2为氧化剂,VOx-MgO为催化剂,反应原理如下:
2CH3CH2CH2CH3+O2
 2CH2 =CHCH2CH3 +2H2O i
2CH2 =CHCH2CH3 +2H2O iCH3 CH2CH2CH3+CO2
 H2C=CHCH2CH3+H2O+CO ii
H2C=CHCH2CH3+H2O+CO ii一定温度下,在体积为10 L的恒容密闭容器中,加入10 mol CH3CH2CH2CH3、7 mol O2、3 mol CO2进行反应i和ii.测得初始压强为20kPa,经过10h,反应达到平衡,此时压强变成25kPa,其中O2的体积分数为16%。回答下列问题:
①v(O2)=
②该温度下,反应ii的平衡常数Kp=
③O2为氧化剂时,1-丁烯的选择性明显低于CO2为氧化剂时的选择性,分析可能原因:
您最近一年使用:0次
解题方法
4 . CO2的回收与利用是科学家研究的热点课题。
已知:反应ICO2(g)+3H2(g) CH3OH(g)+H2O(g)△H1=-58kJ·mol-1
CH3OH(g)+H2O(g)△H1=-58kJ·mol-1
反应ICO2(g)+H2(g) CO(g)+H2O(g)△H2=+41kJ·mol-1
CO(g)+H2O(g)△H2=+41kJ·mol-1
(1)CO(g)和H2(g)反应生成CH3OH(g)的热化学方程式为______________ 。
(2)某实验过程中,控制压强一定,将CO2和H2按一定的初始投料比、一定流速通过催化剂,经过相同时间测得如下实验数据(反应未达到平衡状态):
表中实验数据表明,升高温度,CO2实际转化率提高而甲醇的选择性降低。其原因是____________________________ 。
(3)在一定条件下,选择合适的催化剂只进行反应CO2(g)+H2(g) CO(g)+H2O(g)。调整CO2和H2初始投料比,测得在一定投料比和一定温度下,该反应CO2的平衡转化率如图(各点对应的反应温度可能相同,也可能不同)。
CO(g)+H2O(g)。调整CO2和H2初始投料比,测得在一定投料比和一定温度下,该反应CO2的平衡转化率如图(各点对应的反应温度可能相同,也可能不同)。
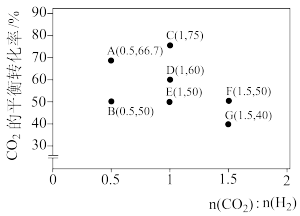
已知:Kx是以物质的量分数表示的化学平衡常数。
①经分析,A、E和G三点对应的反应温度相同,结合数据说明判断理由_______________ 。
②已知反应速率v=v正-v逆=k正x(CO2)x(H2)-k逆x(CO)x(H2O),k正、k逆分别为正、逆向反应速率常数,x为物质的量分数。C、D、E三点中k正-k逆最大的是___________ ,A、B、F三点中v逆最大的是___________ 。计算E点所示的投料比在从起始到平衡的过程中,当CO2转化率达到50%时, =
=___________ 。
(4)关于合成甲醇过程中用到的催化剂,下列说法错误的是___________ (填字母)。
A.参与了反应,改变了反应历程和△HB.使k正和k逆增大,但二者增大倍数不同
C.降低了反应的活化能D.提高了CO2的平衡转化率
已知:反应ICO2(g)+3H2(g)
 CH3OH(g)+H2O(g)△H1=-58kJ·mol-1
CH3OH(g)+H2O(g)△H1=-58kJ·mol-1反应ICO2(g)+H2(g)
 CO(g)+H2O(g)△H2=+41kJ·mol-1
CO(g)+H2O(g)△H2=+41kJ·mol-1(1)CO(g)和H2(g)反应生成CH3OH(g)的热化学方程式为
(2)某实验过程中,控制压强一定,将CO2和H2按一定的初始投料比、一定流速通过催化剂,经过相同时间测得如下实验数据(反应未达到平衡状态):
T/K | CO2实际转化率/% | 甲醇的选择性/% |
543 | 12.3 | 42.3 |
553 | 15.3 | 39.1 |
(3)在一定条件下,选择合适的催化剂只进行反应CO2(g)+H2(g)
 CO(g)+H2O(g)。调整CO2和H2初始投料比,测得在一定投料比和一定温度下,该反应CO2的平衡转化率如图(各点对应的反应温度可能相同,也可能不同)。
CO(g)+H2O(g)。调整CO2和H2初始投料比,测得在一定投料比和一定温度下,该反应CO2的平衡转化率如图(各点对应的反应温度可能相同,也可能不同)。
已知:Kx是以物质的量分数表示的化学平衡常数。
①经分析,A、E和G三点对应的反应温度相同,结合数据说明判断理由
②已知反应速率v=v正-v逆=k正x(CO2)x(H2)-k逆x(CO)x(H2O),k正、k逆分别为正、逆向反应速率常数,x为物质的量分数。C、D、E三点中k正-k逆最大的是
 =
=(4)关于合成甲醇过程中用到的催化剂,下列说法错误的是
A.参与了反应,改变了反应历程和△HB.使k正和k逆增大,但二者增大倍数不同
C.降低了反应的活化能D.提高了CO2的平衡转化率
您最近一年使用:0次
解题方法
5 . 研究者预想合成一个纯粹由氮组成的新物种—N5+N3-,若N5+离子中每个氮原子均满足8电子结构,以下有关N5+推测正确的是
| A.N5+有24个电子 | B.N5+离子中存在三对未成键的电子对 |
| C.N5+阳离子中存在两个氮氮三键 | D.N5+在水中可以稳定存在 |
您最近一年使用:0次
2020-03-22更新
|
826次组卷
|
2卷引用:山西省晋中市和诚中学2019-2020学年高二3月月考化学试题
真题
名校
6 . 常温下将NaOH溶液滴加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述错误的是
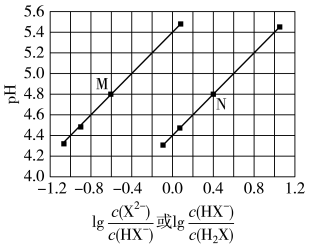

| A.Ka2(H2X)的数量级为10–6 |
B.曲线N表示pH与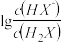 的变化关系 的变化关系 |
| C.NaHX溶液中c(H+)>c(OH-) |
| D.当混合溶液呈中性时,c(Na+)>c(HX-)>c(X2-)>c(OH-)=c(H+) |
您最近一年使用:0次
2017-08-09更新
|
17098次组卷
|
70卷引用:【全国百强校】山西省晋中市平遥县平遥中学2019届高三上学期12月月考化学试题
【全国百强校】山西省晋中市平遥县平遥中学2019届高三上学期12月月考化学试题河北省安平中学2016-2017学年高二下学期期末考试化学试题2017年全国普通高等学校招生统一考试理综化学(新课标Ⅰ卷精编版)黑龙江省哈尔滨市第六中学2017-2018学年高二12月月考化学试题黑龙江省哈尔滨六中2017-2018学年高二12月月考化学试卷辽宁省沈阳市东北育才学校2017-2018学年高二上学期期中考试化学试题云南民族大学附属中学2017-2018学年高二下学期第一次月考化学试题(已下线)《考前20天终极攻略》6月4日 专项四 化学坐标曲线图分析(已下线)《考前20天终极攻略》-5月23日 溶液中的离子平衡(已下线)解密12 盐类的水解——备战2018年高考化学之高频考点解密2018-2019学年鲁科版高中化学选修四:第3章检测题(已下线)2019高考备考一轮复习精品资料 第三章 金属及其化合物 第5讲 数形结合思想的应用【教学案】【全国百强校】四川省棠湖中学2019届高三上学期第三次月考理综-化学试题河南省辉县市一中2018-2019学年高二上学期第二次阶段性考试化学试题【全国百强校】内蒙古自治区杭锦后旗奋斗中学2018-2019学年高二下学期期中考试化学试题安徽省阜阳市颍上二中等三校2020届高三上学期入学考试化学试题河北安平中学2020届高三上学期第二次月考化学试题天津市耀华中学2019-2020学年度高二上学学期期中考试化学试题2019年秋高三化学复习强化练习—— 电解质溶液中的曲线问题江西省上饶中学2019-2020学年高二上学期期中考试(零班、培优班)化学试题吉林省长春市田家炳实验中学2019-2020学年高二上学期期末考试化学试题辽宁省锦州市滨海实验中学2019-2020学年高三上学期期末考试化学试题备考突破2020高三化学专题强化集训——电解质溶液中的曲线问题辽宁省锦州市滨海实验中学2020届高三模拟考试理综化学试题重庆市江北中学2019-2020学年高二上学期期末模拟考试化学试题四川省泸县第四中学2020届高三下学期第一次在线月考理综化学试题(已下线)专题十二 水溶液中的离子平衡(真题汇编)-2020年高考二轮模块化复习之《化学基本原理》名师讲案与提分特训云南省大理白族自治州祥云县第一中学2020届高三下学期4月月考理综化学试题河北省沧州市盐山中学2019-2020学年高二上学期期末考试(B)化学试题(已下线)考点11 弱电解质的电离及溶液pH-2020年高考化学命题预测与模拟试题分类精编(已下线)2020年高考化学押题预测卷02(新课标Ⅲ卷)--《2020年高考押题预测卷》河北衡水中学2020届高三下学期三月份教学质量监测理科综合化学试题(已下线)广东省深圳中学2020届高三3月份教学质量监测卷理综化学试题四川省成都市第七中学2020年高中毕业班教学质量监测卷理科综合化学试题湖南省长沙市礼雅中学2020届高三下学期三月份网络教学质量监测理科综合化学试题广东省深圳中学2020年高中毕业班教学质量监测卷理科综合化学试题贵州省贵阳市第一中学2020届高三教学质量监测理科综合化学试题安徽省合肥市第一中学2019-2020学年高二上学期段二(期中)考试化学试题鲁科版(2019)选择性必修1 第3章 物质在水溶液中的行为 第2节 弱电解质的电离盐类的水解(已下线)第03章 物质在水溶液中的行为 (B卷能力提升卷) -2020-2021学年高二化学选择性必修1同步单元AB卷(新教材鲁科版)(已下线)易错18 电解质溶液图像-备战2021年高考化学一轮复习易错题鲁科版(2019)高二选择性必修第一册第3章 物质在水溶液中的行为 过高考 3年真题强化闯关河南省焦作市博爱县英才学校2020-2021学年高二上学期11月月考化学试题甘肃省白银市会宁县第一中学2020-2021学年高二上学期第二次月考化学试题广东省广州市第一一三中学2020-2021学年高二上学期第二阶段考试化学(选考)试题四川省成都市龙泉中学2021届高三上学期1月月考理综化学试题江西省抚州市金溪县第一中学2020-2021学年高二上学期第二次月考化学试题(已下线)专题12 水溶液中离子平衡(攻克各种图像问题)-2021年高考化学必做热点专题(已下线)解密10 水溶液中离子反应(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)解密10 水溶液中离子反应(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)河北省尚义一中2020-2021学年高二下学期期中考试化学试题四川省遂宁市射洪中学2020—2021学年高二下学期第三次月考化学试题(已下线)考点25 盐类的水解-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点25 盐类的水解-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)课时44 滴定曲线、分布系数曲线的分析-2022年高考化学一轮复习小题多维练(全国通用)湖北省武汉市华中师范大学第一附属中学2020届高三3月份网络教学质量监测卷理综化学试题重庆育才中学2021-2022学年高二上学期第三次定时练习化学试题山西省太原市第五中学2021-2022学年高二上学期12月月考化学试题(已下线)考点28 盐类的水解-备战2023年高考化学一轮复习考点帮(全国通用)江西省抚州市金溪县第一中学2021-2022学年高二下学期第二次月考化学试题(已下线)专题06 水溶液中的离子平衡(练)-2023年高考化学二轮复习讲练测(新高考专用)(已下线)专题21 电解质溶液图像分析-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)专题11 水溶液中的离子平衡图像(选择题)-2023年高考化学毕业班二轮热点题型归纳与变式演练(已下线)专题四 电解质溶液图象(讲)广东省中山大学附属中学2023-2024学年高三上学期8月阶段性检测化学试题湖南省张家界市民族中学2023-2024学年高二上学期第二次月考化学试题山西省实验中学2023-2024学年高二上学期期中考试化学试题内蒙古呼伦贝尔市海拉尔第二中学2023-2024学年高二上学期期末考试化学试题浙江省杭州市源清中学2023-2024学年高二上学期期末考试化学试题江西省宜春市宜丰中学2023-2024学年高一上学期1月期末化学试题
10-11高三·浙江·阶段练习
解题方法
7 . 某氯化铁与氯化亚铁的混合物。现要测定其中铁元素的质量分数,实验按以下步骤进行:

请根据上面流程,回答以下问题:
(1)操作Ⅰ所用到的玻璃仪器除烧杯、玻璃棒外,还必须有____________ 、__________ 。 (填仪器名称)
(2)请写出加入溴水发生的离子反应方程式_________________ 。
(3)将沉淀物加热,冷却至室温,用天平称量其质量为b1g。再次加热并冷却至室温称量其质量为b2g,若b1-b2=0.3g,则接下来还应进行的操作是__________ 。若蒸发皿质量是 W1 g,蒸发皿与加热后固体总质量是W2g,则样品中铁元素的质量分数是___________ 。有同学提出,还可以采用以下方法来测定:

①溶解样品改用了硫酸,而不用盐酸,原因是______________ 。
②选择的还原剂是否能用铁 (填“是”或“否”),原因是:__________________ 。
③若滴定用掉c mol/ L KMnO4溶液bmL,则样品中铁元素的质量分数是_______________ 。

请根据上面流程,回答以下问题:
(1)操作Ⅰ所用到的玻璃仪器除烧杯、玻璃棒外,还必须有
(2)请写出加入溴水发生的离子反应方程式
(3)将沉淀物加热,冷却至室温,用天平称量其质量为b1g。再次加热并冷却至室温称量其质量为b2g,若b1-b2=0.3g,则接下来还应进行的操作是

①溶解样品改用了硫酸,而不用盐酸,原因是
②选择的还原剂是否能用铁 (填“是”或“否”),原因是:
③若滴定用掉c mol/ L KMnO4溶液bmL,则样品中铁元素的质量分数是
您最近一年使用:0次
2016-12-09更新
|
626次组卷
|
6卷引用:2016届山西省晋中市四校高三上学期期中联考化学试卷
2016届山西省晋中市四校高三上学期期中联考化学试卷(已下线)2011届浙江省名校名师新编“百校联盟”交流高三联考(理综)化学部分(已下线)2011届浙江省杭州市长河高中高三市二测模考(理综)化学部分2016届四川省绵阳南山中学高三秋季零诊考试化学试卷2016届海南中学高三考前高考模拟十化学试卷2017届河北省石家庄市辛集中学高三上第一次阶段考试化学卷
8 . 二氧化氯(ClO2)是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水。工业上用潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得。某学生拟用下图所示的装置模拟制取并收集ClO2。
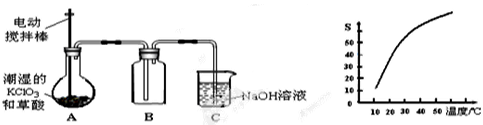
(1)B必须放在冰水浴中控制温度,其原因是________________________________ 。
(2)反应后在装置C中可得NaClO2溶液。已知NaClO2饱和溶液中在温度低于38℃时析出晶体是NaClO2·3H2O,在温度高于38℃时析出晶体是NaClO2。根据右上图所示的NaClO2溶解度曲线,请补充从NaClO2溶液中制NaClO2操作步骤:a______ ;b______ ;③洗涤;④干燥。
(3)亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业。它在碱性环境中稳定存在。某同学查阅资料后设计生产NaClO2的主要流程如下。

① Ⅱ中反应的离子方程式是_________________________ 。
② ClO2是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备。写出该反应化学方程式_______________________________________ 。
③ NaClO2变质可分解为NaClO3和NaCl。取等质量变质前后的NaClO2试样均配成溶液,分别与足量FeSO4溶液反应时,消耗Fe2+物质的量___________ 。(填“相同”,“不同”或“无法判断”)

(1)B必须放在冰水浴中控制温度,其原因是
(2)反应后在装置C中可得NaClO2溶液。已知NaClO2饱和溶液中在温度低于38℃时析出晶体是NaClO2·3H2O,在温度高于38℃时析出晶体是NaClO2。根据右上图所示的NaClO2溶解度曲线,请补充从NaClO2溶液中制NaClO2操作步骤:a
(3)亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业。它在碱性环境中稳定存在。某同学查阅资料后设计生产NaClO2的主要流程如下。

① Ⅱ中反应的离子方程式是
② ClO2是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备。写出该反应化学方程式
③ NaClO2变质可分解为NaClO3和NaCl。取等质量变质前后的NaClO2试样均配成溶液,分别与足量FeSO4溶液反应时,消耗Fe2+物质的量
您最近一年使用:0次
2016-12-09更新
|
328次组卷
|
3卷引用:2016届山西省晋中市四校高三上学期期中联考化学试卷
解题方法
9 . 铅及其化合物可用于蓄电池、耐酸设备及X射线防护材料等。回答下列问题:
(1)铅是碳的同族元素,比碳多4个电子层,铅在元素周期表的位置为_________________ ,Fe3O4可写成FeO·Fe2O3的形式,如果将Pb3O4也写成相对应的形式应为:______________
(2)PbO2与浓盐酸共热生成黄绿色气体,反应的化学方程式为___________________ 。PbO2可由PbO与次氯酸钠溶液反应制得,其反应的离子方程式为______________ 。
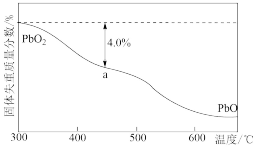
(3)PbO2在加热过程发生分解的失重曲线如右图所示,已知失重曲线上的a点为样品失重4.0%(即 ×100%)的残留固体,若a点固体组成表示为PbOx或mPbO2·nPbO,计算x值和m︰n
×100%)的残留固体,若a点固体组成表示为PbOx或mPbO2·nPbO,计算x值和m︰n_______________ ,____________ 。
(1)铅是碳的同族元素,比碳多4个电子层,铅在元素周期表的位置为
(2)PbO2与浓盐酸共热生成黄绿色气体,反应的化学方程式为

(3)PbO2在加热过程发生分解的失重曲线如右图所示,已知失重曲线上的a点为样品失重4.0%(即
 ×100%)的残留固体,若a点固体组成表示为PbOx或mPbO2·nPbO,计算x值和m︰n
×100%)的残留固体,若a点固体组成表示为PbOx或mPbO2·nPbO,计算x值和m︰n
您最近一年使用:0次
10 . 倡导“低碳经济”。降低大气中CO2的含量,有利于解决气候变暖的环境问题。
(1)工业上可用CO2来生产燃料甲醇。反应原理为:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H<0.
CH3OH(g)+H2O(g) △H<0.
一定温度下,在体积为2L的恒容密闭容器中,充入2molCO2和6molH2.一定条件下发生反应:测得CO2和CH3OH的浓度随时间变化如图所示。

①达到平衡时,CO2的转化率= 。
②从反应开始到平衡。氢气的平均反应速率V(H2)= mol/(L·min)。
③容器内的平衡压强与起始压强之比为 。
④保持容器容积不变,下列措施中能使平衡体系中n(CH3OH)/n(CO2)增大的是 。
⑤某同学依据甲醇燃烧的反应原理,设计如上图所示的电池装置,a、b均为惰性电极。使用时,空气从 口通入(填“A”或“B”):a极的电极反应式为 。
(2)将一定量的CO2气体通入NaOH溶液中,再向所得溶液中逐滴加入盐酸,边加边振荡至过量,产生的气体与HCl物质的量关系如上图所示(忽略气体的溶解和HCl的挥发)。请回答:O点溶液中溶质的化学式 ,a点溶液中各离子浓度由大到小的顺序是 。
(1)工业上可用CO2来生产燃料甲醇。反应原理为:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H<0.
CH3OH(g)+H2O(g) △H<0.一定温度下,在体积为2L的恒容密闭容器中,充入2molCO2和6molH2.一定条件下发生反应:测得CO2和CH3OH的浓度随时间变化如图所示。

①达到平衡时,CO2的转化率= 。
②从反应开始到平衡。氢气的平均反应速率V(H2)= mol/(L·min)。
③容器内的平衡压强与起始压强之比为 。
④保持容器容积不变,下列措施中能使平衡体系中n(CH3OH)/n(CO2)增大的是 。
| A.升高温度 | B.充入He(g),使体系压强增大 |
| C.将H2O(g)从体系中分离出来 | D.再充入1molCO2和3molH2 |
⑤某同学依据甲醇燃烧的反应原理,设计如上图所示的电池装置,a、b均为惰性电极。使用时,空气从 口通入(填“A”或“B”):a极的电极反应式为 。
(2)将一定量的CO2气体通入NaOH溶液中,再向所得溶液中逐滴加入盐酸,边加边振荡至过量,产生的气体与HCl物质的量关系如上图所示(忽略气体的溶解和HCl的挥发)。请回答:O点溶液中溶质的化学式 ,a点溶液中各离子浓度由大到小的顺序是 。
您最近一年使用:0次



