1 . 常温下,已知亚磷酸(H3PO3二元弱酸)溶液中含磷物种浓度之和为0.1mol·L-1,溶液中各含磷物种的pc与pOH关系如图所示(纵坐标数值上小下大,横坐标数值左小右大)。图中pc表示各含磷物种浓度的负对数(pc=-lgc),pOH对数[pOH=-lgc(OH-)]。x、y、z三点的坐标分别为x(7.3,1.3),y(10.0,3.6),z(12.6,1.3)。下列说法错误的是

A.H3PO3的结构简式为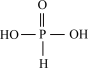 |
B.曲线①表示pc( )随pOH的变化 )随pOH的变化 |
C.H3PO3+HPO  2H2PO 2H2PO 的平衡常数K=1.0×106.3 的平衡常数K=1.0×106.3 |
D.pH=4的溶液中,c(H2PO )=0.1mol·L-1-2c(HPO )=0.1mol·L-1-2c(HPO ) ) |
您最近一年使用:0次
2 . 秦俑彩绘中含有难溶的铅白( )和黄色的
)和黄色的 。常温下,
。常温下, 和
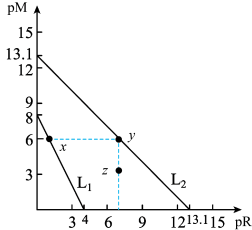
和 在不同的溶液中分别达到沉淀溶解平衡时pM与pR的关系如图所示,其中pM为阳离子浓度的负对数,pR为阴离子浓度的负对数。下列说法错误的是
在不同的溶液中分别达到沉淀溶解平衡时pM与pR的关系如图所示,其中pM为阳离子浓度的负对数,pR为阴离子浓度的负对数。下列说法错误的是
 )和黄色的
)和黄色的 。常温下,
。常温下, 和
和 在不同的溶液中分别达到沉淀溶解平衡时pM与pR的关系如图所示,其中pM为阳离子浓度的负对数,pR为阴离子浓度的负对数。下列说法错误的是
在不同的溶液中分别达到沉淀溶解平衡时pM与pR的关系如图所示,其中pM为阳离子浓度的负对数,pR为阴离子浓度的负对数。下列说法错误的是
A.完全沉淀废液中的 , , 的效果不如 的效果不如 |
B.z点,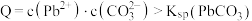 |
C.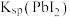 的数量级为 的数量级为 |
D. (s)转化为 (s)转化为 (s)的反应趋势很大 (s)的反应趋势很大 |
您最近一年使用:0次
2023-08-30更新
|
603次组卷
|
2卷引用:山西省朔州市怀仁市怀仁一中三校区2023-2024学年高三上学期第一次月考理综化学试题
3 . 当今世界多国相继规划了碳达峰、碳中和的时间节点,降低空气中二氧化碳含量成为研究热点。因此,研发二氧化碳的利用技术,将二氧化碳转化为能源是缓解环境和能源问题的方案之一、请回答下列问题:
Ⅰ. 耦合乙苯(
耦合乙苯( )脱氢制备苯乙烯(
)脱氢制备苯乙烯( )是综合利用
)是综合利用 的热点研究领域。制备苯乙烯涉及的主要反应如下:
的热点研究领域。制备苯乙烯涉及的主要反应如下:
i、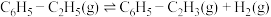

ii、

iii、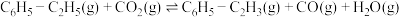
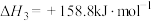
(1)
_____  。当反应达到平衡时,要提高
。当反应达到平衡时,要提高 的平衡产率,可采取的措施为
的平衡产率,可采取的措施为_____ (任写一种)。
(2)在某恒温恒容容器中发生 耦合乙苯(
耦合乙苯( )脱氢制备苯乙烯(
)脱氢制备苯乙烯( )的反应,下列能说明反应达到平衡的是_____(填标号)。
)的反应,下列能说明反应达到平衡的是_____(填标号)。
(3)恒压0.1MPa下,将原料气配比改为下列三种情况:只有 、
、 :
: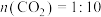 (对应曲线3)、
(对应曲线3)、 仅发生反应下i、ii,测得
仅发生反应下i、ii,测得 的平衡转化率与温度的变化关系如图1所示。
的平衡转化率与温度的变化关系如图1所示。
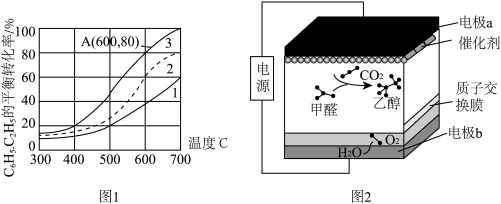
①图中表示原料气配比仅 的曲线是曲线
的曲线是曲线_____ (填“1”或“2”)。
②A点时, 的物质的量分数为0.01,该条件下反应i的
的物质的量分数为0.01,该条件下反应i的
_____ (分压=总压×物质的量分数)MPa.
Ⅱ.中科院化学所研究出了一种常温常压下通过电化学共还原 和甲醛进行偶联的方法,该方法能够同时实现甲醛的处理与
和甲醛进行偶联的方法,该方法能够同时实现甲醛的处理与 的高附加值转化,其工作原理如图2所示,总反应为
的高附加值转化,其工作原理如图2所示,总反应为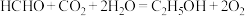 。
。
(4)电极b的电极反应式为_____ ,每生成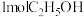 ,电路中转移的电子数为
,电路中转移的电子数为_____  。
。
Ⅰ.
 耦合乙苯(
耦合乙苯( )脱氢制备苯乙烯(
)脱氢制备苯乙烯( )是综合利用
)是综合利用 的热点研究领域。制备苯乙烯涉及的主要反应如下:
的热点研究领域。制备苯乙烯涉及的主要反应如下:i、
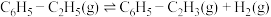

ii、


iii、
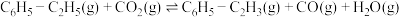
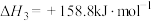
(1)

 。当反应达到平衡时,要提高
。当反应达到平衡时,要提高 的平衡产率,可采取的措施为
的平衡产率,可采取的措施为(2)在某恒温恒容容器中发生
 耦合乙苯(
耦合乙苯( )脱氢制备苯乙烯(
)脱氢制备苯乙烯( )的反应,下列能说明反应达到平衡的是_____(填标号)。
)的反应,下列能说明反应达到平衡的是_____(填标号)。| A.容器内压强不再发生变化 |
| B.CO的百分含量不再发生变化 |
| C.容器内混合气体的密度不再发生变化 |
D.每消耗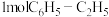 的同时生成 的同时生成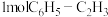 |
 、
、 :
: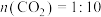 (对应曲线3)、
(对应曲线3)、 仅发生反应下i、ii,测得
仅发生反应下i、ii,测得 的平衡转化率与温度的变化关系如图1所示。
的平衡转化率与温度的变化关系如图1所示。
①图中表示原料气配比仅
 的曲线是曲线
的曲线是曲线②A点时,
 的物质的量分数为0.01,该条件下反应i的
的物质的量分数为0.01,该条件下反应i的
Ⅱ.中科院化学所研究出了一种常温常压下通过电化学共还原
 和甲醛进行偶联的方法,该方法能够同时实现甲醛的处理与
和甲醛进行偶联的方法,该方法能够同时实现甲醛的处理与 的高附加值转化,其工作原理如图2所示,总反应为
的高附加值转化,其工作原理如图2所示,总反应为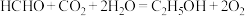 。
。(4)电极b的电极反应式为
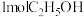 ,电路中转移的电子数为
,电路中转移的电子数为 。
。
您最近一年使用:0次
2023-06-29更新
|
304次组卷
|
3卷引用:山西省应县第一中学校2022-2023学年高二下学期7月期末考试化学试题
4 . 向200mL稀 与稀
与稀 的混合溶液中逐渐加入铁粉,假设加入铁粉的质量与产生气体的体积(标准状况下)之间的关系如图所示,且曲线中每一段只对应一个反应。下列说法错误的是
的混合溶液中逐渐加入铁粉,假设加入铁粉的质量与产生气体的体积(标准状况下)之间的关系如图所示,且曲线中每一段只对应一个反应。下列说法错误的是
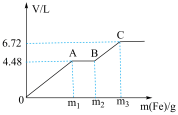
 与稀
与稀 的混合溶液中逐渐加入铁粉,假设加入铁粉的质量与产生气体的体积(标准状况下)之间的关系如图所示,且曲线中每一段只对应一个反应。下列说法错误的是
的混合溶液中逐渐加入铁粉,假设加入铁粉的质量与产生气体的体积(标准状况下)之间的关系如图所示,且曲线中每一段只对应一个反应。下列说法错误的是
A.混合溶液中 的物质的量浓度为1 mol/L 的物质的量浓度为1 mol/L |
| B.若向铜粉中加入100mL上述混合溶液,最多能溶解19.2g铜 |
C.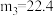 |
D.每一阶段反应转移电子数目之比为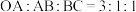 |
您最近一年使用:0次
解题方法
5 . 有甲、乙两位同学均想利用原电池反应检测金属的活动性顺序,两人均用镁片和铝片作电极,但甲同学将电极放入6 mol·L-1的H2SO4溶液中,乙同学将电极放入6 mol·L-1的NaOH溶液中,如图所示。
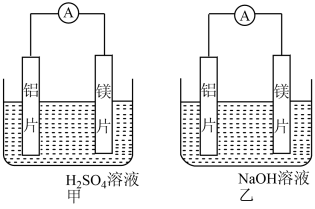
(1)写出甲中正极的电极反应式_____________________________ 。
(2)写出乙电池中总反应的离子方程式:___________________ 。
(3)如果甲与乙同学均认为“构成原电池的电极材料如果都是金属,则构成负极材料的金属应比构成正极材料的金属活泼”,则甲会判断出________ (填写元素符号,下同)的金属活动性更强,而乙会判断出________ 的金属活动性更强。
(4)由此实验,可得到如下哪些正确结论______
(5)上述实验也反过来证明了“直接利用金属活动性顺序判断原电池中的正、负极”这种做法_________ (填“可靠”或“不可靠”)。如不可靠,请你提出另一个判断原电池正、负极的可行实验___________ (如可靠,可不填写)。
(6)将5.1g镁铝合金溶于60mL 5.0 mol·L-1H2SO4溶液中,完全溶解后再加入65mL 10.0mol·L-1的NaOH溶液,得到沉淀的质量为9.7g,继续滴加NaOH溶液时沉淀会减少。
①当加入________ mL NaOH溶液时,可使溶解在硫酸的Mg2+和Al3+恰好完全沉淀。
②合金溶于硫酸时所产生的氢气在标准状况下的体积为________ L。

(1)写出甲中正极的电极反应式
(2)写出乙电池中总反应的离子方程式:
(3)如果甲与乙同学均认为“构成原电池的电极材料如果都是金属,则构成负极材料的金属应比构成正极材料的金属活泼”,则甲会判断出
(4)由此实验,可得到如下哪些正确结论
| A.利用原电池反应判断金属活动性顺序时应注意选择合适的介质 |
| B.镁的金属活动性不一定比铝的金属活动性强 |
| C.该实验说明金属活动性顺序表已过时,已没有使用价值 |
| D.该实验说明化学研究对象复杂、反应受条件影响较大,因此应具体问题具体分析 |
(5)上述实验也反过来证明了“直接利用金属活动性顺序判断原电池中的正、负极”这种做法
(6)将5.1g镁铝合金溶于60mL 5.0 mol·L-1H2SO4溶液中,完全溶解后再加入65mL 10.0mol·L-1的NaOH溶液,得到沉淀的质量为9.7g,继续滴加NaOH溶液时沉淀会减少。
①当加入
②合金溶于硫酸时所产生的氢气在标准状况下的体积为
您最近一年使用:0次
2019-01-30更新
|
701次组卷
|
2卷引用:2015-2016学年山西省怀仁一中高一下第三次月考化学试卷
真题
名校
6 . 用下图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液PH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法不正确的是
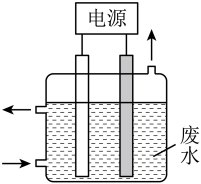

| A.用石墨作阳极,铁作阴极 |
| B.阳极的电极反应式为:Cl- + 2OH--2e-= ClO- + H2O |
| C.阴极的电极反应式为:2H2O + 2e- = H2↑ + 2OH- |
| D.除去CN-的反应:2CN-+ 5ClO- + 2H+ = N2↑ + 2CO2↑ + 5Cl-+ H2O |
您最近一年使用:0次
2019-01-30更新
|
5600次组卷
|
56卷引用:山西省怀仁县第一中学(两校区)2016-2017学年高二下学期期末考试化学试题
山西省怀仁县第一中学(两校区)2016-2017学年高二下学期期末考试化学试题2015年全国普通高等学校招生统一考试化学(四川卷)2016届湖南省浏阳第一中学高三上学期入学考试化学试卷2016届湖北省天门中学高三优录班8月月考化学试卷2016届福建省三明市第一中学高三上学期第二次月考化学试卷2015-2016学年辽宁省沈阳二中高二上12月月考化学试卷2016届河北省衡水市冀州中学高三上一轮复习检测二化学试卷2016届河南省三门峡市陕州中学高三上学期第二次精英对抗赛化学试卷2015-2016学年浙江省东阳中学高二上学期12月阶段测化学试卷2015-2016学年湖南省株洲二中高二上学期期末化学试卷2015-2016学年吉林大学附属中学高二上期末化学试卷2015-2016学年河北省石家庄一中高二上学期期末化学试卷2015-2016学年浙江省湖州中学高二上学期期中化学试卷浙江省宁波市效实中学2015-2016学年高一下期中化学卷2016届海南省农垦中学高三考前押题理综化学试卷2015-2016学年山东济宁微山一中高二下第二次月考化学试卷2016届河南省三门峡市灵宝三中高三上第四次质检化学试卷2017届湖北省孝感高级中学高三上9月调考化学试卷2017届湖北省沙市中学高三上学期第三次考试化学试卷2017届广西桂林十八中高三上10月月考化学试卷2016-2017学年辽宁省实验中学分校高二上期中化学卷2017届河北省冀州中学高三(高复班)上学期一轮检测(二)化学试卷2017届天津市红桥区高三上学期期末考试(下学期开学考试)化学试卷2018版化学(苏教版)高考总复习专题六对接高考精练--电解池、金属的腐蚀与防护安徽省淮北市第一中学2017-2018学年高二上学期第一次月考化学试题安徽省淮北市第一中学2017-2018学年高一上学期第一次月考(开学考)化学试题辽宁省实验中学分校2016-2017学年高二上学期期中考试化学试题福建省厦门双十中学2017-2018学年高二下学期期中考试化学试题鲁科版高二上学期化学选修一:检测题(三)【全国百强校】河北省衡水市武邑中学2018-2019学年高二上学期第一次月考化学试题(已下线)2019高考备考二轮复习精品资料-专题10 电化学及其应用(教学案)福建省晋江市南侨中学2019-2020学年高二上学期第一阶段考试化学试题黑龙江省哈尔滨市尚志市尚志中学2019-2020学年高二上学期第三次月考化学试题云南省丽江市宁蒗县第一中学2019—2020学年高二上学期期末考试化学试题2020年人教版高二化学选修4化学反应原理第4章《电化学基础》练习3-1广西桂林第十八中学2016届高三上学期第三次月考化学试题(已下线)专题十 化学能与电能(真题汇编)-2020年高考二轮模块化复习之《化学基本原理》名师讲案与提分特训黑龙江省绥化市安达市第七中学2019-2020学年高二下学期期中考试化学试题河北省石家庄市第二中学2020届高中毕业班四月份教学质量监测卷理科综合化学部分鲁科版(2019)选择性必修1 第1章 化学反应与能量转化 第3节 电能转化为化学能——电解人教版(2019)高二选择性必修第一册 第四章 化学反应与电能 第二节 电解池 教材帮北京市新学道临川学校2021届高三上学期第一次月考化学试题(已下线)第12单元 电化学基础(A卷 基础过关检测)-2021年高考化学一轮复习单元滚动双测卷四川省南充市阆中中学2020-2021学年高二上学期期中考试化学试题福建省福州市第十一中学2020-2021学年高二上学期期中质量检测化学试题(已下线)4.2.2 电解原理的应用(练习)-2020-2021学年上学期高二化学同步精品课堂(新教材人教版选择性必修1)吉林油田高级中学2019-2020学年高一下学期期末考试化学试题(已下线)练习3 电解池2020-2021学年【补习教材·寒假作业】高二化学(苏教版)湖北省沙洋县沙洋中学2020-2021学年高二12月月考化学试题上海市吴淞中学2021-2022学年高三上学期期中考试化学试题广东省华南师范大学附属中学2021-2022学年高三上学期1月模拟考试化学试题河南省南阳市六校2022-2023学年高二上学期第一次月考化学试题 广东省梅州市梅江区梅州中学2021-2022学年高三下学期开学模拟考试化学试题第4节 金属的腐蚀与防护作业(七) 电解原理的应用广东省江门市新会第一中学2023-2024学年高三下学期热身考试化学试题
名校
7 . 为了探究FeSO4和Cu(NO3)2的混合物中各组分的含量,现设计如下流程:

下列叙述中不正确 的是( )

下列叙述中
| A.n=0.02 | B.m=3.2 |
| C.V=2240 | D.原混合物中FeSO4的质量分数约为89% |
您最近一年使用:0次
2018-03-22更新
|
514次组卷
|
6卷引用:2016届山西怀仁第一中学高三上学期期中考试化学试卷
8 . 某铜矿主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物。实验室以此铜矿石为原料制备CuSO4·5H2O及CaCO3,部分步骤如下:
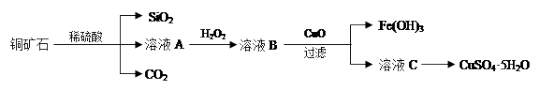
请回答下列问题:
(1)溶液A除含有Cu2+外,还可能含有的金属离子有________ (填离子符号);验证所含离子所用的试剂是在__________ 。
(2)可用生成的CO2制取优质碳酸钙。制备时,先向氯化钙溶液中通入氨气,再通入CO2。
①实验室通常采用加热氯化铵和氢氧化钙混合物的方法制取氨气。某学习小组选取下图所给部分装置制取并收集纯净的氨气。
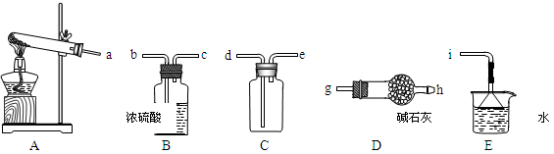
如果按气流方向连接各仪器接口,你认为正确的顺序为
a→_________ 、_________ →_________ 、_________ →i。
其中与i相连漏斗的作用是______________ 。
②为探究氨气和氯气的反应
a. 装置A、B,B装置内的药品依次是____________ 、____________ 。
b.装置C可用于探究氯气与氨气(已知氯气和氨气可发生反应:3Cl2+2NH3=N2+6HCl)的反应。实验打开开关1、3,关闭2,先向烧瓶中通入____________ ,然后关闭1、3,打开2,向烧瓶中缓缓通入一定量的另一种气体。实验一段时间后向烧瓶内出现浓厚的白烟并在容器内壁凝结。
(3)测定铜矿石中Cu2(OH)2CO3质量百分含量的方法是:
a.将1.25g铜矿石制取的CuSO4·5H2O于锥形瓶中,加入适量水完全溶解;
b.向溶液中加入100mL0.25mol/L的氢氧化钠溶液使Cu2+完全沉淀;
c.过滤;
d.滤液中的氢氧化钠溶液用0.5mol/L盐酸滴定至终点,耗用10mL盐酸。则铜矿石中Cu2(OH)2CO3质量分数为_____________ 。
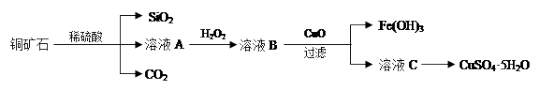
请回答下列问题:
(1)溶液A除含有Cu2+外,还可能含有的金属离子有
(2)可用生成的CO2制取优质碳酸钙。制备时,先向氯化钙溶液中通入氨气,再通入CO2。
①实验室通常采用加热氯化铵和氢氧化钙混合物的方法制取氨气。某学习小组选取下图所给部分装置制取并收集纯净的氨气。
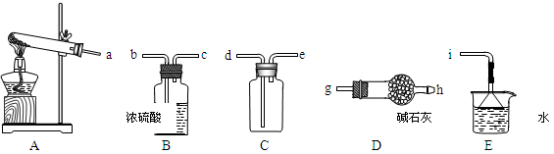
如果按气流方向连接各仪器接口,你认为正确的顺序为
a→
其中与i相连漏斗的作用是
②为探究氨气和氯气的反应
a. 装置A、B,B装置内的药品依次是
b.装置C可用于探究氯气与氨气(已知氯气和氨气可发生反应:3Cl2+2NH3=N2+6HCl)的反应。实验打开开关1、3,关闭2,先向烧瓶中通入

(3)测定铜矿石中Cu2(OH)2CO3质量百分含量的方法是:
a.将1.25g铜矿石制取的CuSO4·5H2O于锥形瓶中,加入适量水完全溶解;
b.向溶液中加入100mL0.25mol/L的氢氧化钠溶液使Cu2+完全沉淀;
c.过滤;
d.滤液中的氢氧化钠溶液用0.5mol/L盐酸滴定至终点,耗用10mL盐酸。则铜矿石中Cu2(OH)2CO3质量分数为
您最近一年使用:0次
9 . 实验室合成乙酸乙酯的步骤如下:在圆底烧瓶内加入乙醇、浓硫酸和乙酸,瓶口竖直安装通有冷却水的冷凝管(使反应混合物的蒸气冷凝为液体流回烧瓶内),加热回流一段时间后换成蒸馏装置进行蒸馏,(如下图所示)得到含有乙醇、乙酸和水的乙酸乙酯粗产品。
请回答下列问题:(已知:乙醇、乙酸、乙酸乙酯的沸点依次是78.4℃、118℃、77.1℃)
(1)在烧瓶中除了加入乙醇、浓硫酸和乙酸外,还应放入碎瓷片,目的是___ 。
(2)在烧瓶中加入一定比例的乙醇和浓硫酸的混合液的方法是:____________ 。
(3)在该实验中,若用1mol乙醇和1mol乙酸在浓硫酸作用下加热,充分反应,能够生成1mol乙酸乙酯?____________ ,原因是__________________________________ 。
(4)现拟分离含乙酸、乙醇和水的乙酸乙酯粗产品,下图是分离操作步骤流程图。请在图中圆括号内填入适当的试剂,在方括号内填入适当的分离方法。
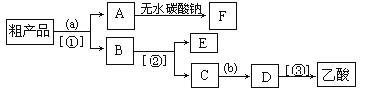
试剂a是____ ;试剂b是_____ ;分离方法①是______________ ,分离方法②是 _______ ,分离方法③是_______________ 。
(5)在得到的A中加入无水碳酸钠粉末,振荡,目的是_________________ 。
(6)写出C→D反应的化学方程式______ 。
请回答下列问题:(已知:乙醇、乙酸、乙酸乙酯的沸点依次是78.4℃、118℃、77.1℃)
(1)在烧瓶中除了加入乙醇、浓硫酸和乙酸外,还应放入碎瓷片,目的是
(2)在烧瓶中加入一定比例的乙醇和浓硫酸的混合液的方法是:
(3)在该实验中,若用1mol乙醇和1mol乙酸在浓硫酸作用下加热,充分反应,能够生成1mol乙酸乙酯?
(4)现拟分离含乙酸、乙醇和水的乙酸乙酯粗产品,下图是分离操作步骤流程图。请在图中圆括号内填入适当的试剂,在方括号内填入适当的分离方法。

试剂a是
(5)在得到的A中加入无水碳酸钠粉末,振荡,目的是
(6)写出C→D反应的化学方程式
您最近一年使用:0次
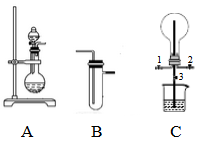
10 . 某实验小组欲探究SO2和Cl2能否发生反应,设计如下图所示的实验装置进行实验.

(1)图中仪器a的名称:___________ ;
(2)装置A中的反应为2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O,反应中的氧化剂是___________ ,生成71g Cl2转移的电子是________ mol.
(3)装置B中蘸有NaOH溶液的棉花的作用___________ ;
(4)打开A、C的装置a的活塞,一段时间后关闭活塞.待反应完全后,小组同学又继续如下实验.
①甲同学取适量B中溶液于试管中,向其中滴加少量AgNO3溶液,有白色沉淀生成.甲同学由此认为SO2和Cl2发生了反应,理由是该反应中生成了___________ (填离子符号)。
②乙同学认为甲同学的结论不合理,认为A中生成的Cl2中混有杂质,应该在装置A、B间增加一个洗气瓶,然后再按甲同学的方法即可得到正确结论。乙同学认为Cl2中混有的杂质是___________ ,洗气瓶中盛有试剂的名称是___________ ;
③丙同学则认为甲、乙两位同学的结论均不合理.丙同学取适量B中溶液于试管中,向其中滴加少量溶液X,有白色沉淀生成,则可得出结论,即SO2与Cl2同时通入水中,可以发生反应.溶液X是___________ (填选项序号)。
a.BaCl2溶液 b.Ba (OH)2溶液 c.Ba (NO3)2溶液 d.品红溶液
SO2与Cl2同时通入水中反应的化学方程式是___________ ;
(5)硫代硫酸钠(Na2S2O3)可替代NaOH溶液吸收氯气,已知25.0mL 0.1mol•L-1的Na2S2O3溶液恰好把标准状况下224mL Cl2完全转化为Cl-时,S2O 转化成
转化成___________ (填选项)
a.S2- b.S c.SO d.SO
d.SO

(1)图中仪器a的名称:
(2)装置A中的反应为2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O,反应中的氧化剂是
(3)装置B中蘸有NaOH溶液的棉花的作用
(4)打开A、C的装置a的活塞,一段时间后关闭活塞.待反应完全后,小组同学又继续如下实验.
①甲同学取适量B中溶液于试管中,向其中滴加少量AgNO3溶液,有白色沉淀生成.甲同学由此认为SO2和Cl2发生了反应,理由是该反应中生成了
②乙同学认为甲同学的结论不合理,认为A中生成的Cl2中混有杂质,应该在装置A、B间增加一个洗气瓶,然后再按甲同学的方法即可得到正确结论。乙同学认为Cl2中混有的杂质是
③丙同学则认为甲、乙两位同学的结论均不合理.丙同学取适量B中溶液于试管中,向其中滴加少量溶液X,有白色沉淀生成,则可得出结论,即SO2与Cl2同时通入水中,可以发生反应.溶液X是
a.BaCl2溶液 b.Ba (OH)2溶液 c.Ba (NO3)2溶液 d.品红溶液
SO2与Cl2同时通入水中反应的化学方程式是
(5)硫代硫酸钠(Na2S2O3)可替代NaOH溶液吸收氯气,已知25.0mL 0.1mol•L-1的Na2S2O3溶液恰好把标准状况下224mL Cl2完全转化为Cl-时,S2O
 转化成
转化成a.S2- b.S c.SO
 d.SO
d.SO
您最近一年使用:0次



