以湿法炼锌厂所产的钴锰渣(主要成分为 、
、 、
、 、
、 ,含少量
,含少量 、
、 、
、 、
、 等)为原料回收制备
等)为原料回收制备 的工艺如下:
的工艺如下: ,
,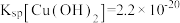 ,
,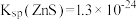 。
。
回答下列问题:
(1)“酸浸”时可能产生有毒气体_______ ,说出该气体的一种用途_______ 。
(2)“氧化调pH”过程中得到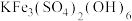 沉淀的离子方程式为
沉淀的离子方程式为_______ 。
(3)若 溶液的
溶液的 ,试分析
,试分析 主要以
主要以______ [填“ ”或“
”或“ ”]形式除去,通过计算说明你的理由
”]形式除去,通过计算说明你的理由______ 。
(4)“滤渣3”中含有S、 ,写出得到
,写出得到 的化学方程式
的化学方程式______ 。
(5)P5O4、P5O7对金属离子的萃取率与pH的关系如图所示。______ 。
②“萃余液2”中的主要成分为______ (填化学式),指出分离钴镍的合适pH范围为______ (填标号)。
A.3~4 B.4~5 C.5~6 D.6~7
 、
、 、
、 、
、 ,含少量
,含少量 、
、 、
、 、
、 等)为原料回收制备
等)为原料回收制备 的工艺如下:
的工艺如下: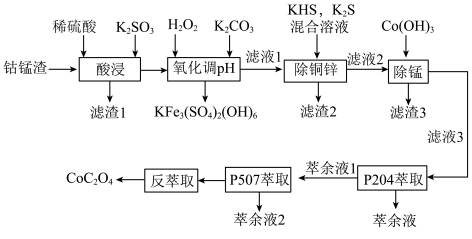
 ,
,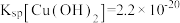 ,
,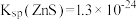 。
。回答下列问题:
(1)“酸浸”时可能产生有毒气体
(2)“氧化调pH”过程中得到
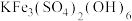 沉淀的离子方程式为
沉淀的离子方程式为(3)若
 溶液的
溶液的 ,试分析
,试分析 主要以
主要以 ”或“
”或“ ”]形式除去,通过计算说明你的理由
”]形式除去,通过计算说明你的理由(4)“滤渣3”中含有S、
 ,写出得到
,写出得到 的化学方程式
的化学方程式(5)P5O4、P5O7对金属离子的萃取率与pH的关系如图所示。
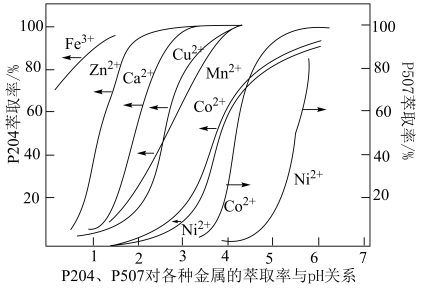
②“萃余液2”中的主要成分为
A.3~4 B.4~5 C.5~6 D.6~7
更新时间:2024-05-24 12:57:57
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐1】铊(Tl)在工业中的用途非常广泛,其中铊锡合金可作超导材料;铊镉合金是原子能工业中的重要材料。铊主要从铅精矿焙烧产生的富铊灰(主要成分PbO、ZnO、Fe2O3、FeO、Tl2O等)中提炼,具体工艺流程如图。

已知:萃取剂选用对铊有很高选择性的酰胺类萃取剂CH3CONR2的二乙苯溶液,萃取过程的反应原理为H++CH3CONR2+TlCl
 [CH3CONR2H]TlCl4。
[CH3CONR2H]TlCl4。
回答下列问题:
(1)“浸取”过程中为提高铊的浸取速率,可采取的措施有___________ (写出两条)。
(2)残渣的主要成分为___________ (填化学式);在实验室中,“萃取”和“反萃取”过程均必须使用的玻璃仪器的名称为___________ 。
(3)“反萃取”过程中发生反应的化学方程式为___________ 。
(4)“还原、氧化、沉淀”过程中生成TlCl,该反应的离子方程式为___________ 。
(5)流程中得到的“TlCl”需要用盐酸洗涤,用平衡原理解释与蒸馏水相比,盐酸洗涤的优点为___________ 。
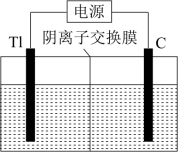
(6)电解Tl2SO4制备金属Tl的装置如图所示。阳极的电极反应式为___________ ;当转移1mole-时,左侧电极室中溶液的质量减少___________ g。

已知:萃取剂选用对铊有很高选择性的酰胺类萃取剂CH3CONR2的二乙苯溶液,萃取过程的反应原理为H++CH3CONR2+TlCl

 [CH3CONR2H]TlCl4。
[CH3CONR2H]TlCl4。回答下列问题:
(1)“浸取”过程中为提高铊的浸取速率,可采取的措施有
(2)残渣的主要成分为
(3)“反萃取”过程中发生反应的化学方程式为
(4)“还原、氧化、沉淀”过程中生成TlCl,该反应的离子方程式为
(5)流程中得到的“TlCl”需要用盐酸洗涤,用平衡原理解释与蒸馏水相比,盐酸洗涤的优点为
(6)电解Tl2SO4制备金属Tl的装置如图所示。阳极的电极反应式为

您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
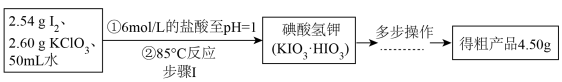
【推荐2】碘酸钙为白色固体,微溶于水,是一种无机精细与专用化学品,一种制备并测定六水合碘酸钙含量的实验设计如下。
几种盐的溶解度( 水)
水)
_______ 。步骤Ⅰ中有黄绿色气体产生,则制备 ;反应的化学方程式为
;反应的化学方程式为_______ 。
(2)下列说法正确的是_______。
(3)步骤Ⅰ中控制温度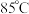 左右的原因是
左右的原因是_______ 。
多步操作有以下步骤,请选择合适的操作并排序完成实验_______ 。
将步骤Ⅰ反应后的溶液转入烧杯中,加入 溶液调节
溶液调节 干燥得到粗产品碘酸钙
干燥得到粗产品碘酸钙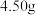
 冰水冷却
冰水冷却  滴加
滴加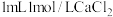 溶液
溶液  过滤
过滤  用冰水洗涤
用冰水洗涤
e.用乙醇和水混合液洗涤 .无水乙醇洗涤
.无水乙醇洗涤
(4)产品中碘酸钙晶体含量测定
①准确称取 粗产品,置于烧杯中,加入
粗产品,置于烧杯中,加入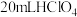 溶解样品,转移到
溶解样品,转移到 容量瓶中定容。量取
容量瓶中定容。量取 溶液于碘量瓶中,加入稍过量的
溶液于碘量瓶中,加入稍过量的 ,充分反应后,加入2滴淀粉溶液,然后用
,充分反应后,加入2滴淀粉溶液,然后用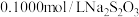 标准溶液滴定,滴定前读数为
标准溶液滴定,滴定前读数为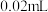 ,滴定终点读数为
,滴定终点读数为 。
。
②空白实验:不取产品,其余试剂用量和步骤相同,消耗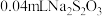 标准溶液。
标准溶液。
已知: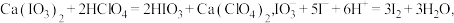
 。
。
碘酸钙晶体中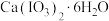 (相对分子质量为498)的纯度为
(相对分子质量为498)的纯度为_______ (计算结果保留两位小数)。该测定实验中,少了一个很关键的步骤是_______ 。
几种盐的溶解度(
 水)
水)温度 | 0 | 10 | 20 | 40 | 60 | 80 |
 | 4.60 | 6.27 | 8.08 | 12.6 | 18.3 | 24.8 |
 | 28.1 | 31.2 | 34.2 | 40.1 | 45.8 | 51.3 |
 | 59.5 | 64.7 | 74.5 | 128 | 137 | 147 |
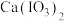 | 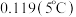 | 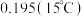 | 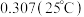 | 0.520 | 0.621 | 0.669 |
 ;反应的化学方程式为
;反应的化学方程式为(2)下列说法正确的是_______。
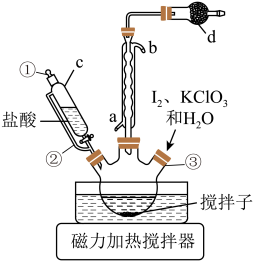
| A.步骤Ⅰ中滴加盐酸时,要先打开①,再打开② |
B.冷凝水从 口进, 口进, 口出 口出 |
C. 中可以装无水 中可以装无水 |
D.步骤Ⅰ中测 的操作:将③打开,用洁净的玻璃棒蘸取少量反应液,滴在 的操作:将③打开,用洁净的玻璃棒蘸取少量反应液,滴在 试纸中间,再和比色卡比色,读数 试纸中间,再和比色卡比色,读数 |
(3)步骤Ⅰ中控制温度
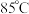 左右的原因是
左右的原因是多步操作有以下步骤,请选择合适的操作并排序完成实验
将步骤Ⅰ反应后的溶液转入烧杯中,加入
 溶液调节
溶液调节 干燥得到粗产品碘酸钙
干燥得到粗产品碘酸钙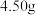
 冰水冷却
冰水冷却  滴加
滴加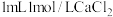 溶液
溶液  过滤
过滤  用冰水洗涤
用冰水洗涤e.用乙醇和水混合液洗涤
 .无水乙醇洗涤
.无水乙醇洗涤(4)产品中碘酸钙晶体含量测定
①准确称取
 粗产品,置于烧杯中,加入
粗产品,置于烧杯中,加入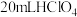 溶解样品,转移到
溶解样品,转移到 容量瓶中定容。量取
容量瓶中定容。量取 溶液于碘量瓶中,加入稍过量的
溶液于碘量瓶中,加入稍过量的 ,充分反应后,加入2滴淀粉溶液,然后用
,充分反应后,加入2滴淀粉溶液,然后用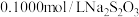 标准溶液滴定,滴定前读数为
标准溶液滴定,滴定前读数为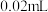 ,滴定终点读数为
,滴定终点读数为 。
。②空白实验:不取产品,其余试剂用量和步骤相同,消耗
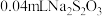 标准溶液。
标准溶液。已知:
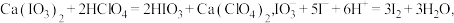
 。
。碘酸钙晶体中
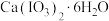 (相对分子质量为498)的纯度为
(相对分子质量为498)的纯度为
您最近一年使用:0次
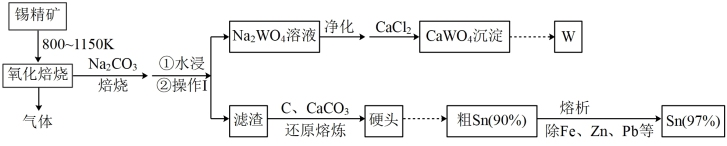
【推荐3】锡是一种质地较软的金属,可塑性强,能制成多种款式的产品。工业上常从锡矿中冶炼锡,其工艺流程如下:
已知:
I.锡精矿:含Sn40~70%,还含有W、S、Si、Cu、Pb、Fe、Zn等元素
II.滤渣的成分为:SnO2、Fe2O3、SiO2等
III.硬头:Sn 46%、Fe 44%等
按要求回答下列问题:
(1)Sn为50号元素,请写出Sn在元素周期表的位置_______ 。
(2)氧化焙烧产生的气体为_______ ,其可造成的环境污染是_______ 。
(3)加Na2CO3焙烧时,Na2CO3与WO3反应的化学方程式为_______ 。
(4)操作1的名称是_______ 。洗涤CaWO4沉淀,判断是否洗净的方法是_______ 。
(5)还原熔炼时,SnO2转化为Sn,同时还生成一种可燃性气体,写出该反应的化学方程式_______ 。
(6)“熔析”时吹入空气或水蒸气,使铁、锌、铅形成浮渣而上浮。Fe在高温时可与水蒸气反应,其化学方程式为_______ 。
(7)用含SnSiF6、H2SiF6、H2SO4的混合液作电解液电解精炼Sn时,粗锡作_______ 极。维持电流强度为10A,电解池工作五分钟,理论产生Sn_______ g(保留3位有效数字)。(已知:F=96500C/mol)

已知:
I.锡精矿:含Sn40~70%,还含有W、S、Si、Cu、Pb、Fe、Zn等元素
II.滤渣的成分为:SnO2、Fe2O3、SiO2等
III.硬头:Sn 46%、Fe 44%等
按要求回答下列问题:
(1)Sn为50号元素,请写出Sn在元素周期表的位置
(2)氧化焙烧产生的气体为
(3)加Na2CO3焙烧时,Na2CO3与WO3反应的化学方程式为
(4)操作1的名称是
(5)还原熔炼时,SnO2转化为Sn,同时还生成一种可燃性气体,写出该反应的化学方程式
(6)“熔析”时吹入空气或水蒸气,使铁、锌、铅形成浮渣而上浮。Fe在高温时可与水蒸气反应,其化学方程式为
(7)用含SnSiF6、H2SiF6、H2SO4的混合液作电解液电解精炼Sn时,粗锡作
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐1】钴在硬质高温合金、催化剂等高新技术领域有广泛应用。从某炼锌厂的废渣(含Zn、Co、Fe、ZnO、SiO2等)中回收钴的一种工艺流程如图:
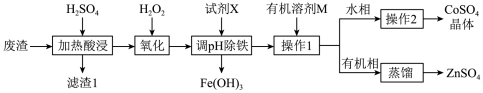
相关金属离子[Co(Mn+ )=0.1mol·L-1]形成氢氧化物沉淀的pH范围如表:
回答下列问题:
(1)滤渣1是_______ ,“加热酸浸”时为确保安全应注意_______ 。
(2)若无氧化步骤,对实验的影响是_______ 。试剂X可以为下列物质中的_______ 。
A. KOH B. Zn(OH)2 C. ZnO D. Na2CO3
(3)操作1的名称是_______ , 从流程信息分析,在有机溶剂M中_______ (填“ZnSO4”或“CoSO4”)溶解度更大。操作2是蒸发浓缩、冷却结晶、_______ 。
(4)工业上也可利用次氯酸钠氧化Co2+生成Co(OH)3沉淀,实现钴的回收。该反应的离子方程式是_______ ,若将次氯酸钠改为Na2S2O8(还原产物为SO ),则氧化剂与还原剂的物质的量之比为
),则氧化剂与还原剂的物质的量之比为_______ 。
(5)常温下,已知Co(OH)3的溶度积常数为Ksp,则Co3+完全沉淀时[c(Co3+)<10-5mol·L-1],溶液的pH至少为_______ (用含Ksp的式子表示)。

相关金属离子[Co(Mn+ )=0.1mol·L-1]形成氢氧化物沉淀的pH范围如表:
| 金属离子 | Co2+ | Fe2+ | Fe3+ | Zn2+ |
| 开始沉淀的pH | 7.15 | 6.3 | 1.5 | 6.2 |
| 沉淀完全的pH | 9.15 | 8.3 | 2.8 | 8.2 |
回答下列问题:
(1)滤渣1是
(2)若无氧化步骤,对实验的影响是
A. KOH B. Zn(OH)2 C. ZnO D. Na2CO3
(3)操作1的名称是
(4)工业上也可利用次氯酸钠氧化Co2+生成Co(OH)3沉淀,实现钴的回收。该反应的离子方程式是
 ),则氧化剂与还原剂的物质的量之比为
),则氧化剂与还原剂的物质的量之比为(5)常温下,已知Co(OH)3的溶度积常数为Ksp,则Co3+完全沉淀时[c(Co3+)<10-5mol·L-1],溶液的pH至少为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】钼(Mo)是一种过渡金属元素,它具有强度高、熔点高、耐腐蚀等优点,被广泛应用于钢铁、石油、化工、电气等领域。钼酸钠晶体(Na2MoO4·2H2O)是一种新型水处理剂。某化学兴趣小组利用废钼催化剂(主要成分为MoS2,含少量Cu2S,FeS2)回收Mo并制备钼酸钠晶体,其主要流程图如图所示:

回答下列问题:
(1)可以提高焙烧效率的措施有____________________________________ (填一条即可),MoS2中的钼元素在空气中焙烧,很容易被氧化成MoO3,若反应中生成0.1molMoO3,反应中转移电子的数目为____________ ;
(2)往固体1中加碳酸钠溶液发生反应的化学方程式为______________________________ ;
(3)操作2为______________________________ ;
(4)制备钼酸钠晶体还可用通过向精制的MoS2中直接加入次氯酸钠溶液与氢氧化钠溶液进行氧化的方法,若氧化过程中,还有硫酸钠生成,则反应的离子方程式为______________ ;
(5)已知钼酸钠溶液中c(MoO42-)=0.40mol•L-1,由钼酸钠溶液制备钼酸钠晶体时,需加入Ba(OH)2固体以除去CO32-,当BaMoO4开始沉淀时,CO32-的浓度为__________________ ;[已知:Ksp(BaCO3)=2.6×10-9,Ksp(BaMoO4)=4.0×10-8,忽略溶液的体积变化]
(6)锂和二硫化钼形成的二次电池的总反应为:xLi+nMoS2 Lix(MoS2)n[Lix(MoS2)n附着在电极上],则电池充电时阳极的电极反应式为
Lix(MoS2)n[Lix(MoS2)n附着在电极上],则电池充电时阳极的电极反应式为__________________________________ 。

回答下列问题:
(1)可以提高焙烧效率的措施有
(2)往固体1中加碳酸钠溶液发生反应的化学方程式为
(3)操作2为
(4)制备钼酸钠晶体还可用通过向精制的MoS2中直接加入次氯酸钠溶液与氢氧化钠溶液进行氧化的方法,若氧化过程中,还有硫酸钠生成,则反应的离子方程式为
(5)已知钼酸钠溶液中c(MoO42-)=0.40mol•L-1,由钼酸钠溶液制备钼酸钠晶体时,需加入Ba(OH)2固体以除去CO32-,当BaMoO4开始沉淀时,CO32-的浓度为
(6)锂和二硫化钼形成的二次电池的总反应为:xLi+nMoS2
 Lix(MoS2)n[Lix(MoS2)n附着在电极上],则电池充电时阳极的电极反应式为
Lix(MoS2)n[Lix(MoS2)n附着在电极上],则电池充电时阳极的电极反应式为
您最近一年使用:0次
【推荐3】金、银是生活中常见的贵金属,用途非常广泛。从某矿渣(主要成分为:AgCl、 、
、 、
、 )中获取高纯银的流程如图所示:
)中获取高纯银的流程如图所示:

已知: ,
,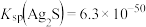 .
.
(1)“预处理”前需先将矿渣粉碎制浆的原因是_______ ;加入 溶液将
溶液将 转化为AgCl,该反应的化学方程式为
转化为AgCl,该反应的化学方程式为_______ .
(2)“分银”时AgCl与 反应生成
反应生成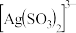 的离子方程式为
的离子方程式为_______ ,该反应的平衡常数
_______ 。(已知: ,
, )
)
(3)“分银渣”主要成分为 、
、 、
、_______ (填化学式)。
(4)“分银”时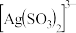 的浓度与溶液pH的关系如图1;
的浓度与溶液pH的关系如图1; 及其与
及其与 形成的微粒的浓度分数
形成的微粒的浓度分数 随溶液pH变化的关系如图2。
随溶液pH变化的关系如图2。

①“分银”pH应控制在_______ 范围。
②“沉银”时的终点pH需控制在3.5~5.5范围内,不能过低的原因是_______ .
 、
、 、
、 )中获取高纯银的流程如图所示:
)中获取高纯银的流程如图所示:
已知:
 ,
,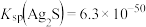 .
.(1)“预处理”前需先将矿渣粉碎制浆的原因是
 溶液将
溶液将 转化为AgCl,该反应的化学方程式为
转化为AgCl,该反应的化学方程式为(2)“分银”时AgCl与
 反应生成
反应生成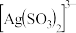 的离子方程式为
的离子方程式为
 ,
, )
)(3)“分银渣”主要成分为
 、
、 、
、(4)“分银”时
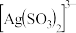 的浓度与溶液pH的关系如图1;
的浓度与溶液pH的关系如图1; 及其与
及其与 形成的微粒的浓度分数
形成的微粒的浓度分数 随溶液pH变化的关系如图2。
随溶液pH变化的关系如图2。
①“分银”pH应控制在
②“沉银”时的终点pH需控制在3.5~5.5范围内,不能过低的原因是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐1】以镁铝复合氧化物(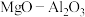 )为载体的负载型镍铜双金属催化剂(
)为载体的负载型镍铜双金属催化剂(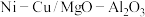 )是一种新型高效加氢或脱氢催化剂,其制备流程如下:
)是一种新型高效加氢或脱氢催化剂,其制备流程如下:
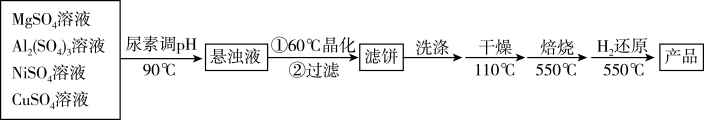
回答下列问题:
(1)在加热条件下,尿素 在水中发生非氧化还原反应,放出
在水中发生非氧化还原反应,放出_______ 和_______ 两种气体(写化学式)。
(2)“晶化”过程中,需保持恒温60℃,可采用的加热方式为_______ 。
(3)“洗涤”过程中,检验滤饼是否洗净的方法是_______ 。
(4)“还原”过程中所发生反应的化学方程式为_______ 。
(5) 溶液在强碱溶液中被NaClO氧化可得NiOOH沉淀,请写出对应离子方程式
溶液在强碱溶液中被NaClO氧化可得NiOOH沉淀,请写出对应离子方程式____ 。
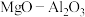 )为载体的负载型镍铜双金属催化剂(
)为载体的负载型镍铜双金属催化剂(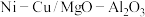 )是一种新型高效加氢或脱氢催化剂,其制备流程如下:
)是一种新型高效加氢或脱氢催化剂,其制备流程如下:
回答下列问题:
(1)在加热条件下,尿素
 在水中发生非氧化还原反应,放出
在水中发生非氧化还原反应,放出(2)“晶化”过程中,需保持恒温60℃,可采用的加热方式为
(3)“洗涤”过程中,检验滤饼是否洗净的方法是
(4)“还原”过程中所发生反应的化学方程式为
(5)
 溶液在强碱溶液中被NaClO氧化可得NiOOH沉淀,请写出对应离子方程式
溶液在强碱溶液中被NaClO氧化可得NiOOH沉淀,请写出对应离子方程式
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】醋酸镍[(CH3COO)2Ni]是一种重要的化工原料。一种以含镍废料(含NiS、Al2O3、FeO、CaO、SiO2)为原料,制取醋酸镍的工艺流程图如下:
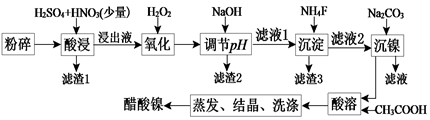
相关离子生成氢氧化物的pH和相关物质的溶解性如下表:
(1)将粉碎的含镍废料酸浸时要不断搅拌,粉碎和搅拌的目的是________________ 。
(2)调节pH步骤中,溶液pH的调节范围是__________________________________ 。
(3)滤渣1和滤渣3主要成分的化学式分别是________________ ,_____________ 。
(4)氧化步骤中加入H2O2发生反应的离子方程式为____________________________ 。
(5)酸浸过程中,lmol NiS失去6NA个电子,同时生成两种无色有毒气体。该反应的化学方程式为____________________ 。
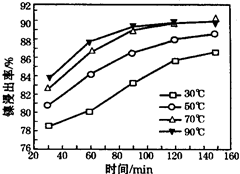
(6)保持其他条件不变,在不同温度下对含镍废料进行酸浸,镍浸出率随时间变化如右图。酸浸的最佳温度与时间分别为:_______ ℃、_______ min。
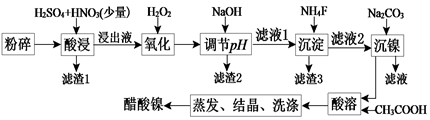
相关离子生成氢氧化物的pH和相关物质的溶解性如下表:
| 金属离子 | 开始沉淀pH | 沉淀完全pH | 物质 | 20℃溶解性(H2O) | |
| Fe3+ | 1.1 | 3.2 | CaSO4 | 微溶 | |
| Fe2+ | 5.8 | 8.8 | NiF2 | 可溶 | |
| Al3+ | 3.0 | 5.0 | CaF2 | 难溶 | |
| Ni2+ | 6.7 | 9.5 | NiCO3 | Ksp=9.6×10-6 |
(2)调节pH步骤中,溶液pH的调节范围是
(3)滤渣1和滤渣3主要成分的化学式分别是

(4)氧化步骤中加入H2O2发生反应的离子方程式为
(5)酸浸过程中,lmol NiS失去6NA个电子,同时生成两种无色有毒气体。该反应的化学方程式为
(6)保持其他条件不变,在不同温度下对含镍废料进行酸浸,镍浸出率随时间变化如右图。酸浸的最佳温度与时间分别为:
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】硼镁泥是硼镁矿生产硼砂(Na2B4O7·l0H2O)时的废渣,其主要成分是MgO,还含有CaO、Al2O3、Fe2O3、FeO、MnO、B2O3、SiO2等杂质。以硼镁泥为原料制取的七水硫酸镁在印染、造纸和医药等工业上都有广泛的应用。硼镁泥制取七水硫酸镁的工艺流程如图:
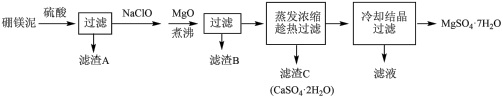
(1)滤渣A的主要成分是___ 。
(2)滤渣B中含有不溶于稀盐酸的黑色固体,则滤渣B含有的成分有___ ,加MgO并煮沸的目的是___ 。
(3)写出加NaClO过程中锰元素发生反应的离子方程式___ 。
(4)趁热过滤的目的是___ 。
(5)因B2O3溶于硫酸,所以此法制备的七水硫酸镁含有少量硼酸(H3BO3),硼酸与NaOH溶液反应可制得硼砂,写出该反应的化学方程式___ 。失去结晶水的硼砂与金属钠、氢气及石英砂一起反应可制备有机化学中的“万能还原剂-NaBH4”和另一种钠盐,写出其反应的化学方程式___ 。

(1)滤渣A的主要成分是
(2)滤渣B中含有不溶于稀盐酸的黑色固体,则滤渣B含有的成分有
(3)写出加NaClO过程中锰元素发生反应的离子方程式
(4)趁热过滤的目的是
(5)因B2O3溶于硫酸,所以此法制备的七水硫酸镁含有少量硼酸(H3BO3),硼酸与NaOH溶液反应可制得硼砂,写出该反应的化学方程式
您最近一年使用:0次



