钼(Mo)是一种过渡金属元素,它具有强度高、熔点高、耐腐蚀等优点,被广泛应用于钢铁、石油、化工、电气等领域。钼酸钠晶体(Na2MoO4·2H2O)是一种新型水处理剂。某化学兴趣小组利用废钼催化剂(主要成分为MoS2,含少量Cu2S,FeS2)回收Mo并制备钼酸钠晶体,其主要流程图如图所示:

回答下列问题:
(1)可以提高焙烧效率的措施有____________________________________ (填一条即可),MoS2中的钼元素在空气中焙烧,很容易被氧化成MoO3,若反应中生成0.1molMoO3,反应中转移电子的数目为____________ ;
(2)往固体1中加碳酸钠溶液发生反应的化学方程式为______________________________ ;
(3)操作2为______________________________ ;
(4)制备钼酸钠晶体还可用通过向精制的MoS2中直接加入次氯酸钠溶液与氢氧化钠溶液进行氧化的方法,若氧化过程中,还有硫酸钠生成,则反应的离子方程式为______________ ;
(5)已知钼酸钠溶液中c(MoO42-)=0.40mol•L-1,由钼酸钠溶液制备钼酸钠晶体时,需加入Ba(OH)2固体以除去CO32-,当BaMoO4开始沉淀时,CO32-的浓度为__________________ ;[已知:Ksp(BaCO3)=2.6×10-9,Ksp(BaMoO4)=4.0×10-8,忽略溶液的体积变化]
(6)锂和二硫化钼形成的二次电池的总反应为:xLi+nMoS2 Lix(MoS2)n[Lix(MoS2)n附着在电极上],则电池充电时阳极的电极反应式为
Lix(MoS2)n[Lix(MoS2)n附着在电极上],则电池充电时阳极的电极反应式为__________________________________ 。

回答下列问题:
(1)可以提高焙烧效率的措施有
(2)往固体1中加碳酸钠溶液发生反应的化学方程式为
(3)操作2为
(4)制备钼酸钠晶体还可用通过向精制的MoS2中直接加入次氯酸钠溶液与氢氧化钠溶液进行氧化的方法,若氧化过程中,还有硫酸钠生成,则反应的离子方程式为
(5)已知钼酸钠溶液中c(MoO42-)=0.40mol•L-1,由钼酸钠溶液制备钼酸钠晶体时,需加入Ba(OH)2固体以除去CO32-,当BaMoO4开始沉淀时,CO32-的浓度为
(6)锂和二硫化钼形成的二次电池的总反应为:xLi+nMoS2
 Lix(MoS2)n[Lix(MoS2)n附着在电极上],则电池充电时阳极的电极反应式为
Lix(MoS2)n[Lix(MoS2)n附着在电极上],则电池充电时阳极的电极反应式为
更新时间:2018/05/06 11:05:40
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】铬及其化合物在催化、金属防腐等方面具有重要应用。
(1)催化剂 可由
可由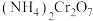 加热分解制备,反应同时生成无污染气体。
加热分解制备,反应同时生成无污染气体。
①完成化学方程式: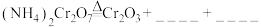 。
。______
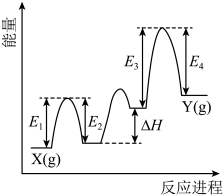
②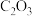 催化丙烷脱氢过程中,部分反应历程如图,
催化丙烷脱氢过程中,部分反应历程如图, 过程的焓变为
过程的焓变为_______ (列式表示)。
③ 可用于
可用于 的催化氧化。设计从
的催化氧化。设计从 出发经过3步反应制备
出发经过3步反应制备 的路线
的路线_______ (用“→”表示含氮物质间的转化,例如 ,并在箭头上标注其他反应物):其中一个有颜色变化的反应的化学方程式为
,并在箭头上标注其他反应物):其中一个有颜色变化的反应的化学方程式为_______ 。
(2) 溶液中存在多个平衡。本题条件下仅需考虑如下平衡:
溶液中存在多个平衡。本题条件下仅需考虑如下平衡:
(ⅰ) Cr2O (aq)+H2O(l)
(aq)+H2O(l) 2HCrO
2HCrO (aq)
(aq)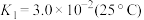
(ⅱ) HCr O (aq)
(aq)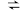 Cr O
Cr O (aq)+H+(aq)
(aq)+H+(aq)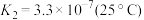
①下列有关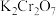 溶液的说法正确的有
溶液的说法正确的有________
A.加入少量硫酸,溶液的 不变
不变
B.加入少量水稀释,溶液中离子总数增加
C.加入少量 溶液,反应(ⅰ)的平衡逆向移动
溶液,反应(ⅰ)的平衡逆向移动
D.加入少量 固体,平衡时
固体,平衡时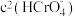 与
与 的比值保持不变
的比值保持不变
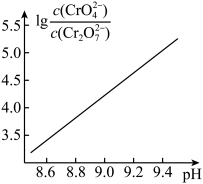
② 时,
时,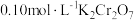 ,溶液中
,溶液中 随
随 的变化关系如图。当
的变化关系如图。当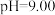 时,设
时,设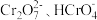 与
与 的平衡浓度分别为
的平衡浓度分别为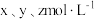 ,则x、y、z之间的关系式为
,则x、y、z之间的关系式为_______ =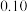 。
。
(1)催化剂
 可由
可由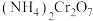 加热分解制备,反应同时生成无污染气体。
加热分解制备,反应同时生成无污染气体。①完成化学方程式:
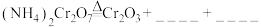 。
。②
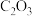 催化丙烷脱氢过程中,部分反应历程如图,
催化丙烷脱氢过程中,部分反应历程如图, 过程的焓变为
过程的焓变为
③
 可用于
可用于 的催化氧化。设计从
的催化氧化。设计从 出发经过3步反应制备
出发经过3步反应制备 的路线
的路线 ,并在箭头上标注其他反应物):其中一个有颜色变化的反应的化学方程式为
,并在箭头上标注其他反应物):其中一个有颜色变化的反应的化学方程式为(2)
 溶液中存在多个平衡。本题条件下仅需考虑如下平衡:
溶液中存在多个平衡。本题条件下仅需考虑如下平衡:(ⅰ) Cr2O
 (aq)+H2O(l)
(aq)+H2O(l) 2HCrO
2HCrO (aq)
(aq)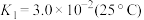
(ⅱ) HCr O
 (aq)
(aq)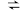 Cr O
Cr O (aq)+H+(aq)
(aq)+H+(aq)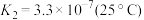
①下列有关
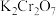 溶液的说法正确的有
溶液的说法正确的有A.加入少量硫酸,溶液的
 不变
不变B.加入少量水稀释,溶液中离子总数增加
C.加入少量
 溶液,反应(ⅰ)的平衡逆向移动
溶液,反应(ⅰ)的平衡逆向移动D.加入少量
 固体,平衡时
固体,平衡时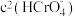 与
与 的比值保持不变
的比值保持不变②
 时,
时,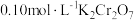 ,溶液中
,溶液中 随
随 的变化关系如图。当
的变化关系如图。当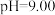 时,设
时,设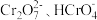 与
与 的平衡浓度分别为
的平衡浓度分别为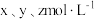 ,则x、y、z之间的关系式为
,则x、y、z之间的关系式为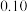 。
。
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐2】某厂利用富锗ZnO烟尘(还含有CuO、CaO、PbO2、FeO、MnO2等)生产锗精矿和碱式碳酸锌[Zn2(OH)2CO3]。其流程如图:

已知:Ⅰ.酸浸时,锰与铅元素被还原为+2价,锗以Ge4+存在。
Ⅱ.25℃:Ksp[Fe(OH)3]=4×10-38、Ksp[Zn(OH)2]=1.2×10-17。
请回答下列问题:
(1)基态Zn2+的价层电子排布式______ 。
(2)浸渣①主要含有______ ;酸浸中PbO2与98%H2SO4反应的化学方程式为______ 。
(3)流程中,“Ⅰ”加入Zn粉主要是为了置换______ (填离子符号);常温下,“Ⅱ”控制pH最高为______ (溶液中金属离子浓度均按0.12mol•L-1计算)。
(4)沉锌的离子方程式为______ 。
(5)若ZnS晶胞沿体对角线方向投影,所得的原子投影外围图形为正六边形,如图乙所示,请用“ ”在图乙中标出晶胞中4个Zn原子的投影位置
”在图乙中标出晶胞中4个Zn原子的投影位置______ ;设晶胞中S离子与其最近的Zn离子的距离为dnm,其密度为ρg•cm-3,阿伏加德罗常数NA为______ (用含d、ρ的式子表示)。


已知:Ⅰ.酸浸时,锰与铅元素被还原为+2价,锗以Ge4+存在。
Ⅱ.25℃:Ksp[Fe(OH)3]=4×10-38、Ksp[Zn(OH)2]=1.2×10-17。
请回答下列问题:
(1)基态Zn2+的价层电子排布式
(2)浸渣①主要含有
(3)流程中,“Ⅰ”加入Zn粉主要是为了置换
(4)沉锌的离子方程式为
(5)若ZnS晶胞沿体对角线方向投影,所得的原子投影外围图形为正六边形,如图乙所示,请用“
 ”在图乙中标出晶胞中4个Zn原子的投影位置
”在图乙中标出晶胞中4个Zn原子的投影位置
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】工业上常用添加Fe2+EDTA的溶液处理氮氧化物。某实验小组欲探究60 ℃下,20 mmol·L-1 Fe2+EDTA溶液脱除NO的能力
Ⅰ.NO的吸收。取250 mL 20 mmol·L-1 Fe2+EDTA溶液于三颈烧瓶中,按如图所示连接仪器。

(1)装置A中盛放浓硝酸的仪器名称为___________ ,导管m的作用为___________
(2)滴加浓硝酸前,需要先打开K,通入一段时间氮气,目的为___________
(3)对C装置采用的合适加热方式是___________
(4)装置D中酸性KMnO4溶液可将NO氧化为NO ,发生反应的离子方程式为
,发生反应的离子方程式为___________
Ⅱ.NO吸收效果的检测。实验步骤如下:
a.取装置C中的吸收液100 mL,加入H2O2溶液,将Fe2+EDTA吸收液络合的NO及Fe2+氧化为NO 及Fe3+,微热使剩余的H2O2完全分解
及Fe3+,微热使剩余的H2O2完全分解
b.在酸性环境下,向其中加入V1 mL物质的量浓度为c1 mol·L-1的Fe2+(足量),将NO 转化为NO
转化为NO
c.用c2 mol·L-1K2Cr2O7标准液滴定b中溶液至终点,消耗标准液V2 mL
(5)Fe2+EDTA吸收液的吸收能力为___________ g(用含字母的代数式表示)NO/100 mL吸收液
(6)若步骤c滴定终点时俯视读数,则测定结果将___________ (填“偏高”“偏低”或“不变”)
Ⅰ.NO的吸收。取250 mL 20 mmol·L-1 Fe2+EDTA溶液于三颈烧瓶中,按如图所示连接仪器。

(1)装置A中盛放浓硝酸的仪器名称为
(2)滴加浓硝酸前,需要先打开K,通入一段时间氮气,目的为
(3)对C装置采用的合适加热方式是
(4)装置D中酸性KMnO4溶液可将NO氧化为NO
 ,发生反应的离子方程式为
,发生反应的离子方程式为Ⅱ.NO吸收效果的检测。实验步骤如下:
a.取装置C中的吸收液100 mL,加入H2O2溶液,将Fe2+EDTA吸收液络合的NO及Fe2+氧化为NO
 及Fe3+,微热使剩余的H2O2完全分解
及Fe3+,微热使剩余的H2O2完全分解b.在酸性环境下,向其中加入V1 mL物质的量浓度为c1 mol·L-1的Fe2+(足量),将NO
 转化为NO
转化为NOc.用c2 mol·L-1K2Cr2O7标准液滴定b中溶液至终点,消耗标准液V2 mL
(5)Fe2+EDTA吸收液的吸收能力为
(6)若步骤c滴定终点时俯视读数,则测定结果将
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐1】以铬铁矿(主要成分为FeO和Cr2O3,含有Al2O3、SiO2等杂质)为主要原料生产化工原料红矾钠(主要成分为Na2Cr2O7·2H2O),其主要工艺流程如图:

查阅资料得知:
ⅰ.Cr2O3可溶于硫酸得到Cr3+;常温下,NaBiO3不溶于水,有强氧化性,在碱性条件下,能将Cr3+转化为CrO 。
。
ⅱ.
回答下列问题:
(1)反应之前先将矿石粉碎的目的是_______ 。
(2)步骤③加的试剂为_______ ,此时溶液pH要调到4.9~5的目的_______ 。
(3)已知:Ksp[Fe(OH)3]=4.0×10-38。则当调节溶液的pH=3时,溶液中的c(Fe3+)=_______ mol/L 。
(4)配平并补充完成反应④的离子反应方程式:______ 。
_______NaBiO3 + _______Cr3+ + 7OH- + H2O=_______Bi(OH)3+_______CrO +_______Na+
+_______Na+
(5)⑤中酸化是使CrO 转化为Cr2O
转化为Cr2O ,写出该反应的离子方程式:
,写出该反应的离子方程式:_______ 。
(6)将溶液H经过蒸发浓缩、冷却结晶、过滤、洗涤、干燥即得红矾钠粗晶体,精制红矾钠粗晶体需要采用的操作是_______ (填操作名称)。

查阅资料得知:
ⅰ.Cr2O3可溶于硫酸得到Cr3+;常温下,NaBiO3不溶于水,有强氧化性,在碱性条件下,能将Cr3+转化为CrO
 。
。ⅱ.
| 金属离子 | Fe3+ | Al3+ | Cr3+ | Fe2+ | Bi3+ |
| 开始沉淀的pH | 2.7 | 3.4 | 5.0 | 7.5 | 0.7 |
| 沉淀完全的pH | 3.7 | 4.9 | 5.9 | 9.7 | 4.5 |
回答下列问题:
(1)反应之前先将矿石粉碎的目的是
(2)步骤③加的试剂为
(3)已知:Ksp[Fe(OH)3]=4.0×10-38。则当调节溶液的pH=3时,溶液中的c(Fe3+)=
(4)配平并补充完成反应④的离子反应方程式:
_______NaBiO3 + _______Cr3+ + 7OH- + H2O=_______Bi(OH)3+_______CrO
 +_______Na+
+_______Na+(5)⑤中酸化是使CrO
 转化为Cr2O
转化为Cr2O ,写出该反应的离子方程式:
,写出该反应的离子方程式:(6)将溶液H经过蒸发浓缩、冷却结晶、过滤、洗涤、干燥即得红矾钠粗晶体,精制红矾钠粗晶体需要采用的操作是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】以含钛高炉渣(主要成分为TiO2,还含有少量CaO、Fe2O3、SiO2)为原料生产BaTiO3的工艺流程如下:
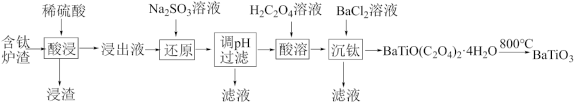
相关金属离子c(Mn+)=0.1mol·L-1时,形成氢氧化物沉淀的pH范围如下:
(1)“浸渣”的成分为___________ 。
(2)为了提高“酸浸”的浸取率,可采取的措施为___________ 。(任写一条)
(3)写出加入Na2SO3还原的方程式:___________ 。
(4)“调pH”的范围是___________ 。
(5)过滤得到BaTiO(C2O4)2·4H2O需要经过洗涤、减压烘干,检验沉淀是否洗净的方法是___________ 。(Ag2C2O4、BaC2O4、CaC2O4·H2O的溶度积分别为5.4×10-12、1.6×10-7、4×10-9)。
(6)隔绝空气条件下,BaTiO(C2O4)2·4H2O在800℃灼烧得到BaTiO3。
①灼烧在实验室所使用的陶瓷仪器为:___________ 。
②该反应的化学方程式为:___________ 。

相关金属离子c(Mn+)=0.1mol·L-1时,形成氢氧化物沉淀的pH范围如下:
| 金属离子 |  |  |  |
| 开始沉淀的pH | 0.5 | 6.3 | 1.5 |
| 沉淀完全的pH | 2.5 | 8.3 | 2.8 |
(2)为了提高“酸浸”的浸取率,可采取的措施为
(3)写出加入Na2SO3还原的方程式:
(4)“调pH”的范围是
(5)过滤得到BaTiO(C2O4)2·4H2O需要经过洗涤、减压烘干,检验沉淀是否洗净的方法是
(6)隔绝空气条件下,BaTiO(C2O4)2·4H2O在800℃灼烧得到BaTiO3。
①灼烧在实验室所使用的陶瓷仪器为:
②该反应的化学方程式为:
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】某硫酸工厂的酸性废水中砷(As)元素含量极高,为控制砷的排放,可采用化学沉降法处理含砷废水,相关数据如下表。请回答以下问题:
表1几种盐的Ksp
表2工厂污染物排放浓度及允许排放标准
(1)该硫酸工厂排放的废水中硫酸的物质的量浓度c(H2SO4)=___ mol•L-1。
(2)若酸性废水中Fe3+的浓度为1.0×10-4mol•L-1,则c(AsO )=
)=___ mol•L-1。
(3)工厂排放出的酸性废水中的三价砷(弱酸H3AsO3)不易沉降,可投入MnO2先将其氧化成五价砷(弱酸H3AsO4),此时MnO2被还原为Mn2+,该反应的离子方程式为____ 。
(4)在处理含砷废水时采用分段式,先向废水中投入生石灰调节pH到2,再投入生石灰将pH调节到8左右,使五价砷以Ca3(AsO4)2的形式沉降。
①将pH调节到2时废水中有大量沉淀产生,沉淀主要成分的化学式为____ 。
②Ca3(AsO4)2在pH调节到8左右才开始沉淀,原因为__ 。
③砷酸(H3AsO4)分步电离的平衡常数(25℃)为Ka1=5.6×10-3,Ka2=1.7×10-7,Ka3=4.0×10-12,第三步电离的平衡常数表达式为Ka3=____ ,Na3AsO4第一步水解的离子方程式为AsO +H2O
+H2O HAsO
HAsO +OH-,该步水解的平衡常数(25℃)为
+OH-,该步水解的平衡常数(25℃)为___ 。
表1几种盐的Ksp
| 难溶物 | Ksp |
| Ca3(AsO4)2 | 6.8×10-19 |
| CaSO4 | 4.9×10-5 |
| FeAsO4 | 5.7×10-21 |
表2工厂污染物排放浓度及允许排放标准
| 污染物 | H2SO4 | As |
| 废水浓度 | 29.4g•L-1 | 1.6g•L-1 |
| 排放标准 | pH=6~9 | 0.5mg•L-1 |
(1)该硫酸工厂排放的废水中硫酸的物质的量浓度c(H2SO4)=
(2)若酸性废水中Fe3+的浓度为1.0×10-4mol•L-1,则c(AsO
 )=
)=(3)工厂排放出的酸性废水中的三价砷(弱酸H3AsO3)不易沉降,可投入MnO2先将其氧化成五价砷(弱酸H3AsO4),此时MnO2被还原为Mn2+,该反应的离子方程式为
(4)在处理含砷废水时采用分段式,先向废水中投入生石灰调节pH到2,再投入生石灰将pH调节到8左右,使五价砷以Ca3(AsO4)2的形式沉降。
①将pH调节到2时废水中有大量沉淀产生,沉淀主要成分的化学式为
②Ca3(AsO4)2在pH调节到8左右才开始沉淀,原因为
③砷酸(H3AsO4)分步电离的平衡常数(25℃)为Ka1=5.6×10-3,Ka2=1.7×10-7,Ka3=4.0×10-12,第三步电离的平衡常数表达式为Ka3=
 +H2O
+H2O HAsO
HAsO +OH-,该步水解的平衡常数(25℃)为
+OH-,该步水解的平衡常数(25℃)为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐1】用废铅蓄电池的铅泥(含PbSO4、PbO和Pb等)可制备精细化工产品3PbO·PbSO4·H2O(三盐),主要制备流程如下。
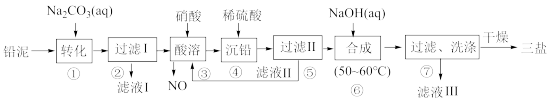
请回答下列问题:
(1)铅蓄电池在生活中有广泛应用,其工作原理是Pb+PbO2+2H2SO4 2PbSO4+2H2O。若铅蓄电池放电前正、负极质量相等,放电时转移了1 mol电子,则理论上两极质量之差为
2PbSO4+2H2O。若铅蓄电池放电前正、负极质量相等,放电时转移了1 mol电子,则理论上两极质量之差为_____________ 。
(2)将滤液Ⅰ、滤液Ⅲ合并,经蒸发浓缩、降温结晶、过滤等操作,可得到一种结晶水合物(Mr=322),其化学式为______________________ 。
(3)步骤③酸溶时铅与硝酸反应生成Pb(NO3)2及NO。滤液Ⅱ中溶质的主要成分为______ (填化学式)。
(4)步骤⑥合成三盐的化学方程式为______________________ 。
(5)步骤⑦的洗涤操作中,检验沉淀是否洗涤完全的操作方法是__________________ 。

请回答下列问题:
(1)铅蓄电池在生活中有广泛应用,其工作原理是Pb+PbO2+2H2SO4
 2PbSO4+2H2O。若铅蓄电池放电前正、负极质量相等,放电时转移了1 mol电子,则理论上两极质量之差为
2PbSO4+2H2O。若铅蓄电池放电前正、负极质量相等,放电时转移了1 mol电子,则理论上两极质量之差为(2)将滤液Ⅰ、滤液Ⅲ合并,经蒸发浓缩、降温结晶、过滤等操作,可得到一种结晶水合物(Mr=322),其化学式为
(3)步骤③酸溶时铅与硝酸反应生成Pb(NO3)2及NO。滤液Ⅱ中溶质的主要成分为
(4)步骤⑥合成三盐的化学方程式为
(5)步骤⑦的洗涤操作中,检验沉淀是否洗涤完全的操作方法是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】镍氢电池是一种性能良好的蓄电池,电池容量大,充电过程快,具有很好的应用前景。
Ⅰ.已知某镍氢二次电池放电时的总反应式为NiOOH + MH Ni(OH)2 + M,电解质溶液为KOH溶液,其中MH被称为储氢电极。充电时储氢电极为
Ni(OH)2 + M,电解质溶液为KOH溶液,其中MH被称为储氢电极。充电时储氢电极为_____ 极,请写出充电时阳极反应式:____________ 。
Ⅱ.废旧电池对环境有一定的危害,某种型号镍电池的电极材料由Ni(OH)2、碳粉、氧化铁等涂覆在铝箔上制成。研究小组设计如下工艺流程,对该电池的电极材料进行资源回收:

已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+。
②某温度下:Ksp[Ni(OH)2] = 5.0×10-16、Ksp[NiC2O4] = 4.0×10-10
Ksp[Fe(OH)3] = 4.0×10-38、Ksp[Al(OH)3] = 3.0×10-34
回答下列问题:
(1)第②步调节溶液的pH,最佳的试剂为________
a.NaOH b.NiO c.CO2 d.HCl
(2)写出步骤④中反应的化学方程式_____________ ,请从沉淀转化的角度,解释该反应能发生的原因_______________ 。
(3)第⑤步电解滤液的阴极产物为___________ ,另一电极产物全部用于氧化沉淀Ⅲ,该反应的离子方程式为:_____________ ,理论上当电解池转移10mol电子时,能得到产物Ni(OH)3 ________ kg。
Ⅰ.已知某镍氢二次电池放电时的总反应式为NiOOH + MH
 Ni(OH)2 + M,电解质溶液为KOH溶液,其中MH被称为储氢电极。充电时储氢电极为
Ni(OH)2 + M,电解质溶液为KOH溶液,其中MH被称为储氢电极。充电时储氢电极为Ⅱ.废旧电池对环境有一定的危害,某种型号镍电池的电极材料由Ni(OH)2、碳粉、氧化铁等涂覆在铝箔上制成。研究小组设计如下工艺流程,对该电池的电极材料进行资源回收:

已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+。
②某温度下:Ksp[Ni(OH)2] = 5.0×10-16、Ksp[NiC2O4] = 4.0×10-10
Ksp[Fe(OH)3] = 4.0×10-38、Ksp[Al(OH)3] = 3.0×10-34
回答下列问题:
(1)第②步调节溶液的pH,最佳的试剂为
a.NaOH b.NiO c.CO2 d.HCl
(2)写出步骤④中反应的化学方程式
(3)第⑤步电解滤液的阴极产物为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐3】工业上用钒炉渣(主要含 FeO·V 2O3,还含有少量 SiO2、P2O5等杂质)提取V2O5的流程如下:

(1)焙烧的目的是将FeO·V 2O3转化为可溶性的NaVO3,写出该反应的化学方程式____ ;浸出渣的主要成分为_______________ (填化学式)。
(2)用 MgSO4溶液除硅、磷时,滤渣的主要成分为 Mg3(PO4)2、MgSiO3。
①若滤液中 c(SiO32- )=0.08 mol·L-1,则 c(PO43- )=_____ 。(已知:Ksp (MgSiO3 )=2.4×10-5,Ksp [Mg3 (PO4 )2 ]=2.7×10-27)
②随着温度升高,Mg2+的水解程度增大,导致除磷率下降,但除硅率升高,其原因是____ 。[随温度升高,MgSiO3、Mg3(PO4)2的溶解度变化忽略不计]
(3)元素钒在溶液中主要以V2+(紫色)、V3+(绿色)、VO2+(蓝色)、VO2+(浅黄色)等形式存在。钒液可充电电池的工作原理如图所示。
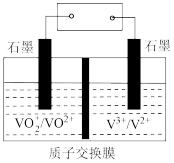
已知溶液中 c(H+)=1.0 mol·L-1,阴离子为 SO42-。
①充电时,左槽溶液颜色由蓝色逐渐变为浅黄色,则左侧电极的电极反应式为____ 。
②放电过程中,右槽溶液颜色变化为_____ 。
③放电时,若转移的电子数为 3.01×1022,则左槽溶液中 n(H+)的变化为_____ 。

(1)焙烧的目的是将FeO·V 2O3转化为可溶性的NaVO3,写出该反应的化学方程式
(2)用 MgSO4溶液除硅、磷时,滤渣的主要成分为 Mg3(PO4)2、MgSiO3。
①若滤液中 c(SiO32- )=0.08 mol·L-1,则 c(PO43- )=
②随着温度升高,Mg2+的水解程度增大,导致除磷率下降,但除硅率升高,其原因是
(3)元素钒在溶液中主要以V2+(紫色)、V3+(绿色)、VO2+(蓝色)、VO2+(浅黄色)等形式存在。钒液可充电电池的工作原理如图所示。

已知溶液中 c(H+)=1.0 mol·L-1,阴离子为 SO42-。
①充电时,左槽溶液颜色由蓝色逐渐变为浅黄色,则左侧电极的电极反应式为
②放电过程中,右槽溶液颜色变化为
③放电时,若转移的电子数为 3.01×1022,则左槽溶液中 n(H+)的变化为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐1】I.1-溴丁烷可用于合成麻醉药,生产染料和香料。实验室用溴化钠、1-丁醇、浓硫酸制备1-溴丁烷的反应原理、装置示意图及相关数据如下:
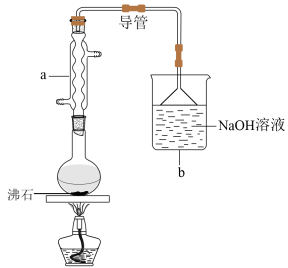
①
②
实验步骤:
在圆底烧瓶中加入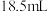 1-丁醇,
1-丁醇,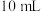 浓
浓 、一定量
、一定量 固体和2-3粒沸石,加热回流
固体和2-3粒沸石,加热回流 。反应液冷却至室温后倒入分液漏斗中,分别用适量的水、饱和
。反应液冷却至室温后倒入分液漏斗中,分别用适量的水、饱和 溶液、水洗涤。分离出的产物经干燥、蒸馏后得到
溶液、水洗涤。分离出的产物经干燥、蒸馏后得到 产品。
产品。
(1)仪器a的名称是___________ ,装置b中 溶液的作用是
溶液的作用是________________ 。
(2)实验中可能产生多种副产物。
①该实验中产生的有机副产物可能为______________________ (写一种,用结构简式表示),写出生成该副产物的化学方程式_______________________ 。
②若实验中部分 被浓硫酸氧化,可使制得的产品呈黄色,反应的化学方程式为
被浓硫酸氧化,可使制得的产品呈黄色,反应的化学方程式为___________ 。
(3)分离反应液的过程中,产物应从分液漏斗的___________ (选填“上口倒出”或“下口放出”)。
Ⅱ.青蒿素是治疗疟疾有效药物,其结构简式如下图所示。
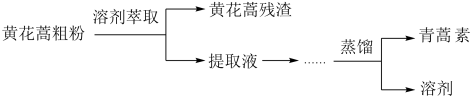
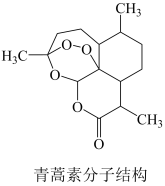
研究团队使用不同溶剂提取青蒿素的实验结果如下:
(4)提取青蒿素使用的溶剂最好选择___________ 。

①

②

相对分子质量 | 密度( | 水中溶解性 | |
1-丁醇 | 74 | 0.8 | 可溶 |
1-溴丁烷 | 137 | 1.3 | 难溶 |
在圆底烧瓶中加入
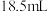 1-丁醇,
1-丁醇,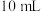 浓
浓 、一定量
、一定量 固体和2-3粒沸石,加热回流
固体和2-3粒沸石,加热回流 。反应液冷却至室温后倒入分液漏斗中,分别用适量的水、饱和
。反应液冷却至室温后倒入分液漏斗中,分别用适量的水、饱和 溶液、水洗涤。分离出的产物经干燥、蒸馏后得到
溶液、水洗涤。分离出的产物经干燥、蒸馏后得到 产品。
产品。(1)仪器a的名称是
 溶液的作用是
溶液的作用是(2)实验中可能产生多种副产物。
①该实验中产生的有机副产物可能为
②若实验中部分
 被浓硫酸氧化,可使制得的产品呈黄色,反应的化学方程式为
被浓硫酸氧化,可使制得的产品呈黄色,反应的化学方程式为(3)分离反应液的过程中,产物应从分液漏斗的
Ⅱ.青蒿素是治疗疟疾有效药物,其结构简式如下图所示。


研究团队使用不同溶剂提取青蒿素的实验结果如下:
溶剂 | 水 | 乙醇 | 乙醚 |
沸点 | 100 | 78 | 35 |
提取效率 | 几乎为0 |
|
|
(4)提取青蒿素使用的溶剂最好选择
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】以硫铁矿(主要成分为 ,还有少量CuS、
,还有少量CuS、 等杂质)为原料制备绿矾晶体
等杂质)为原料制备绿矾晶体 的工艺流程如下:
的工艺流程如下:

(1)“酸浸”过程,矿渣中的 与稀
与稀 反应的离子方程式
反应的离子方程式_______________ 。
(2)烟气中的 会污染环境,可用足量氨水吸收,写出该反应的离子方程式
会污染环境,可用足量氨水吸收,写出该反应的离子方程式_____ 。
(3)滤液中金属阳离子的检验方法__________ 。
(4) 溶液制备绿矾晶体过程中要保持
溶液制备绿矾晶体过程中要保持 过量,理由
过量,理由______ 。(结合化学用语说明原因)
(5)燃料细菌脱硫法是用氧化亚铁硫杆菌 对硫铁矿进行催化脱硫,同时得到
对硫铁矿进行催化脱硫,同时得到 溶液。其过程如图所示:
溶液。其过程如图所示:
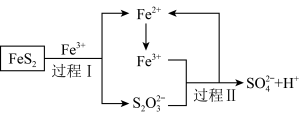
已知总反应为: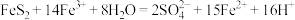
①将过程I离子方程式补充完整
____ FeS2+_____ Fe3++______ _______ =7Fe2++________ S2O32-+_____ _____
②过程II反应的离子方程式___________________________________ 。
(6)绿矾晶体在空气中易被氧化。取 样品,加水完全溶解,用酸化的
样品,加水完全溶解,用酸化的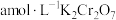 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液
溶液 。反应原理:
。反应原理: 。则绿矾晶体纯度的计算式为
。则绿矾晶体纯度的计算式为_______________ 。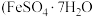 摩尔质量为
摩尔质量为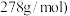
 ,还有少量CuS、
,还有少量CuS、 等杂质)为原料制备绿矾晶体
等杂质)为原料制备绿矾晶体 的工艺流程如下:
的工艺流程如下: 
(1)“酸浸”过程,矿渣中的
 与稀
与稀 反应的离子方程式
反应的离子方程式(2)烟气中的
 会污染环境,可用足量氨水吸收,写出该反应的离子方程式
会污染环境,可用足量氨水吸收,写出该反应的离子方程式(3)滤液中金属阳离子的检验方法
(4)
 溶液制备绿矾晶体过程中要保持
溶液制备绿矾晶体过程中要保持 过量,理由
过量,理由(5)燃料细菌脱硫法是用氧化亚铁硫杆菌
 对硫铁矿进行催化脱硫,同时得到
对硫铁矿进行催化脱硫,同时得到 溶液。其过程如图所示:
溶液。其过程如图所示: 
已知总反应为:
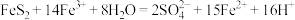
①将过程I离子方程式补充完整
②过程II反应的离子方程式
(6)绿矾晶体在空气中易被氧化。取
 样品,加水完全溶解,用酸化的
样品,加水完全溶解,用酸化的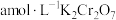 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液
溶液 。反应原理:
。反应原理: 。则绿矾晶体纯度的计算式为
。则绿矾晶体纯度的计算式为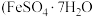 摩尔质量为
摩尔质量为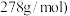
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐3】某“变废为宝”学生探究小组设计如下工艺流程,对废锌(含铁和铜的氧化物杂质)和除氯后的卤水(含碘离子)联合应用,最终制得胆矾、 、碘等。
、碘等。
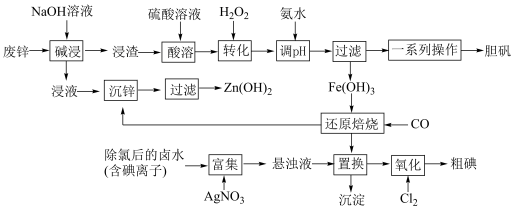
已知:①锌元素与铝元素的性质类似,例如氧化锌也能溶于强碱{生成 }。
}。
②本工艺条件下,相关金属离子形成氢氧化物沉淀的pH范围如下:
③还原性: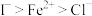
回答下列问题:
(1)“碱浸”中发生反应的化学方程式为____________________ 。
(2)“转化”中,加入足量H2O2的目的是____________________ 。
(3)“调pH”时需控制该溶液的pH范围为______ 之间。“调pH”之后,需要加热煮沸10 min,冷却后再“过滤”。煮沸10 min的作用是____________________ 。
(4)“还原焙烧”的气体产物可循环利用到“沉锌”中。若该气体不足,“沉锌”中发生反应的离子方程式为____________________ 。
(5)“氧化”过程中若反应物用量比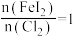 时,氧化产物为
时,氧化产物为______ (填化学式)
 、碘等。
、碘等。
已知:①锌元素与铝元素的性质类似,例如氧化锌也能溶于强碱{生成
 }。
}。②本工艺条件下,相关金属离子形成氢氧化物沉淀的pH范围如下:
金属离子 |
|
|
|
|
开始沉淀的pH | 6.2 | 6.3 | 1.5 | 4.7 |
沉淀完全的pH | 8.2 | 8.3 | 2.8 | 6.8 |
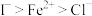
回答下列问题:
(1)“碱浸”中发生反应的化学方程式为
(2)“转化”中,加入足量H2O2的目的是
(3)“调pH”时需控制该溶液的pH范围为
(4)“还原焙烧”的气体产物可循环利用到“沉锌”中。若该气体不足,“沉锌”中发生反应的离子方程式为
(5)“氧化”过程中若反应物用量比
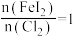 时,氧化产物为
时,氧化产物为
您最近一年使用:0次

 )
)





