铬及其化合物在催化、金属防腐等方面具有重要应用。
(1)催化剂 可由
可由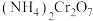 加热分解制备,反应同时生成无污染气体。
加热分解制备,反应同时生成无污染气体。
①完成化学方程式: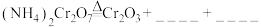 。
。______
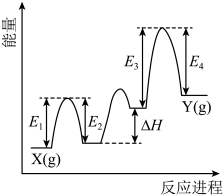
② 催化丙烷脱氢过程中,部分反应历程如图,
催化丙烷脱氢过程中,部分反应历程如图, 过程的焓变为
过程的焓变为_______ (列式表示)。
③ 可用于
可用于 的催化氧化。设计从
的催化氧化。设计从 出发经过3步反应制备
出发经过3步反应制备 的路线
的路线_______ (用“→”表示含氮物质间的转化,例如 ,并在箭头上标注其他反应物):其中一个有颜色变化的反应的化学方程式为
,并在箭头上标注其他反应物):其中一个有颜色变化的反应的化学方程式为_______ 。
(2) 溶液中存在多个平衡。本题条件下仅需考虑如下平衡:
溶液中存在多个平衡。本题条件下仅需考虑如下平衡:
(ⅰ) Cr2O (aq)+H2O(l)
(aq)+H2O(l) 2HCrO
2HCrO (aq)
(aq)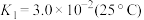
(ⅱ) HCr O (aq)
(aq)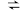 Cr O
Cr O (aq)+H+(aq)
(aq)+H+(aq)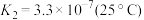
①下列有关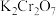 溶液的说法正确的有
溶液的说法正确的有________
A.加入少量硫酸,溶液的 不变
不变
B.加入少量水稀释,溶液中离子总数增加
C.加入少量 溶液,反应(ⅰ)的平衡逆向移动
溶液,反应(ⅰ)的平衡逆向移动
D.加入少量 固体,平衡时
固体,平衡时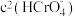 与
与 的比值保持不变
的比值保持不变
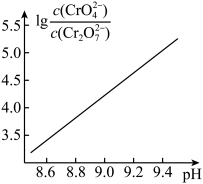
② 时,
时,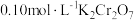 ,溶液中
,溶液中 随
随 的变化关系如图。当
的变化关系如图。当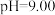 时,设
时,设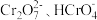 与
与 的平衡浓度分别为
的平衡浓度分别为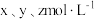 ,则x、y、z之间的关系式为
,则x、y、z之间的关系式为_______ =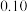 。
。
(1)催化剂
 可由
可由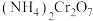 加热分解制备,反应同时生成无污染气体。
加热分解制备,反应同时生成无污染气体。①完成化学方程式:
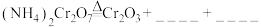 。
。②
 催化丙烷脱氢过程中,部分反应历程如图,
催化丙烷脱氢过程中,部分反应历程如图, 过程的焓变为
过程的焓变为
③
 可用于
可用于 的催化氧化。设计从
的催化氧化。设计从 出发经过3步反应制备
出发经过3步反应制备 的路线
的路线 ,并在箭头上标注其他反应物):其中一个有颜色变化的反应的化学方程式为
,并在箭头上标注其他反应物):其中一个有颜色变化的反应的化学方程式为(2)
 溶液中存在多个平衡。本题条件下仅需考虑如下平衡:
溶液中存在多个平衡。本题条件下仅需考虑如下平衡:(ⅰ) Cr2O
 (aq)+H2O(l)
(aq)+H2O(l) 2HCrO
2HCrO (aq)
(aq)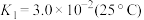
(ⅱ) HCr O
 (aq)
(aq)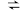 Cr O
Cr O (aq)+H+(aq)
(aq)+H+(aq)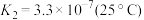
①下列有关
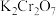 溶液的说法正确的有
溶液的说法正确的有A.加入少量硫酸,溶液的
 不变
不变B.加入少量水稀释,溶液中离子总数增加
C.加入少量
 溶液,反应(ⅰ)的平衡逆向移动
溶液,反应(ⅰ)的平衡逆向移动D.加入少量
 固体,平衡时
固体,平衡时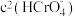 与
与 的比值保持不变
的比值保持不变②
 时,
时,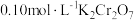 ,溶液中
,溶液中 随
随 的变化关系如图。当
的变化关系如图。当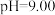 时,设
时,设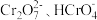 与
与 的平衡浓度分别为
的平衡浓度分别为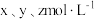 ,则x、y、z之间的关系式为
,则x、y、z之间的关系式为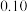 。
。
22-23高三上·福建厦门·期中 查看更多[2]
更新时间:2022-11-12 20:58:58
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】Cl2O是一种高效消毒剂,易溶于水且会与水反应,与有机物接触时会爆炸。制备原理: HgO+2Cl2 HgCl2+Cl2O, 装置如图(部分夹持仪器已省略)。
HgCl2+Cl2O, 装置如图(部分夹持仪器已省略)。

已知:
回答下列问题:
(1)仪器a的名称是___________ ,装置A中所发生反应的离子反应方程式为____________ 。
(2)装置B中的试剂是饱和食盐水,其作用是___________ ;装置C中盛放的是__________ 。
(3)制取Cl2O是“气-固”反应,反应柱D中不利于该反应的措施是___________ 。
a.将HgO粉末化并加热去除水分,加玻璃珠与之混合填入反应柱D
b.为使Cl2与HgO充分接触,让混合气从下口进入反应柱D并调控流速
c.为提高Cl2O的生成速率,将加热带缠绕于反应柱D并加热到45°C
(4)装置E中的液态冷却剂可选用___________ (液氨、冰盐水、液氮) ;装置A、B、C间连接器的材质与反应柱D、装置E、F间连接器的材质有明显差别,原因是___________ 。
(5)若将装置组装完整,虚框F中可选用___________ (填字母序号)。

(6)ClO2和Cl2O在消毒时自身均被还原为Cl-,ClO2的消毒能力是等质量Cl2O的___________ 倍(结果保留两位小数)。
 HgCl2+Cl2O, 装置如图(部分夹持仪器已省略)。
HgCl2+Cl2O, 装置如图(部分夹持仪器已省略)。
已知:
| Cl2O | N2 | NH3 | Cl2 | |
| 熔点/°C | -120.6 | -209.86 | -77.3 | -101 |
| 沸点/°C | 2.0 | -195.8 | -33.35 | -34.6 |
(1)仪器a的名称是
(2)装置B中的试剂是饱和食盐水,其作用是
(3)制取Cl2O是“气-固”反应,反应柱D中不利于该反应的措施是
a.将HgO粉末化并加热去除水分,加玻璃珠与之混合填入反应柱D
b.为使Cl2与HgO充分接触,让混合气从下口进入反应柱D并调控流速
c.为提高Cl2O的生成速率,将加热带缠绕于反应柱D并加热到45°C
(4)装置E中的液态冷却剂可选用
(5)若将装置组装完整,虚框F中可选用

(6)ClO2和Cl2O在消毒时自身均被还原为Cl-,ClO2的消毒能力是等质量Cl2O的
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐2】由锡精矿(主要成分为SnO2、Cu、Pb等)制备锡酸钠(Na2SnO3)工艺流程如图。
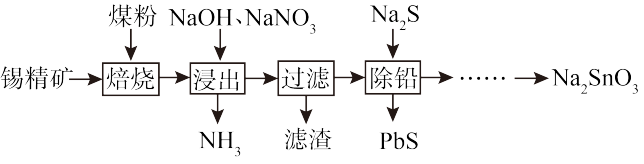
(1)锡精矿在焙烧前往往进行粉碎,其目的为___ 。
(2)焙烧过程中,若只考虑煤粉将SnO2,转变为Sn,反应中氧化剂与还原剂的物质的量之比为___ 。
(3)浸出时,Sn、Pb分别转化为Na2SnO3、Na2PbO2,Sn发生反应的化学方程式为____ 。
(4)滤渣的主要成分为____ (填化学式)。
(5)除铅过程中反应的离子方程式为____ 。
(6)已知Na2SnO3•3H2O可溶于水,难溶于乙醇,加热至140℃时会失去结晶水,若实验室欲制得锡酸钠晶体,则最后一步从滤液中得到锡酸钠晶体的操作步骤为___ 、冷却结晶、过滤、用乙醇洗涤、低温干燥。
(7)Na2SnO3产品纯度的测定:称取10.0g粗产品,配成100mL溶液,用滴定管量取25.00mL溶液于锥形瓶中,加入稀盐酸酸化,加入足量的碘化钾溶液,充分反应后,用0.01mol·L-1Na2S2O3,溶液滴定生成的I2,反应终点时平均消耗Na2S2O3溶液的体积为VmL。
已知:Ⅰ.SnO +H++I-→SnO
+H++I-→SnO +H2O+I2;
+H2O+I2;
Ⅱ.2S2O +I2=S4O
+I2=S4O +2I-。
+2I-。
①将反应Ⅰ配平为___ 。
②该产品的纯度P为___ (写出表达式即可)。

(1)锡精矿在焙烧前往往进行粉碎,其目的为
(2)焙烧过程中,若只考虑煤粉将SnO2,转变为Sn,反应中氧化剂与还原剂的物质的量之比为
(3)浸出时,Sn、Pb分别转化为Na2SnO3、Na2PbO2,Sn发生反应的化学方程式为
(4)滤渣的主要成分为
(5)除铅过程中反应的离子方程式为
(6)已知Na2SnO3•3H2O可溶于水,难溶于乙醇,加热至140℃时会失去结晶水,若实验室欲制得锡酸钠晶体,则最后一步从滤液中得到锡酸钠晶体的操作步骤为
(7)Na2SnO3产品纯度的测定:称取10.0g粗产品,配成100mL溶液,用滴定管量取25.00mL溶液于锥形瓶中,加入稀盐酸酸化,加入足量的碘化钾溶液,充分反应后,用0.01mol·L-1Na2S2O3,溶液滴定生成的I2,反应终点时平均消耗Na2S2O3溶液的体积为VmL。
已知:Ⅰ.SnO
 +H++I-→SnO
+H++I-→SnO +H2O+I2;
+H2O+I2;Ⅱ.2S2O
 +I2=S4O
+I2=S4O +2I-。
+2I-。①将反应Ⅰ配平为
②该产品的纯度P为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】硫酸亚铁晶体俗称绿矾(FeSO4 • 7H2O),重铬酸钠晶体俗称红矾钠(Na2Cr2O7·2H2O),它们都是重要的化工产品。工业上以铬铁矿[主要成分是[Fe(CrO2)2]为原料制备绿矾和红矾钠的工艺流程如图所示。

请回答下列问题:
(1)已知Fe(CrO2)2中铬元素的化合价为+3价,则Fe(CrO2)中铁元素的化合价为_______ 。
(2)化学上可将某些盐写成氧化物的形式,如Na2SiO3写成Na2O·SiO2,则Fe(CrO2)2可写成_______ 。(填化学式)
(3)煅烧铬铁矿时,矿石中的Fe(CrO2)2转变成可溶于水的Na2CrO4,反应的化学方程式:4Fe(CrO2)2+8Na2CO3+7O2 2Fe2O3+8Na2CrO4+8CO2
2Fe2O3+8Na2CrO4+8CO2
①该反应中还原剂与氧化剂的物质的量之比为_______ 。
②为了加快该反应的反应速率,可采取的措施是_______ (填一种即可)。
(4)已知 在氢离子浓度不同的酸性溶液中有不同的反应:2
在氢离子浓度不同的酸性溶液中有不同的反应:2 +2H+=
+2H+= +H2O; 3
+H2O; 3 +4H+=
+4H+=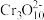 +2H2O
+2H2O
①往混合溶液甲中加入硫酸必须适量的原因是_______ 。
②混合溶液乙中溶质的化学式为_______  。
。
(5)从溶液丁到绿巩的实验操作为蒸发浓缩、_______ 、过滤、洗涤、干燥。

请回答下列问题:
(1)已知Fe(CrO2)2中铬元素的化合价为+3价,则Fe(CrO2)中铁元素的化合价为
(2)化学上可将某些盐写成氧化物的形式,如Na2SiO3写成Na2O·SiO2,则Fe(CrO2)2可写成
(3)煅烧铬铁矿时,矿石中的Fe(CrO2)2转变成可溶于水的Na2CrO4,反应的化学方程式:4Fe(CrO2)2+8Na2CO3+7O2
 2Fe2O3+8Na2CrO4+8CO2
2Fe2O3+8Na2CrO4+8CO2①该反应中还原剂与氧化剂的物质的量之比为
②为了加快该反应的反应速率,可采取的措施是
(4)已知
 在氢离子浓度不同的酸性溶液中有不同的反应:2
在氢离子浓度不同的酸性溶液中有不同的反应:2 +2H+=
+2H+= +H2O; 3
+H2O; 3 +4H+=
+4H+=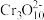 +2H2O
+2H2O①往混合溶液甲中加入硫酸必须适量的原因是
②混合溶液乙中溶质的化学式为
 。
。(5)从溶液丁到绿巩的实验操作为蒸发浓缩、
您最近一年使用:0次
【推荐1】氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。请回答下列问题:
(1)用CH4 催化还原NOx 可以消除氮氧化物的污染。例如:
CH4(g) + 4NO2(g) = 4NO(g)+CO2(g) + 2H2O(g) ΔH1=-574 kJ·mol-1
CH4(g) + 4NO(g) = 2N2(g)+CO2(g) + 2H2O(g) ΔH2
若1 mol CH4 还原NO2 至N2,整个过程中放出的热量为867 kJ,则ΔH2=_______ ;
(2)工业合成氨气需要的反应条件非常高且产量低,而一些科学家采用高质子导电性的SCY陶瓷(能传递H+)实现氨的电化学合成,从而大大提高了氮气和氢气的转化率。电化学合成氨过程的总反应式为:N2+3H2 2NH3,则在电化学合成氨的过程中,阴极反应式为
2NH3,则在电化学合成氨的过程中,阴极反应式为__________________________________________ ;
(3)在一定条件下,将l mol N2 与3 mol H2 混合于一个10 L密闭容器中,反应达到平衡时,A点混合气体中氨占25%,试回答:
①N2的转化率为______ ;
②右图中在状态A时,平衡常数KA____________ (填写代入数值的表达式,不要求算出具体数值);当温度由T1变化到T2时, KA ____ KB(填“>”、“<”或“=”)。

③在容积固定的密闭容器中发生上述反应,各物质的浓度如下表:
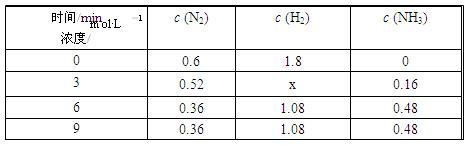
反应从0 min到3 min之间,H2的反应速率为______________ ;反应在3 min时,条件发生了改变,改变的条件可能是________ (填序号)。
a.使用催化剂 b.降低温度 c.增加H2的浓度
(1)用CH4 催化还原NOx 可以消除氮氧化物的污染。例如:
CH4(g) + 4NO2(g) = 4NO(g)+CO2(g) + 2H2O(g) ΔH1=-574 kJ·mol-1
CH4(g) + 4NO(g) = 2N2(g)+CO2(g) + 2H2O(g) ΔH2
若1 mol CH4 还原NO2 至N2,整个过程中放出的热量为867 kJ,则ΔH2=
(2)工业合成氨气需要的反应条件非常高且产量低,而一些科学家采用高质子导电性的SCY陶瓷(能传递H+)实现氨的电化学合成,从而大大提高了氮气和氢气的转化率。电化学合成氨过程的总反应式为:N2+3H2
 2NH3,则在电化学合成氨的过程中,阴极反应式为
2NH3,则在电化学合成氨的过程中,阴极反应式为(3)在一定条件下,将l mol N2 与3 mol H2 混合于一个10 L密闭容器中,反应达到平衡时,A点混合气体中氨占25%,试回答:
①N2的转化率为
②右图中在状态A时,平衡常数KA

③在容积固定的密闭容器中发生上述反应,各物质的浓度如下表:

反应从0 min到3 min之间,H2的反应速率为
a.使用催化剂 b.降低温度 c.增加H2的浓度
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】汽车尾气是导致雾霾天气的重要源头之一,其含有的NO(g)和CO(g)在一定温度和催化剂条件下可发生反应。
(一)已知:反应l: N2(g)+O2(g)=2NO(g) △H1 K1
反应2: CO(g)+ 1/2O2(g)=CO2 (g) △H2 K2
反应3: 2NO(g)+2C0(g)=N2(g)+CO2(g) △H3 K3
则反应3的焓变△H3=_______ (用△H1和△H2表示) 平衡常数K3=_____ (用K1和K2表示)。
(二)向1.0L恒容密闭容器中,充入N2O(g)和C0(g),可发生如下反应:
N2O(g)+C0(g) N2(g)+CO2(g),所得实验数据如下表:
N2(g)+CO2(g),所得实验数据如下表:
上述实验编号①中,若10min时测得n(N2)=0.12mol,则0至10min内,用CO2表示的平均反应速率以v(CO2)=________ ;
(2)500℃时,欲使N2O的平衡转化率a(N2O)≥80%,则起始时n(N2O):n(CO)≤______ 。
(3)上述实验编号④达平衡时,b____ 0.24(填“>”、“<”或“=”),原因是_______ 。
(4) N2O(g)+C0(g) N2(g)+CO2(g)的反应体系达到平衡后,各物质的浓度在不同条件下的变化情况如下图所示:
N2(g)+CO2(g)的反应体系达到平衡后,各物质的浓度在不同条件下的变化情况如下图所示:
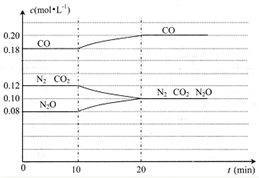
①若在第10min仅改变了一个条件,第20min时是在新条件下达到新的平衡状态,则第10min 时改变的条件可能是_______ ;
②比较CO在第5min和第25min时速率的大小v(5)____ v(25)(填”>”、“<”或“= ”),你判断的理由是______________ 。
(一)已知:反应l: N2(g)+O2(g)=2NO(g) △H1 K1
反应2: CO(g)+ 1/2O2(g)=CO2 (g) △H2 K2
反应3: 2NO(g)+2C0(g)=N2(g)+CO2(g) △H3 K3
则反应3的焓变△H3=
(二)向1.0L恒容密闭容器中,充入N2O(g)和C0(g),可发生如下反应:
N2O(g)+C0(g)
 N2(g)+CO2(g),所得实验数据如下表:
N2(g)+CO2(g),所得实验数据如下表:| 实验编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | |
| n(N2O) | n(CO) | n(CO2) | ||
| ① | 400 | 0.20 | 0.30 | 0.14 |
| ② | 500 | 0.10 | 0.40 | 0.080 |
| ③ | 500 | 0.30 | 0.20 | A |
| ④ | 600 | 0.60 | 0.40 | B |
上述实验编号①中,若10min时测得n(N2)=0.12mol,则0至10min内,用CO2表示的平均反应速率以v(CO2)=
(2)500℃时,欲使N2O的平衡转化率a(N2O)≥80%,则起始时n(N2O):n(CO)≤
(3)上述实验编号④达平衡时,b
(4) N2O(g)+C0(g)
 N2(g)+CO2(g)的反应体系达到平衡后,各物质的浓度在不同条件下的变化情况如下图所示:
N2(g)+CO2(g)的反应体系达到平衡后,各物质的浓度在不同条件下的变化情况如下图所示:
①若在第10min仅改变了一个条件,第20min时是在新条件下达到新的平衡状态,则第10min 时改变的条件可能是
②比较CO在第5min和第25min时速率的大小v(5)
您最近一年使用:0次
【推荐3】氢气是一种清洁能源,氢气的制取和储存是氢能源利用领域的研究热点。
(1)H2S热分解制氢的原理: 2H2S(g)=2H2(g) + S2(g)△H= 169.8 kJ/mol,分解时常向反应器中通入一定比例空气,使部分H2S燃烧,其目的是______ ;燃烧生成的SO2与H2S进一步反应,硫元素转化为S2,写出反应的化学方程式:________ 。
(2)氨硼烷(NH3BH3)是储氢量最高的材料之一,其受热时固体残留率随温度的变化如图甲所示。氨硼烷还可作燃料电池,其工作原理如图乙所示。

①110℃时残留固体的化学式为_________ 。
②氨硼烷电池工作时负极的电极反应式为_________ 。
(3)十氢萘(C10H18)是具有高储氢密度的氢能载体,经历“C10H18- C10H12-C10H8”的脱氢过程释放氢气。已知:
C10H18(l) C10H12(l) +3H2(g)△H1
C10H12(l) +3H2(g)△H1
C10H12(l) C10H8(l)+2H2(g)△H2
C10H8(l)+2H2(g)△H2
温度335℃、高压下,在恒容密闭反应器中进行液态十氢萘( 1.00 mol)催化脱氢实验,测得C10H12和C10H8的物质的量n1和n2随时间的变化关系如图丙所示。图丁表示催化剂对反应活化能的影响。

①△H1___ △H2(选填“>”、“=”或“<”)。
②8 h时,反应体系内氢气的物质的量为_____ mol(忽略其他副反应)。
③n1显著低于n2可能的原因是__________ 。
(1)H2S热分解制氢的原理: 2H2S(g)=2H2(g) + S2(g)△H= 169.8 kJ/mol,分解时常向反应器中通入一定比例空气,使部分H2S燃烧,其目的是
(2)氨硼烷(NH3BH3)是储氢量最高的材料之一,其受热时固体残留率随温度的变化如图甲所示。氨硼烷还可作燃料电池,其工作原理如图乙所示。

①110℃时残留固体的化学式为
②氨硼烷电池工作时负极的电极反应式为
(3)十氢萘(C10H18)是具有高储氢密度的氢能载体,经历“C10H18- C10H12-C10H8”的脱氢过程释放氢气。已知:
C10H18(l)
 C10H12(l) +3H2(g)△H1
C10H12(l) +3H2(g)△H1C10H12(l)
 C10H8(l)+2H2(g)△H2
C10H8(l)+2H2(g)△H2温度335℃、高压下,在恒容密闭反应器中进行液态十氢萘( 1.00 mol)催化脱氢实验,测得C10H12和C10H8的物质的量n1和n2随时间的变化关系如图丙所示。图丁表示催化剂对反应活化能的影响。

①△H1
②8 h时,反应体系内氢气的物质的量为
③n1显著低于n2可能的原因是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】Ⅰ.CH3COOH为常见的弱酸,在工业生产和生活中有广泛应用。
(1)中和100 mL pH=3的CH3COOH溶液和1 L pH=4的CH3COOH溶液,需要等物质的量浓度的NaOH溶液的体积分别为V1和V2,则V1____ (填“>”、“=”或“<”)V2。
(2)常温下,用0.100 0 mol·L-1 NaOH溶液滴定20.00 mL某未知浓度的CH3COOH溶液,滴定曲线如图所示。其中A点所示溶液中c(CH3COO-)=2c(CH3COOH),C点所示溶液中存在:c(CH3COO-)+c(CH3COOH)=c(Na+)。则CH3COOH的电离常数Ka=____ ,CH3COOH的实际浓度为_____ 。

Ⅱ.将0.23 mol二氧化硫气体和0.11 mol氧气混合放入容积为1 L的恒容密闭容器中,发生反应生成三氧化硫气体,反应达到平衡时,得到0.12 mol三氧化硫气体。若温度保持不变,向其中再加入0.50 mol氧气后重新达到平衡,则氧气的转化率____ (填“增大”、“不变”或“减小”,下同),混合气体的密度____ ,该温度下反应的平衡常数K____ ;若温度保持不变,向其中再加入0.12 mol氦气后重新达到平衡,则二氧化硫的转化率___ 。
Ⅲ.向BaCl2溶液中先后滴加AgNO3溶液和KBr溶液,当两种沉淀共存时, =
=______ 。[Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=1.8×10-10]
(1)中和100 mL pH=3的CH3COOH溶液和1 L pH=4的CH3COOH溶液,需要等物质的量浓度的NaOH溶液的体积分别为V1和V2,则V1
(2)常温下,用0.100 0 mol·L-1 NaOH溶液滴定20.00 mL某未知浓度的CH3COOH溶液,滴定曲线如图所示。其中A点所示溶液中c(CH3COO-)=2c(CH3COOH),C点所示溶液中存在:c(CH3COO-)+c(CH3COOH)=c(Na+)。则CH3COOH的电离常数Ka=

Ⅱ.将0.23 mol二氧化硫气体和0.11 mol氧气混合放入容积为1 L的恒容密闭容器中,发生反应生成三氧化硫气体,反应达到平衡时,得到0.12 mol三氧化硫气体。若温度保持不变,向其中再加入0.50 mol氧气后重新达到平衡,则氧气的转化率
Ⅲ.向BaCl2溶液中先后滴加AgNO3溶液和KBr溶液,当两种沉淀共存时,
 =
=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】铁元素在溶液中可以Fe2+、Fe3+、FeO42-、H3FeO4+等形式存在。回答下列问题:
(1) Fe2+与Ag+在溶液中可发生反应。室温时,向初始浓度为0.1mol·L-1的Fe(NO3)2溶液中加入AgNO3固体,溶液中Fe3 +的平衡浓度c(Fe3+)随c(Ag+)的变化如图甲所示(忽略溶液体积变化):
①用离子方程式表示Fe(NO3)2溶液中的转化反应__________________ 。
②根据A点数据,计算Fe2+的转化率________ 。
③升高温度,溶液中Fe2+的转化率减小,则该反应的△H_______ 0 (填“ >”“<”或“=”);降温时,该反应的平衡常数将________ (填“变大”“变小”或 “不变”)。
(2)利用图乙所示的装置,证明上述反应的可逆性。闭合电键K,立即观察到电流计指针发生偏转,此时盐桥中的K+由右向左移动,则石墨电极为电池的________ 极(填“正”或“负”),银电极的电极反应式为_________________ 。
(3)高铁酸盐在水溶液中有四种含铁微粒。25℃时,它们的物质的量分数随PH的变化如图丙所示:
①为获得尽可能纯净的高铁酸盐,应控制pH的最小值为___________ 。
②H3FeO4+ 的电离常数分别为K1=2.51×l0-2 K2=4.16×10-4 K3=5.01×10-8,
当PH =6时,溶液中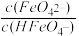 =
=______________ 。
(1) Fe2+与Ag+在溶液中可发生反应。室温时,向初始浓度为0.1mol·L-1的Fe(NO3)2溶液中加入AgNO3固体,溶液中Fe3 +的平衡浓度c(Fe3+)随c(Ag+)的变化如图甲所示(忽略溶液体积变化):

①用离子方程式表示Fe(NO3)2溶液中的转化反应
②根据A点数据,计算Fe2+的转化率
③升高温度,溶液中Fe2+的转化率减小,则该反应的△H
(2)利用图乙所示的装置,证明上述反应的可逆性。闭合电键K,立即观察到电流计指针发生偏转,此时盐桥中的K+由右向左移动,则石墨电极为电池的
(3)高铁酸盐在水溶液中有四种含铁微粒。25℃时,它们的物质的量分数随PH的变化如图丙所示:
①为获得尽可能纯净的高铁酸盐,应控制pH的最小值为
②H3FeO4+ 的电离常数分别为K1=2.51×l0-2 K2=4.16×10-4 K3=5.01×10-8,
当PH =6时,溶液中
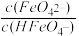 =
=
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】回答下列问题:
(1)现用物质的量浓度为0.2000 mol·L-1的标准NaOH溶液去滴定20ml某盐酸的物质的量浓度(以酚酞为指示剂),请填写下列空白:①用标准NaOH溶液滴定时,应将标准NaOH溶液注入______ (填“甲”或“乙”)中。
②判断到达滴定终点的实验现象是______________ 。
③如图表示50mL滴定管中液面的位置,如果液面处的读数是a,则滴定管中液体体积为_________ (填代号)。
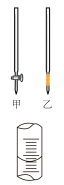
A.a mL B.大于a mL C.等于(50-a)mL D.大于(50-a)mL
(2)某研究性学习小组用0.2000 mol·L-1NaOH标准溶液滴定20.00 mL醋酸溶液的浓度,实验数据记录如下:
计算醋酸溶液的浓度______ (保留四位有效数字)。
(3)浓度会影响弱酸、弱碱的电离程度。用pH计测定不同浓度的醋酸的pH,结果如表:
①根据表中数据,可以得出醋酸是弱电解质的结论,你认为得出此结论的依据是__________ 。
②从表中的数据,还可以得出另一结论:随着醋酸浓度的增大,醋酸的电离程度将__________ (填“增大”“减小”或“不变”)。
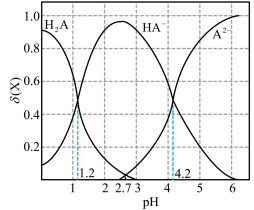
(4)向0.10mol·L-1二元弱酸H2A溶液中逐滴滴入NaOH溶液,溶液中的H2A、HA-、A2-的物质的量分数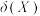 随pH的变化如图所示[已知
随pH的变化如图所示[已知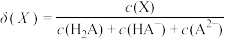 ]。则
]。则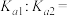
_______ 。
(1)现用物质的量浓度为0.2000 mol·L-1的标准NaOH溶液去滴定20ml某盐酸的物质的量浓度(以酚酞为指示剂),请填写下列空白:①用标准NaOH溶液滴定时,应将标准NaOH溶液注入
②判断到达滴定终点的实验现象是
③如图表示50mL滴定管中液面的位置,如果液面处的读数是a,则滴定管中液体体积为

A.a mL B.大于a mL C.等于(50-a)mL D.大于(50-a)mL
(2)某研究性学习小组用0.2000 mol·L-1NaOH标准溶液滴定20.00 mL醋酸溶液的浓度,实验数据记录如下:
| 实验序号 | l | 2 | 3 | 4 |
| 消耗NaOH溶液的体积 | 20.07 | 20.02 | 18.80 | 19.97 |
(3)浓度会影响弱酸、弱碱的电离程度。用pH计测定不同浓度的醋酸的pH,结果如表:
醋酸浓度 | 0.0010 | 0.0100 | 0.0200 | 0.1000 | 0.2000 |
pH | 3.88 | 3.38 | 3.23 | 2.88 | 2.73 |
②从表中的数据,还可以得出另一结论:随着醋酸浓度的增大,醋酸的电离程度将
(4)向0.10mol·L-1二元弱酸H2A溶液中逐滴滴入NaOH溶液,溶液中的H2A、HA-、A2-的物质的量分数
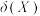 随pH的变化如图所示[已知
随pH的变化如图所示[已知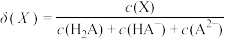 ]。则
]。则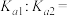

您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
真题
名校
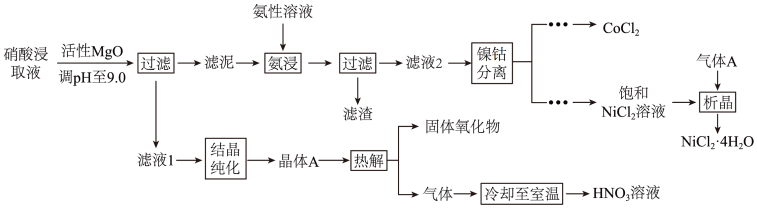
【推荐1】 均是重要的战略性金属。从处理后的矿石硝酸浸取液(含
均是重要的战略性金属。从处理后的矿石硝酸浸取液(含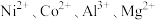 )中,利用氨浸工艺可提取
)中,利用氨浸工艺可提取 ,并获得高附加值化工产品。工艺流程如下:
,并获得高附加值化工产品。工艺流程如下:
已知:氨性溶液由 、
、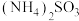 和
和 配制。常温下,
配制。常温下,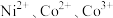 与
与 形成可溶于水的配离子:
形成可溶于水的配离子: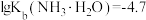 ;
; 易被空气氧化为
易被空气氧化为 ;部分氢氧化物的
;部分氢氧化物的 如下表。
如下表。
回答下列问题:
(1)活性 可与水反应,化学方程式为
可与水反应,化学方程式为___________ 。
(2)常温下, 的氨性溶液中,
的氨性溶液中,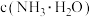
___________  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
(3)“氨浸”时,由 转化为
转化为 的离子方程式为
的离子方程式为___________ 。
(4) 会使滤泥中的一种胶状物质转化为疏松分布的棒状颗粒物。滤渣的X射线衍射图谱中,出现了
会使滤泥中的一种胶状物质转化为疏松分布的棒状颗粒物。滤渣的X射线衍射图谱中,出现了 的明锐衍射峰。
的明锐衍射峰。
① 属于
属于___________ (填“晶体”或“非晶体”)。
② 提高了
提高了 的浸取速率,其原因是
的浸取速率,其原因是___________ 。
(5)①“析晶”过程中通入的酸性气体A为___________ 。
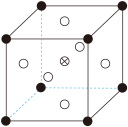
②由 可制备
可制备 晶体,其立方晶胞如图。
晶体,其立方晶胞如图。 与O最小间距大于
与O最小间距大于 与O最小间距,x、y为整数,则
与O最小间距,x、y为整数,则 在晶胞中的位置为
在晶胞中的位置为___________ ;晶体中一个 周围与其最近的O的个数为
周围与其最近的O的个数为___________ 。
(6)①“结晶纯化”过程中,没有引入新物质。晶体A含6个结晶水,则所得 溶液中
溶液中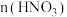 与
与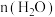 的比值,理论上最高为
的比值,理论上最高为___________ 。
②“热解”对于从矿石提取 工艺的意义,在于可重复利用
工艺的意义,在于可重复利用 和
和___________ (填化学式)。
 均是重要的战略性金属。从处理后的矿石硝酸浸取液(含
均是重要的战略性金属。从处理后的矿石硝酸浸取液(含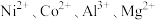 )中,利用氨浸工艺可提取
)中,利用氨浸工艺可提取 ,并获得高附加值化工产品。工艺流程如下:
,并获得高附加值化工产品。工艺流程如下:
已知:氨性溶液由
 、
、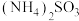 和
和 配制。常温下,
配制。常温下,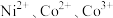 与
与 形成可溶于水的配离子:
形成可溶于水的配离子: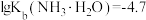 ;
; 易被空气氧化为
易被空气氧化为 ;部分氢氧化物的
;部分氢氧化物的 如下表。
如下表。| 氢氧化物 |  |  |  |  |  |
 | 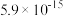 |  |  | 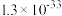 | 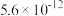 |
(1)活性
 可与水反应,化学方程式为
可与水反应,化学方程式为(2)常温下,
 的氨性溶液中,
的氨性溶液中,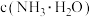
 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。(3)“氨浸”时,由
 转化为
转化为 的离子方程式为
的离子方程式为(4)
 会使滤泥中的一种胶状物质转化为疏松分布的棒状颗粒物。滤渣的X射线衍射图谱中,出现了
会使滤泥中的一种胶状物质转化为疏松分布的棒状颗粒物。滤渣的X射线衍射图谱中,出现了 的明锐衍射峰。
的明锐衍射峰。①
 属于
属于②
 提高了
提高了 的浸取速率,其原因是
的浸取速率,其原因是(5)①“析晶”过程中通入的酸性气体A为
②由
 可制备
可制备 晶体,其立方晶胞如图。
晶体,其立方晶胞如图。 与O最小间距大于
与O最小间距大于 与O最小间距,x、y为整数,则
与O最小间距,x、y为整数,则 在晶胞中的位置为
在晶胞中的位置为 周围与其最近的O的个数为
周围与其最近的O的个数为
(6)①“结晶纯化”过程中,没有引入新物质。晶体A含6个结晶水,则所得
 溶液中
溶液中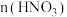 与
与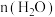 的比值,理论上最高为
的比值,理论上最高为②“热解”对于从矿石提取
 工艺的意义,在于可重复利用
工艺的意义,在于可重复利用 和
和
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】I已知25℃时,醋酸、碳酸、氢氰酸的电离平衡常数如下表(单位省略):
(1)写出碳酸的第一步电离方程式___ 。
(2)25℃时,等浓度的三种溶液①NaCN溶液、②Na2CO3溶液、③CH3COONa溶液,pH由大到小的顺序为___ (填序号)。
(3)25℃时,向NaCN溶液中通入少量CO2,反应的离子方程式为___ 。
(4)将浓度为0.02mol/L的HCN与0.01mol/LNaOH溶液等体积混合,测得混合溶液中c(Na+)>c(CN-),下列关系正确的是___ 。
a.c(H+)>c(OH-) b.c(H+)+c(HCN)=c(OH-) c.c(HCN)+c(CN-)=0.01mol/L
(5)25℃时,浓度均为0.01mol/L的①NaCN、②CH3COONa、③NaCl溶液中,阴离子总浓度由大到小的顺序为___ (填序号)。
Ⅱ.酸性高锰酸钾标准溶液是实验室常用的氧化还原滴定标准试剂。
(6)某同学用0.1000mol/L的酸性高锰酸钾标准溶液滴定某试样中过氧化氢的含量,反应原理为2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑。
①滴定时,用___ 装KMnO4溶液。
②滴定到达终点的现象是___ 。
③用移液管吸取25.00m试样置于锥形瓶中,重复滴定四次,每次消耗的酸性KMnO4标准溶液体积如下表所示:
则试样中过氧化氢的浓度为___ mol/L。
| 醋酸 | 碳酸 | 氢氰酸 |
| Ka=1.7×10-5 | Ka1=4.2×10-7 Ka2=5.6×10-11 | Ka=6.2×10-10 |
(1)写出碳酸的第一步电离方程式
(2)25℃时,等浓度的三种溶液①NaCN溶液、②Na2CO3溶液、③CH3COONa溶液,pH由大到小的顺序为
(3)25℃时,向NaCN溶液中通入少量CO2,反应的离子方程式为
(4)将浓度为0.02mol/L的HCN与0.01mol/LNaOH溶液等体积混合,测得混合溶液中c(Na+)>c(CN-),下列关系正确的是
a.c(H+)>c(OH-) b.c(H+)+c(HCN)=c(OH-) c.c(HCN)+c(CN-)=0.01mol/L
(5)25℃时,浓度均为0.01mol/L的①NaCN、②CH3COONa、③NaCl溶液中,阴离子总浓度由大到小的顺序为
Ⅱ.酸性高锰酸钾标准溶液是实验室常用的氧化还原滴定标准试剂。
(6)某同学用0.1000mol/L的酸性高锰酸钾标准溶液滴定某试样中过氧化氢的含量,反应原理为2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑。
①滴定时,用
②滴定到达终点的现象是
③用移液管吸取25.00m试样置于锥形瓶中,重复滴定四次,每次消耗的酸性KMnO4标准溶液体积如下表所示:
| 第一次 | 第二次 | 第三次 | 第四次 | |
| 体积(mL) | 17.10 | 18.10 | 17.00 | 16.90 |
则试样中过氧化氢的浓度为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】10℃时加热NaHCO3饱和溶液,测得该溶液的pH发生如下变化:
甲同学认为该溶液pH升高的原因是 的水解程度增大,碱性增强。
的水解程度增大,碱性增强。
(1)乙同学认为该溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度___________ (填“大于”或“小于”)NaHCO3的水解程度。
(2)丙同学认为甲、乙的判断都不充分,还需要进一步做实验来验证。
①在加热煮沸的溶液中加入足量的试剂X,若产生沉淀,则乙同学的判断正确。其中试剂X是____________ (填序号)。
A.Ba(OH)2溶液 B.BaCl2溶液
C.NaOH溶液 D.澄清石灰水
②将加热煮沸后的溶液冷却到10℃,若溶液的pH___________ (填“高于”“低于”或“等于”)8.3,则甲同学的判断正确。
③查阅资料,发现NaHCO3的分解温度为150℃,丙同学断言___________ (填“甲”或“乙”)同学的判断是错误的,理由是___________ 。
(3)下列关于NaHCO3饱和水溶液的表述正确的是___________(填序号)。
| 温度 | 10℃ | 20℃ | 30℃ | 加热煮沸后冷却到50℃ |
| pH | 8.3 | 8.4 | 8.5 | 8.8 |
 的水解程度增大,碱性增强。
的水解程度增大,碱性增强。(1)乙同学认为该溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度
(2)丙同学认为甲、乙的判断都不充分,还需要进一步做实验来验证。
①在加热煮沸的溶液中加入足量的试剂X,若产生沉淀,则乙同学的判断正确。其中试剂X是
A.Ba(OH)2溶液 B.BaCl2溶液
C.NaOH溶液 D.澄清石灰水
②将加热煮沸后的溶液冷却到10℃,若溶液的pH
③查阅资料,发现NaHCO3的分解温度为150℃,丙同学断言
(3)下列关于NaHCO3饱和水溶液的表述正确的是___________(填序号)。
A. |
B.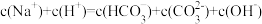 |
C. 的电离程度大于 的电离程度大于 的水解程度 的水解程度 |
您最近一年使用:0次



