某“变废为宝”学生探究小组设计如下工艺流程,对废锌(含铁和铜的氧化物杂质)和除氯后的卤水(含碘离子)联合应用,最终制得胆矾、 、碘等。
、碘等。
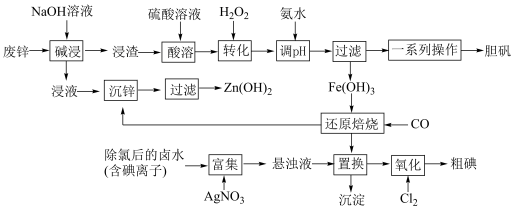
已知:①锌元素与铝元素的性质类似,例如氧化锌也能溶于强碱{生成 }。
}。
②本工艺条件下,相关金属离子形成氢氧化物沉淀的pH范围如下:
③还原性: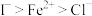
回答下列问题:
(1)“碱浸”中发生反应的化学方程式为____________________ 。
(2)“转化”中,加入足量H2O2的目的是____________________ 。
(3)“调pH”时需控制该溶液的pH范围为______ 之间。“调pH”之后,需要加热煮沸10 min,冷却后再“过滤”。煮沸10 min的作用是____________________ 。
(4)“还原焙烧”的气体产物可循环利用到“沉锌”中。若该气体不足,“沉锌”中发生反应的离子方程式为____________________ 。
(5)“氧化”过程中若反应物用量比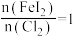 时,氧化产物为
时,氧化产物为______ (填化学式)
 、碘等。
、碘等。
已知:①锌元素与铝元素的性质类似,例如氧化锌也能溶于强碱{生成
 }。
}。②本工艺条件下,相关金属离子形成氢氧化物沉淀的pH范围如下:
金属离子 |
|
|
|
|
开始沉淀的pH | 6.2 | 6.3 | 1.5 | 4.7 |
沉淀完全的pH | 8.2 | 8.3 | 2.8 | 6.8 |
回答下列问题:
(1)“碱浸”中发生反应的化学方程式为
(2)“转化”中,加入足量H2O2的目的是
(3)“调pH”时需控制该溶液的pH范围为
(4)“还原焙烧”的气体产物可循环利用到“沉锌”中。若该气体不足,“沉锌”中发生反应的离子方程式为
(5)“氧化”过程中若反应物用量比
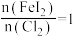 时,氧化产物为
时,氧化产物为
更新时间:2024-03-19 21:40:00
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
名校
【推荐1】纳米氧化镁是在磁性、催化方面有许多特异功能的新材料,具有重要价值。工业以菱镁矿(主要成分为MgCO3,少量FeCO3和SiO2杂质)为原料制备纳米氧化镁工艺流程如图:
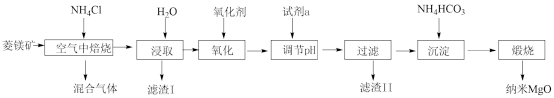
试回答下列问题:
(1)“焙烧”时生成的主要气体有___________ ;滤渣I的主要成分为___________ 。
(2)已知在该条件下金属离子开始沉淀和完全沉淀的pH如表:
上述流程中“氧化”的目的是___________ 。氧化剂常用空气或H2O2而不选用酸性KMnO4,解释其原因___________ 。
(3)试剂a可能是___________ 。
(4)资料显示煅烧MgCO3比煅烧Mg(OH)2更容易生成MgO纳米材料。“沉淀”时若将NH4HCO3更换成Na2CO3,则产生的后果是___________ 。
(5)该流程中可以循环利用的物质是___________ 。

试回答下列问题:
(1)“焙烧”时生成的主要气体有
(2)已知在该条件下金属离子开始沉淀和完全沉淀的pH如表:
| 金属离子 | Fe2+ | Fe3+ | Mg2+ |
| 开始沉淀pH | 6.3 | 1.5 | 8.9 |
| 完全沉淀pH | 8.1 | 2.8 | 10.9 |
(3)试剂a可能是
(4)资料显示煅烧MgCO3比煅烧Mg(OH)2更容易生成MgO纳米材料。“沉淀”时若将NH4HCO3更换成Na2CO3,则产生的后果是
(5)该流程中可以循环利用的物质是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】三氯化铬( )为紫色单斜晶体,熔点为83℃,易潮解,易升华,能溶于水但不易水解,高温下能被氧气氧化,工业上主要用作媒染剂和催化剂。
)为紫色单斜晶体,熔点为83℃,易潮解,易升华,能溶于水但不易水解,高温下能被氧气氧化,工业上主要用作媒染剂和催化剂。
(1)某化学小组用 和
和 在高温下制备无水三氯化铬,部分实验装置如图所示,其中锥形瓶内装有
在高温下制备无水三氯化铬,部分实验装置如图所示,其中锥形瓶内装有 ,其沸点为76.8℃。
,其沸点为76.8℃。________ 。
(2)装置D中还会生成光气( ),D中反应的化学方程式为
),D中反应的化学方程式为________ 。
(3)该实验装置有设计不合理的地方,请写出改进方法:________ 。(写一点即可)
(4)为进一步探究 的性质,某同学取试管若干支,分别加入10滴0.1
的性质,某同学取试管若干支,分别加入10滴0.1
 溶液,并用4滴2
溶液,并用4滴2
 酸化,再分别加入不同滴数的0.1
酸化,再分别加入不同滴数的0.1
 溶液,并在不同的温度下进行实验,反应现象记录于表中。
溶液,并在不同的温度下进行实验,反应现象记录于表中。
①浓度对反应的影响: 与
与 在常温下反应,观察不到
在常温下反应,观察不到 离子的橙色,甲同学认为其中一个原因是
离子的橙色,甲同学认为其中一个原因是 离子的橙色被
离子的橙色被 离子的紫红色掩盖,另一种可能的原因是
离子的紫红色掩盖,另一种可能的原因是_______ 。所以必须将反应液加热至沸腾4~5min后,才能观察到反应液由紫红色逐渐变为橙黄色的实验现象。
② 与
与 的用量对反应的影响对表中数据进行分析,在上述反应条件下,欲将
的用量对反应的影响对表中数据进行分析,在上述反应条件下,欲将 氧化为
氧化为 ,
, 与
与 最佳用量比为
最佳用量比为______ 。这与由反应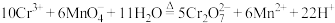 所推断得到的用量比不符,你推测的原因是
所推断得到的用量比不符,你推测的原因是________ 。
(5)Cr(Ⅲ)的存在形态的物质的量分数随溶液pH的分布如图所示。请补充完整由 溶液制备纯净的
溶液制备纯净的 的实验方案:取适量
的实验方案:取适量 溶液,
溶液,_______ ;充分反应后过滤,用蒸馏水洗涤沉淀,低温烘干沉淀,得到 晶体。
晶体。
 )为紫色单斜晶体,熔点为83℃,易潮解,易升华,能溶于水但不易水解,高温下能被氧气氧化,工业上主要用作媒染剂和催化剂。
)为紫色单斜晶体,熔点为83℃,易潮解,易升华,能溶于水但不易水解,高温下能被氧气氧化,工业上主要用作媒染剂和催化剂。(1)某化学小组用
 和
和 在高温下制备无水三氯化铬,部分实验装置如图所示,其中锥形瓶内装有
在高温下制备无水三氯化铬,部分实验装置如图所示,其中锥形瓶内装有 ,其沸点为76.8℃。
,其沸点为76.8℃。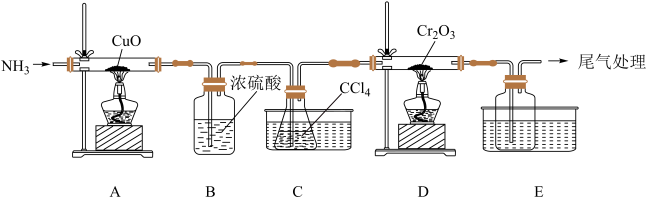
(2)装置D中还会生成光气(
 ),D中反应的化学方程式为
),D中反应的化学方程式为(3)该实验装置有设计不合理的地方,请写出改进方法:
(4)为进一步探究
 的性质,某同学取试管若干支,分别加入10滴0.1
的性质,某同学取试管若干支,分别加入10滴0.1
 溶液,并用4滴2
溶液,并用4滴2
 酸化,再分别加入不同滴数的0.1
酸化,再分别加入不同滴数的0.1
 溶液,并在不同的温度下进行实验,反应现象记录于表中。
溶液,并在不同的温度下进行实验,反应现象记录于表中。 的用量(滴数) 的用量(滴数) | 在不同温度下的反应现象 | |
| 25℃ | 90~100℃ | |
| 1 | 紫红色 | 蓝绿色溶液 |
| 2~3 | 紫红色 | 黄绿色溶液,且随 滴数增加,黄色成分增多 滴数增加,黄色成分增多 |
| 10 | 紫红色 | 澄清的橙黄色溶液 |
| 11~23 | 紫红色 | 橙黄色溶液,有棕褐色沉淀,且随 滴数增加,沉淀增多 滴数增加,沉淀增多 |
| 24~25 | 紫红色 | 紫红色溶液,有较多的棕褐色沉淀 |
 与
与 在常温下反应,观察不到
在常温下反应,观察不到 离子的橙色,甲同学认为其中一个原因是
离子的橙色,甲同学认为其中一个原因是 离子的橙色被
离子的橙色被 离子的紫红色掩盖,另一种可能的原因是
离子的紫红色掩盖,另一种可能的原因是②
 与
与 的用量对反应的影响对表中数据进行分析,在上述反应条件下,欲将
的用量对反应的影响对表中数据进行分析,在上述反应条件下,欲将 氧化为
氧化为 ,
, 与
与 最佳用量比为
最佳用量比为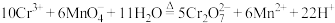 所推断得到的用量比不符,你推测的原因是
所推断得到的用量比不符,你推测的原因是(5)Cr(Ⅲ)的存在形态的物质的量分数随溶液pH的分布如图所示。请补充完整由
 溶液制备纯净的
溶液制备纯净的 的实验方案:取适量
的实验方案:取适量 溶液,
溶液, 晶体。
晶体。
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】钨是熔点最高的金属,在国民经济和国防军工领域具有重要用途。工业上用白钨矿(主要成分是CaWO4)生产金属钨粉的流程如图:
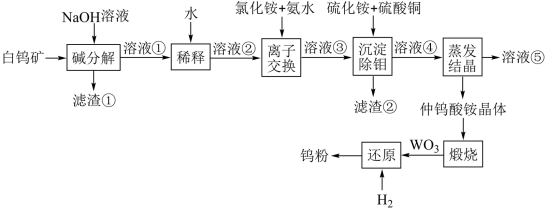
请根据上述流程回答以下问题:
(1)白钨矿与氢氧化钠反应的其中一个产物是可溶于水的钨酸钠,写出该化学反应方程式:_____ 。
(2)溶液②为钨酸钠溶液,经离子交换后得到溶液③为钨酸铵溶液,该过程中加入氨水的作用是调节溶液的pH和_____ 。
(3)溶液④为钨酸铵溶液,其经过蒸发结晶后得到仲钨酸铵[(NH4)10W12O41·5H2O]晶体,结晶过程中钨酸铵溶液没有完全蒸干,还得到溶液⑤,主要原因是_____ 。
(4)溶液⑤进入“离子交换”中循环使用,其目的为_____ (填编号)。
A.转变为钨酸铵 B.回收硫酸铵 C.提升钨的收率 D.富集钨元素
(5)请写出仲钨酸铵煅烧分解的反应方程式:_____ 。
(6)“沉淀除钼”,先加入硫化铵,把钼酸铵转化为硫代钼酸铵,再加入硫酸铜。加入硫酸铜溶液的作用是_____ 。(填编号)。
A.生成CuS沉淀,除去多余的硫化铵
B.生成硫代钼酸铜沉淀而除去
C.生成更多的钨酸铵
D.氧化钼酸铵,形成沉淀而除去
(7)用氢气或Al均可还原WO3,为得到纯度较高的产品,应选择的方法是_____ (填“氢气还原”或“Al还原”)。

请根据上述流程回答以下问题:
(1)白钨矿与氢氧化钠反应的其中一个产物是可溶于水的钨酸钠,写出该化学反应方程式:
(2)溶液②为钨酸钠溶液,经离子交换后得到溶液③为钨酸铵溶液,该过程中加入氨水的作用是调节溶液的pH和
(3)溶液④为钨酸铵溶液,其经过蒸发结晶后得到仲钨酸铵[(NH4)10W12O41·5H2O]晶体,结晶过程中钨酸铵溶液没有完全蒸干,还得到溶液⑤,主要原因是
(4)溶液⑤进入“离子交换”中循环使用,其目的为
A.转变为钨酸铵 B.回收硫酸铵 C.提升钨的收率 D.富集钨元素
(5)请写出仲钨酸铵煅烧分解的反应方程式:
(6)“沉淀除钼”,先加入硫化铵,把钼酸铵转化为硫代钼酸铵,再加入硫酸铜。加入硫酸铜溶液的作用是
A.生成CuS沉淀,除去多余的硫化铵
B.生成硫代钼酸铜沉淀而除去
C.生成更多的钨酸铵
D.氧化钼酸铵,形成沉淀而除去
(7)用氢气或Al均可还原WO3,为得到纯度较高的产品,应选择的方法是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐1】硅酸钠被国家列为“我国优先发展的精细化学品”和“今后我国无机化工产品发展重点”之一.如图是用海边的石英砂(含氯化钠、氧化铁等杂质)制备硅酸钠的工艺流程示意简图:
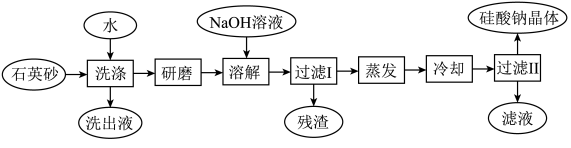
(1)要将上流程图中洗出液中的溶质析出,采用的方法是_____________;
(2)蒸发时用到的硅酸盐仪器有_____________ ;
(3)在以上流程中,要将洗净的石英砂研磨成粉末,目的是_____________;
(4)上流程中加入NaOH溶液,反应的离子方程式是_____________ ;
(5)硅酸钠溶液呈碱性,其原因是(用一离子方程式表示)_____________ ,硅酸钠的用途很广,其中的一种用途是_____________ ;
(6)用上流程中的残渣来焊接铁轨,反应的化学方程式是_____________ 。

(1)要将上流程图中洗出液中的溶质析出,采用的方法是_____________;
| A.蒸发结晶 | B.冷却结晶 | C.先蒸发,再冷却结晶 | D.先冷却,再蒸发结晶 |
(3)在以上流程中,要将洗净的石英砂研磨成粉末,目的是_____________;
| A.增加反应物的浓度,增大化学反应速率,提高生产效率 |
| B.作为催化剂载体,增加反应物与催化剂接触面积,增加反应速率,提高生产效率 |
| C.增加反应物之间的接触面积,增大反应速率,提高生产效率 |
| D.增加正反应速率,减小逆反应速率,使平衡向正反应方向移动,降低生产成本 |
(5)硅酸钠溶液呈碱性,其原因是(用一离子方程式表示)
(6)用上流程中的残渣来焊接铁轨,反应的化学方程式是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】柠檬酸铁铵[(NH4)3Fe(C6H5O7)2]易溶于水,不溶于乙醇等有机溶剂,是一种含铁量较高的补铁剂.实验室利用柠檬酸(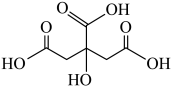 )制备柠檬酸铁铵的实验步骤如下:
)制备柠檬酸铁铵的实验步骤如下:
ii.降温至40℃,滴加一定量的氨水充分反应,生成柠檬酸亚铁铵(NH4FeC6H5O7)。
iii.控温40℃,缓慢滴加一定量的双氧水充分反应,经一系列操作,得到产品。
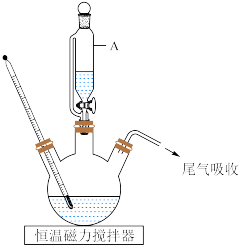
回答下列问题:
(1)仪器A的名称是
(2)步骤i中,若柠檬酸加入量逐渐增多,最终会导致柠檬酸铁铵的含铁量逐渐减少,可能的原因是
(3)步骤ii、iii中均需控温40℃的原因是
(4)步骤iii中制备柠檬酸铁铵的化学方程式
(5)为了测定产品的纯度,实验的基本原理是将Fe3+还原成Fe2+后,采用分光光度法来测定纯度.实验时测得样品的纯度显著偏低,检查实验发现配制样品溶液时少加了一种还原试剂,该试剂应为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】氰化钠是一种重要的基本化工原料,同时也是一种剧毒物质。一旦泄漏需要及时处理,一般可以通过喷洒双氧水或过硫酸钠(Na2S2O8)溶液来处理,以减轻环境污染。工业制备过硫酸钠的反应原理如下:
主反应:(NH4)2S2O8+2NaOH Na2S2O8+2NH3↑+2H2O
Na2S2O8+2NH3↑+2H2O
副反应:2 NH3+3Na2S2O8+2NaOH 6Na2SO4+6H2O +N2
6Na2SO4+6H2O +N2
某化学兴趣小组利用上述原理在实验室制备过硫酸钠,并检测用过硫酸钠溶液处理后的氰化钠废水是否达标排放。
【实验一】实验室通过如图所示装置制备Na2S2O8。
(1)图中仪器E的名称为____________ ,欲控制通入O2的通入速率,采取的有效措施为_______ (答一条)
(2)装置a中反应产生的气体需要持续通入装置c的原因是____________________ 。
(3)上述装置中还需补充的实验仪器或装置有_______ (填字母)。
A.温度计 B.洗气瓶 C.水浴装置 D.酒精灯
【实验二】测定用过硫酸钠溶液处理后的废水中氰化钠的含量。
已知:①废水中氰化钠的最高排放标准为0.50 mg·L-1。②Ag++2CN-=[Ag(CN)2]-,Ag++I-=AgI↓,AgI呈黄色,且CN-优先与Ag+反应。实验如下:取100.00 mL处理后的氰化钠废水于锥形瓶中,并滴加几滴KI溶液作指示剂,用1.00×10-4 mol·L-1的标准AgNO3溶液滴定,消耗AgNO3溶液的体积为1.50 mL。
(4)滴定终点的现象是________________________________________ 。
(5)处理后的废水中氰化钠的浓度________ (填“符合”“不符合”)排放标准。
主反应:(NH4)2S2O8+2NaOH
 Na2S2O8+2NH3↑+2H2O
Na2S2O8+2NH3↑+2H2O副反应:2 NH3+3Na2S2O8+2NaOH
 6Na2SO4+6H2O +N2
6Na2SO4+6H2O +N2某化学兴趣小组利用上述原理在实验室制备过硫酸钠,并检测用过硫酸钠溶液处理后的氰化钠废水是否达标排放。
【实验一】实验室通过如图所示装置制备Na2S2O8。
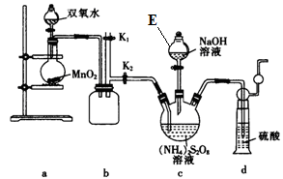
(1)图中仪器E的名称为
(2)装置a中反应产生的气体需要持续通入装置c的原因是
(3)上述装置中还需补充的实验仪器或装置有
A.温度计 B.洗气瓶 C.水浴装置 D.酒精灯
【实验二】测定用过硫酸钠溶液处理后的废水中氰化钠的含量。
已知:①废水中氰化钠的最高排放标准为0.50 mg·L-1。②Ag++2CN-=[Ag(CN)2]-,Ag++I-=AgI↓,AgI呈黄色,且CN-优先与Ag+反应。实验如下:取100.00 mL处理后的氰化钠废水于锥形瓶中,并滴加几滴KI溶液作指示剂,用1.00×10-4 mol·L-1的标准AgNO3溶液滴定,消耗AgNO3溶液的体积为1.50 mL。
(4)滴定终点的现象是
(5)处理后的废水中氰化钠的浓度
您最近一年使用:0次







