名校
解题方法
1 . 甲醇是一种可再生能源,具有广泛的开发和应用前景。工业上一般采用下列两种反应合成甲醇。
反应Ⅰ:CO(g)+2H2(g) CH3OH(g) ΔH1
CH3OH(g) ΔH1
反应Ⅱ:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH2
CH3OH(g)+H2O(g) ΔH2
下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(KⅠ):
(1)在一定条件下将2 mol CO和6 mol H2充入2 L的密闭容器中发生反应Ⅰ,5 min后测得c(CO)=0.4 mol·L-1,计算可得此段时间的反应速率(用H2表示)为________ mol·L-1·min-1。
(2)由表中数据判断ΔH1______ (填“>”“<”或“=”)0;反应CO2(g)+H2(g)  CO(g)+H2O(g) ΔH3=
CO(g)+H2O(g) ΔH3=_________ (用ΔH1和ΔH2表示)。
(3)若容器容积不变,则下列措施可提高反应Ⅰ中CO转化率的是______ (填序号)。
a.充入CO,使体系总压强增大
b.将CH3OH(g)从体系中分离
c.充入He,使体系总压强增大
d.使用高效催化剂
(4)写出反应Ⅱ的化学平衡常数表达式:KⅡ=__________________ ;保持恒温恒容,将反应Ⅱ的平衡体系中各物质浓度均增大为原来的2倍,则化学平衡_______ (填“正向”“逆向”或“不”)移动,平衡常数KⅡ__________ (填“变大”“变小”或“不变”)。
(5)比较这两种合成甲醇的方法,原子利用率较高的是______ (填“Ⅰ”或“Ⅱ”)。
反应Ⅰ:CO(g)+2H2(g)
 CH3OH(g) ΔH1
CH3OH(g) ΔH1反应Ⅱ:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH2
CH3OH(g)+H2O(g) ΔH2下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(KⅠ):
| 温度 | 250 ℃ | 300 ℃ | 350 ℃ |
| KⅠ | 2.0 | 0.27 | 0.012 |
(1)在一定条件下将2 mol CO和6 mol H2充入2 L的密闭容器中发生反应Ⅰ,5 min后测得c(CO)=0.4 mol·L-1,计算可得此段时间的反应速率(用H2表示)为
(2)由表中数据判断ΔH1
 CO(g)+H2O(g) ΔH3=
CO(g)+H2O(g) ΔH3=(3)若容器容积不变,则下列措施可提高反应Ⅰ中CO转化率的是
a.充入CO,使体系总压强增大
b.将CH3OH(g)从体系中分离
c.充入He,使体系总压强增大
d.使用高效催化剂
(4)写出反应Ⅱ的化学平衡常数表达式:KⅡ=
(5)比较这两种合成甲醇的方法,原子利用率较高的是
您最近一年使用:0次
2018-04-22更新
|
697次组卷
|
10卷引用:黑龙江省五校(嫩江市第一中学、嫩江市职业高中、伊拉哈中学、海江中学等)2021-2022学年高二上学期期中联考化学试题
黑龙江省五校(嫩江市第一中学、嫩江市职业高中、伊拉哈中学、海江中学等)2021-2022学年高二上学期期中联考化学试题江苏省吴江汾湖高级中学2020-2021学年高二下学期阶段性教学质量检测化学试题云南省曲靖市马龙二中2020-2021学年高二5月月考化学试题山西省运城市芮城中学2021-2022学年高二上学期阶段性月考化学试题四川省宜宾市南溪一中2017-2018学年高二下学期第一次月考化学试题(已下线)2019年9月29日《每日一题》选修4—— 每周一测(已下线)考点12 化学反应速率化学平衡——《备战2020年高考精选考点专项突破题集》山东省临沂市费县地区化学2020-2021学年高二上学期9月月考化学试题人教版(2019)高二化学选择性必修1第二章 化学反应速率与化学平衡 过素养 学科素养拓展训练河南省正阳县高级中学2020-2021学年高二上学期第二次素质检测化学试题
名校
2 . 1 L 0.5 mol·L-1 H2SO4溶液与足量Ba(OH)2稀溶液反应放出a kJ热量;1 L 0.5 mol·L-1 HCl溶液与足量NaOH稀溶液充分反应放出b kJ热量;则500 mL 0.4 mol·L-1 BaCl2溶液与足量稀硫酸反应放出的热量为( )
| A.0.4(a+2b) kJ | B.0.4(a-2b) kJ |
| C.0.2(a-2b) kJ | D.0.2(a+2b) kJ |
您最近一年使用:0次
2017-06-24更新
|
198次组卷
|
5卷引用:黑龙江省哈尔滨市哈师大附中2020-2021学年高一下学期期中考试化学试题
真题
名校
3 . 资源的高效利用对保护环境、促进经济持续健康发展具有重要作用。磷尾矿主要含Ca5(PO4)3F和CaCO3·MgCO3。某研究小组提出了磷尾矿综合利用的研究方案,制备具有重要工业用途的CaCO3、Mg(OH)2、P4和H2,其简化流程如下:
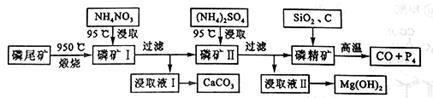
已知:①Ca5(PO4)3F在950℃不分解;
②4Ca5(PO4)3F+18SiO2+30C 2CaF2+30CO+18CaSiO3+3P4
2CaF2+30CO+18CaSiO3+3P4
请回答下列问题:
(1)950℃煅烧磷尾矿生成气体的主要成分是___________ 。
(2)实验室过滤所需的玻璃仪器是_____________ 。
(3)NH4NO3溶液能从磷矿Ⅰ中浸取出Ca2+的原因是__________ 。
(4)在浸取液Ⅱ中通入NH3,发生反应的化学方程式是____________ 。
(5)工业上常用磷精矿[Ca5(PO4)3F]和硫酸反应制备磷酸。已知25℃,101kPa时:
CaO(s)+H2SO4(l)=CaSO4(s)+H2O(l) ΔH=-271kJ/mol
5 CaO(s)+3H3PO4(l)+HF(g)= Ca5(PO4)3F (s)+5H2O(l) ΔH=-937kJ/mol
则Ca5(PO4)3F和硫酸反应生成磷酸的热化学方程式是_________________ 。
(6)在一定条件下CO(g)+H2O(g) CO2(g)+H2(g),当CO与H2O(g)的起始物质的量之比为1:5,达平衡时,CO转化了
CO2(g)+H2(g),当CO与H2O(g)的起始物质的量之比为1:5,达平衡时,CO转化了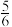 。若a kg含Ca5(PO4)3F(相对分子质量为504)的质量分数为10%的磷尾矿,在上述过程中有b%的Ca5(PO4)3F转化为P4,将产生的CO与H2O(g)按起始物质的量之比1:3混合,则相同条件下达平衡时能产生H2
。若a kg含Ca5(PO4)3F(相对分子质量为504)的质量分数为10%的磷尾矿,在上述过程中有b%的Ca5(PO4)3F转化为P4,将产生的CO与H2O(g)按起始物质的量之比1:3混合,则相同条件下达平衡时能产生H2________ kg。

已知:①Ca5(PO4)3F在950℃不分解;
②4Ca5(PO4)3F+18SiO2+30C
 2CaF2+30CO+18CaSiO3+3P4
2CaF2+30CO+18CaSiO3+3P4请回答下列问题:
(1)950℃煅烧磷尾矿生成气体的主要成分是
(2)实验室过滤所需的玻璃仪器是
(3)NH4NO3溶液能从磷矿Ⅰ中浸取出Ca2+的原因是
(4)在浸取液Ⅱ中通入NH3,发生反应的化学方程式是
(5)工业上常用磷精矿[Ca5(PO4)3F]和硫酸反应制备磷酸。已知25℃,101kPa时:
CaO(s)+H2SO4(l)=CaSO4(s)+H2O(l) ΔH=-271kJ/mol
5 CaO(s)+3H3PO4(l)+HF(g)= Ca5(PO4)3F (s)+5H2O(l) ΔH=-937kJ/mol
则Ca5(PO4)3F和硫酸反应生成磷酸的热化学方程式是
(6)在一定条件下CO(g)+H2O(g)
 CO2(g)+H2(g),当CO与H2O(g)的起始物质的量之比为1:5,达平衡时,CO转化了
CO2(g)+H2(g),当CO与H2O(g)的起始物质的量之比为1:5,达平衡时,CO转化了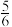 。若a kg含Ca5(PO4)3F(相对分子质量为504)的质量分数为10%的磷尾矿,在上述过程中有b%的Ca5(PO4)3F转化为P4,将产生的CO与H2O(g)按起始物质的量之比1:3混合,则相同条件下达平衡时能产生H2
。若a kg含Ca5(PO4)3F(相对分子质量为504)的质量分数为10%的磷尾矿,在上述过程中有b%的Ca5(PO4)3F转化为P4,将产生的CO与H2O(g)按起始物质的量之比1:3混合,则相同条件下达平衡时能产生H2
您最近一年使用:0次
2016-12-09更新
|
2890次组卷
|
5卷引用:黑龙江省密山四中2020-2021学年高二下学期期末考试化学试题



