解题方法
1 . (I)A、B、C、D均为中学化学常见的纯净物,A是单质。它们之间有如下的反应关系:
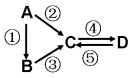
(1)若B是淡黄色固体,②③反应均用到同一种液态氢化物。D物质常用于食品工业。写出④反应的化学方程式___________________________ 。
(2)若B是气态氢化物。C、D是氧化物且会造成光化学烟雾污染。写出③反应的化学方程式______________ 。
(3)若D物质具有两性,②③反应均要用强碱溶液,④反应是通入过量的一种引起温室效应的主要气体。写出④反应离子方程式________________________ 。
(4)若A是太阳能电池用的光伏材料。C、D为钠盐,两种物质中钠、氧外的元素为同一主族,且溶液均显碱性。写出②反应的化学方程式________________________ 。
(5)若A是应用最广泛的金属。④反应用到A,②⑤反应均用到同一种非金属单质。写出④反应的离子方程式______________________________________________ 。
(II)在温度相同、体积均为1 L的三个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下。已知:2SO2(g)+O2(g) 2SO3(g) ΔH =-98.3kJ·mol-1。
2SO3(g) ΔH =-98.3kJ·mol-1。
则:α1+α2=_________________ ,p=________________ mol,b+c="_______________ kJ" 。
(III)HA、H2B、H3C三种弱酸,根据“较强酸+较弱酸盐=较强酸盐+较弱酸”的反应规律,它们之间能发生下列反应:A.HA+HC2-(少量)=A-+H2C- B.H2B(少量)+2A-=B2-+2HA
C.H2B(少量)+H2C-=HB-+H3C
回答下列问题:
(1)相同条件下,HA、H2B、H3C三种酸中,酸性最强的是_____________ 。
(2)A-、B2-、C3-、HB-、H2C-、HC2-六种离子中,最易结合质子(H+)的是_________ ,最难结合质子的是____________ 。
(3)完成下列反应的离子方程式HA(过量)+C3-:________________________________ 。
(IV)在25下,将a mol/L的氨水与0.01 mol/L的盐酸等体积混合,反应平衡时溶液中c(NH4+) = c(Cl-),则溶液显______________ (填“酸”、“碱”或“中”)性;用含a的代数式表示NH3·H2O的电离常数Kb=_____________ 。

(1)若B是淡黄色固体,②③反应均用到同一种液态氢化物。D物质常用于食品工业。写出④反应的化学方程式
(2)若B是气态氢化物。C、D是氧化物且会造成光化学烟雾污染。写出③反应的化学方程式
(3)若D物质具有两性,②③反应均要用强碱溶液,④反应是通入过量的一种引起温室效应的主要气体。写出④反应离子方程式
(4)若A是太阳能电池用的光伏材料。C、D为钠盐,两种物质中钠、氧外的元素为同一主族,且溶液均显碱性。写出②反应的化学方程式
(5)若A是应用最广泛的金属。④反应用到A,②⑤反应均用到同一种非金属单质。写出④反应的离子方程式
(II)在温度相同、体积均为1 L的三个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下。已知:2SO2(g)+O2(g)
 2SO3(g) ΔH =-98.3kJ·mol-1。
2SO3(g) ΔH =-98.3kJ·mol-1。| 容 器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 2 mol SO2、1 mol O2 | 2 mol SO3 | m mol SO2、n mol O2、p mol SO3 |
| c(SO3) /mol·L-1 | 1.4 | 1.4 | 1.4 |
| 能量变化 | 放出a kJ | 吸收b kJ | 吸收c kJ |
| SO2或SO3的转化率 | α1 | α2 | 12.5% |
则:α1+α2=
(III)HA、H2B、H3C三种弱酸,根据“较强酸+较弱酸盐=较强酸盐+较弱酸”的反应规律,它们之间能发生下列反应:A.HA+HC2-(少量)=A-+H2C- B.H2B(少量)+2A-=B2-+2HA
C.H2B(少量)+H2C-=HB-+H3C
回答下列问题:
(1)相同条件下,HA、H2B、H3C三种酸中,酸性最强的是
(2)A-、B2-、C3-、HB-、H2C-、HC2-六种离子中,最易结合质子(H+)的是
(3)完成下列反应的离子方程式HA(过量)+C3-:
(IV)在25下,将a mol/L的氨水与0.01 mol/L的盐酸等体积混合,反应平衡时溶液中c(NH4+) = c(Cl-),则溶液显
您最近一年使用:0次
解题方法
2 . 研究发现铜具有独特的杀菌功能, 能较好地抑制病菌的生长。现有工业上由辉铜矿石(主要成分Cu2S)的冶炼铜两种方案:
Ⅰ 火法炼铜在1200℃发生的主要反应为:
①2Cu2S+3O2=2Cu2O+2SO2 ②2Cu2O+Cu2S= 6Cu+SO2↑
此方案的尾气可以用表中方法处理
Ⅱ“细菌冶金”是利用某些细菌的特殊代谢功能开采金属矿石,例如溶液中亚铁硫杆菌能利用空气中的氧气将黄铁矿(主要成分FeS2)氧化为Fe2(SO4)3,并使溶液酸性增强;利用Fe2(SO4)3作氧化剂溶解辉铜矿石,溶液酸性又进一步增强,过滤未溶解完的辉铜矿石,在滤液中加入足量的铁屑,待反应完全后过滤出铜和剩余的铁屑,得溶液Xml(设整个过程中其它杂质不参与反应,不考虑溶液离子水解)。其流程如图:

(1)Ⅱ相对于Ⅰ的优点是______________________________ 。(说一点即可)
(2)Ⅰ中反应2Cu2O+Cu2S= 6Cu+SO2↑氧化剂是________
(3)已知CO的燃烧热283. 0 kJ·mol-1,写出S(g)与O2(g)反应生成SO2(g)的热化学方程式___________ 。
(4)若用Ⅰ中方法2吸收尾气,则开始时阳极的电极反应式为________________ 。
(5)写出Ⅱ中黄铁矿氧化过程的化学反应方程式______________________________
(6)假设Ⅱ中每一步都完全反应,消耗掉标况下空气5×22.4VL(氧气体积分数为20%),则所得c(Fe2+)=________________ (可以写表达式)。
Ⅰ 火法炼铜在1200℃发生的主要反应为:
①2Cu2S+3O2=2Cu2O+2SO2 ②2Cu2O+Cu2S= 6Cu+SO2↑
此方案的尾气可以用表中方法处理
| 方法1 | 用生物质热解气(主要成分CO、CH4、H2)将SO2在高温下还原成单质硫,其部分热化学方程式为: 2CO(g)+SO2(g)= S(g)+2CO2(g) ΔH="+8." 0 kJ·mol-1 2H2(g)+SO2(g)= S(g)+2H2O(g) ΔH="+90." 4 kJ·mol-1 |
| 方法2 | 用Na2SO3溶液充分吸收SO2得NaHSO3溶液,然后电解该溶液可制得硫酸 |

(1)Ⅱ相对于Ⅰ的优点是
(2)Ⅰ中反应2Cu2O+Cu2S= 6Cu+SO2↑氧化剂是
(3)已知CO的燃烧热283. 0 kJ·mol-1,写出S(g)与O2(g)反应生成SO2(g)的热化学方程式
(4)若用Ⅰ中方法2吸收尾气,则开始时阳极的电极反应式为
(5)写出Ⅱ中黄铁矿氧化过程的化学反应方程式
(6)假设Ⅱ中每一步都完全反应,消耗掉标况下空气5×22.4VL(氧气体积分数为20%),则所得c(Fe2+)=
您最近一年使用:0次



