1 . 氨气广泛应用于化工、轻工、化肥、制药、合成纤维等领域,合成氨工业极大地影响了人类的发展历程。
(1)工业上用氨和二氧化碳为原料,在一定条件下合成尿素CO(NH2)2,已知:
①2NH3(g)+CO2(g)=NH2COONH4(s) ΔH = -159.5kJ/mol
②NH2COONH4(s)=CO(NH2)2(s)+H2O(g) ΔH = +116.5kJ/mol
③H2O(l)=H2O(g) ΔH = +44.0kJ/mol
写出氨气与二氧化碳生成尿素和液态水的热化学反应方程式__________ 。
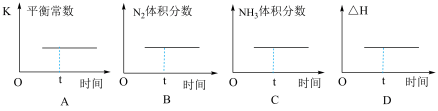
(2)已知反应N2(g)+3H2(g)⇌2NH3(g) ΔH <0,一定温度下,将N2和H2以物质的量之比为1∶1充入盛有催化剂的密闭容器,下列图象t时刻一定处于平衡状态的是______ 。
(3)200℃时,将N2(g)和H2(g)以物质的量之比为1∶3充入恒压容器中,容器内起始压强为P0,达到平衡时N2的转化率为50%,则该反应的平衡常数KP=___________ (用含有P0的式子表示。KP为分压平衡常数,气体分压=气体总压强×该气体的体积分数)
(4)某温度下,将一定量的NH3充入盛有催化剂的恒容容器中,一段时间达到平衡后,升高温度,当再次达到平衡时,N2的分压增大,原因是_________ 。
(5)我国科学家利用密度泛函理论筛选出合成氨的优良催化剂——担载单原子钼的缺陷硼氮单层材料,反应历程如图:
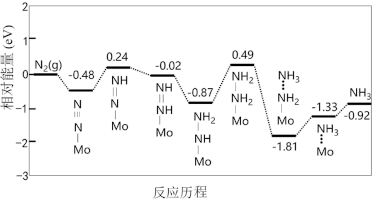
该反应历程中需要吸收能量的最大能垒(活化能)E=__________ eV。
(6)中科院大连化物所应用混合导体透氧膜制备氨合成气和液体燃料合成气,工作原理如图所示,请写出膜Ⅰ侧H2O发生的电极反应方程式:_________ 。

(7)25℃时,将2a mol/L的稀氨水与a mol/L的盐酸等体积混合后,试比较下列关系的大小(填“<”“>”或“=”):c(NH ) + c(H+)
) + c(H+)____ c(NH3∙H2O) + c(OH-) (NH3∙H2O的Kb=1.8×10-5)
(1)工业上用氨和二氧化碳为原料,在一定条件下合成尿素CO(NH2)2,已知:
①2NH3(g)+CO2(g)=NH2COONH4(s) ΔH = -159.5kJ/mol
②NH2COONH4(s)=CO(NH2)2(s)+H2O(g) ΔH = +116.5kJ/mol
③H2O(l)=H2O(g) ΔH = +44.0kJ/mol
写出氨气与二氧化碳生成尿素和液态水的热化学反应方程式
(2)已知反应N2(g)+3H2(g)⇌2NH3(g) ΔH <0,一定温度下,将N2和H2以物质的量之比为1∶1充入盛有催化剂的密闭容器,下列图象t时刻一定处于平衡状态的是

(3)200℃时,将N2(g)和H2(g)以物质的量之比为1∶3充入恒压容器中,容器内起始压强为P0,达到平衡时N2的转化率为50%,则该反应的平衡常数KP=
(4)某温度下,将一定量的NH3充入盛有催化剂的恒容容器中,一段时间达到平衡后,升高温度,当再次达到平衡时,N2的分压增大,原因是
(5)我国科学家利用密度泛函理论筛选出合成氨的优良催化剂——担载单原子钼的缺陷硼氮单层材料,反应历程如图:

该反应历程中需要吸收能量的最大能垒(活化能)E=
(6)中科院大连化物所应用混合导体透氧膜制备氨合成气和液体燃料合成气,工作原理如图所示,请写出膜Ⅰ侧H2O发生的电极反应方程式:

(7)25℃时,将2a mol/L的稀氨水与a mol/L的盐酸等体积混合后,试比较下列关系的大小(填“<”“>”或“=”):c(NH
 ) + c(H+)
) + c(H+)
您最近一年使用:0次
名校
解题方法
2 . “低碳经济”正成为科学家研究的主要课题,为了减少空气中的温室气体,并且充分利用二氧化碳资源,科学家们设想了一系列捕捉和封存二氧化碳的方法。
(1)有科学家提出可利用FeO吸收和利用CO2,相关热化学方程式如下:
6FeO(s)+CO2(g)=2Fe3O4(s)+C(s) ΔH=-76.0kJ·mol-1
①上述反应中每生成1molFe3O4,转移电子的物质的量为_______ mol。
②已知:C(s)+2H2O(g)=CO2(g)+2H2(g) △H=+113.4kJ·mol-1,则反应:3FeO(s)+H2O(g)=Fe3O4(s)+H2(g)的△H=__________ 。
(2)用氨水捕集烟气中的CO2生成铵盐是减少CO2排放的可行措施之一。
①分别用不同pH的吸收剂吸收烟气中的CO2,CO2脱除效率与吸收剂的pH关系如图所示,若烟气中CO2的含量(体积分数)为12%,烟气通入氨水的流量为0.052 m3·h-1(标准状况),用pH为12.81的氨水吸收烟气30min,脱除的CO2的物质的量最多为____________ (精确到0.01)。
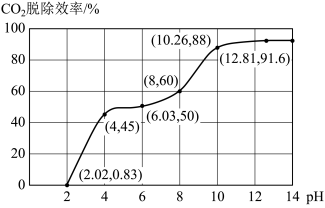
②通常情况下温度升高,CO2脱除效率提高,但高于40℃时,脱除CO2效率降低的主要原因是______________ 。
(3)一定条件下,Pd-Mg/SiO2催化剂可使CO2“甲烷化”从而变废为宝,其反应机理如图所示,回答下列问题:
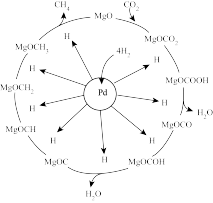
① 该反应的化学方程式为________________ ;反应过程中碳元素的化合价为-2价的中间体是_________ 。
② 向一容积为2L的恒容密闭容器中充入一定量的CO2和H2,在300℃时发生上述反应,达到平衡时各物质的浓度分别为CO2:0.2mol·L-1、H2:0.8mol·L-1、CH4:0.8mol·L-1、H2O:1.6mol·L-1,CO2的平衡转化率为_________________ ;300℃时上述反应的平衡常数K=___________________ 。
③已知该反应正反应放热,现有两个相同恒容绝热(与外界无热量交换)密闭容器Ⅰ、Ⅱ,在Ⅰ中充入1molCO2和4molH2,在Ⅱ中充入1molCH4和2molH2O(g),300℃下开始反应。达到平衡时,下列说法正确的是________ (填字母):
A.容器Ⅰ、Ⅱ中正反应速率相同
B.容器Ⅰ、Ⅱ中CH4的物质的量分数相同
C.容器Ⅰ中CO2的物质的量比容器Ⅱ中的多
D.容器Ⅰ中CO2的转化率与容器Ⅱ中CH4的转化率之和小于1。
(1)有科学家提出可利用FeO吸收和利用CO2,相关热化学方程式如下:
6FeO(s)+CO2(g)=2Fe3O4(s)+C(s) ΔH=-76.0kJ·mol-1
①上述反应中每生成1molFe3O4,转移电子的物质的量为
②已知:C(s)+2H2O(g)=CO2(g)+2H2(g) △H=+113.4kJ·mol-1,则反应:3FeO(s)+H2O(g)=Fe3O4(s)+H2(g)的△H=
(2)用氨水捕集烟气中的CO2生成铵盐是减少CO2排放的可行措施之一。
①分别用不同pH的吸收剂吸收烟气中的CO2,CO2脱除效率与吸收剂的pH关系如图所示,若烟气中CO2的含量(体积分数)为12%,烟气通入氨水的流量为0.052 m3·h-1(标准状况),用pH为12.81的氨水吸收烟气30min,脱除的CO2的物质的量最多为

②通常情况下温度升高,CO2脱除效率提高,但高于40℃时,脱除CO2效率降低的主要原因是
(3)一定条件下,Pd-Mg/SiO2催化剂可使CO2“甲烷化”从而变废为宝,其反应机理如图所示,回答下列问题:

① 该反应的化学方程式为
② 向一容积为2L的恒容密闭容器中充入一定量的CO2和H2,在300℃时发生上述反应,达到平衡时各物质的浓度分别为CO2:0.2mol·L-1、H2:0.8mol·L-1、CH4:0.8mol·L-1、H2O:1.6mol·L-1,CO2的平衡转化率为
③已知该反应正反应放热,现有两个相同恒容绝热(与外界无热量交换)密闭容器Ⅰ、Ⅱ,在Ⅰ中充入1molCO2和4molH2,在Ⅱ中充入1molCH4和2molH2O(g),300℃下开始反应。达到平衡时,下列说法正确的是
A.容器Ⅰ、Ⅱ中正反应速率相同
B.容器Ⅰ、Ⅱ中CH4的物质的量分数相同
C.容器Ⅰ中CO2的物质的量比容器Ⅱ中的多
D.容器Ⅰ中CO2的转化率与容器Ⅱ中CH4的转化率之和小于1。
您最近一年使用:0次
2018-04-13更新
|
367次组卷
|
3卷引用:2017-2018学年人教版选修4化学平衡之平衡状态的判断习题专项训练题



