解题方法
1 . 工业上以黄铁矿为原料制备硫酸的原理示意图如下。
(1)黄铁矿主要成分的化学式是_______ 。
(2)SO2使品红溶液褪色,体现SO2具有_______ 性。
(3)步骤Ⅲ的化学方程式是_______ 。
(4)下列说法不正确 的是_______。

(1)黄铁矿主要成分的化学式是
(2)SO2使品红溶液褪色,体现SO2具有
(3)步骤Ⅲ的化学方程式是
(4)下列说法
| A.步骤Ⅰ前需将黄铁矿粉碎,目的是增大接触面积,加快反应速率 |
| B.步骤Ⅱ中使用催化剂,能使SO2的转化率达到100% |
| C.步骤Ⅲ中选用98.3%的浓硫酸作吸收剂 |
| D.图中每一步含硫物质均发生氧化反应 |
您最近一年使用:0次
解题方法
2 .  溶液在工业上用于蚀刻铜箔电路板,从蚀刻后的废液中可回收铜并使蚀刻液再生,流程如图所示(省略部分物质)。
溶液在工业上用于蚀刻铜箔电路板,从蚀刻后的废液中可回收铜并使蚀刻液再生,流程如图所示(省略部分物质)。 蚀刻铜箔的离子方程式
蚀刻铜箔的离子方程式_____ 。
2.要检验废液中是否还存在 ,实验方案是
,实验方案是_____ 。
3.操作I的名称是_____(单选)
4.为了从固体中分离出铜,需加入的试剂X是_____。(单选)
5.若要使溶液Ⅱ再生为蚀刻液,可选用的试剂是_____ (填化学式)。发生反应的化学方程式是_____ 。
 溶液在工业上用于蚀刻铜箔电路板,从蚀刻后的废液中可回收铜并使蚀刻液再生,流程如图所示(省略部分物质)。
溶液在工业上用于蚀刻铜箔电路板,从蚀刻后的废液中可回收铜并使蚀刻液再生,流程如图所示(省略部分物质)。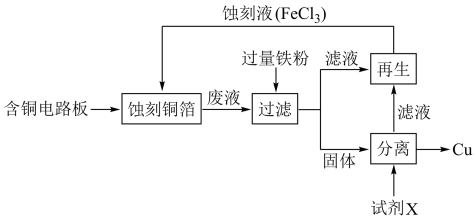
 蚀刻铜箔的离子方程式
蚀刻铜箔的离子方程式2.要检验废液中是否还存在
 ,实验方案是
,实验方案是3.操作I的名称是_____(单选)
| A.蒸发 | B.结晶 | C.过滤 | D.分液 |
A. | B. | C. | D. |
您最近一年使用:0次
解题方法
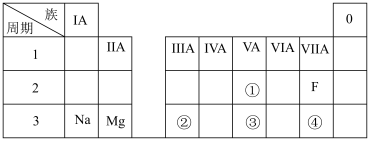
3 . 下表是元素周期表的一部分,除标出的元素外,表中的每个编号代表一种元素,请根据要求回答问题:________ 。
(2)表中所列元素中,金属性最强的是________ (填元素符号)。
(3)①、②的原子半径大小关系:①________ (填“>”或“<”)②。
(4)②的最高价氧化物与④的最简单氢化物的水溶液反应的离子方程式是________________________ 。
(2)表中所列元素中,金属性最强的是
(3)①、②的原子半径大小关系:①
(4)②的最高价氧化物与④的最简单氢化物的水溶液反应的离子方程式是
您最近一年使用:0次
解题方法
4 .  是重要的供氧剂。图所示装置(省略夹持部件)用于验证
是重要的供氧剂。图所示装置(省略夹持部件)用于验证 和
和 的反应,所需
的反应,所需 由
由 固体与稀盐酸反应制备。回答下列问题:
固体与稀盐酸反应制备。回答下列问题:______ 。
(2)验证装置的气密性时,需用F替换装置中的E。若装置气密性良好,应观察到F中的导管口会有______ 的现象。
(3)装置中的B与C用于除去 气体中的杂质。饱和
气体中的杂质。饱和 溶液的作用是吸收
溶液的作用是吸收______ (填化学式)气体;为了干燥 气体,C中盛放的试剂是足量的
气体,C中盛放的试剂是足量的______ 。
(4)实验过程中,D中部分 固体由淡黄色变为
固体由淡黄色变为______ 色。在E的瓶口放置一条带火星的木条,若木条复燃,则说明生成的气体是______ (填化学式),并且E中的气体______ (填“已集满”或“未集满”)。收集气体时,E的瓶口朝上的主要原因是______ 。
(5)完成上述实验后,除去玻璃纤维,回收D中的所有固体药品共22.76g。使该固体与过量的水充分反应,假定该反应生成的气体共224mL(标准状况)。据此计算,实验中与 反应的
反应的 的物质的量为
的物质的量为______ mol。
 是重要的供氧剂。图所示装置(省略夹持部件)用于验证
是重要的供氧剂。图所示装置(省略夹持部件)用于验证 和
和 的反应,所需
的反应,所需 由
由 固体与稀盐酸反应制备。回答下列问题:
固体与稀盐酸反应制备。回答下列问题:
(2)验证装置的气密性时,需用F替换装置中的E。若装置气密性良好,应观察到F中的导管口会有
(3)装置中的B与C用于除去
 气体中的杂质。饱和
气体中的杂质。饱和 溶液的作用是吸收
溶液的作用是吸收 气体,C中盛放的试剂是足量的
气体,C中盛放的试剂是足量的(4)实验过程中,D中部分
 固体由淡黄色变为
固体由淡黄色变为(5)完成上述实验后,除去玻璃纤维,回收D中的所有固体药品共22.76g。使该固体与过量的水充分反应,假定该反应生成的气体共224mL(标准状况)。据此计算,实验中与
 反应的
反应的 的物质的量为
的物质的量为
您最近一年使用:0次
名校
解题方法
5 . 硫酸铜可用于游泳池消毒,工业上一种利用含铜矿石(主要含 、
、 、FeS以及少量
、FeS以及少量 等)制备硫酸铜晶体的工艺流程如图所示:
等)制备硫酸铜晶体的工艺流程如图所示:
(1)为了提高“焙烧”的反应速率,可采取的措施为__________ (任写一种即可)。
(2)“焙烧”时金属元素均转化为其高价氧化物(CuO、 ),
), 发生反应的化学方程式为
发生反应的化学方程式为__________ 。
(3)“酸溶”后,溶液中的金属阳离子有__________ ;“滤渣a”用途为__________ (任写一点即可)。
(4)“转化”时发生反应的离子方程式为__________ ,不能将双氧水替换为硝酸的原因是__________ ,“一系列操作”包括蒸发浓缩、__________ 、过滤、干燥。
(5)硫酸铜晶体(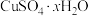 )结晶水的测定:准确称量硫酸铜晶体的质量
)结晶水的测定:准确称量硫酸铜晶体的质量 ,低温加热至晶体全部变为白色,冷却至室温后称量,反复几次,最终质量恒为
,低温加热至晶体全部变为白色,冷却至室温后称量,反复几次,最终质量恒为 ,则结晶水
,则结晶水
__________ (用字母表示)。
(6)某Cu、O化合物的晶胞结构如图所示,该晶体的密度为 ,晶胞参数为
,晶胞参数为 。
。
①O的配位数为__________ 。
②阿伏加德罗常数=__________ (用含 、a的字母表示)。
、a的字母表示)。
 、
、 、FeS以及少量
、FeS以及少量 等)制备硫酸铜晶体的工艺流程如图所示:
等)制备硫酸铜晶体的工艺流程如图所示: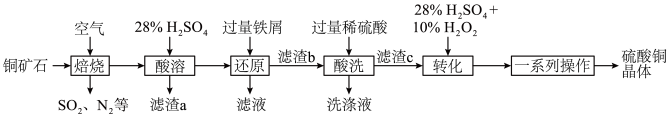
(1)为了提高“焙烧”的反应速率,可采取的措施为
(2)“焙烧”时金属元素均转化为其高价氧化物(CuO、
 ),
), 发生反应的化学方程式为
发生反应的化学方程式为(3)“酸溶”后,溶液中的金属阳离子有
(4)“转化”时发生反应的离子方程式为
(5)硫酸铜晶体(
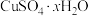 )结晶水的测定:准确称量硫酸铜晶体的质量
)结晶水的测定:准确称量硫酸铜晶体的质量 ,低温加热至晶体全部变为白色,冷却至室温后称量,反复几次,最终质量恒为
,低温加热至晶体全部变为白色,冷却至室温后称量,反复几次,最终质量恒为 ,则结晶水
,则结晶水
(6)某Cu、O化合物的晶胞结构如图所示,该晶体的密度为
 ,晶胞参数为
,晶胞参数为 。
。①O的配位数为
②阿伏加德罗常数=
 、a的字母表示)。
、a的字母表示)。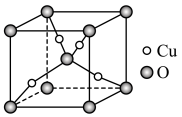
您最近一年使用:0次
2024-04-10更新
|
195次组卷
|
3卷引用:河北省2024届普通高中高三学业水平选择性考试仿真模拟化学卷(三)
6 . 亚硝酸钠( )是一种白色结晶状粉末,易溶于水,易被氧化,可用作织物染色的媒染剂、漂白剂等;工业制取亚硝酸钠晶体的基本流程如图所示。现设计相关实验测定其产品纯度。
)是一种白色结晶状粉末,易溶于水,易被氧化,可用作织物染色的媒染剂、漂白剂等;工业制取亚硝酸钠晶体的基本流程如图所示。现设计相关实验测定其产品纯度。 溶液从设备顶部以雾状喷下吸收从底部通入的尾气,其优点是:
溶液从设备顶部以雾状喷下吸收从底部通入的尾气,其优点是:_____ 。
(2)还原:若硝酸在“还原”阶段只生成 ,则氧化剂与还原剂的物质的量之比为:
,则氧化剂与还原剂的物质的量之比为:____ 。
(3)测定产品中 纯度。实验操作如下:
纯度。实验操作如下:
ⅰ.用电子天平称取7.500g样品,配成500mL样品溶液。
ⅱ.向锥形瓶中准确移入50.00mL样品溶液,滴加适量的 溶液酸化,加热至40~50℃,冷却后,用0.10
溶液酸化,加热至40~50℃,冷却后,用0.10
 溶液进行滴定(已知:
溶液进行滴定(已知: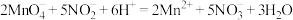 ),至恰好完全反应,消耗
),至恰好完全反应,消耗 溶液40.00mL。
溶液40.00mL。
ⅲ.重复滴定三次。
①测定时操作时间不宜过长,否则测定的结果将会___________ (填“偏大”或“偏小”)。
②该亚硝酸钠晶体产品中可能含有的杂质有:___________ 、 和
和 。
。
③试计算产品中 纯度(即
纯度(即 的质量分数)是
的质量分数)是___________ (写出计算过程)。
 )是一种白色结晶状粉末,易溶于水,易被氧化,可用作织物染色的媒染剂、漂白剂等;工业制取亚硝酸钠晶体的基本流程如图所示。现设计相关实验测定其产品纯度。
)是一种白色结晶状粉末,易溶于水,易被氧化,可用作织物染色的媒染剂、漂白剂等;工业制取亚硝酸钠晶体的基本流程如图所示。现设计相关实验测定其产品纯度。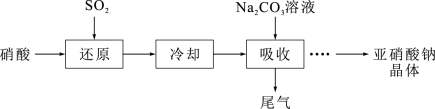
 溶液从设备顶部以雾状喷下吸收从底部通入的尾气,其优点是:
溶液从设备顶部以雾状喷下吸收从底部通入的尾气,其优点是:(2)还原:若硝酸在“还原”阶段只生成
 ,则氧化剂与还原剂的物质的量之比为:
,则氧化剂与还原剂的物质的量之比为:(3)测定产品中
 纯度。实验操作如下:
纯度。实验操作如下:ⅰ.用电子天平称取7.500g样品,配成500mL样品溶液。
ⅱ.向锥形瓶中准确移入50.00mL样品溶液,滴加适量的
 溶液酸化,加热至40~50℃,冷却后,用0.10
溶液酸化,加热至40~50℃,冷却后,用0.10
 溶液进行滴定(已知:
溶液进行滴定(已知: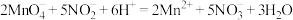 ),至恰好完全反应,消耗
),至恰好完全反应,消耗 溶液40.00mL。
溶液40.00mL。ⅲ.重复滴定三次。
①测定时操作时间不宜过长,否则测定的结果将会
②该亚硝酸钠晶体产品中可能含有的杂质有:
 和
和 。
。③试计算产品中
 纯度(即
纯度(即 的质量分数)是
的质量分数)是
您最近一年使用:0次
2023-12-22更新
|
201次组卷
|
2卷引用: 江苏省盐城市2023-2024学年高二学业水平合格性考试模拟预测化学试题
7 . Ⅰ.已知A和B两支试管的溶液中共含有 、
、 、
、 、
、 、
、 、
、 六种离子,向试管B的溶液中滴入酚酞,溶液呈粉红色。请回答下列问题:
六种离子,向试管B的溶液中滴入酚酞,溶液呈粉红色。请回答下列问题:
(1)试管B中含有的离子为_______ ;
(2)若向试管A的溶液中加入合适的药品,过滤后可以得到相应的金属和仅含一种溶质的溶液,则加入的药品是_______ (填化学式);
(3)若将试管A和试管B中的溶液按一定体积比混合过滤后,蒸干滤液可得到一种纯净物,该物质可以用作_______ (列举一种用途即可),混合过程中发生反应的离子方程式为:_______ 、_______ 。
Ⅱ.甲同学用如下装置模拟“侯氏制碱法”制纯碱。
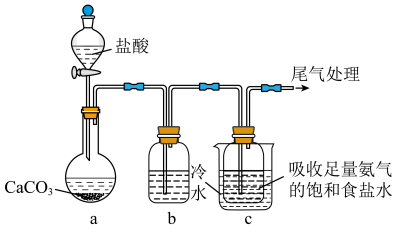
(4)c中饱和食盐水事先吸收足量 的原因是
的原因是_______ ;
(5)装置c中发生反应的离子反应方程式为_______ 。
 、
、 、
、 、
、 、
、 、
、 六种离子,向试管B的溶液中滴入酚酞,溶液呈粉红色。请回答下列问题:
六种离子,向试管B的溶液中滴入酚酞,溶液呈粉红色。请回答下列问题:(1)试管B中含有的离子为
(2)若向试管A的溶液中加入合适的药品,过滤后可以得到相应的金属和仅含一种溶质的溶液,则加入的药品是
(3)若将试管A和试管B中的溶液按一定体积比混合过滤后,蒸干滤液可得到一种纯净物,该物质可以用作
Ⅱ.甲同学用如下装置模拟“侯氏制碱法”制纯碱。

(4)c中饱和食盐水事先吸收足量
 的原因是
的原因是(5)装置c中发生反应的离子反应方程式为
您最近一年使用:0次
解题方法
8 . 乙酸硅[ (CH3COO)4Si,熔点:110°C,沸点:148°C]是白色至米色晶体。某校同学设计实验先制备SiCl4(熔点:-70℃,沸点:57.6℃,极易水解),再由SiCl4与乙酸酐[(CH3CO)2O(熔点:-73℃,沸点:140℃反应制备乙酸硅。回答下列问题:
(1)制备SiCl4装置(部分夹持仪器已省路)如下:
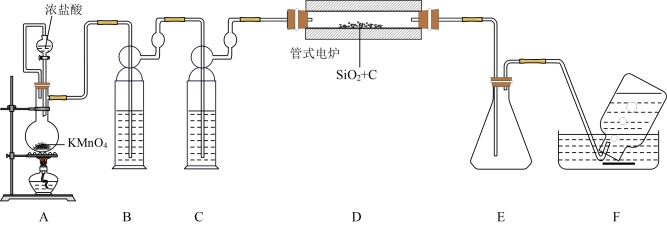
①A中制取Cl2反应的离子方程式为_______ 。
②B中盛放的试剂是_______ 。
③F中收集到的气体是CO,制备SiCl4的化学方程式为_______ 。
④上述设计的装置有一处明显不妥,改进的方法是_______ 。
(2)制备(CH3COO)4Si的反应装置如图所示。将一定量的SiCl4放入仪器a中,在电磁搅拌下,由滴液漏斗滴入过量的乙酸酐,关闭活塞。SiCl4和(CH3CO)2O的反应为放热反应,反应后反应混合物带色,并开始析出(CH3COO)4Si晶体。
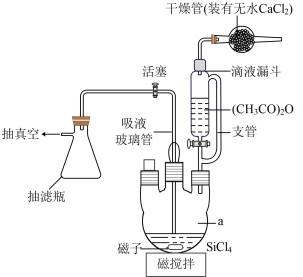
①仪器a的名称为_______ ;图中支管的作用是_______ 。
②写出生成(CH3COO)4Si的化学方程式:_______ (生成物有两种)。
③完成反应后,将反应混合液放置数日,再用干冰-丙酮浴冷却后,将导管伸入液面以下,_______ (结合装置图填写操作),获得(CH3COO)4Si晶体粗品,若得到较纯 (CH3COO)4Si,则下一步操作为_______ 。
(1)制备SiCl4装置(部分夹持仪器已省路)如下:

①A中制取Cl2反应的离子方程式为
②B中盛放的试剂是
③F中收集到的气体是CO,制备SiCl4的化学方程式为
④上述设计的装置有一处明显不妥,改进的方法是
(2)制备(CH3COO)4Si的反应装置如图所示。将一定量的SiCl4放入仪器a中,在电磁搅拌下,由滴液漏斗滴入过量的乙酸酐,关闭活塞。SiCl4和(CH3CO)2O的反应为放热反应,反应后反应混合物带色,并开始析出(CH3COO)4Si晶体。

①仪器a的名称为
②写出生成(CH3COO)4Si的化学方程式:
③完成反应后,将反应混合液放置数日,再用干冰-丙酮浴冷却后,将导管伸入液面以下,
您最近一年使用:0次
2022-06-10更新
|
593次组卷
|
2卷引用:天津市2023届普通高中学业水平等级性考试模拟化学试题
名校
解题方法
9 . 已知A是一种气态烃,其密度在标准状况下是H2的14倍。下列关系图中部分产物可能略去,试回答下列问题: R—OH+NaX(R代表烃基,X代表卤素原子)
R—OH+NaX(R代表烃基,X代表卤素原子)
(1)C分子的官能团的名称为_______ 。
(2)反应①~⑦中属于取代反应的是_______ 。
(3)C与F以物质的量之比2:1反应生成G,反应④的化学方程式为_______ 。
(4)B物质可在催化剂作用下被空气中的氧气氧化为具有刺激性气味的物质,写出反应的化学方程式_______ 。
(5)聚苯乙烯的结构简式为_______ 。
(6)下列说法正确的是_______ 。
a.D在一定条件下可能会和水反应生成B和C
b.B和F属于同系物
c.A、B、F和I都能使酸性高锰酸钾溶液褪色
d.与E互为同分异构体的有机物只有1种
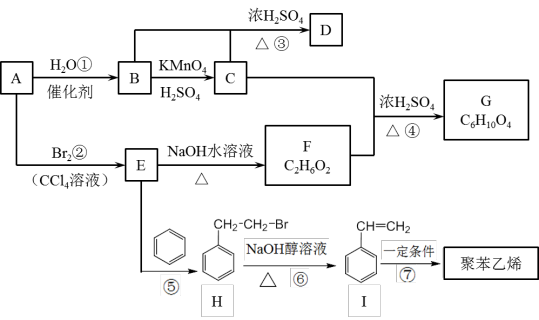
 R—OH+NaX(R代表烃基,X代表卤素原子)
R—OH+NaX(R代表烃基,X代表卤素原子)(1)C分子的官能团的名称为
(2)反应①~⑦中属于取代反应的是
(3)C与F以物质的量之比2:1反应生成G,反应④的化学方程式为
(4)B物质可在催化剂作用下被空气中的氧气氧化为具有刺激性气味的物质,写出反应的化学方程式
(5)聚苯乙烯的结构简式为
(6)下列说法正确的是
a.D在一定条件下可能会和水反应生成B和C
b.B和F属于同系物
c.A、B、F和I都能使酸性高锰酸钾溶液褪色
d.与E互为同分异构体的有机物只有1种
您最近一年使用:0次
2022-04-25更新
|
1485次组卷
|
5卷引用:浙江省宁波市效实中学2023-2024学年高一下学期学业水平模拟考试化学试卷
浙江省宁波市效实中学2023-2024学年高一下学期学业水平模拟考试化学试卷浙江省宁波市北仑中学2021-2022学年高一下学期期中考试(2-10选考班)化学试题(已下线)7.3.2 乙酸 官能团与有机物的分类-2021-2022学年高一化学课后培优练(人教版2019必修第二册)湖南省长郡中学2021-2022学年高一下学期选考科目调研考试化学试题山东省临沂市第一中学文峰校区2022-2023学年高一下学期5月段考化学试题
10 . 绿矾(FeSO4·7H2O)是自然界存在的一种矿石,翠绿如宝石,很早就引起人们的重视。已知:2FeSO4·7H2O Fe2O3+SO3↑+SO2↑+14H2O。某研究性学习小组用如图所示装置对绿矾进行焙烧,并检验其焙烧产物。请回答下列问题:
Fe2O3+SO3↑+SO2↑+14H2O。某研究性学习小组用如图所示装置对绿矾进行焙烧,并检验其焙烧产物。请回答下列问题:

(1)装置C的作用是___ 。
(2)装置D可以观察到的实验现象是___ 。
(3)实验结束后,请设计一个实验方案检验装置A中生成的固体产物(不考虑其他反应)___ 。
 Fe2O3+SO3↑+SO2↑+14H2O。某研究性学习小组用如图所示装置对绿矾进行焙烧,并检验其焙烧产物。请回答下列问题:
Fe2O3+SO3↑+SO2↑+14H2O。某研究性学习小组用如图所示装置对绿矾进行焙烧,并检验其焙烧产物。请回答下列问题:
(1)装置C的作用是
(2)装置D可以观察到的实验现象是
(3)实验结束后,请设计一个实验方案检验装置A中生成的固体产物(不考虑其他反应)
您最近一年使用:0次



