1 . 下列有关反应热的说法正确的是
| A.任何化学反应中的能量变化都表现为热量变化 |
B.若C(石墨,s)=C(金刚石,s)  H>0,则金刚石比石墨稳定 H>0,则金刚石比石墨稳定 |
| C.25℃,101kPa时,H2SO4和Ba(OH)2反应生成1mol水放出的热量与HCl和NaOH反应生成1mol水放出的热量一定相等 |
D.2H2(g)+O2(g)=2H2O(l)  H=-571.6kJ•mol-1,则 H=-571.6kJ•mol-1,则 的燃烧热 的燃烧热 H=-285.8kJ•mol-1 H=-285.8kJ•mol-1 |
您最近一年使用:0次
名校
2 . 下列说法不正确的是
| A.CH4 的燃烧热是890.3kJ·mol-1,则表示 CH4 的燃烧热的热化学方程式为:CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1 |
| B.由C(金刚石)=C(石墨) ΔH=-1.9 kJ·mol-1可知,石墨比金刚石稳定 |
| C.在稀溶液中:H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1,若将含 1mol HNO3 的稀溶液与含 1mol Ba(OH)2 的稀溶液混合,放出的热量为 57.3 kJ |
| D.1mol 钠蒸气与 2 mol 钠蒸气完全燃烧时,燃烧热相同 |
您最近一年使用:0次
2023-08-19更新
|
371次组卷
|
2卷引用:重庆市大足中学2021-2022学年高二上学期第一次月考化学试题
名校
解题方法
3 . 已知热化学方程式:①S(s) + O2(g) = SO2(g) ΔH = -296 kJ·mol-1;
②2SO2(g) + O2(g) 2SO3(g) ΔH = -196.6 kJ·mol-1;
2SO3(g) ΔH = -196.6 kJ·mol-1;
③H2S(g) + O2(g) = SO2(g)+ H2O(l) ΔH = -586 kJ·mol-1。
O2(g) = SO2(g)+ H2O(l) ΔH = -586 kJ·mol-1。
下列说法错误的是
②2SO2(g) + O2(g)
 2SO3(g) ΔH = -196.6 kJ·mol-1;
2SO3(g) ΔH = -196.6 kJ·mol-1; ③H2S(g) +
 O2(g) = SO2(g)+ H2O(l) ΔH = -586 kJ·mol-1。
O2(g) = SO2(g)+ H2O(l) ΔH = -586 kJ·mol-1。下列说法错误的是
| A.硫的燃烧热是394.3 kJ·mol-1 |
| B.由盖斯定律可得出热化学方程式:2H2S(g) + SO2(g) = 3S(s) + 2H2O(l) ΔH = -284 kJ·mol-1 |
| C.S(g)+O2(g)= SO2(g) ΔH < -296 kJ·mol -1 |
| D.在一定条件下,将1 mol SO2(g)与0.5 mol O2(g)放入一 密闭容器中充分反应,放出的热量小于98.3 kJ |
您最近一年使用:0次
2022-02-18更新
|
505次组卷
|
4卷引用:重庆市第八中学校2021-2022学年高二下学期第一次月考化学试题
名校
解题方法
4 . 如图1、图2分别表示 和
和 分解时的能量变化情况(单位:kJ)。下列说法错误的是
分解时的能量变化情况(单位:kJ)。下列说法错误的是
 和
和 分解时的能量变化情况(单位:kJ)。下列说法错误的是
分解时的能量变化情况(单位:kJ)。下列说法错误的是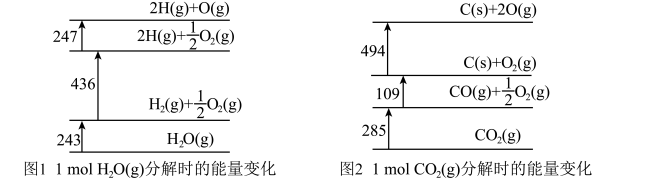
A.CO的燃烧热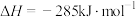 |
B. 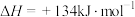 |
C.O=O的键能为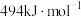 |
D.无法求得 的反应热 的反应热 |
您最近一年使用:0次
2023-10-27更新
|
458次组卷
|
11卷引用:重庆市百师联盟2024届高三一轮复习联考(二)
重庆市百师联盟2024届高三一轮复习联考(二)河南省豫北名校2024届高三毕业班上学期一轮复习联考(二)化学试题山西省部分学校2023-2024学年高三上学期10月月考(一轮复习联考(二))化学试题河北省石家庄部分高中2023-2024学年高三上学期10月期中考试化学试题甘肃省部分校2024届高三上学期10月月考化学试题辽宁省部分学校2023-2024学年高三上学期一轮复习联考(二)化学试题江西省上饶市广信中学2023-2024学年高二上学期11月月考化学试题福建省厦门外国语学校2023-2024学年高二上学期期中考试化学试题(已下线)寒假作业01 化学反应的热效应-【寒假分层作业】2024年高二化学寒假培优练(人教版2019)河北省保定市唐县第一中学2023-2024学年高三上学期11月期中考试化学试题(已下线)专题05 化学反应与能量-【好题汇编】2024年高考化学一模试题分类汇编(全国通用)
5 . 在下列各说法中,正确的是
| A.热化学方程式中的化学计量数可以是分数 | B. 表示放热反应, 表示放热反应, 表示吸热反应 表示吸热反应 |
C. 的大小与热化学方程式中的计量数无关 的大小与热化学方程式中的计量数无关 | D.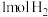 与 与 反应放出的热就是 反应放出的热就是 的燃烧热 的燃烧热 |
您最近一年使用:0次
2021-10-25更新
|
168次组卷
|
2卷引用:重庆市巴渝学校2023-2024学年高二上学期期中(半期)考试化学试题
解题方法
6 . 下列热化学方程式的书写及相关说法正确的是
A.500℃、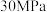 下,将 下,将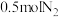 和 和 置于密闭的容器中充分反应生成 置于密闭的容器中充分反应生成 ,放出的热量为 ,放出的热量为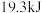 ,其热化学方程式为 ,其热化学方程式为 则 则 |
B.含 的稀溶液与稀盐酸完全中和放出 的稀溶液与稀盐酸完全中和放出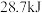 的热量,则稀醋酸和稀 的热量,则稀醋酸和稀 溶液反应的热化学方程式为 溶液反应的热化学方程式为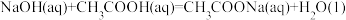  |
C.已知 , ,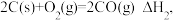 则 则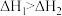 |
D.已知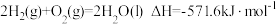 ,则氢气的燃烧热为571.6kJ· mol-1 ,则氢气的燃烧热为571.6kJ· mol-1 |
您最近一年使用:0次
名校
解题方法
7 . 下列说法中正确的是
A.HCl和NaOH的稀溶液反应生成1mol  (l)的反应热 (l)的反应热 ,则 ,则 和 和 的稀溶液反应生成1mol 的稀溶液反应生成1mol  (1)的反应热 (1)的反应热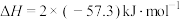 |
B.甲烷的燃烧热 ,则 ,则 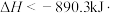  |
C.CO(g)的燃烧热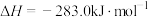 ,则 ,则 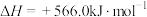 |
D.已知:500℃、30MPa下,  ,将1.5mol ,将1.5mol  和过量的 和过量的 在此条件下充分反应,放出热量46.2kJ 在此条件下充分反应,放出热量46.2kJ |
您最近一年使用:0次
2022-12-02更新
|
353次组卷
|
5卷引用:重庆市万州第二高级中学2021-2022学高二下学期入学考试化学试题
8 . 通过以下反应均可获取H2,下列有关说法正确的是
①太阳光催化分解水制氢:2H2O(l) = 2H2(g) + O2(g) ΔH1=+571.6 kJ·mol-1
②焦炭与水反应制氢:C(s) + H2O(g) = CO(g) + H2(g) ΔH2=+131.3 kJ·mol-1
③甲烷与水反应制氢:CH4(g) + H2O(g) = CO(g) + 3H2(g) ΔH3=+206.1 kJ·mol-1
①太阳光催化分解水制氢:2H2O(l) = 2H2(g) + O2(g) ΔH1=+571.6 kJ·mol-1
②焦炭与水反应制氢:C(s) + H2O(g) = CO(g) + H2(g) ΔH2=+131.3 kJ·mol-1
③甲烷与水反应制氢:CH4(g) + H2O(g) = CO(g) + 3H2(g) ΔH3=+206.1 kJ·mol-1
| A.反应①可知,氢气的燃烧热为571.6kJ·mol-1 |
| B.反应②为吸热反应,不能自发进行 |
| C.反应③使用催化剂,∆H3减小 |
| D.反应CH4(g) = C(s) + 2H2(g) 的∆H=+74.8 kJ·mol-1 |
您最近一年使用:0次
2022-08-16更新
|
290次组卷
|
2卷引用:重庆市第七中学校2021-2022学年高二上学期第二次月考化学试题
9 . 下列有关说法正确的是
| A.已知2C(s)+2O2(g)=2CO2(g) ΔH1,2C(s)+O2(g)=2CO(g) ΔH2,则ΔH1<ΔH2 |
| B.已知2H2(g)+O2(g)=2H2O(g) ΔH=-571.6kJ·mol-1,则H2的燃烧热为285.8kJ·mol-1 |
C.已知HI(g) 1/2H2(g)+1/2I2(s) ΔH=-26.5kJ·mol-1,由此可知,在密闭容器中充入1mol HI气体,充分分解后可以放出26.5kJ的热量 1/2H2(g)+1/2I2(s) ΔH=-26.5kJ·mol-1,由此可知,在密闭容器中充入1mol HI气体,充分分解后可以放出26.5kJ的热量 |
| D.HCl和NaOH反应中和热ΔH=-57.3kJ·mol-1,H2SO4(aq)+Ca(OH)2(aq)=CaSO4(s)+2H2O(l) ΔH=-114.6kJ·mol-1 |
您最近一年使用:0次
2022-03-30更新
|
214次组卷
|
2卷引用:重庆市主城区六校2020-2021学年高二上学期期末联考化学试题
名校
解题方法
10 . 甲醇是一种重要的化工原料,广泛应用于化工生产,也可以直接用作燃料.已知:
CH3OH(l)+O2(g)=CO(g)+2H2O(g) △H1=﹣443.64kJ•mol﹣1
2CO(g)+O2(g)=2CO2(g) △H2=﹣566.0kJ•mol﹣1
下列说法或热化学方程式正确的是( )
CH3OH(l)+O2(g)=CO(g)+2H2O(g) △H1=﹣443.64kJ•mol﹣1
2CO(g)+O2(g)=2CO2(g) △H2=﹣566.0kJ•mol﹣1
下列说法或热化学方程式正确的是( )
| A.CO的燃烧热为566.0kJ•mol﹣1 |
| B.2molCO和1molO2的总能量比2molCO2的总能量低 |
| C.完全燃烧20g甲醇,生成二氧化碳和水蒸气时放出的热量为908.3kJ |
| D.2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=﹣1453.28kJ•mol﹣1 |
您最近一年使用:0次
2019-12-10更新
|
85次组卷
|
3卷引用:重庆市第七中学校2022届高三上学期第一次月考化学试题



