名校
解题方法
1 . 环氧乙烷( ,简称EO)是在有机合成中常用的试剂。EO常温下易燃易爆,其爆炸极限为3~100%。近年来,常用以乙烯、氧气、氮气混合气投料的乙烯氧化法制备EO。部分涉及反应为:
,简称EO)是在有机合成中常用的试剂。EO常温下易燃易爆,其爆炸极限为3~100%。近年来,常用以乙烯、氧气、氮气混合气投料的乙烯氧化法制备EO。部分涉及反应为:


副反应:


(1)已知

 ,则EO的燃烧热为
,则EO的燃烧热为(2)在温度为T,压强为
 的环境下,欲提高乙烯的平衡转化率,需
的环境下,欲提高乙烯的平衡转化率,需(3)向温度为T,体积为V的容器中加入投料比为2:3:2.8的乙烯、氧气、氮气。已知平衡后:
 ,
,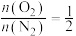 (其中二碳化合物为分子中含两个碳原子的化合物)。忽略其他反应,乙烯的平衡转化率为
(其中二碳化合物为分子中含两个碳原子的化合物)。忽略其他反应,乙烯的平衡转化率为(4)以Ag为催化剂的反应机理如下:
反应Ⅰ:
 慢
慢反应Ⅱ:
 快
快反应Ⅲ:
 快
快①定能够提高主反应反应速率的措施有
A.降低温度 B.通入惰性气体
C.增大
 浓度 D.增大
浓度 D.增大 浓度
浓度②加入1,2-二氯乙烷会发生
 。一定条件下,反应经过一定时间后,EO产率及选择性与1,2-二氯乙烷浓度关系如图。1,2-二氯乙烷能使EO产量先增加后降低的原因是
。一定条件下,反应经过一定时间后,EO产率及选择性与1,2-二氯乙烷浓度关系如图。1,2-二氯乙烷能使EO产量先增加后降低的原因是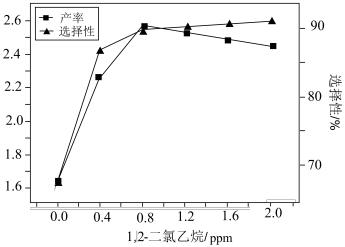
您最近一年使用:0次
2023-12-26更新
|
287次组卷
|
2卷引用:湖北省武汉市华中师范大学第一附属中学2023-2024学年高三上学期11月期中考试化学试题
2023高三·全国·专题练习
名校
解题方法
2 . 回答下列问题。
(1)用NH3可以消除氮氧化物的污染,已知:
反应Ⅰ:4NH3(g)+3O2(g) 2N2(g)+6H2O(g) ΔH1=a kJ·mol-1
2N2(g)+6H2O(g) ΔH1=a kJ·mol-1
反应Ⅱ:N2(g)+O2(g) 2NO(g) ΔH2=b kJ·mol-1
2NO(g) ΔH2=b kJ·mol-1
反应Ⅲ:4NH3(g)+6NO(g) 5N2(g)+6H2O(g) ΔH3=c kJ·mol-1
5N2(g)+6H2O(g) ΔH3=c kJ·mol-1
则反应Ⅱ中的b=___________ (用含a、c的代数式表示),反应Ⅲ中的ΔS___________ (填“>”“<”或“=”)0。
(2)已知:①2CO(g)+SO2(g) S(l)+2CO2(g) ΔH1=-37.0 kJ·mol-1
S(l)+2CO2(g) ΔH1=-37.0 kJ·mol-1
②2H2(g)+SO2(g) S(l)+2H2O(g) ΔH2=+45.4 kJ·mol-1
S(l)+2H2O(g) ΔH2=+45.4 kJ·mol-1
③CO的燃烧热ΔH3=-283 kJ·mol-1,
请回答:
表示液态硫(S)的燃烧热的热化学方程式为___________ ;反应②中,正反应活化能E1___________ (填“>”“<”或“=”)ΔH2。
(3)若某温度下,CH3COOH(aq)与NaOH(aq)反应的ΔH=-46.8 kJ·mol-1,H2SO4(aq)与NaOH(aq)的中和热为57.3 kJ·mol-1,则CH3COOH在水溶液中电离的反应热ΔH1=___________ 。
(4)已知:
则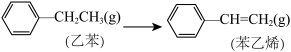 +H2(g) ΔH=
+H2(g) ΔH=___________ ;又知H2和苯乙烯的燃烧热ΔH分别为-290 kJ·mol-1和-4400 kJ·mol-1,则乙苯的燃烧热ΔH=___________ kJ·mol-1。
(1)用NH3可以消除氮氧化物的污染,已知:
反应Ⅰ:4NH3(g)+3O2(g)
 2N2(g)+6H2O(g) ΔH1=a kJ·mol-1
2N2(g)+6H2O(g) ΔH1=a kJ·mol-1反应Ⅱ:N2(g)+O2(g)
 2NO(g) ΔH2=b kJ·mol-1
2NO(g) ΔH2=b kJ·mol-1反应Ⅲ:4NH3(g)+6NO(g)
 5N2(g)+6H2O(g) ΔH3=c kJ·mol-1
5N2(g)+6H2O(g) ΔH3=c kJ·mol-1则反应Ⅱ中的b=
(2)已知:①2CO(g)+SO2(g)
 S(l)+2CO2(g) ΔH1=-37.0 kJ·mol-1
S(l)+2CO2(g) ΔH1=-37.0 kJ·mol-1②2H2(g)+SO2(g)
 S(l)+2H2O(g) ΔH2=+45.4 kJ·mol-1
S(l)+2H2O(g) ΔH2=+45.4 kJ·mol-1③CO的燃烧热ΔH3=-283 kJ·mol-1,
请回答:
表示液态硫(S)的燃烧热的热化学方程式为
(3)若某温度下,CH3COOH(aq)与NaOH(aq)反应的ΔH=-46.8 kJ·mol-1,H2SO4(aq)与NaOH(aq)的中和热为57.3 kJ·mol-1,则CH3COOH在水溶液中电离的反应热ΔH1=
(4)已知:
| 化学键 | C—H | C—C | C=C | H—H |
| 键能/(kJ·mol-1) | 412 | 348 | 612 | 436 |
 +H2(g) ΔH=
+H2(g) ΔH=
您最近一年使用:0次
名校
解题方法
3 . 回答下列问题:
(1)已知下列热化学方程式:
2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ/mol
C3H8(g)+5O2(g)=3CO2(g)+4H2O(g) ΔH=-2044.0 kJ/mol
①已知:H2O(l)=H2O(g) ΔH=+44.0 kJ/mol。写出丙烷(C3H8)燃烧生成二氧化碳和液态水的热化学方程式:_______ 。
②现有H2和C3H8的混合气体共30 mol,完全燃烧生成液态水时放热27916 kJ,计算混合气体中H2和C3H8的体积比是_______ 。
③当反应②中转移电子数10NA时,燃烧的丙烷(C3H8)的质量是_______ g,生成的CO2在标准状况下的体积是_______ L。
(2)在 2 L密闭容器中, 充入1 mol N2和2.6 mol H2,在一定的条件下反应,2分钟后达到平衡状态,2分钟内以NH3表示的平均反应速率为0.1 mol·(L·min)-1。填写下列空白:
①该反应的平衡常数表达式为K=_______ ,已知K300 ℃>K350 ℃,则ΔH_______ 0(填“>”或“<”)。
②平衡时混合气体中三种气体的物质的量之比为_______ 。
③平衡时混合气体的压强是反应前混合气体的压强的_______ %。
(1)已知下列热化学方程式:
2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ/mol
C3H8(g)+5O2(g)=3CO2(g)+4H2O(g) ΔH=-2044.0 kJ/mol
①已知:H2O(l)=H2O(g) ΔH=+44.0 kJ/mol。写出丙烷(C3H8)燃烧生成二氧化碳和液态水的热化学方程式:
②现有H2和C3H8的混合气体共30 mol,完全燃烧生成液态水时放热27916 kJ,计算混合气体中H2和C3H8的体积比是
③当反应②中转移电子数10NA时,燃烧的丙烷(C3H8)的质量是
(2)在 2 L密闭容器中, 充入1 mol N2和2.6 mol H2,在一定的条件下反应,2分钟后达到平衡状态,2分钟内以NH3表示的平均反应速率为0.1 mol·(L·min)-1。填写下列空白:
①该反应的平衡常数表达式为K=
②平衡时混合气体中三种气体的物质的量之比为
③平衡时混合气体的压强是反应前混合气体的压强的
您最近一年使用:0次
解题方法
4 . “氢能”是未来最理想的新能源。
(1)实验测得,1g氢气燃烧生成液态水时放出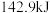 热量,则氢气燃烧的热化学方程式为
热量,则氢气燃烧的热化学方程式为________  填序号
填序号 。
。
A.

B.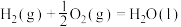
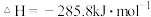
C.

D.
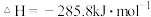
(2)某化学家根据“原子经济”的思想,设计了如下制备 的反应步骤:
的反应步骤:




请你根据“原子经济”的思想完成上述步骤 的化学方程式:
的化学方程式:__________ 。并根据“绿色化学”的思想评估该方法制 的主要缺点:
的主要缺点:_______ 。
(3)利用核能分解水制氢气,是目前正在研究的课题。如图是其中的一种流程,其中用了过量的碘。

完成下列反应的化学方程式:
反应 :
:________________________________ ;
反应 :
:________________________________ 。
此法制取氢气的最大优点是________________________________ 。
(1)实验测得,1g氢气燃烧生成液态水时放出
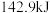 热量,则氢气燃烧的热化学方程式为
热量,则氢气燃烧的热化学方程式为 填序号
填序号 。
。A.


B.
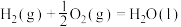
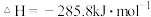
C.


D.

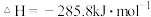
(2)某化学家根据“原子经济”的思想,设计了如下制备
 的反应步骤:
的反应步骤:




请你根据“原子经济”的思想完成上述步骤
 的化学方程式:
的化学方程式: 的主要缺点:
的主要缺点:(3)利用核能分解水制氢气,是目前正在研究的课题。如图是其中的一种流程,其中用了过量的碘。

完成下列反应的化学方程式:
反应
 :
:反应
 :
:此法制取氢气的最大优点是
您最近一年使用:0次
名校
解题方法
5 . 化石燃料的燃烧会产生大量污染大气的二氧化硫和温室气体二氧化碳。而氢气和氮气都被认为是无碳无污染的清洁能源。
Ⅰ.“氢能”将是未来最理想的新能源。
(1)某些合金可用于储存氢,金属储氢的原理可表示为M(s)+xH2═MH2x(s) △H<0(M表示某种合金)。图甲表示温度分别为T1、T2时,最大吸氢量与氢气压强的关系。

下列说法中正确的是___ (填字母代号)。
a.T1>T2
b.增大M的量,上述平衡向右移动
c.增大氢气压强,加快氢气的吸收速率
d.金属储氢过程中M作还原剂,价态升高
(2)工业上通常用生产水煤气的方法制得氢气。其中C(s)+H2O(g) CO(g)+H2(g) △H>0,在850℃时平衡常数K=1。若向1L的恒容密闭真空容器中同时加入xmolC和6.0molH2O。
CO(g)+H2(g) △H>0,在850℃时平衡常数K=1。若向1L的恒容密闭真空容器中同时加入xmolC和6.0molH2O。
①850℃时反应达到平衡,x应满足的条件是_____ 。
②对于上述平衡状态,改变下列条件能使反应速率增大,且平衡向正向移动的是____ (填字母代号)。
a.选用更高效的催化剂
b.升高温度
c.及时分离出氢气
d.增加氢气的浓度
Ⅱ.CO2是合成尿素的原料。
现以熔融碳酸盐为电解质,稀土金属材料为电极组成氢氧燃料电池(如装置乙所示),其中负极通入H2,正极通入O2和CO2的混合气体。装置丙中a、b为石墨,电解一段时间后,b电极附近滴入酚酞溶液变红,NaCl溶液的体积为100mL。

(1)工作过程中,装置乙中电极c为____ (填电极名称)极。
(2)若在a极产生112mL(标准状况)气体,25℃时丙装置中所得溶液pH=____ (忽略电解前后溶液体积变化,不考虑气体的溶解)。
Ⅲ.氨是制备尿素的原料。NH3、N2O4等在工农业生产、航天航空等领域有广泛应用。
(1)氨在氧气中燃烧,生产水和一种空气组成成分的单质。已知:N2(g)+3H2(g) 2NH3(g) △H=-92.4kJ/mol,H2的燃烧热为286kJ/mol。试写出氨在氧气中燃烧生成液态水的热化学方程式:
2NH3(g) △H=-92.4kJ/mol,H2的燃烧热为286kJ/mol。试写出氨在氧气中燃烧生成液态水的热化学方程式:________________________ 。
(2)氨气溶于水得到氨水,在25℃下,将amol·L-1的氨水和bmol·L-1的硫酸溶液以3:2的体积比混合,反应后溶液呈中性。用含a和b的代数式表示出NH3·H2O的电离平衡常数:___________ 。
(3)用氨水除去SO2,已知25℃时,NH3·H2O的Kb=1.8×10-5,H2SO3的Ka1=1.3×10-2,Ka2=6.2×10-8。若氨水的浓度为2.0mol·L-1,将SO2通入该氨水中,当c(OH-)降至1.0×10-7mol·L-1时,溶液中离子浓度从大到小的关系是_________________ 。
Ⅰ.“氢能”将是未来最理想的新能源。
(1)某些合金可用于储存氢,金属储氢的原理可表示为M(s)+xH2═MH2x(s) △H<0(M表示某种合金)。图甲表示温度分别为T1、T2时,最大吸氢量与氢气压强的关系。

下列说法中正确的是
a.T1>T2
b.增大M的量,上述平衡向右移动
c.增大氢气压强,加快氢气的吸收速率
d.金属储氢过程中M作还原剂,价态升高
(2)工业上通常用生产水煤气的方法制得氢气。其中C(s)+H2O(g)
 CO(g)+H2(g) △H>0,在850℃时平衡常数K=1。若向1L的恒容密闭真空容器中同时加入xmolC和6.0molH2O。
CO(g)+H2(g) △H>0,在850℃时平衡常数K=1。若向1L的恒容密闭真空容器中同时加入xmolC和6.0molH2O。①850℃时反应达到平衡,x应满足的条件是
②对于上述平衡状态,改变下列条件能使反应速率增大,且平衡向正向移动的是
a.选用更高效的催化剂
b.升高温度
c.及时分离出氢气
d.增加氢气的浓度
Ⅱ.CO2是合成尿素的原料。
现以熔融碳酸盐为电解质,稀土金属材料为电极组成氢氧燃料电池(如装置乙所示),其中负极通入H2,正极通入O2和CO2的混合气体。装置丙中a、b为石墨,电解一段时间后,b电极附近滴入酚酞溶液变红,NaCl溶液的体积为100mL。

(1)工作过程中,装置乙中电极c为
(2)若在a极产生112mL(标准状况)气体,25℃时丙装置中所得溶液pH=
Ⅲ.氨是制备尿素的原料。NH3、N2O4等在工农业生产、航天航空等领域有广泛应用。
(1)氨在氧气中燃烧,生产水和一种空气组成成分的单质。已知:N2(g)+3H2(g)
 2NH3(g) △H=-92.4kJ/mol,H2的燃烧热为286kJ/mol。试写出氨在氧气中燃烧生成液态水的热化学方程式:
2NH3(g) △H=-92.4kJ/mol,H2的燃烧热为286kJ/mol。试写出氨在氧气中燃烧生成液态水的热化学方程式:(2)氨气溶于水得到氨水,在25℃下,将amol·L-1的氨水和bmol·L-1的硫酸溶液以3:2的体积比混合,反应后溶液呈中性。用含a和b的代数式表示出NH3·H2O的电离平衡常数:
(3)用氨水除去SO2,已知25℃时,NH3·H2O的Kb=1.8×10-5,H2SO3的Ka1=1.3×10-2,Ka2=6.2×10-8。若氨水的浓度为2.0mol·L-1,将SO2通入该氨水中,当c(OH-)降至1.0×10-7mol·L-1时,溶液中离子浓度从大到小的关系是
您最近一年使用:0次



