1 . 下列依据热化学方程式得出的结论正确的是
A.若  ,则 ,则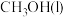 的燃烧热为 的燃烧热为 |
B.若  ,则红磷比白磷稳定 ,则红磷比白磷稳定 |
C.已知  ,则 ,则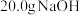 固体与稀盐酸完全中和,放出 固体与稀盐酸完全中和,放出 的热量 的热量 |
D.已知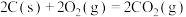  , ,  ,则 ,则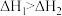 |
您最近一年使用:0次
2021-01-10更新
|
523次组卷
|
7卷引用:辽宁省沈阳市郊联体2020-2021学年高二上学期期末考试化学试题
名校
解题方法
2 .  在
在 、101kP下,1g硫粉完全燃烧放出9kJ的热量,写出表示该反应燃烧热的热化学方程式为
、101kP下,1g硫粉完全燃烧放出9kJ的热量,写出表示该反应燃烧热的热化学方程式为___________
 和
和 通过灼热的炭层,生成HCl和
通过灼热的炭层,生成HCl和 ,当有2mol电子转移时反应释放出145kJ热量,写出该反应的热化学方程式:
,当有2mol电子转移时反应释放出145kJ热量,写出该反应的热化学方程式:___________ 。
 已知拆开
已知拆开 键,
键,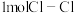 键,
键,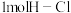 键,分别需要的能量是436kJ、243kJ、431kJ,则
键,分别需要的能量是436kJ、243kJ、431kJ,则 与
与 反应生成HCl的热化学方程式为
反应生成HCl的热化学方程式为 ___________ 。
 已知:
已知: ,
,
写出碳和氧气生成一氧化碳的热化学方程式:___________
 同一反应的生成物状态不同时反应热不同,如
同一反应的生成物状态不同时反应热不同,如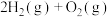 =
= ①,
①,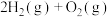 =
= ②,则
②,则
___________  填“
填“ ”、“
”、“ ”或“
”或“ ”,下同
”,下同 。
。
 在
在 、101kP下,1g硫粉完全燃烧放出9kJ的热量,写出表示该反应燃烧热的热化学方程式为
、101kP下,1g硫粉完全燃烧放出9kJ的热量,写出表示该反应燃烧热的热化学方程式为 和
和 通过灼热的炭层,生成HCl和
通过灼热的炭层,生成HCl和 ,当有2mol电子转移时反应释放出145kJ热量,写出该反应的热化学方程式:
,当有2mol电子转移时反应释放出145kJ热量,写出该反应的热化学方程式: 已知拆开
已知拆开 键,
键,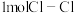 键,
键,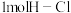 键,分别需要的能量是436kJ、243kJ、431kJ,则
键,分别需要的能量是436kJ、243kJ、431kJ,则 与
与 反应生成HCl的热化学方程式为
反应生成HCl的热化学方程式为  已知:
已知: ,
,
写出碳和氧气生成一氧化碳的热化学方程式:
 同一反应的生成物状态不同时反应热不同,如
同一反应的生成物状态不同时反应热不同,如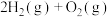 =
= ①,
①,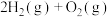 =
= ②,则
②,则
 填“
填“ ”、“
”、“ ”或“
”或“ ”,下同
”,下同 。
。
您最近一年使用:0次
2020-12-23更新
|
218次组卷
|
2卷引用:四川省巴中市平昌县驷马中学2020-2021学年高二上学期期末测试化学试题
名校
解题方法
3 . 填空
(1)已知C(s,石墨)=C(s,金刚石) ΔH>0,则稳定性:金刚石___ (填“>”或“<”)石墨。
(2)已知:2C(s)+2O2(g)=2CO2(g) ΔH1;2C(s)+O2(g)=2CO(g) ΔH2;则ΔH1____ (填“>”或“<”)ΔH2。
(3)“嫦娥五号”发射时,用肼(N2H4)作燃料,四氧化二氮作氧化剂,二者反应生成氮气和气态水。已知:
①N2(g)+2O2(g)=N2O4(g) ΔH=+10.7 kJ·mol-1;
②N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH=-543 kJ·mol-1
写出气态肼和N2O4反应的热化学方程式:________ 。
(4)25 ℃、101 kPa时,14 g CO在足量的O2中充分燃烧,放出141.3 kJ热量,则CO的燃烧热ΔH=____ 。
(5)0.50 L 2.00 mol·L-1H2SO4溶液与2.10 L 1.00 mol·L-1 KOH溶液完全反应,放出114.6 kJ热量,该反应的中和热ΔH=______ 。
(6)已知断开1 mol H-H键、1 mol N-H键、1 mol N≡N键分别需要的能量是436 kJ、391 kJ、946 kJ,则N2与H2反应生成NH3的热化学方程式是________ 。
(1)已知C(s,石墨)=C(s,金刚石) ΔH>0,则稳定性:金刚石
(2)已知:2C(s)+2O2(g)=2CO2(g) ΔH1;2C(s)+O2(g)=2CO(g) ΔH2;则ΔH1
(3)“嫦娥五号”发射时,用肼(N2H4)作燃料,四氧化二氮作氧化剂,二者反应生成氮气和气态水。已知:
①N2(g)+2O2(g)=N2O4(g) ΔH=+10.7 kJ·mol-1;
②N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH=-543 kJ·mol-1
写出气态肼和N2O4反应的热化学方程式:
(4)25 ℃、101 kPa时,14 g CO在足量的O2中充分燃烧,放出141.3 kJ热量,则CO的燃烧热ΔH=
(5)0.50 L 2.00 mol·L-1H2SO4溶液与2.10 L 1.00 mol·L-1 KOH溶液完全反应,放出114.6 kJ热量,该反应的中和热ΔH=
(6)已知断开1 mol H-H键、1 mol N-H键、1 mol N≡N键分别需要的能量是436 kJ、391 kJ、946 kJ,则N2与H2反应生成NH3的热化学方程式是
您最近一年使用:0次
2020-12-15更新
|
320次组卷
|
6卷引用:第六章能力提升检测卷(精练)-2022年高考化学一轮复习讲练测
(已下线)第六章能力提升检测卷(精练)-2022年高考化学一轮复习讲练测(已下线)专题18 化学反应与能量(限时精练)-2022年高三毕业班化学常考点归纳与变式演练重庆市沙坪坝实验中学校2021-2022学年高二上学期12月月考化学试题2015届四川省成都郫县高三第二次阶诊断性考试理综化学试卷河北省安平中学2017-2018学年高一下学期期末考试化学试题1贵州省毕节市七星关区毕节市实验高级中学2020-2021学年高二上学期期中考试化学试题
名校
4 . 32g甲烷完全燃烧。生成二氧化碳气体和液态水。放出1 780kJ热量。则甲烷燃烧热为
| A.1780 kJ•mol-1 | B.-1780 kJ•mol-1 | C.890 kJ•mol-1 | D.-890 kJ•mol-1 |
您最近一年使用:0次
2020-12-10更新
|
104次组卷
|
2卷引用:广西钦州市第四中学2020-2021学年下学期高二3月月考化学(体艺班)试题
5 . 一定条件下,充分燃烧一定量的丁烷放出热量为QkJ(Q>0),经测定完全吸收生成的二氧化碳需消耗5mol·L-1的KOH溶液100mL,恰好生成正盐,则此条件下反应:C4H10(g)+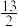 O2(g)=4CO2(g)+5H2O(g)的△H为( )
O2(g)=4CO2(g)+5H2O(g)的△H为( )
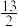 O2(g)=4CO2(g)+5H2O(g)的△H为( )
O2(g)=4CO2(g)+5H2O(g)的△H为( )| A.+8QkJ | B.+16QkJ | C.-8QkJ | D.-16QkJ |
您最近一年使用:0次
2020-10-28更新
|
314次组卷
|
23卷引用:黑龙江省大庆市实验中学实验一部2020-2021学年高一下学期4月阶段性教学质量检测化学试题
黑龙江省大庆市实验中学实验一部2020-2021学年高一下学期4月阶段性教学质量检测化学试题福建省宁化第一中学2021-2022学年高二上学期开学考试化学试题安徽省太和县第八中学2021-2022学年高二上学期第一次月考化学试题(已下线)2011-2012学年陕西省师大附中高一下学期期末考试化学试卷(已下线)2013届甘肃省张掖二中高三10月月考化学试卷(奥班)(已下线)2014年化学高考总复习课时演练 6化学反应与能量练习卷(已下线)2014-2015学年河南省周口中英文学校高二10月月考化学试卷2014-2015学年吉林省吉林市一中高一下期末考试化学试卷2015-2016学年内蒙古包头九中高一6月月考化学试卷2016-2017学年青海省西宁五中高二上月考一化学卷2016-2017学年青海省西宁五中高二11月月考化学试卷2016-2017学年辽宁省沈阳铁路实验中学高一4月月考化学试卷黑龙江省双鸭山市第一中学2017-2018学年高二9月月考化学试题吉林省汪清县第六中学2017-2018学年高二上学期期末考试化学试题河北省承德市第二中学2017-2018学年高二上学期第一次月考化学试题【全国百强校】陕西省西安市长安区第一中学2018-2019学年高二上学期期中考试化学试题(已下线)第01章 化学反应的热效应(B卷能力提高篇)-2020-2021学年高二化学选择性必修1同步单元AB卷(新教材人教版)宁夏回族自治区海原县第一中学2020-2021学年高二上学期第一次月考化学试题新疆乌鲁木齐市第四中学2020-2021学年高二上学期期中考试化学试题云南省玉龙县第一中学2021-2022学年高二下学期3月份考试化学试题福建省三明市第二中学2022-2023学年高二上学期开学适应性练习化学试题(已下线)专题02 盖斯定律、反应热的计算【考题猜想】(6大题型)-2023-2024学年高二化学期中考点大串讲(人教版2019选择性必修1)天津市蓟州中学2022-2023学年高二上学期第一次月考化学试题
名校
解题方法
6 . 下列说法或表示方法正确的是( )
| A.等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出热量多 |
| B.由C(石墨)=C(金刚石)ΔH=+1.90kJ/mol可知,金刚石比石墨稳定 |
| C.在稀溶液中,H+(aq)+OH-(aq)=H2O(1)ΔH=-57.3kJ/mol,若将含0.5molH2SO4的浓硫酸与含1molNaOH溶液混合,放出的热量大于57.3kJ |
| D.在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O(l)ΔH=-285.8kJ/mol |
您最近一年使用:0次
2020-10-26更新
|
281次组卷
|
20卷引用:辽宁省丹东市凤城市第一中学2021-2022学年高二上学期10月份月考化学试题
辽宁省丹东市凤城市第一中学2021-2022学年高二上学期10月份月考化学试题2015-2016学年山西太原五中高二上第一周考理科化学试卷2015-2016学年陕西西安第一中学高二上期中考试化学试卷2017届陕西省西安中学高三上学期月考二化学试卷重庆市第十八中学2016-2017学年高一下学期期中考试化学试题【全国校级联考】新疆伊宁生产建设兵团五校联考2017-2018学年高二下学期期末考试化学试题辽宁省阜新市海州高级中学2019届高三上学期第一次月考化学试题【全国百强校】江西省南昌市第二中学2018-2019学年高二上学期第一次月考化学试题(已下线)考点08 化学反应中的热效应——备战2019年浙江新高考化学考点山西省朔州市怀仁一中2019-2020学年高二上学期第一次月考化学试卷第2章《化学键 化学反应规律》单元测试——鲁科版(2019)必修第二册新疆博尔塔拉蒙古自治州第五师高级中学2019-2020学年高一下学期期中考试化学试题黑龙江省哈尔滨师范大学青冈实验中学校2019届高三12月月考化学试题河北省保定市唐县第一中学2020-2021学年高二9月月考化学试题山东省惠民县第二中学致远部2020-2021学年高二上学期10月月考化学试题广东省广州市第一一三中学22020-2021学年高二上学期第一阶段考试化学(选考)试题湖南省中方一中2020-2021学年高二上学期期中考试化学试题福建省永安市第一中学2020-2021学年高二上学期期中考试化学试题广东省清远市凤霞中学2020-2021学年高二上学期期中考试化学(选科)试题辽宁省鞍山市第一中学2023-2024学年高一下学期第一次月考化学试卷
7 . (1)已知①CO(g)+ O2(g)=CO2(g) ΔH1=- 283 kJ·mol-1,
O2(g)=CO2(g) ΔH1=- 283 kJ·mol-1,
②C(s)+ O2(g)=CO(g) ΔH2= - 110 kJ·mol-1,则碳的燃烧热ΔH =
O2(g)=CO(g) ΔH2= - 110 kJ·mol-1,则碳的燃烧热ΔH =__________ 。
(2)工业合成氨的热化学方程式为N2(g)+3H2(g)⇌2NH3(g) ΔH = -92.4 kJ·mol-1;已知N≡N键的键能是948.9kJ·mol-1,H—H键的键能是436.0 kJ·mol-1,则N—H键的键能是__________ ;向体系中加入2 mol N2充分反应,放出的热量_________ (填“大于”“小于”或“等于”)184.8 kJ,原因是____________________ 。
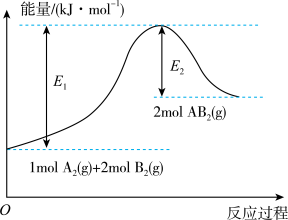
(3)已知某反应过程如图所示,则该反应为的______ ( 填“放热”或“吸热”)反应,该反应的热化学方程式为__________ 。
 O2(g)=CO2(g) ΔH1=- 283 kJ·mol-1,
O2(g)=CO2(g) ΔH1=- 283 kJ·mol-1,②C(s)+
 O2(g)=CO(g) ΔH2= - 110 kJ·mol-1,则碳的燃烧热ΔH =
O2(g)=CO(g) ΔH2= - 110 kJ·mol-1,则碳的燃烧热ΔH =(2)工业合成氨的热化学方程式为N2(g)+3H2(g)⇌2NH3(g) ΔH = -92.4 kJ·mol-1;已知N≡N键的键能是948.9kJ·mol-1,H—H键的键能是436.0 kJ·mol-1,则N—H键的键能是
(3)已知某反应过程如图所示,则该反应为的

您最近一年使用:0次
2020-10-21更新
|
644次组卷
|
5卷引用:黑龙江省齐齐哈尔市五校2021-2022学年高二上学期期中联考化学试题
名校
解题方法
8 . 已知:①C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1
②2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1
现有0.2 mol木炭粉和氢气组成的悬浮气,在氧气中完全燃烧,共放出67.93 kJ的热量,则混合物中C与H2的物质的量之比为( )
②2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1
现有0.2 mol木炭粉和氢气组成的悬浮气,在氧气中完全燃烧,共放出67.93 kJ的热量,则混合物中C与H2的物质的量之比为( )
| A.1∶1 | B.1∶2 | C.2∶3 | D.3∶2 |
您最近一年使用:0次
2020-10-13更新
|
2114次组卷
|
16卷引用:安徽省怀宁中学2020-2021学年高一下学期第一次月考化学试题
安徽省怀宁中学2020-2021学年高一下学期第一次月考化学试题吉林省大安市第六中学2021-2022学年高二上学期第一次月考化学试题(已下线)第1章 化学反应的热效应(能力提升卷)-【高效检测】2021-2022学年高二化学章末测试卷(人教版2019选择性必修1)宁夏银川市第六中学2021-2022学年高二上学期第一次月考化学试题湖北省部分省级示范高中2021-2022学年高二上学期期中测试化学试题辽宁省葫芦岛市第八高级中学2021–2022学年高二上学期期中考试化学试题陕西省安康市汉滨区江北高级中学2021-2022学年高二上学期第一次阶段性检测化学试题2015-2016学年湖北省荆州中学高二上第一次月考化学试卷内蒙古乌兰察布市北京八中乌兰察布分校2018-2019学年高二上学期第二次月考调研化学试题宁夏长庆高级中学2019-2020学年高二上学期第一次月考化学试题云南省昆明市寻甸县民族中学2019-2020学年高二下学期第一次月考化学试题河北省邢台市第七中学2019-2020学年高二上学期10月月考化学试题宁夏长庆高级中学2020-2021学年高二上学期第一次月考化学试题云南省玉溪第二中学2020-2021学年高二上学期期中质量检测化学试题湖南省张家界市慈利县第一中学2023-2024学年高二上学期第二次月考化学试题湖南省益阳市桃江县第四中学2023-2024学年高二上学期第一次月考化学试卷
名校
解题方法
9 . 反应2H2(g)+O2(g)=2H2O(l)过程中的能量变化如图所示,下列有关说法正确的是


| A.ΔH1=ΔH3-ΔH2 | B.ΔH2为该反应的反应热 |
| C.ΔH1<0 | D.ΔH3为氢气的燃烧热 |
您最近一年使用:0次
2020-10-11更新
|
402次组卷
|
13卷引用:广西南宁市第四中学2020-2021学年高二下学期开学考试化学试题
广西南宁市第四中学2020-2021学年高二下学期开学考试化学试题湖南省嘉禾县第一中学2021-2022学年高二上学期9月月考化学试题重庆市沙坪坝实验中学校2021-2022学年高二上学期10月月考化学试题【全国区级联考】重庆市开州区2017-2018学年高一下学期期末测试化学试题【全国百强校】黑龙江省鹤岗市第一中学2019届高三上学期第一次月考化学试题河北省唐山市开滦第二中学2019-2020学年高二10月月考化学试题江西省上饶中学2019-2020学年高二上学期期中考试(实验、重点班)化学试题2020届高三化学二轮复习———燃烧热的综合河北省秦皇岛市第一中学2020-2021学年高二上学期第一次月考化学试题甘肃省武威第六中学2020-2021学年高二上学期第二次学段考试化学试题天津市滨海新区汉沽第六中学2020-2021学年高二上学期期中化学试题黑龙江省齐齐哈尔市恒昌中学校2022-2023学年高二上学期第一次月考化学试题新疆生产建设兵团第三师图木舒克市第一中学2023-2024学年高二10月月考化学试题
名校
解题方法
10 . 已知下列热化学方程式:
①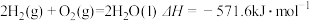
②
(1)氢气的摩尔燃烧焓是______________ 。
(2)已知: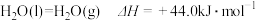 。写出丙烷
。写出丙烷 燃烧生成二氧化碳和液态水的热化学方程式:
燃烧生成二氧化碳和液态水的热化学方程式:___________________________ 。
(3)实验测得 和
和 的混合气体共
的混合气体共 ,完全燃烧生成液态水时放热
,完全燃烧生成液态水时放热 ,则混合气体中
,则混合气体中 和
和 的体积比是
的体积比是__________ 。
(4)当反应②中转移10mol电子时,燃烧的丙烷 的质量是
的质量是_________ g,生成的CO2在标准状况下的体积是_________ L。
①
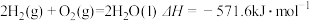
②

(1)氢气的摩尔燃烧焓是
(2)已知:
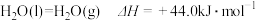 。写出丙烷
。写出丙烷 燃烧生成二氧化碳和液态水的热化学方程式:
燃烧生成二氧化碳和液态水的热化学方程式:(3)实验测得
 和
和 的混合气体共
的混合气体共 ,完全燃烧生成液态水时放热
,完全燃烧生成液态水时放热 ,则混合气体中
,则混合气体中 和
和 的体积比是
的体积比是(4)当反应②中转移10mol电子时,燃烧的丙烷
 的质量是
的质量是
您最近一年使用:0次
2020-09-13更新
|
115次组卷
|
2卷引用:安徽省泗县第一中学2021-2022学年高二上学期开学考试化学试题



