解题方法
1 . 依据下列热化学方程式得出的结论中,正确的是
A.已知 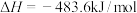 ,则氢气的燃烧热 ,则氢气的燃烧热 为 为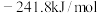 |
B.已知C(石墨,s)= C(金刚石,s)  ,则金刚石比石墨稳定 ,则金刚石比石墨稳定 |
C.已知 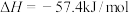 ,则含 ,则含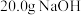 的稀溶液与稀盐酸完全中和,放出 的稀溶液与稀盐酸完全中和,放出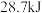 的热量 的热量 |
D.已知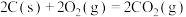  ; ;  ,则 ,则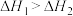 |
您最近一年使用:0次
解题方法
2 . 研究化学反应中的能量变化具有重要的意义。回答下列问题:
(1)甲醇是人们开发和利用的一种新能源。已知:
2H2(g)+O2(g)=2H2O(1) △H1=-571.8kJ/mol
CH3OH(l)+ O2(g)=CO2(g)+2H2(g) △H2=-192.9kJ/mol
O2(g)=CO2(g)+2H2(g) △H2=-192.9kJ/mol
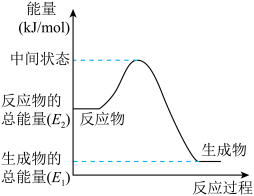
①由上述热化学方程式可知甲醇的燃烧热△H=____________ 。
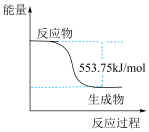
②上述第二个反应的能量变化如图所示,则△H2=___________ k/mol。(用E1、E2的相关式子表示)。.
(2)已知反应N2(g)+3H2(g) 2NH3(g),试根据表中所列键能数据估算该反应的△H=
2NH3(g),试根据表中所列键能数据估算该反应的△H=________ 。
(3)1molH2和1molCH4完全燃烧放出的热量分别为286kJ、890kJ,等质量的H2和CH4完全燃烧,放出热量较多的是__________ (填化学式)。
(4)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态过氧化氢,当它们混合反应时,即产生大量氮气和水蒸气,并放出大量热。已知0.4mol液态肼与足量液态过氧化氢反应,生成氮气和水蒸气,放出256kJ的热量。
①写出该反应的热化学方程式:_____________ 。
②此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是___________ 。
(1)甲醇是人们开发和利用的一种新能源。已知:
2H2(g)+O2(g)=2H2O(1) △H1=-571.8kJ/mol
CH3OH(l)+
 O2(g)=CO2(g)+2H2(g) △H2=-192.9kJ/mol
O2(g)=CO2(g)+2H2(g) △H2=-192.9kJ/mol①由上述热化学方程式可知甲醇的燃烧热△H=
②上述第二个反应的能量变化如图所示,则△H2=

(2)已知反应N2(g)+3H2(g)
 2NH3(g),试根据表中所列键能数据估算该反应的△H=
2NH3(g),试根据表中所列键能数据估算该反应的△H=| 化学键 | H-H | N-H | N≡N |
| 键能(kJ/mol) | 436 | 391 | 945 |
(3)1molH2和1molCH4完全燃烧放出的热量分别为286kJ、890kJ,等质量的H2和CH4完全燃烧,放出热量较多的是
(4)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态过氧化氢,当它们混合反应时,即产生大量氮气和水蒸气,并放出大量热。已知0.4mol液态肼与足量液态过氧化氢反应,生成氮气和水蒸气,放出256kJ的热量。
①写出该反应的热化学方程式:
②此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是
您最近一年使用:0次
3 . 生产、生活中的化学反应都伴随着能量的变化。回答下列问题:
(1) 分子可形成单斜硫和斜方硫,转化过程如下:
分子可形成单斜硫和斜方硫,转化过程如下:
 ,则常温下,
,则常温下, (单斜)与
(单斜)与 (斜方)中较稳定的是
(斜方)中较稳定的是______ [填“ (单斜)”或“
(单斜)”或“ (斜方)”]
(斜方)”]
(2)丙烷( )常用作运动会火炬燃料。如图是一定量丙烷完全燃烧生成
)常用作运动会火炬燃料。如图是一定量丙烷完全燃烧生成 和
和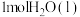 过程中的能量变化图。写出丙烷燃烧的热化学方程式:
过程中的能量变化图。写出丙烷燃烧的热化学方程式:______ ,丙烷的燃烧热( )为
)为_____ 。
(3)水煤气是由 和
和 组成的混合气体,在工业上常用作燃料。已知:
组成的混合气体,在工业上常用作燃料。已知: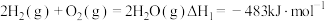 ;
; 。现取
。现取 (标准状况)水煤气,使其完全燃烧生成
(标准状况)水煤气,使其完全燃烧生成 和
和 ,测得反应共放热
,测得反应共放热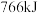 ,则水煤气中
,则水煤气中 与
与 的物质的量之比是
的物质的量之比是___ 。
(4)盖斯定律:不管化学过程是一步完成或分多步完成,整个过程的总热效应相同。
①反应 分两步进行:
分两步进行:
(ⅰ)
(ⅱ)
下列示意图中,能正确表示总反应过程中能量变化的是___ (填字母)。
A.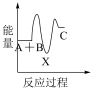 B.
B. 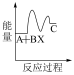 C.
C. 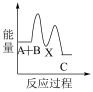 D.
D.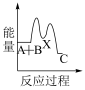
②已知:
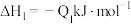

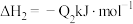


若将 液态无水酒精完全燃烧,并恢复到室温,则整个过程中放出的热量为
液态无水酒精完全燃烧,并恢复到室温,则整个过程中放出的热量为___  (用含
(用含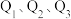 的代数式表示)。
的代数式表示)。
(5)下表中的数据表示断裂 化学键需消耗的能量(即键能,单位为
化学键需消耗的能量(即键能,单位为 ):
):
热化学方程式: ,则
,则 键的键能为
键的键能为______  。
。
(1)
 分子可形成单斜硫和斜方硫,转化过程如下:
分子可形成单斜硫和斜方硫,转化过程如下:
 ,则常温下,
,则常温下, (单斜)与
(单斜)与 (斜方)中较稳定的是
(斜方)中较稳定的是 (单斜)”或“
(单斜)”或“ (斜方)”]
(斜方)”](2)丙烷(
 )常用作运动会火炬燃料。如图是一定量丙烷完全燃烧生成
)常用作运动会火炬燃料。如图是一定量丙烷完全燃烧生成 和
和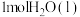 过程中的能量变化图。写出丙烷燃烧的热化学方程式:
过程中的能量变化图。写出丙烷燃烧的热化学方程式: )为
)为
(3)水煤气是由
 和
和 组成的混合气体,在工业上常用作燃料。已知:
组成的混合气体,在工业上常用作燃料。已知: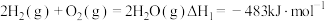 ;
; 。现取
。现取 (标准状况)水煤气,使其完全燃烧生成
(标准状况)水煤气,使其完全燃烧生成 和
和 ,测得反应共放热
,测得反应共放热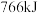 ,则水煤气中
,则水煤气中 与
与 的物质的量之比是
的物质的量之比是(4)盖斯定律:不管化学过程是一步完成或分多步完成,整个过程的总热效应相同。
①反应
 分两步进行:
分两步进行:(ⅰ)

(ⅱ)

下列示意图中,能正确表示总反应过程中能量变化的是
A.
 B.
B.  C.
C.  D.
D.
②已知:

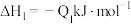

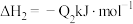


若将
 液态无水酒精完全燃烧,并恢复到室温,则整个过程中放出的热量为
液态无水酒精完全燃烧,并恢复到室温,则整个过程中放出的热量为 (用含
(用含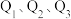 的代数式表示)。
的代数式表示)。(5)下表中的数据表示断裂
 化学键需消耗的能量(即键能,单位为
化学键需消耗的能量(即键能,单位为 ):
):| 化学键 |  |  |
| 键能 | 436 | 431 |
 ,则
,则 键的键能为
键的键能为 。
。
您最近一年使用:0次
解题方法
4 . 下列热化学方程式正确的是
A.通常状况下,将1 g氢气在氯气中完全燃烧,放出92.4 kJ热量: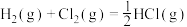 ; ;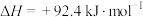 |
B.已知充分燃烧a g乙炔气体时生成1 mol二氧化碳气体和液态水,并放出b kJ热量: ; ;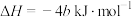 |
C.1 g炭与适量水蒸气反应生成一氧化碳和氢气,需吸收10.94 kJ的热量: 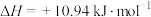 |
D.已知甲烷燃烧生成二氧化碳和液态水放出的热量为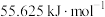 : : ; ; |
您最近一年使用:0次
名校
5 . I.50mL0.50mol·L-1盐酸与50mL0.55mol·L-1NaOH溶液在图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热,回答下列问题:
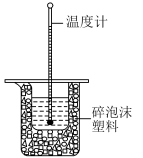
(1)从实验装置上看,图中尚缺少的一种玻璃用品是________ 。
(2)实验中改用60mL0.50mol·L-1盐酸与50mL0.55mol·L-1NaOH溶液进行反应,与上述实验相比,所放出的热量_______ (填“相等”、“不相等”),所求中和热______ 。(填“相等”、“不相等”)
(3)化学反应中的能量变化,通常主要表现为热量的变化。下列反应中,属于放热反应的是_____ (填序号)。
a.Ba(OH)2·8H2O与NH4Cl混合搅拌 b.高温煅烧石灰石 c.铝与盐酸反应
(4)已知N2(g)+2O2(g)=2 NO2(g) ΔH =+67.7 kJ·mol-1
N2H4(g)+O2(g)= N2(g)+2H2O (l) ΔH =-534 kJ·mol-1
根据盖斯定律写出肼与NO2完全反应生成氮气和气态水的热化学方程式___________ 。
Ⅱ.CO、SO2、NO均为大气污染物,通过下列反应可以实现可持续发展。已知:
①2CO(g)+SO2(g)=S(g)+2CO2(g) ΔH=+8.0kJ/mol-1
②2H2(g)+SO2(g)=S(g)+2H2O(g) ΔH=+90.4kJ·mol -1
③2NO(g)+2CO(g)=N2(g)+2CO2(g) ΔH=-746.5kJ·mol -1
请回答:
(5)反应①属于______  填“吸热”或“放热”
填“吸热”或“放热” 反应。
反应。
(6)反应②生成0.5mol S(g)时,ΔH=________ 。
(7)反应③消耗30g NO(g)时,ΔH=________ 。

(1)从实验装置上看,图中尚缺少的一种玻璃用品是
(2)实验中改用60mL0.50mol·L-1盐酸与50mL0.55mol·L-1NaOH溶液进行反应,与上述实验相比,所放出的热量
(3)化学反应中的能量变化,通常主要表现为热量的变化。下列反应中,属于放热反应的是
a.Ba(OH)2·8H2O与NH4Cl混合搅拌 b.高温煅烧石灰石 c.铝与盐酸反应
(4)已知N2(g)+2O2(g)=2 NO2(g) ΔH =+67.7 kJ·mol-1
N2H4(g)+O2(g)= N2(g)+2H2O (l) ΔH =-534 kJ·mol-1
根据盖斯定律写出肼与NO2完全反应生成氮气和气态水的热化学方程式
Ⅱ.CO、SO2、NO均为大气污染物,通过下列反应可以实现可持续发展。已知:
①2CO(g)+SO2(g)=S(g)+2CO2(g) ΔH=+8.0kJ/mol-1
②2H2(g)+SO2(g)=S(g)+2H2O(g) ΔH=+90.4kJ·mol -1
③2NO(g)+2CO(g)=N2(g)+2CO2(g) ΔH=-746.5kJ·mol -1
请回答:
(5)反应①属于
 填“吸热”或“放热”
填“吸热”或“放热” 反应。
反应。(6)反应②生成0.5mol S(g)时,ΔH=
(7)反应③消耗30g NO(g)时,ΔH=
您最近一年使用:0次
2024-02-02更新
|
107次组卷
|
2卷引用:四川省眉山市仁寿第一中学校(北校区)2023-2024学年高二上学期11月期中化学试题
名校
6 . 我国向世界郑重承诺:2030年前实现碳达峰,2060年前实现碳中和。而研发二氧化碳捕捉和碳利用技术则是关键,其中 催化加氢合成甲酸(反应为:
催化加氢合成甲酸(反应为: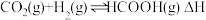 )是一种很有前景的方法,且生成的甲酸是重要化工原料。回答下列问题:
)是一种很有前景的方法,且生成的甲酸是重要化工原料。回答下列问题:
(1)已知: 时,部分物质的相对能量如表所示。
时,部分物质的相对能量如表所示。
则
_________  ,此条件下
,此条件下 的燃烧热
的燃烧热
________ (填“大于”、“小于”或“等于”) 的燃烧热
的燃烧热 。
。
(2) 催化加氢合成甲酸的过程中,不断升高温度,下列图像正确的是________(填选项字母)。
催化加氢合成甲酸的过程中,不断升高温度,下列图像正确的是________(填选项字母)。
(3)恒容密闭容器中充入一定量的 和
和 去合成
去合成 ,下列示意图正确且能说明该反应进行到
,下列示意图正确且能说明该反应进行到 时刻达到平衡状态的是___________(填选项字母)。
时刻达到平衡状态的是___________(填选项字母)。
(4)恒温、恒容的密闭容器中充入 ,
,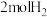 和
和 (不参与反应)发生反应合成甲酸,测得反应过程中体系压强随时间的变化曲线如图所示。
(不参与反应)发生反应合成甲酸,测得反应过程中体系压强随时间的变化曲线如图所示。
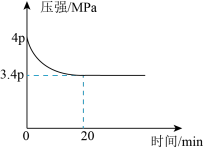
① ,用
,用 表示的化学反应速率为
表示的化学反应速率为___________ 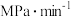 ;
;
②此反应的分压平衡常数
___________ ( 为以分压表示的平衡常数,
为以分压表示的平衡常数,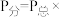 物质的量分数;用含P的式子表示)。
物质的量分数;用含P的式子表示)。
 催化加氢合成甲酸(反应为:
催化加氢合成甲酸(反应为: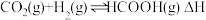 )是一种很有前景的方法,且生成的甲酸是重要化工原料。回答下列问题:
)是一种很有前景的方法,且生成的甲酸是重要化工原料。回答下列问题:(1)已知:
 时,部分物质的相对能量如表所示。
时,部分物质的相对能量如表所示。| 物质 |  |  |  |
相对能量/( ) ) |  | 0 |  |

 ,此条件下
,此条件下 的燃烧热
的燃烧热
 的燃烧热
的燃烧热 。
。(2)
 催化加氢合成甲酸的过程中,不断升高温度,下列图像正确的是________(填选项字母)。
催化加氢合成甲酸的过程中,不断升高温度,下列图像正确的是________(填选项字母)。A.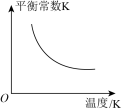 | B.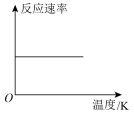 | C.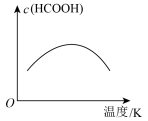 | D. |
(3)恒容密闭容器中充入一定量的
 和
和 去合成
去合成 ,下列示意图正确且能说明该反应进行到
,下列示意图正确且能说明该反应进行到 时刻达到平衡状态的是___________(填选项字母)。
时刻达到平衡状态的是___________(填选项字母)。A.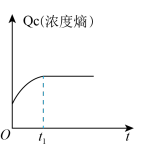 | B. | C. | D. |
(4)恒温、恒容的密闭容器中充入
 ,
, 和
和 (不参与反应)发生反应合成甲酸,测得反应过程中体系压强随时间的变化曲线如图所示。
(不参与反应)发生反应合成甲酸,测得反应过程中体系压强随时间的变化曲线如图所示。
①
 ,用
,用 表示的化学反应速率为
表示的化学反应速率为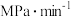 ;
;②此反应的分压平衡常数

 为以分压表示的平衡常数,
为以分压表示的平衡常数, 物质的量分数;用含P的式子表示)。
物质的量分数;用含P的式子表示)。
您最近一年使用:0次
名校
解题方法
7 . 环氧乙烷( ,简称EO)是在有机合成中常用的试剂。EO常温下易燃易爆,其爆炸极限为3~100%。近年来,常用以乙烯、氧气、氮气混合气投料的乙烯氧化法制备EO。部分涉及反应为:
,简称EO)是在有机合成中常用的试剂。EO常温下易燃易爆,其爆炸极限为3~100%。近年来,常用以乙烯、氧气、氮气混合气投料的乙烯氧化法制备EO。部分涉及反应为:
主反应:

副反应:

(1)已知
 ,则EO的燃烧热为
,则EO的燃烧热为___________ 。
(2)在温度为T,压强为 的环境下,欲提高乙烯的平衡转化率,需
的环境下,欲提高乙烯的平衡转化率,需___________ 体系中氮气分压(填“增大”或“减小”)。但在实际生产中并非如此,其可能原因是___________ 。
(3)向温度为T,体积为V的容器中加入投料比为2:3:2.8的乙烯、氧气、氮气。已知平衡后: ,
,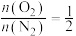 (其中二碳化合物为分子中含两个碳原子的化合物)。忽略其他反应,乙烯的平衡转化率为
(其中二碳化合物为分子中含两个碳原子的化合物)。忽略其他反应,乙烯的平衡转化率为_______ ,副反应的平衡常数为___________ 。
(4)以Ag为催化剂的反应机理如下:
反应Ⅰ: 慢
慢
反应Ⅱ: 快
快
反应Ⅲ: 快
快
①定能够提高主反应反应速率的措施有_______ (填标号)。
A.降低温度 B.通入惰性气体
C.增大 浓度 D.增大
浓度 D.增大 浓度
浓度
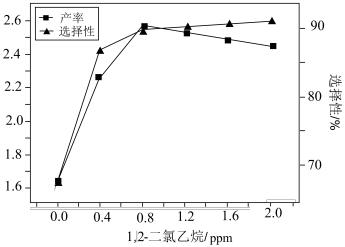
②加入1,2-二氯乙烷会发生 。一定条件下,反应经过一定时间后,EO产率及选择性与1,2-二氯乙烷浓度关系如图。1,2-二氯乙烷能使EO产量先增加后降低的原因是
。一定条件下,反应经过一定时间后,EO产率及选择性与1,2-二氯乙烷浓度关系如图。1,2-二氯乙烷能使EO产量先增加后降低的原因是_______ 。
 ,简称EO)是在有机合成中常用的试剂。EO常温下易燃易爆,其爆炸极限为3~100%。近年来,常用以乙烯、氧气、氮气混合气投料的乙烯氧化法制备EO。部分涉及反应为:
,简称EO)是在有机合成中常用的试剂。EO常温下易燃易爆,其爆炸极限为3~100%。近年来,常用以乙烯、氧气、氮气混合气投料的乙烯氧化法制备EO。部分涉及反应为:主反应:


副反应:


(1)已知

 ,则EO的燃烧热为
,则EO的燃烧热为(2)在温度为T,压强为
 的环境下,欲提高乙烯的平衡转化率,需
的环境下,欲提高乙烯的平衡转化率,需(3)向温度为T,体积为V的容器中加入投料比为2:3:2.8的乙烯、氧气、氮气。已知平衡后:
 ,
,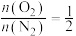 (其中二碳化合物为分子中含两个碳原子的化合物)。忽略其他反应,乙烯的平衡转化率为
(其中二碳化合物为分子中含两个碳原子的化合物)。忽略其他反应,乙烯的平衡转化率为(4)以Ag为催化剂的反应机理如下:
反应Ⅰ:
 慢
慢反应Ⅱ:
 快
快反应Ⅲ:
 快
快①定能够提高主反应反应速率的措施有
A.降低温度 B.通入惰性气体
C.增大
 浓度 D.增大
浓度 D.增大 浓度
浓度②加入1,2-二氯乙烷会发生
 。一定条件下,反应经过一定时间后,EO产率及选择性与1,2-二氯乙烷浓度关系如图。1,2-二氯乙烷能使EO产量先增加后降低的原因是
。一定条件下,反应经过一定时间后,EO产率及选择性与1,2-二氯乙烷浓度关系如图。1,2-二氯乙烷能使EO产量先增加后降低的原因是
您最近一年使用:0次
8 . 实验室测定有机化合物(固态或液态)的燃烧热常用弹式热量计(装置结构如图所示)。实验原理:间接法测定水吸收的热量即为物质燃烧释放的热量。

某实验小组用该装置测定萘[C10H8(s)]的燃烧热,实验步骤如下:常温常压下,用分析天平称取0.6400g萘压片并放入样品盘中,密封后向钢弹中充入过量氧气,向热量计中注入1.21kg ,用电火花引发燃烧反应并立即打开搅拌器,记录实验数据,重复实验三次。
,用电火花引发燃烧反应并立即打开搅拌器,记录实验数据,重复实验三次。
回答下列问题:
(1)该装置中缺少的实验仪器是___________ (填仪器名称)。
(2)钢弹(燃烧池)采用钢制的原因是___________ 。
(3)样品压片压太紧实会造成的结果是___________ ;若点火后没有立即打开搅拌器(实验仪器位置按图示摆放的情况下),可能造成测得的物质燃烧热( )
)___________ (填“偏大”“偏小”或“不变”)。
(4)该小组记录实验过程中温度变化值为5.10℃,查得水的比热容为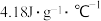 ,根据题给数据写出表示萘燃烧热的热化学方程式:
,根据题给数据写出表示萘燃烧热的热化学方程式:___________ (忽略电火花引燃时的热量及萘本身的热容误差,焓变数据保留两位小数)。
(5)若称取0.1000g的萘,其他条件不变也能据此实验求得萘的燃烧热,但这样操作可能造成数据不准确是因为___________ 。

某实验小组用该装置测定萘[C10H8(s)]的燃烧热,实验步骤如下:常温常压下,用分析天平称取0.6400g萘压片并放入样品盘中,密封后向钢弹中充入过量氧气,向热量计中注入1.21kg
 ,用电火花引发燃烧反应并立即打开搅拌器,记录实验数据,重复实验三次。
,用电火花引发燃烧反应并立即打开搅拌器,记录实验数据,重复实验三次。回答下列问题:
(1)该装置中缺少的实验仪器是
(2)钢弹(燃烧池)采用钢制的原因是
(3)样品压片压太紧实会造成的结果是
 )
)(4)该小组记录实验过程中温度变化值为5.10℃,查得水的比热容为
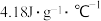 ,根据题给数据写出表示萘燃烧热的热化学方程式:
,根据题给数据写出表示萘燃烧热的热化学方程式:(5)若称取0.1000g的萘,其他条件不变也能据此实验求得萘的燃烧热,但这样操作可能造成数据不准确是因为
您最近一年使用:0次
9 . 宇宙中所有的一切都是能量的变化,研究化学反应中的能量变化意义重大。
(1)奥运会火炬常用的燃料为丙烷、丁烷等。已知:丙烷的燃烧热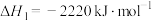 ,正丁烷的燃烧热
,正丁烷的燃烧热 ;异丁烷的燃烧热
;异丁烷的燃烧热 。下列有关说法正确的是
。下列有关说法正确的是_______ (填字母)。
A.奥运火炬燃烧时的能量转化形式主要是由化学能转化为热能、光能
B.燃烧等质量的正丁烷、异丁烷放热更多的是异丁烷
C.正丁烷比异丁烷稳定
(2)根据丙烷的燃烧热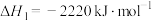 ,
,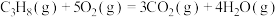

 ,则a
,则a___________ 2220(填“<”或“>”或“=”)。
(3)用 催化还原氮氧化物可以消除氮氧化物的污染。已知:
催化还原氮氧化物可以消除氮氧化物的污染。已知:
①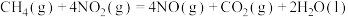
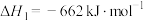
②
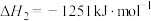
则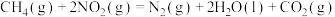

___________ 。
(4)已知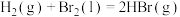
 ,其他相关数据如下表:
,其他相关数据如下表:
则表中a=___________ ;根据键能大小可判断,上述三种物质中最稳定的是___________ 。
(5)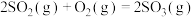 反应过程的能量变化如图所示。
反应过程的能量变化如图所示。

已知:1mol (g)氧化为1mol
(g)氧化为1mol  (g)的
(g)的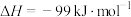 。请回答下列问题:
。请回答下列问题:
①图中
___________ 。
②根据上述计算的焓变值,阐述热化学方程式: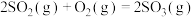
 代表的含义
代表的含义___________ 。
(1)奥运会火炬常用的燃料为丙烷、丁烷等。已知:丙烷的燃烧热
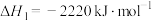 ,正丁烷的燃烧热
,正丁烷的燃烧热 ;异丁烷的燃烧热
;异丁烷的燃烧热 。下列有关说法正确的是
。下列有关说法正确的是A.奥运火炬燃烧时的能量转化形式主要是由化学能转化为热能、光能
B.燃烧等质量的正丁烷、异丁烷放热更多的是异丁烷
C.正丁烷比异丁烷稳定
(2)根据丙烷的燃烧热
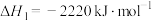 ,
,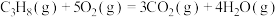

 ,则a
,则a(3)用
 催化还原氮氧化物可以消除氮氧化物的污染。已知:
催化还原氮氧化物可以消除氮氧化物的污染。已知:①
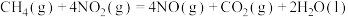
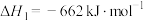
②

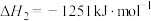
则
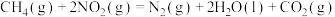

(4)已知
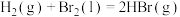
 ,其他相关数据如下表:
,其他相关数据如下表:| 物质 |  (g) (g) |  (l) (l) | HBr(g) |
| 1mol分子中的化学键断裂时需要吸收的能量(kJ) | 436 | 230 | a |
(5)
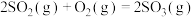 反应过程的能量变化如图所示。
反应过程的能量变化如图所示。
已知:1mol
 (g)氧化为1mol
(g)氧化为1mol  (g)的
(g)的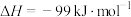 。请回答下列问题:
。请回答下列问题:①图中

②根据上述计算的焓变值,阐述热化学方程式:
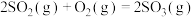
 代表的含义
代表的含义
您最近一年使用:0次
10 . 已知25℃时一些燃料的燃烧热数据如表所示:
使用上述燃料,最能体现“低碳经济”理念的是
| 燃料 | 一氧化碳 | 甲烷 | 乙醇 | 正戊烷(C5H12) |
| 燃烧热/(kJ/mol) | 283.0 | 890 | 1366.8 | 3161.0 |
| A.一氧化碳 | B.甲烷 | C.乙醇 | D.正戊烷 |
您最近一年使用:0次
2023-10-26更新
|
145次组卷
|
2卷引用:湖北省武汉市第四中学2023-2024学年高二上学期10月月考化学试题



