1 . 生产、生活中的化学反应都伴随着能量的变化。回答下列问题:
(1) 分子可形成单斜硫和斜方硫,转化过程如下:
分子可形成单斜硫和斜方硫,转化过程如下:
 ,则常温下,
,则常温下, (单斜)与
(单斜)与 (斜方)中较稳定的是
(斜方)中较稳定的是______ [填“ (单斜)”或“
(单斜)”或“ (斜方)”]
(斜方)”]
(2)丙烷( )常用作运动会火炬燃料。如图是一定量丙烷完全燃烧生成
)常用作运动会火炬燃料。如图是一定量丙烷完全燃烧生成 和
和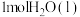 过程中的能量变化图。写出丙烷燃烧的热化学方程式:
过程中的能量变化图。写出丙烷燃烧的热化学方程式:______ ,丙烷的燃烧热( )为
)为_____ 。
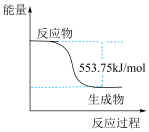
(3)水煤气是由 和
和 组成的混合气体,在工业上常用作燃料。已知:
组成的混合气体,在工业上常用作燃料。已知: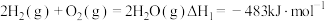 ;
; 。现取
。现取 (标准状况)水煤气,使其完全燃烧生成
(标准状况)水煤气,使其完全燃烧生成 和
和 ,测得反应共放热
,测得反应共放热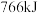 ,则水煤气中
,则水煤气中 与
与 的物质的量之比是
的物质的量之比是___ 。
(4)盖斯定律:不管化学过程是一步完成或分多步完成,整个过程的总热效应相同。
①反应 分两步进行:
分两步进行:
(ⅰ)
(ⅱ)
下列示意图中,能正确表示总反应过程中能量变化的是___ (填字母)。
A.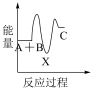 B.
B. 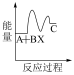 C.
C. 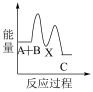 D.
D.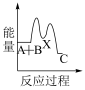
②已知:
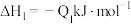

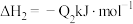


若将 液态无水酒精完全燃烧,并恢复到室温,则整个过程中放出的热量为
液态无水酒精完全燃烧,并恢复到室温,则整个过程中放出的热量为___  (用含
(用含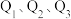 的代数式表示)。
的代数式表示)。
(5)下表中的数据表示断裂 化学键需消耗的能量(即键能,单位为
化学键需消耗的能量(即键能,单位为 ):
):
热化学方程式: ,则
,则 键的键能为
键的键能为______  。
。
(1)
 分子可形成单斜硫和斜方硫,转化过程如下:
分子可形成单斜硫和斜方硫,转化过程如下:
 ,则常温下,
,则常温下, (单斜)与
(单斜)与 (斜方)中较稳定的是
(斜方)中较稳定的是 (单斜)”或“
(单斜)”或“ (斜方)”]
(斜方)”](2)丙烷(
 )常用作运动会火炬燃料。如图是一定量丙烷完全燃烧生成
)常用作运动会火炬燃料。如图是一定量丙烷完全燃烧生成 和
和 过程中的能量变化图。写出丙烷燃烧的热化学方程式:
过程中的能量变化图。写出丙烷燃烧的热化学方程式: )为
)为
(3)水煤气是由
 和
和 组成的混合气体,在工业上常用作燃料。已知:
组成的混合气体,在工业上常用作燃料。已知: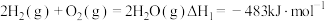 ;
; 。现取
。现取 (标准状况)水煤气,使其完全燃烧生成
(标准状况)水煤气,使其完全燃烧生成 和
和 ,测得反应共放热
,测得反应共放热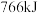 ,则水煤气中
,则水煤气中 与
与 的物质的量之比是
的物质的量之比是(4)盖斯定律:不管化学过程是一步完成或分多步完成,整个过程的总热效应相同。
①反应
 分两步进行:
分两步进行:(ⅰ)

(ⅱ)

下列示意图中,能正确表示总反应过程中能量变化的是
A.
 B.
B.  C.
C.  D.
D.
②已知:

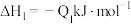

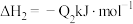


若将
 液态无水酒精完全燃烧,并恢复到室温,则整个过程中放出的热量为
液态无水酒精完全燃烧,并恢复到室温,则整个过程中放出的热量为 (用含
(用含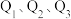 的代数式表示)。
的代数式表示)。(5)下表中的数据表示断裂
 化学键需消耗的能量(即键能,单位为
化学键需消耗的能量(即键能,单位为 ):
):| 化学键 |  |  |
| 键能 | 436 | 431 |
 ,则
,则 键的键能为
键的键能为 。
。
您最近一年使用:0次
名校
2 . 利用CO2(g)与H2(g)反应生成CH3OCH3(g)和H2O(g)有利于实现碳中和,其反应过程中的能量变化如图所示。下列有关说法正确的是
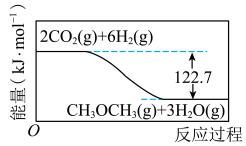

| A.若该反应在绝热密闭容器中进行,则反应过程中体系温度会降低 |
| B.1 molH2(g)在O2(g)中完全燃烧生成H2O(g)时放出的热量大于20.45kJ |
| C.若反应消耗0.4 molCO2(g)和1.2molH2(g),则该反应放出49.08kJ热量 |
| D.CH3OCH3(g)+3H2O(g)=2CO2(g) +6H2(g) ∆H=-122.7 kJ·mol-1 |
您最近一年使用:0次
2023-10-17更新
|
154次组卷
|
2卷引用:山东学情2023-2024学年高二上学期10月质量检测(鲁科版)化学试题
3 . 含碳化合物是环境、能源科学研究的热点。
已知:①
②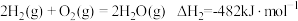
键能是指气态分子中1mol化学键解离成气态原子所吸收的能量。几种共价键的键能如下:
回答下列问题:
(1)CO(g)的燃烧热
___________  。
。
(2)a=___________ ,b=___________ 。
(3)已知 ,下图中
,下图中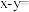
___________ 。
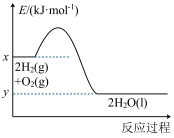
(4)2.24L(标准状况)CO和H2的混合气体在氧气中完全反应生成CO2(g)、H2O(g),放出的热量可能是___________(填字母)。
(5)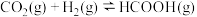 的速率方程
的速率方程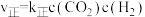 ,
, ,其中k为速率常数,与温度、催化剂有关,k的经验公式为
,其中k为速率常数,与温度、催化剂有关,k的经验公式为 (R和C为常数,
(R和C为常数, 为活化能,T为温度)。在催化剂作用下,
为活化能,T为温度)。在催化剂作用下, 与
与 的关系如图所示:
的关系如图所示:
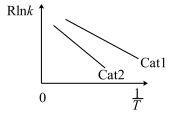
①催化效率较高的是___________ (填“Cat1”或“Cat2”),判断依据是___________ 。
②该反应的平衡常数表达式为___________ 。某温度下,平衡常数K为2, 为5,则
为5,则 为
为___________ 。
已知:①

②
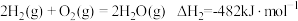
键能是指气态分子中1mol化学键解离成气态原子所吸收的能量。几种共价键的键能如下:
| 共价键 | C—C | O=O | C—H | C=O | H—H | H—O |  |
键能/( ) ) | 343 | a | 413 | b | 436 | 465 | 1076 |
(1)CO(g)的燃烧热

 。
。(2)a=
(3)已知
 ,下图中
,下图中

(4)2.24L(标准状况)CO和H2的混合气体在氧气中完全反应生成CO2(g)、H2O(g),放出的热量可能是___________(填字母)。
| A.28.8kJ | B.24.1kJ | C.26.6kJ | D.24.2kJ |
(5)
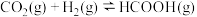 的速率方程
的速率方程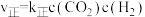 ,
, ,其中k为速率常数,与温度、催化剂有关,k的经验公式为
,其中k为速率常数,与温度、催化剂有关,k的经验公式为 (R和C为常数,
(R和C为常数, 为活化能,T为温度)。在催化剂作用下,
为活化能,T为温度)。在催化剂作用下, 与
与 的关系如图所示:
的关系如图所示:
①催化效率较高的是
②该反应的平衡常数表达式为
 为5,则
为5,则 为
为
您最近一年使用:0次
2023高三·全国·专题练习
名校
解题方法
4 . 回答下列问题。
(1)用NH3可以消除氮氧化物的污染,已知:
反应Ⅰ:4NH3(g)+3O2(g) 2N2(g)+6H2O(g) ΔH1=a kJ·mol-1
2N2(g)+6H2O(g) ΔH1=a kJ·mol-1
反应Ⅱ:N2(g)+O2(g) 2NO(g) ΔH2=b kJ·mol-1
2NO(g) ΔH2=b kJ·mol-1
反应Ⅲ:4NH3(g)+6NO(g) 5N2(g)+6H2O(g) ΔH3=c kJ·mol-1
5N2(g)+6H2O(g) ΔH3=c kJ·mol-1
则反应Ⅱ中的b=___________ (用含a、c的代数式表示),反应Ⅲ中的ΔS___________ (填“>”“<”或“=”)0。
(2)已知:①2CO(g)+SO2(g) S(l)+2CO2(g) ΔH1=-37.0 kJ·mol-1
S(l)+2CO2(g) ΔH1=-37.0 kJ·mol-1
②2H2(g)+SO2(g) S(l)+2H2O(g) ΔH2=+45.4 kJ·mol-1
S(l)+2H2O(g) ΔH2=+45.4 kJ·mol-1
③CO的燃烧热ΔH3=-283 kJ·mol-1,
请回答:
表示液态硫(S)的燃烧热的热化学方程式为___________ ;反应②中,正反应活化能E1___________ (填“>”“<”或“=”)ΔH2。
(3)若某温度下,CH3COOH(aq)与NaOH(aq)反应的ΔH=-46.8 kJ·mol-1,H2SO4(aq)与NaOH(aq)的中和热为57.3 kJ·mol-1,则CH3COOH在水溶液中电离的反应热ΔH1=___________ 。
(4)已知:
则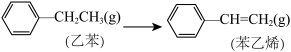 +H2(g) ΔH=
+H2(g) ΔH=___________ ;又知H2和苯乙烯的燃烧热ΔH分别为-290 kJ·mol-1和-4400 kJ·mol-1,则乙苯的燃烧热ΔH=___________ kJ·mol-1。
(1)用NH3可以消除氮氧化物的污染,已知:
反应Ⅰ:4NH3(g)+3O2(g)
 2N2(g)+6H2O(g) ΔH1=a kJ·mol-1
2N2(g)+6H2O(g) ΔH1=a kJ·mol-1反应Ⅱ:N2(g)+O2(g)
 2NO(g) ΔH2=b kJ·mol-1
2NO(g) ΔH2=b kJ·mol-1反应Ⅲ:4NH3(g)+6NO(g)
 5N2(g)+6H2O(g) ΔH3=c kJ·mol-1
5N2(g)+6H2O(g) ΔH3=c kJ·mol-1则反应Ⅱ中的b=
(2)已知:①2CO(g)+SO2(g)
 S(l)+2CO2(g) ΔH1=-37.0 kJ·mol-1
S(l)+2CO2(g) ΔH1=-37.0 kJ·mol-1②2H2(g)+SO2(g)
 S(l)+2H2O(g) ΔH2=+45.4 kJ·mol-1
S(l)+2H2O(g) ΔH2=+45.4 kJ·mol-1③CO的燃烧热ΔH3=-283 kJ·mol-1,
请回答:
表示液态硫(S)的燃烧热的热化学方程式为
(3)若某温度下,CH3COOH(aq)与NaOH(aq)反应的ΔH=-46.8 kJ·mol-1,H2SO4(aq)与NaOH(aq)的中和热为57.3 kJ·mol-1,则CH3COOH在水溶液中电离的反应热ΔH1=
(4)已知:
| 化学键 | C—H | C—C | C=C | H—H |
| 键能/(kJ·mol-1) | 412 | 348 | 612 | 436 |
 +H2(g) ΔH=
+H2(g) ΔH=
您最近一年使用:0次
5 . 化学反应中的热效应又称反应热,包括燃烧热、中和热等,其数据广泛应用于科学研究和工业生产方面。
(1)若 石墨完全燃烧放出的热量为
石墨完全燃烧放出的热量为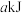 ,则石墨完全燃烧的热化学方程式为
,则石墨完全燃烧的热化学方程式为___________ 。
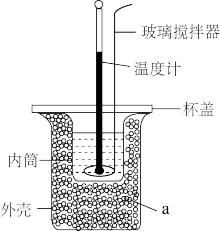
(2)利用如图所示装置测定中和反应的反应热的实验步骤如下:①用量筒量取 盐酸倒入内筒中,测出盐酸温度;②用另一量筒量取
盐酸倒入内筒中,测出盐酸温度;②用另一量筒量取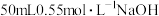 溶液,测出
溶液,测出 溶液温度;③将
溶液温度;③将 溶液沿玻璃棒缓慢倒入内筒中,设法使之混合均匀,测出混合液最高温度。装置中a的作用是
溶液沿玻璃棒缓慢倒入内筒中,设法使之混合均匀,测出混合液最高温度。装置中a的作用是___________ ,上述实验步骤中一处不合理的操作应改成___________ 。假设盐酸和氢氧化钠溶液的密度都是 ,又知中和反应后生成溶液的比热容
,又知中和反应后生成溶液的比热容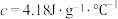 。测得溶液的温度依次为20.1℃、20.3℃、23.4℃,可计算出中和反应的反应热
。测得溶液的温度依次为20.1℃、20.3℃、23.4℃,可计算出中和反应的反应热
___________  (保留三位有效数字)。如果采用氨水代替氢氧化钠溶液,测得的中和反应的反应热
(保留三位有效数字)。如果采用氨水代替氢氧化钠溶液,测得的中和反应的反应热
___________ (“偏大”“偏小”或“相等”)。
(3)键能指 气态分子解离为气态原子所需的能量。已知
气态分子解离为气态原子所需的能量。已知 ,其中H—H、O=O、O—H的键能依次为
,其中H—H、O=O、O—H的键能依次为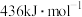 、
、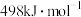 、
、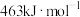 ,又知
,又知
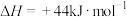 ,则氢气的燃烧热
,则氢气的燃烧热
___________ 。
(1)若
 石墨完全燃烧放出的热量为
石墨完全燃烧放出的热量为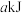 ,则石墨完全燃烧的热化学方程式为
,则石墨完全燃烧的热化学方程式为(2)利用如图所示装置测定中和反应的反应热的实验步骤如下:①用量筒量取
 盐酸倒入内筒中,测出盐酸温度;②用另一量筒量取
盐酸倒入内筒中,测出盐酸温度;②用另一量筒量取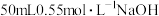 溶液,测出
溶液,测出 溶液温度;③将
溶液温度;③将 溶液沿玻璃棒缓慢倒入内筒中,设法使之混合均匀,测出混合液最高温度。装置中a的作用是
溶液沿玻璃棒缓慢倒入内筒中,设法使之混合均匀,测出混合液最高温度。装置中a的作用是 ,又知中和反应后生成溶液的比热容
,又知中和反应后生成溶液的比热容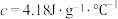 。测得溶液的温度依次为20.1℃、20.3℃、23.4℃,可计算出中和反应的反应热
。测得溶液的温度依次为20.1℃、20.3℃、23.4℃,可计算出中和反应的反应热
 (保留三位有效数字)。如果采用氨水代替氢氧化钠溶液,测得的中和反应的反应热
(保留三位有效数字)。如果采用氨水代替氢氧化钠溶液,测得的中和反应的反应热

(3)键能指
 气态分子解离为气态原子所需的能量。已知
气态分子解离为气态原子所需的能量。已知 ,其中H—H、O=O、O—H的键能依次为
,其中H—H、O=O、O—H的键能依次为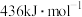 、
、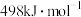 、
、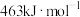 ,又知
,又知
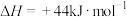 ,则氢气的燃烧热
,则氢气的燃烧热
您最近一年使用:0次
6 . 能源是国民经济发展的重要基础。请根据所学知识回答下列问题:
Ⅰ.在标准状况下,1.68L家用燃料(仅由C、H两种元素组成的某气体)质量为1.2g,在25℃和101kPa下完全燃烧生成 和
和 时,放出66.77kJ的热量。
时,放出66.77kJ的热量。
(1)该气体的分子式为___________ 。该气体的燃烧热
___________ 。(保留一位小数)
Ⅱ.火箭发射时可以用肼( ,液态)作燃料,
,液态)作燃料, 作氧化剂,二者反应生成
作氧化剂,二者反应生成 和水蒸气。
和水蒸气。
已知:
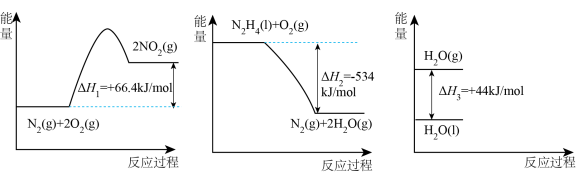
(2)请写出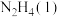 与
与 反应的热化学方程式
反应的热化学方程式___________ 。
(3)32g液态肼与足量 反应生成氮气和液态水时,放出的热量是
反应生成氮气和液态水时,放出的热量是___________ kJ。
(4)上述反应用于火箭推进器的原因:①能快速产生大量气体;②___________ 。
Ⅲ.氢能是一种极具发展潜力的清洁能源。 可用CO在高温下与水蒸气反应制得,是目前大规模制取氢气的方法之一
可用CO在高温下与水蒸气反应制得,是目前大规模制取氢气的方法之一
已知:在25℃、101kPa下,
①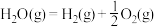
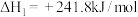
②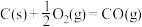
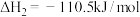
③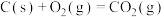

(5)25℃、101kPa下,CO与水蒸气反应转化为 和
和 的热化学方程式为
的热化学方程式为___________ 。
Ⅰ.在标准状况下,1.68L家用燃料(仅由C、H两种元素组成的某气体)质量为1.2g,在25℃和101kPa下完全燃烧生成
 和
和 时,放出66.77kJ的热量。
时,放出66.77kJ的热量。(1)该气体的分子式为

Ⅱ.火箭发射时可以用肼(
 ,液态)作燃料,
,液态)作燃料, 作氧化剂,二者反应生成
作氧化剂,二者反应生成 和水蒸气。
和水蒸气。已知:

(2)请写出
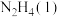 与
与 反应的热化学方程式
反应的热化学方程式(3)32g液态肼与足量
 反应生成氮气和液态水时,放出的热量是
反应生成氮气和液态水时,放出的热量是(4)上述反应用于火箭推进器的原因:①能快速产生大量气体;②
Ⅲ.氢能是一种极具发展潜力的清洁能源。
 可用CO在高温下与水蒸气反应制得,是目前大规模制取氢气的方法之一
可用CO在高温下与水蒸气反应制得,是目前大规模制取氢气的方法之一已知:在25℃、101kPa下,
①
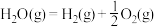
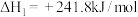
②
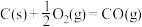
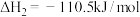
③
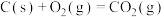

(5)25℃、101kPa下,CO与水蒸气反应转化为
 和
和 的热化学方程式为
的热化学方程式为
您最近一年使用:0次
7 . 热值
(1)定义:在101 kPa,_____ 物质完全燃烧所放出的热量。
(2)单位:________ 。
(3)热值与标准燃烧热的换算:
如甲烷的热值为55.6kJ·g-1,则甲烷的标准燃烧热为_____________ 。
(1)定义:在101 kPa,
(2)单位:
(3)热值与标准燃烧热的换算:
如甲烷的热值为55.6kJ·g-1,则甲烷的标准燃烧热为
您最近一年使用:0次
名校
8 . 化学反应中常伴随着能量变化,请按要求回答问题:
(1)1molNO2(g)和1molCO(g)反应生成CO2(g)和NO(g)过程中的能量变化示意图如图1所示,已知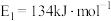 ,
, ,NO2和CO反应的热化学方程式为
,NO2和CO反应的热化学方程式为_______ 。
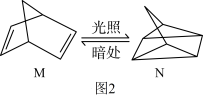
(2)有机物M经过太阳光光照可转化成N,转化过程如图2所示: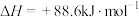 ,分则M、N相比,较稳定的是
,分则M、N相比,较稳定的是_______ 。
(3)25℃、101kPa时,56gCO在足量的O2中充分燃烧,放出565.2kJ热量,则CO的燃烧热为
_______ 。
(4)将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料, ,则反应过程中,每转移1mol电子放出的热量为
,则反应过程中,每转移1mol电子放出的热量为_______ kJ。
(5)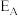 、
、 、
、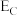 、
、 分别表示A(g)、B(g)、C(g)、D(g)所具有的能量,则对于反应:
分别表示A(g)、B(g)、C(g)、D(g)所具有的能量,则对于反应:
_______  (用含
(用含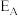 、
、 、
、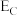 、
、 的代数式表示)。
的代数式表示)。
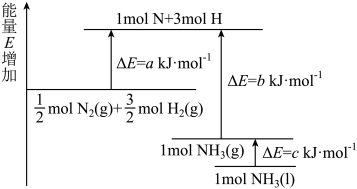
(6)合成氨反应的能量变化如下图所示,则反应
_______  。
。
(7)用50mL0.50mol/L盐酸与50mL0.65mol/LNaOH溶液进行中和反应的反应热的测定实验,测得酸、碱初始温度的平均值为25.0℃,反应过程中监测到最高温度的平均值为28.4℃,实验中盐酸和氢氧化钠溶液的密度均可取为 ,反应后溶液的比热容
,反应后溶液的比热容 。则生成1mol液态水时,反应热
。则生成1mol液态水时,反应热
_______  (
(保留三位有效数字 )。
(1)1molNO2(g)和1molCO(g)反应生成CO2(g)和NO(g)过程中的能量变化示意图如图1所示,已知
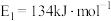 ,
, ,NO2和CO反应的热化学方程式为
,NO2和CO反应的热化学方程式为
(2)有机物M经过太阳光光照可转化成N,转化过程如图2所示:
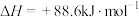 ,分则M、N相比,较稳定的是
,分则M、N相比,较稳定的是
(3)25℃、101kPa时,56gCO在足量的O2中充分燃烧,放出565.2kJ热量,则CO的燃烧热为

(4)将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料,
 ,则反应过程中,每转移1mol电子放出的热量为
,则反应过程中,每转移1mol电子放出的热量为(5)
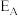 、
、 、
、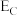 、
、 分别表示A(g)、B(g)、C(g)、D(g)所具有的能量,则对于反应:
分别表示A(g)、B(g)、C(g)、D(g)所具有的能量,则对于反应:
 (用含
(用含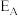 、
、 、
、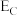 、
、 的代数式表示)。
的代数式表示)。(6)合成氨反应的能量变化如下图所示,则反应

 。
。
(7)用50mL0.50mol/L盐酸与50mL0.65mol/LNaOH溶液进行中和反应的反应热的测定实验,测得酸、碱初始温度的平均值为25.0℃,反应过程中监测到最高温度的平均值为28.4℃,实验中盐酸和氢氧化钠溶液的密度均可取为
 ,反应后溶液的比热容
,反应后溶液的比热容 。则生成1mol液态水时,反应热
。则生成1mol液态水时,反应热
 (
(
您最近一年使用:0次
2023-05-29更新
|
176次组卷
|
2卷引用:陕西省西北工业大学附属中学2022-2023学年高一下学期第二次月考化学试题
名校
解题方法
9 . 填空
(1)硫元素广泛存在于自然界中,常与铁、铜等金属元素形成硫化物。黄铁矿( )中S元素的化合价为
)中S元素的化合价为_______ ,黄铜矿( )中Fe元素化合价为
)中Fe元素化合价为_______ 。
(2)氢氟酸是HF的水溶液,工业上用氢氟酸溶蚀玻璃生产磨砂玻璃,其反应原理是_______ (用化学方程式表示)。
(3)天然橡胶的主要成分是聚异戊二烯,其结构简式如下。

写出聚异戊二烯单体的结构简式_______ 。
(4)乙酸乙酯是一种常用的萃取剂。请写出由乙醇和乙酸生成乙酸乙酯的化学方程式_______ 。
(5)工业制氢的一个重要反应是利用 还原
还原 。已知:
。已知:
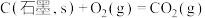



则表示 燃烧热的热化学方程式为
燃烧热的热化学方程式为_______ 。
(6)已知: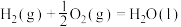
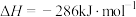

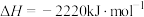
在常温常压下, 和
和 的混合气体共3mol完全燃烧生成
的混合气体共3mol完全燃烧生成 和液态水放出2792kJ的热量,则该混合气体中,
和液态水放出2792kJ的热量,则该混合气体中, 和
和 的体积比为
的体积比为_______ 。
(1)硫元素广泛存在于自然界中,常与铁、铜等金属元素形成硫化物。黄铁矿(
 )中S元素的化合价为
)中S元素的化合价为 )中Fe元素化合价为
)中Fe元素化合价为(2)氢氟酸是HF的水溶液,工业上用氢氟酸溶蚀玻璃生产磨砂玻璃,其反应原理是
(3)天然橡胶的主要成分是聚异戊二烯,其结构简式如下。

写出聚异戊二烯单体的结构简式
(4)乙酸乙酯是一种常用的萃取剂。请写出由乙醇和乙酸生成乙酸乙酯的化学方程式
(5)工业制氢的一个重要反应是利用
 还原
还原 。已知:
。已知: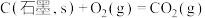



则表示
 燃烧热的热化学方程式为
燃烧热的热化学方程式为(6)已知:
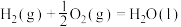
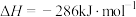

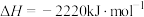
在常温常压下,
 和
和 的混合气体共3mol完全燃烧生成
的混合气体共3mol完全燃烧生成 和液态水放出2792kJ的热量,则该混合气体中,
和液态水放出2792kJ的热量,则该混合气体中, 和
和 的体积比为
的体积比为
您最近一年使用:0次
2023高三·全国·专题练习
解题方法
10 . 已知水的比热容为4.18×10-3kJ•(g•℃)-1,10g硫磺在O2中完全燃烧生成气态SO2,放出的热量能量使500gH2O温度由18℃升至62.4℃,则硫磺的燃烧热为___________ ,热化学方程式为___________ 。
您最近一年使用:0次



