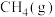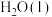1 . 科学家利用多种催化剂,实现甲烷和 的超干重整,获得富
的超干重整,获得富 产物。装置示意图及反应原理如下。
产物。装置示意图及反应原理如下。 ,先通
,先通 和
和 混合气,分离水蒸气;再通惰性气体,获得富
混合气,分离水蒸气;再通惰性气体,获得富 产物。各催化剂表面发生的反应为:
产物。各催化剂表面发生的反应为:
① 表面:
表面: (反应①)、
(反应①)、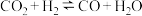 (反应②)
(反应②)
② 表面:
表面: (反应③)、
(反应③)、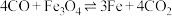 (反应④)
(反应④)
③ 表面:
表面: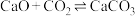 (反应⑤)
(反应⑤)
请回答:
(1)已知反应①的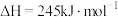 且
且 的燃烧热为
的燃烧热为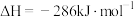 ,则
,则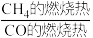
_______ 2(选填“>”“<”或“=”)。
(2) 催化下,研究单独使用
催化下,研究单独使用 对反应②的影响:
对反应②的影响: 。
。
①该反应的反应速率与浓度关系可表示为: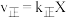 、
、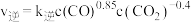 ,其中
,其中 、
、 为速率常数。则
为速率常数。则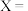
_______ (用含各物质的浓度的表达式表示)。
②某温度下该反应的平衡常数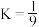 ,将等物质的量的
,将等物质的量的 和
和 通入含
通入含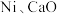 的反应器中,平衡后
的反应器中,平衡后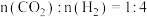 ,则
,则 的转化率为
的转化率为_______  (结果保留一位小数)。
(结果保留一位小数)。
(3)下列说法正确的是_______。
(4)一般情况下,催化剂并不能提高产物的平衡产率。但在该设计中,CO的平衡产率明显高于反应①单独进行时的 平衡产率,原因是
平衡产率,原因是_______ 。
 的超干重整,获得富
的超干重整,获得富 产物。装置示意图及反应原理如下。
产物。装置示意图及反应原理如下。
 ,先通
,先通 和
和 混合气,分离水蒸气;再通惰性气体,获得富
混合气,分离水蒸气;再通惰性气体,获得富 产物。各催化剂表面发生的反应为:
产物。各催化剂表面发生的反应为:①
 表面:
表面: (反应①)、
(反应①)、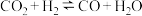 (反应②)
(反应②)②
 表面:
表面: (反应③)、
(反应③)、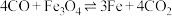 (反应④)
(反应④)③
 表面:
表面: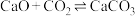 (反应⑤)
(反应⑤)请回答:
(1)已知反应①的
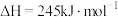 且
且 的燃烧热为
的燃烧热为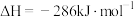 ,则
,则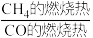
(2)
 催化下,研究单独使用
催化下,研究单独使用 对反应②的影响:
对反应②的影响: 。
。①该反应的反应速率与浓度关系可表示为:
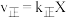 、
、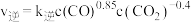 ,其中
,其中 、
、 为速率常数。则
为速率常数。则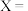
②某温度下该反应的平衡常数
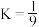 ,将等物质的量的
,将等物质的量的 和
和 通入含
通入含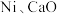 的反应器中,平衡后
的反应器中,平衡后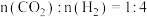 ,则
,则 的转化率为
的转化率为 (结果保留一位小数)。
(结果保留一位小数)。(3)下列说法正确的是_______。
A.获得等量 ,该技术的能耗小于单独用反应①的能耗 ,该技术的能耗小于单独用反应①的能耗 |
B.原料气中 与 与 的物质的量之比必须控制为 的物质的量之比必须控制为 |
C.该技术利用 暂存了 暂存了 ,利用 ,利用 暂存了还原性 暂存了还原性 |
D.须严格控制温度,防止 吸收水蒸气变成 吸收水蒸气变成 |
 平衡产率,原因是
平衡产率,原因是
您最近一年使用:0次
2 . 一种太空生命保障系统利用电解水供氧,生成的氢气与宇航员呼出的二氧化碳在催化剂作用下生成水和甲烷,水可循环使用。
(1)已知 与
与 的燃烧热分别为
的燃烧热分别为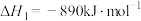 ,
, ;
;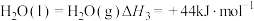 ,写出
,写出 与
与 生成
生成 和
和 的热化学方程式
的热化学方程式_________________ 。
(2)一定温度下,在恒容密闭容器中 与
与 反应生成
反应生成 和
和 。
。
①能说明该反应达到平衡状态的是_________________ (填字母)。
A. B.容器内压强一定
B.容器内压强一定
C.气体平均相对分子质量一定 D.混合气体密度一定
②已知容器的容积为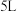 ,初始加入
,初始加入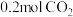 ,和
,和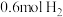 ,反应平衡后测得
,反应平衡后测得 的转化率为
的转化率为 ,则该反应的平衡常数为
,则该反应的平衡常数为_________________ 。
③温度不变,往②平衡状态中再加入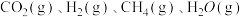 各
各 ,则此时反应速率
,则此时反应速率
_________________ 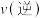 。(填“
。(填“ ”“
”“ ”或“
”或“ ")
")
(3)工业上在一定条件下利用 与
与 可直接合成有机中间体二甲醚:
可直接合成有机中间体二甲醚: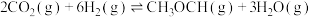 。
。
当 时,实验测得
时,实验测得 的平衡转化率随温度及压强变化如图所示:
的平衡转化率随温度及压强变化如图所示:
_________________ (填“ ”或“
”或“ ”)0。
”)0。
②图中压强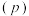 由大到小的顺序是
由大到小的顺序是_________________ 。
(1)已知
 与
与 的燃烧热分别为
的燃烧热分别为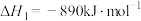 ,
, ;
;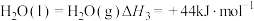 ,写出
,写出 与
与 生成
生成 和
和 的热化学方程式
的热化学方程式(2)一定温度下,在恒容密闭容器中
 与
与 反应生成
反应生成 和
和 。
。①能说明该反应达到平衡状态的是
A.
 B.容器内压强一定
B.容器内压强一定C.气体平均相对分子质量一定 D.混合气体密度一定
②已知容器的容积为
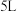 ,初始加入
,初始加入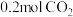 ,和
,和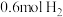 ,反应平衡后测得
,反应平衡后测得 的转化率为
的转化率为 ,则该反应的平衡常数为
,则该反应的平衡常数为③温度不变,往②平衡状态中再加入
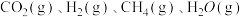 各
各 ,则此时反应速率
,则此时反应速率
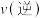 。(填“
。(填“ ”“
”“ ”或“
”或“ ")
")(3)工业上在一定条件下利用
 与
与 可直接合成有机中间体二甲醚:
可直接合成有机中间体二甲醚: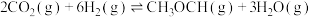 。
。当
 时,实验测得
时,实验测得 的平衡转化率随温度及压强变化如图所示:
的平衡转化率随温度及压强变化如图所示: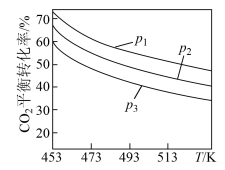

 ”或“
”或“ ”)0。
”)0。②图中压强
 由大到小的顺序是
由大到小的顺序是
您最近一年使用:0次
名校
3 . Ⅰ、CO2催化加氢制CH3OH的反应体系中,发生的主要反应有:
①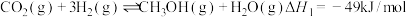
②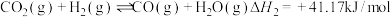
③
(1)③___________ (填“高温自发”“低温自发”或“任何温度下都自发”),该反应中活化能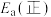
___________ 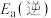 。(填“>”或“<”)
。(填“>”或“<”)
(2)反应①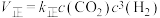 ,
, ,(
,( 、
、 只是温度的函数)。若该温度下的平衡常数K=10,则
只是温度的函数)。若该温度下的平衡常数K=10,则
___________  。升高温度,
。升高温度, 增大的倍数
增大的倍数___________ (填“大于”“小于”或“等于”) 增大的倍数。
增大的倍数。
(3)一定压强下,往某密闭容器中按投料比 充入H2和CO2,反应达到平衡时,测得各组分的物质的量分数随温度变化的曲线如图所示。
充入H2和CO2,反应达到平衡时,测得各组分的物质的量分数随温度变化的曲线如图所示。___________ 。
A.恒温恒压时充入氦气,反应①、③的平衡均逆向移动,反应②不移动
B.增大 的比值,H2的平衡转化率增大
的比值,H2的平衡转化率增大
C.图中X、Y分别代表CO、H2O
D.体系中的CO2的物质的量分数随温度变化不大,原因是温度变化,反应①、②的平衡移动方向相反
②在一定温度下,向恒容密闭容器中充入lnolCO2和3molH2,仅发生反应①。实验测得CH3OH的平衡分压与起始投料比[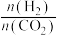 ]的关系如图。起始时容器内气体的总压强为8pkPa,则b点时反应的平衡常数Kp=
]的关系如图。起始时容器内气体的总压强为8pkPa,则b点时反应的平衡常数Kp=___________ 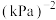 (用含p的表达式表示)。(已知:用气体分压计算的平衡常数为Kp,分压=总压×物质的量分数)。
(用含p的表达式表示)。(已知:用气体分压计算的平衡常数为Kp,分压=总压×物质的量分数)。
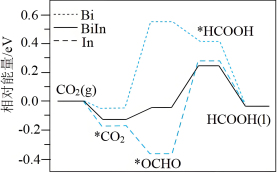
(4)我国学者探究了BiIn合金催化剂电化学还原CO2生产HCOOH的催化性能及机理,并通过DFT计算催化剂表面该还原过程的物质的相对能量,如图所示(带“*”表示物质处于吸附态),试从图分析,采用BiIn合金催化剂优于中金属Bi和单金属In催化剂的原因分别是___________ 。
①
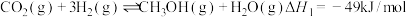
②
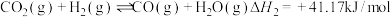
③

(1)③
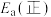
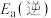 。(填“>”或“<”)
。(填“>”或“<”)(2)反应①
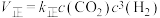 ,
, ,(
,( 、
、 只是温度的函数)。若该温度下的平衡常数K=10,则
只是温度的函数)。若该温度下的平衡常数K=10,则
 。升高温度,
。升高温度, 增大的倍数
增大的倍数 增大的倍数。
增大的倍数。(3)一定压强下,往某密闭容器中按投料比
 充入H2和CO2,反应达到平衡时,测得各组分的物质的量分数随温度变化的曲线如图所示。
充入H2和CO2,反应达到平衡时,测得各组分的物质的量分数随温度变化的曲线如图所示。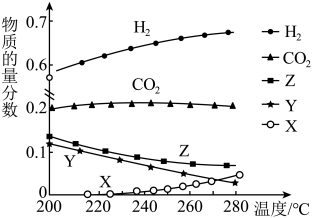
A.恒温恒压时充入氦气,反应①、③的平衡均逆向移动,反应②不移动
B.增大
 的比值,H2的平衡转化率增大
的比值,H2的平衡转化率增大C.图中X、Y分别代表CO、H2O
D.体系中的CO2的物质的量分数随温度变化不大,原因是温度变化,反应①、②的平衡移动方向相反
②在一定温度下,向恒容密闭容器中充入lnolCO2和3molH2,仅发生反应①。实验测得CH3OH的平衡分压与起始投料比[
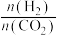 ]的关系如图。起始时容器内气体的总压强为8pkPa,则b点时反应的平衡常数Kp=
]的关系如图。起始时容器内气体的总压强为8pkPa,则b点时反应的平衡常数Kp=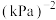 (用含p的表达式表示)。(已知:用气体分压计算的平衡常数为Kp,分压=总压×物质的量分数)。
(用含p的表达式表示)。(已知:用气体分压计算的平衡常数为Kp,分压=总压×物质的量分数)。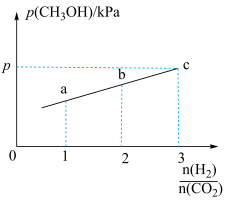
(4)我国学者探究了BiIn合金催化剂电化学还原CO2生产HCOOH的催化性能及机理,并通过DFT计算催化剂表面该还原过程的物质的相对能量,如图所示(带“*”表示物质处于吸附态),试从图分析,采用BiIn合金催化剂优于中金属Bi和单金属In催化剂的原因分别是
您最近一年使用:0次
7日内更新
|
285次组卷
|
2卷引用:2024届辽宁省实验中学高三下学期考前模拟训练(五模)化学试卷
4 . 杭州第19届亚运会主火炬首次使用甲醇作燃料。已知:
I.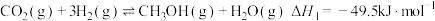
Ⅱ.
Ⅲ.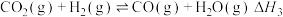
回答下列问题:
(1)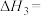
______  ,反应Ⅱ自发进行的条件是
,反应Ⅱ自发进行的条件是______ 。
(2)一定温度下,在恒容密闭容器中充入 和
和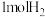 只发生反应I。下列叙述正确的是______(填标号)。
只发生反应I。下列叙述正确的是______(填标号)。
(3)科学家对反应Ⅱ机理进行计算模拟,反应过程中能量变化如图所示。______ 步反应,总反应的最大能垒是______  。催化剂主要降低第
。催化剂主要降低第______ 步能垒。
(4)一定温度下,在甲、乙两个体积相同的反应容器中分别充入 和
和 ,发生反应
,发生反应 和Ⅲ,其中一个容器使用水分子膜分离技术。实验测得
和Ⅲ,其中一个容器使用水分子膜分离技术。实验测得 平得转化率与压强关系如图所示(已知:
平得转化率与压强关系如图所示(已知: 点
点 选择性为
选择性为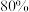 )。
)。 平衡转化率增大的原因是
平衡转化率增大的原因是______ 。采用水分子膜分离技术的是______ (填“甲”或“乙”)。
②该温度下, 点对应的反应Ⅲ平衡常数
点对应的反应Ⅲ平衡常数
______ (结果保留两位有效数字)。提示:用气体分压计算的平衡常数为压强平衡常数 ,气体分压
,气体分压 总压
总压 气体物质的量分数;
气体物质的量分数; 的选择性
的选择性 。
。
I.
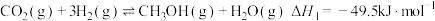
Ⅱ.

Ⅲ.
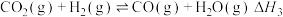
回答下列问题:
(1)
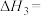
 ,反应Ⅱ自发进行的条件是
,反应Ⅱ自发进行的条件是(2)一定温度下,在恒容密闭容器中充入
 和
和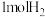 只发生反应I。下列叙述正确的是______(填标号)。
只发生反应I。下列叙述正确的是______(填标号)。A.达到平衡时最多生成 |
B. 体积分数不变时达到平衡状态 体积分数不变时达到平衡状态 |
C.平衡后再充入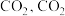 平衡转化率增大 平衡转化率增大 |
| D.升温,反应速䆥增大,平衡常数减小 |
(3)科学家对反应Ⅱ机理进行计算模拟,反应过程中能量变化如图所示。

 。催化剂主要降低第
。催化剂主要降低第(4)一定温度下,在甲、乙两个体积相同的反应容器中分别充入
 和
和 ,发生反应
,发生反应 和Ⅲ,其中一个容器使用水分子膜分离技术。实验测得
和Ⅲ,其中一个容器使用水分子膜分离技术。实验测得 平得转化率与压强关系如图所示(已知:
平得转化率与压强关系如图所示(已知: 点
点 选择性为
选择性为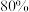 )。
)。
 平衡转化率增大的原因是
平衡转化率增大的原因是②该温度下,
 点对应的反应Ⅲ平衡常数
点对应的反应Ⅲ平衡常数
 ,气体分压
,气体分压 总压
总压 气体物质的量分数;
气体物质的量分数; 的选择性
的选择性 。
。
您最近一年使用:0次
名校
5 . 水煤气变换反应是工业上的重要反应,可用于制氢。
水煤气变换反应:
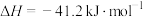
该反应分两步完成:
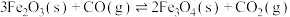
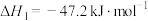
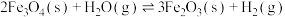

请回答:
(1)
_____________  。
。
(2)恒定总压1.70MPa和水碳比[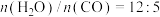 ]投料,在不同条件下达到平衡时
]投料,在不同条件下达到平衡时 和
和 的分压(某成分分压=总压×该成分的物质的量分数)如下表:
的分压(某成分分压=总压×该成分的物质的量分数)如下表:
①在条件1下,水煤气变换反应的平衡常数K=___________ 。
②对比条件1,条件2中 产率下降是因为发生了一个不涉及
产率下降是因为发生了一个不涉及 的副反应,写出该反应方程式
的副反应,写出该反应方程式___________ 。
(3)下列说法正确的是 。
(4)水煤气变换反应是放热的可逆反应,需在多个催化剂反应层间进行降温操作以“去除”反应过程中的余热(如图1所示),保证反应在最适宜温度附近进行。_____________ 。
C.通过热交换器换热
②若采用喷入冷水(蒸气)的方式降温,在图3中作出CO平衡转化率随温度变化的曲线_____________ 。________________ 。
水煤气变换反应:

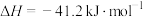
该反应分两步完成:
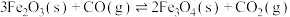
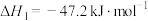
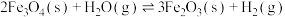

请回答:
(1)

 。
。(2)恒定总压1.70MPa和水碳比[
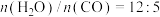 ]投料,在不同条件下达到平衡时
]投料,在不同条件下达到平衡时 和
和 的分压(某成分分压=总压×该成分的物质的量分数)如下表:
的分压(某成分分压=总压×该成分的物质的量分数)如下表:
|
|
| |
条件1 | 0.40 | 0.40 | 0 |
条件2 | 0.42 | 0.36 | 0.02 |
②对比条件1,条件2中
 产率下降是因为发生了一个不涉及
产率下降是因为发生了一个不涉及 的副反应,写出该反应方程式
的副反应,写出该反应方程式(3)下列说法正确的是 。
A.通入反应器的原料气中应避免混入 |
B.恒定水碳比[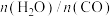 ],增加体系总压可提高 ],增加体系总压可提高 的平衡产率 的平衡产率 |
C.通入过量的水蒸气可防止 被进一步还原为Fe 被进一步还原为Fe |
| D.通过充入惰性气体增加体系总压,可提高反应速率 |
(4)水煤气变换反应是放热的可逆反应,需在多个催化剂反应层间进行降温操作以“去除”反应过程中的余热(如图1所示),保证反应在最适宜温度附近进行。

C.通过热交换器换热
②若采用喷入冷水(蒸气)的方式降温,在图3中作出CO平衡转化率随温度变化的曲线

您最近一年使用:0次
6 . 我国力争于2030年前做到碳达峰,2060年前实现碳中和。CH4与CO2重整是CO2利用的研究热点之一、该重整反应体系主要涉及以下反应:
a) CH4(g)+CO2(g) ⇌ 2CO(g)+2H2(g) ∆H1
b) CO2(g)+H2(g) ⇌ CO(g)+H2O(g) ∆H2
c) CH4(g) ⇌ C(s)+2H2(g) ∆H3
d) 2CO(g) ⇌ CO2(g)+C(s) ∆H4
e) CO(g)+H2(g) ⇌ H2O(g)+C(s) ∆H5
(1)根据盖斯定律,反应a的∆H1=___________ (写出一个代数式即可)。
(2)上述反应体系在一定条件下建立平衡后,下列说法正确的有___________。
(3)一定条件下,CH4分解形成碳的反应历程如图1所示。该历程分___________ 步进行,其中,第___________ 步的正反应活化能最大。 为相对压力平衡常数,其表达式写法:在浓度平衡常数表达式中,用相对分压代替浓度。气体的相对分压等于其分压(单位为kPa)除以p0(p0=100kPa)。反应a、c、e的ln K
为相对压力平衡常数,其表达式写法:在浓度平衡常数表达式中,用相对分压代替浓度。气体的相对分压等于其分压(单位为kPa)除以p0(p0=100kPa)。反应a、c、e的ln K 随
随 (温度的倒数)的变化如图2所示。
(温度的倒数)的变化如图2所示。
①反应a、c、e中,属于吸热反应的有___________ (填字母)。
②反应c的相对压力平衡常数表达式为K =
=___________ 。
(5)CO2用途广泛,写出基于其物理性质的一种用途:___________ 。
a) CH4(g)+CO2(g) ⇌ 2CO(g)+2H2(g) ∆H1
b) CO2(g)+H2(g) ⇌ CO(g)+H2O(g) ∆H2
c) CH4(g) ⇌ C(s)+2H2(g) ∆H3
d) 2CO(g) ⇌ CO2(g)+C(s) ∆H4
e) CO(g)+H2(g) ⇌ H2O(g)+C(s) ∆H5
(1)根据盖斯定律,反应a的∆H1=
(2)上述反应体系在一定条件下建立平衡后,下列说法正确的有___________。
| A.增大CO2与CH4的浓度,反应a、b、c的正反应速率都增加 |
| B.移去部分C(s),反应c、d、e的平衡均向右移动 |
| C.加入反应a的催化剂,可提高CH4的平衡转化率 |
| D.降低反应温度,反应a~e的正、逆反应速率都减小 |
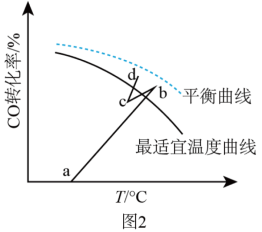
(3)一定条件下,CH4分解形成碳的反应历程如图1所示。该历程分
 为相对压力平衡常数,其表达式写法:在浓度平衡常数表达式中,用相对分压代替浓度。气体的相对分压等于其分压(单位为kPa)除以p0(p0=100kPa)。反应a、c、e的ln K
为相对压力平衡常数,其表达式写法:在浓度平衡常数表达式中,用相对分压代替浓度。气体的相对分压等于其分压(单位为kPa)除以p0(p0=100kPa)。反应a、c、e的ln K 随
随 (温度的倒数)的变化如图2所示。
(温度的倒数)的变化如图2所示。①反应a、c、e中,属于吸热反应的有
②反应c的相对压力平衡常数表达式为K
 =
=(5)CO2用途广泛,写出基于其物理性质的一种用途:
您最近一年使用:0次
解题方法
7 . 甲醛( )在化工、医药、农药等方面有广泛的应用。利用甲醇一定条件下直接脱氢可制甲醛,涉及的反应如下:
)在化工、医药、农药等方面有广泛的应用。利用甲醇一定条件下直接脱氢可制甲醛,涉及的反应如下:
反应I:

反应Ⅱ: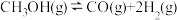

已知:①平衡状态下,甲醛选择性 ;甲醛的收率
;甲醛的收率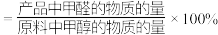 。
。
②几种物质的燃烧热( )如下表:
)如下表:
回答下列问题:
(1)
___________ ,反应I的正反应活化能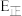
___________ (填“>”或“<”)逆反应活化能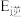 。
。
(2)反应I、反应Ⅱ的反应历程可表示为:
历程i:……
历程ii: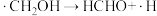
历程iii:
历程iV: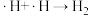
写出历程i的反应方程式:___________ 。
(3)将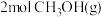 加入容积为
加入容积为 的刚性密闭容器中,温度对平衡状态下
的刚性密闭容器中,温度对平衡状态下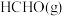 的选择性和收率的影响如图所示。
的选择性和收率的影响如图所示。___________ (填“I”或“Ⅱ”),判断的依据是___________ 。
②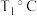 ,反应进行到
,反应进行到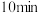 时达到平衡,此时
时达到平衡,此时 的转化率为
的转化率为___________ ,
___________ ,反应I的平衡常数
___________  。
。
 )在化工、医药、农药等方面有广泛的应用。利用甲醇一定条件下直接脱氢可制甲醛,涉及的反应如下:
)在化工、医药、农药等方面有广泛的应用。利用甲醇一定条件下直接脱氢可制甲醛,涉及的反应如下:反应I:


反应Ⅱ:
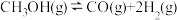

已知:①平衡状态下,甲醛选择性
 ;甲醛的收率
;甲醛的收率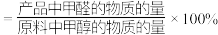 。
。②几种物质的燃烧热(
 )如下表:
)如下表:| 物质 |  | 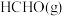 | 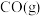 | 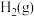 |
燃烧热 |  |  |  | 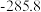 |
(1)

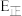
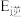 。
。(2)反应I、反应Ⅱ的反应历程可表示为:
历程i:……
历程ii:
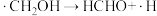
历程iii:

历程iV:
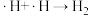
写出历程i的反应方程式:
(3)将
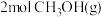 加入容积为
加入容积为 的刚性密闭容器中,温度对平衡状态下
的刚性密闭容器中,温度对平衡状态下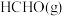 的选择性和收率的影响如图所示。
的选择性和收率的影响如图所示。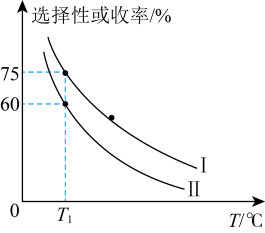
②
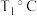 ,反应进行到
,反应进行到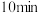 时达到平衡,此时
时达到平衡,此时 的转化率为
的转化率为

 。
。
您最近一年使用:0次
名校
8 .  还原CO2是实现“双碱”经济的有效途径之一,涉及反应如下:
还原CO2是实现“双碱”经济的有效途径之一,涉及反应如下:
Ⅰ:

Ⅱ: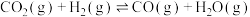

回答下列问题:
(1)物质的标准生成焓是指在标态和某温度下,由元素最稳定的单质生成1mol纯净物时的焓变。一些物质298K时的标准生成焓(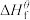 )
)


______ 
(2)有利于提高CO平衡产率的条件是______(填标号)。
(3)反应Ⅰ的正、逆反应速率方程为: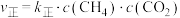 、
、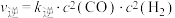 ,
, 、
、 符合阿伦尼乌斯公式
符合阿伦尼乌斯公式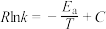 (
( 为活化能:T为温度:R、c为常数),实验测得
为活化能:T为温度:R、c为常数),实验测得 的实验数据如图所示,则正反应的活化能
的实验数据如图所示,则正反应的活化能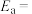
______  ,升高温度
,升高温度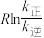 的值
的值______ (填“增大”“减小”或“不变”)。 而产生积碳,从而导致催化剂活性降低。若向容器中通入过量水蒸气可以清除积碳.反应的化学方程式为
而产生积碳,从而导致催化剂活性降低。若向容器中通入过量水蒸气可以清除积碳.反应的化学方程式为______ ,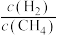 的值
的值______ (填“增大”“减小”或“不变”)。
(5)在101kPa时,工业上按投料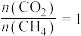 加入刚性密闭容器中,只发生Ⅰ、Ⅱ两个反应,
加入刚性密闭容器中,只发生Ⅰ、Ⅱ两个反应, 和
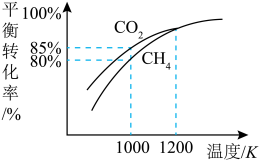
和 的平衡转化率与温度的关系如图所示.温度高于1200 K时,
的平衡转化率与温度的关系如图所示.温度高于1200 K时, 和
和 的平衡转化率趋于相等的原因可能是
的平衡转化率趋于相等的原因可能是______ ;计算1000 K时反应Ⅱ的压强平衡常数
______ (计算结果保留3位有效数字,用平衡分压代替平衡浓度,分压=总压×物质的量分数)。
 还原CO2是实现“双碱”经济的有效途径之一,涉及反应如下:
还原CO2是实现“双碱”经济的有效途径之一,涉及反应如下:Ⅰ:


Ⅱ:

回答下列问题:
(1)物质的标准生成焓是指在标态和某温度下,由元素最稳定的单质生成1mol纯净物时的焓变。一些物质298K时的标准生成焓(
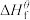 )
)


物质 |
|
|
|
|
|
| -74.8 | -110 | -393.5 | -286 | 0 |
(2)有利于提高CO平衡产率的条件是______(填标号)。
| A.低温低压 | B.低温高压 | C.高温低压 | D.高温高压 |
(3)反应Ⅰ的正、逆反应速率方程为:
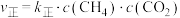 、
、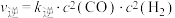 ,
, 、
、 符合阿伦尼乌斯公式
符合阿伦尼乌斯公式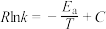 (
( 为活化能:T为温度:R、c为常数),实验测得
为活化能:T为温度:R、c为常数),实验测得 的实验数据如图所示,则正反应的活化能
的实验数据如图所示,则正反应的活化能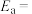
 ,升高温度
,升高温度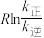 的值
的值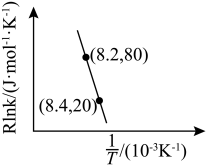
 而产生积碳,从而导致催化剂活性降低。若向容器中通入过量水蒸气可以清除积碳.反应的化学方程式为
而产生积碳,从而导致催化剂活性降低。若向容器中通入过量水蒸气可以清除积碳.反应的化学方程式为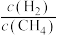 的值
的值(5)在101kPa时,工业上按投料
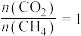 加入刚性密闭容器中,只发生Ⅰ、Ⅱ两个反应,
加入刚性密闭容器中,只发生Ⅰ、Ⅱ两个反应, 和
和 的平衡转化率与温度的关系如图所示.温度高于1200 K时,
的平衡转化率与温度的关系如图所示.温度高于1200 K时, 和
和 的平衡转化率趋于相等的原因可能是
的平衡转化率趋于相等的原因可能是
您最近一年使用:0次
2024-06-02更新
|
205次组卷
|
3卷引用:2024届山东省菏泽市高三下学期二模化学试题
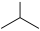
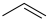
9 . 异丁烯(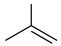 )是重要的化工生产原料,可由异丁烷(
)是重要的化工生产原料,可由异丁烷(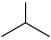 )催化脱氢制备,反应如下:
)催化脱氢制备,反应如下:
主反应:
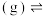

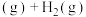
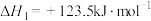
副反应:
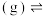
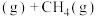

 纯物质的热效应被称为该物质的摩尔生成焓。上述物质的摩尔生成焓如下表:
纯物质的热效应被称为该物质的摩尔生成焓。上述物质的摩尔生成焓如下表:| 气态物质 |
|
| C2H4 | CH4 |
摩尔生成焓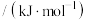 | -134.5 | 20.4 | 52.3 | -74.8 |
(1)


(2)有利于提高异丁烷平衡转化率的条件是
A.低温 B.高温 C.低压 D.高压 E.催化剂
(3)其他条件相同,在恒压
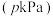 密闭容器中充入异丁烷和
密闭容器中充入异丁烷和 各
各 (
( 作惰性气体),经过相同时间测得相关数据如图1和图2所示。[
作惰性气体),经过相同时间测得相关数据如图1和图2所示。[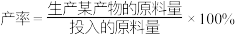 空速(GHSV)表示单位时间通过单位体积催化剂的气体量](不考虑温度对催化剂活性的影响,异丁烷分子在催化剂表面能较快吸附)
空速(GHSV)表示单位时间通过单位体积催化剂的气体量](不考虑温度对催化剂活性的影响,异丁烷分子在催化剂表面能较快吸附)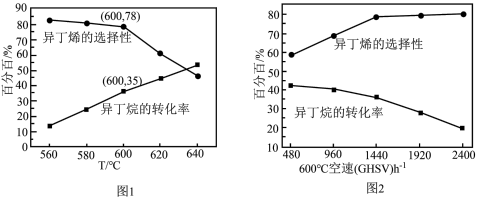
 时异丁烯产率为
时异丁烯产率为②下列说法错误的是
A.由图1可知,温度越高,异丁烷的转化率越大,丙烯的产率越小
B.混入
 的目的之一是减小异丁烷的吸附速率,同时带走催化剂局部多余的热量,从而抑制催化剂的积碳
的目的之一是减小异丁烷的吸附速率,同时带走催化剂局部多余的热量,从而抑制催化剂的积碳C.图2中,空速增加,异丁烷转化率降低的原因可能是原料气在催化剂中停留时间过短
D.图2中,空速增加,异丁烯选择性升高的原因可能是原料气将产物迅速带走,抑制了副反应的发生
③图1中,随着温度升高,异丁烷转化率升高而异丁烯选择性下降的原因可能是
④温度为
 ,反应
,反应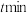 后达到平衡,此时异丁烷的转化率为
后达到平衡,此时异丁烷的转化率为 ,异丁烯的选择性为
,异丁烯的选择性为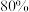 ,
,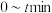 内,
内, 的分压平均变化率为
的分压平均变化率为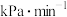 ;该条件下,主反应的平衡常数
;该条件下,主反应的平衡常数
 。
。
您最近一年使用:0次
2024-05-30更新
|
160次组卷
|
3卷引用:河北省保定市九校2024届高三下学期二模化学试题
名校
10 . 在推进碳达峰、碳中和的大背景下,可以通过多种手段实现 的减排和资源化利用。请回答下列问题:
的减排和资源化利用。请回答下列问题:
(1)科学家设想,二氧化碳加氢还原转化为推进剂甲烷,以实现星际旅行的愿望。其中涉及的主要反应如下:
反应Ⅰ: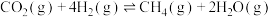

反应Ⅱ:

①已知: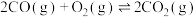
 ,则反应
,则反应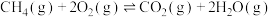 的
的
______ (用含 、
、 、
、 的代数式表示)。
的代数式表示)。
②反应Ⅰ的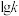 与温度的关系如图1所示。已知反应Ⅰ的速率方程为
与温度的关系如图1所示。已知反应Ⅰ的速率方程为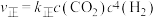 ,
, ,其中
,其中 、
、 为速率常数,只受温度影响。
为速率常数,只受温度影响。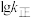 曲线的是
曲线的是______ (填“MH”或“NG”);反应Ⅰ的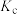 (浓度平衡常数)与速率常数之间的关系为
(浓度平衡常数)与速率常数之间的关系为______ (用含 、
、 的代数式表示)。
的代数式表示)。
③向某恒压密闭容器中充入5 mol CO2、和20mol 、和在不同温度下同时发生上述反应Ⅰ和反应Ⅱ,平衡时两种含碳物质的物质的量
、和在不同温度下同时发生上述反应Ⅰ和反应Ⅱ,平衡时两种含碳物质的物质的量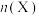 与温度T的关系如图2所示。
与温度T的关系如图2所示。______ (填含碳物质的分子式)的物质的量与温度的关系变化曲线;800K时,若平衡时容器内总压为p,图2中缺少的含碳物质平衡时为1.0 mol,则反应Ⅱ的压强平衡常数
_____ (结果保留两位有效数字, 为用分压表示的平衡常数,分压=总压×物质的量分数)。
为用分压表示的平衡常数,分压=总压×物质的量分数)。
(2)二氧化碳加氢制甲醇发生的主要化学反应如下:
①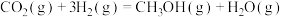
 kJ⋅mol
kJ⋅mol
②
 kJ⋅mol
kJ⋅mol
控制压强为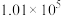 Pa、
Pa、 ,其他条件相同时,在密闭容器中发生上述反应①、②,反应温度对
,其他条件相同时,在密闭容器中发生上述反应①、②,反应温度对 的平衡转化率及
的平衡转化率及 的平衡选择性的影响如图3、4所示[
的平衡选择性的影响如图3、4所示[ 的选择性可表示为
的选择性可表示为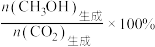 ]。
]。 的平衡转化率随温度升高而降低的原因是
的平衡转化率随温度升高而降低的原因是____________ 。
(3)金红石型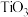 ,可用于
,可用于 催化氢化
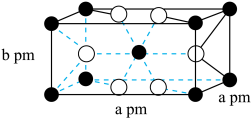
催化氢化 ,其立方晶胞结构如图所示,设阿伏加德罗常数的值为
,其立方晶胞结构如图所示,设阿伏加德罗常数的值为 。
。______ 中心(填字母)。
A.三角形 B.四面体 C.六面体 D.八面体
②该晶体的密度为______ g·cm (用含a、b、
(用含a、b、 的代数式表示)。
的代数式表示)。
 的减排和资源化利用。请回答下列问题:
的减排和资源化利用。请回答下列问题:(1)科学家设想,二氧化碳加氢还原转化为推进剂甲烷,以实现星际旅行的愿望。其中涉及的主要反应如下:
反应Ⅰ:
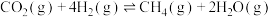

反应Ⅱ:


①已知:
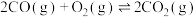
 ,则反应
,则反应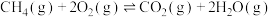 的
的
 、
、 、
、 的代数式表示)。
的代数式表示)。②反应Ⅰ的
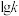 与温度的关系如图1所示。已知反应Ⅰ的速率方程为
与温度的关系如图1所示。已知反应Ⅰ的速率方程为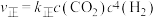 ,
, ,其中
,其中 、
、 为速率常数,只受温度影响。
为速率常数,只受温度影响。
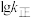 曲线的是
曲线的是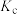 (浓度平衡常数)与速率常数之间的关系为
(浓度平衡常数)与速率常数之间的关系为 、
、 的代数式表示)。
的代数式表示)。③向某恒压密闭容器中充入5 mol CO2、和20mol
 、和在不同温度下同时发生上述反应Ⅰ和反应Ⅱ,平衡时两种含碳物质的物质的量
、和在不同温度下同时发生上述反应Ⅰ和反应Ⅱ,平衡时两种含碳物质的物质的量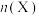 与温度T的关系如图2所示。
与温度T的关系如图2所示。

 为用分压表示的平衡常数,分压=总压×物质的量分数)。
为用分压表示的平衡常数,分压=总压×物质的量分数)。(2)二氧化碳加氢制甲醇发生的主要化学反应如下:
①
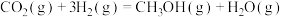
 kJ⋅mol
kJ⋅mol
②

 kJ⋅mol
kJ⋅mol
控制压强为
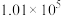 Pa、
Pa、 ,其他条件相同时,在密闭容器中发生上述反应①、②,反应温度对
,其他条件相同时,在密闭容器中发生上述反应①、②,反应温度对 的平衡转化率及
的平衡转化率及 的平衡选择性的影响如图3、4所示[
的平衡选择性的影响如图3、4所示[ 的选择性可表示为
的选择性可表示为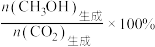 ]。
]。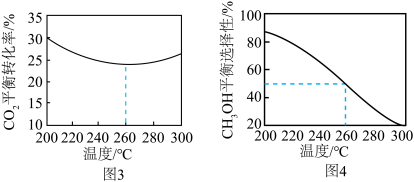
 的平衡转化率随温度升高而降低的原因是
的平衡转化率随温度升高而降低的原因是(3)金红石型
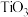 ,可用于
,可用于 催化氢化
催化氢化 ,其立方晶胞结构如图所示,设阿伏加德罗常数的值为
,其立方晶胞结构如图所示,设阿伏加德罗常数的值为 。
。
A.三角形 B.四面体 C.六面体 D.八面体
②该晶体的密度为
 (用含a、b、
(用含a、b、 的代数式表示)。
的代数式表示)。
您最近一年使用:0次

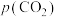 /MPa
/MPa /MPa
/MPa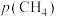 /MPa
/MPa