解题方法
1 . 某温度时,在一个2L的密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示。根据图中数据填空:
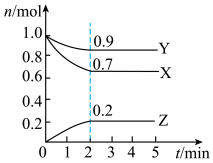
(1)该反应的化学方程式为______ 。
(2)反应开始至2min末,以气体X表示的平均反应速率为_____ ;反应开始时与反应达平衡状态时的压强之比为_____ 。
(3)恒温恒容条件下,能说明该反应达到化学平衡状态的标志是_____ 。
①混合气体的压强不再变化
②混合气体的密度不再变化
③X的百分含量不再变化
④混合气体的平均相对分子质量不再变化
⑤v(X):v(Y)=3:1

(1)该反应的化学方程式为
(2)反应开始至2min末,以气体X表示的平均反应速率为
(3)恒温恒容条件下,能说明该反应达到化学平衡状态的标志是
①混合气体的压强不再变化
②混合气体的密度不再变化
③X的百分含量不再变化
④混合气体的平均相对分子质量不再变化
⑤v(X):v(Y)=3:1
| A.①②⑤ | B.①③④ | C.②③④ | D.③④⑤ |
您最近一年使用:0次
名校
解题方法
2 . (1)在一定温度下的恒容密闭容器中,可逆反应达到平衡状态时,一些宏观物理量恒定不变:a.各物质的浓度不变,b.平衡混合物中各组分的物质的量分数或质量分数不变,c.容器内气体压强不变,d.容器内气体密度不变,e.容器内气体颜色不变。
①能说明反应N2(g)+3H2(g) 2NH3(g)达到平衡状态的有
2NH3(g)达到平衡状态的有__ ;
②能说明反应H2(g)+I2(g) 2HI(g)达到平衡状态的有
2HI(g)达到平衡状态的有__ ;
(2)为了研究碳酸钙与盐酸反应的反应速率,某同学通过如图实验装置测定反应中生成的CO2气体体积,并绘制出如图所示的曲线。请分析讨论以下问题。


①化学反应速率最快的时间段是___ (填选项),影响此时间段反应速率的主要因素是___ ;
A.O~t1 B.t1~t2 C.t2~t3 D.t3~t4
②为了减缓上述反应速率,欲向盐酸中加入下列物质,你认为可行的有___ ;
A.蒸馏水 B.NaCl固体 C.NaCl溶液 D.通入HCl气体
①能说明反应N2(g)+3H2(g)
 2NH3(g)达到平衡状态的有
2NH3(g)达到平衡状态的有②能说明反应H2(g)+I2(g)
 2HI(g)达到平衡状态的有
2HI(g)达到平衡状态的有(2)为了研究碳酸钙与盐酸反应的反应速率,某同学通过如图实验装置测定反应中生成的CO2气体体积,并绘制出如图所示的曲线。请分析讨论以下问题。


①化学反应速率最快的时间段是
A.O~t1 B.t1~t2 C.t2~t3 D.t3~t4
②为了减缓上述反应速率,欲向盐酸中加入下列物质,你认为可行的有
A.蒸馏水 B.NaCl固体 C.NaCl溶液 D.通入HCl气体
您最近一年使用:0次
2019-12-12更新
|
337次组卷
|
2卷引用:吉林省延边朝鲜族自治州汪清县第四中学2019-2020学年高二上学期第一次阶段考试化学试题
解题方法
3 . 在一体积为2 L的密闭容器中充入1 mol N2、2 mol H2,在催化剂作用下发生可逆反应:N2(g)+3H2(g)⇌2NH3(g),NH3的物质的量随时间变化如图所示。回答下列问题:
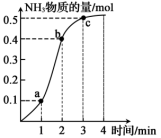
(1)0~1min的反应速率v1与2~3min的反应速率v2相比较,v1_______ (填“>”“=”或“<”)v2,1~2min的反应速率v(H2)=_______ mol·L-1·min-1。
(2)从图象可以看出,前3min内,1~2min反应速率最快,1~2min反应速率变快的原因是_ 。
(3)反应最大限度是在_______ min时,此时密闭容器中总物质的量为_______ mol。
(4)研究发现降低温度有利于平衡向生成NH3的方向移动,而工业实际采用在较高温度下进行反应的原因是_______ 。
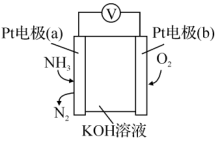
(5)电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如图。则电池负极为_______ (填“a”或“b”)。

(1)0~1min的反应速率v1与2~3min的反应速率v2相比较,v1
(2)从图象可以看出,前3min内,1~2min反应速率最快,1~2min反应速率变快的原因是
(3)反应最大限度是在
(4)研究发现降低温度有利于平衡向生成NH3的方向移动,而工业实际采用在较高温度下进行反应的原因是
(5)电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如图。则电池负极为

您最近一年使用:0次
名校
解题方法
4 . 如图,已知某反应在体积为5L的密闭容器中进行,各物质的量随时间的变化情况如图所示(已知A、B、C均为气体)。___________ 。
(2)反应开始至两分钟时,B的平均反应速率为___________ 。
(3)下列能说明反应已达到平衡状态的是___________ 。
A.v(A)=2v(B)
B.容器内气体密度不变
C.各组分的物质的量相等
D.混合气体的平均相对分子质量不再改变的状态
(4)由图求得平衡时A的转化率为___________ ,C的含量(体积分数)为___________ 。
(5)平衡时容器内气体的压强与起始时容器内压强的比值为___________ 。
(6)已知:H-H的键能为436kJ/mol,N-H的键能为391kJ/mol,生成1molNH3过程中放出46kJ的热量。则N≡N的键能为___________ kJ/mol。

(2)反应开始至两分钟时,B的平均反应速率为
(3)下列能说明反应已达到平衡状态的是
A.v(A)=2v(B)
B.容器内气体密度不变
C.各组分的物质的量相等
D.混合气体的平均相对分子质量不再改变的状态
(4)由图求得平衡时A的转化率为
(5)平衡时容器内气体的压强与起始时容器内压强的比值为
(6)已知:H-H的键能为436kJ/mol,N-H的键能为391kJ/mol,生成1molNH3过程中放出46kJ的热量。则N≡N的键能为
您最近一年使用:0次
2021-05-02更新
|
1017次组卷
|
7卷引用:陕西省西安电子科技大学附属中学2020-2021学年高一下学期期中考试化学试题
11-12高二上·江苏无锡·期中
5 . 下表为某汽车在不同速率时所产生的空气污染物质量(按汽车平均行驶1km计算)
根据上表,下列说法不正确的是
| 污染物 | 速率/km·h-1 | ||
| 50 | 80 | 120 | |
| 一氧化碳/g | 8.7 | 5.4 | 9.6 |
| 氮的氧化物/g | 0.6 | 1.5 | 3.8 |
| 碳氢化合物/g | 0.7 | 0.6 | 0.8 |
| A.汽车行驶时,污染物中CO含量最高 |
| B.汽车速率为120 km·h-1时,污染最严重 |
| C.从环保角度考虑,最合适的汽车速率为50 km·h-1 |
| D.汽车速度增加时,氮氧化物的质量增加得最快 |
您最近一年使用:0次
11-12高一下·江苏盐城·期中
6 . 下列有关反应限度的说法错误的是
| A.某条件下可逆反应达到限度之前,逆反应速率逐渐增大可能与生成物浓度逐渐增大有关 |
| B.炼铁高炉尾气中CO含量不随高炉高度改变而改变,是因为有关反应达到了限度 |
| C.化学反应的限度决定了反应物在该条件下的最大转化率 |
| D.可逆反应的限度不随反应条件的改变而改变 |
您最近一年使用:0次
13-14高三上·江苏扬州·阶段练习
7 . 已知2SO2(g)+O2(g)  2SO3 (g) △H =-a kJ·mol-1(a>0)。恒温恒容下,在10L的密闭容器中加入0.1molSO2和0.05molO2,经过2min达到平衡状态,反应放热0. 025a kJ。下列判断正确的是
2SO3 (g) △H =-a kJ·mol-1(a>0)。恒温恒容下,在10L的密闭容器中加入0.1molSO2和0.05molO2,经过2min达到平衡状态,反应放热0. 025a kJ。下列判断正确的是
 2SO3 (g) △H =-a kJ·mol-1(a>0)。恒温恒容下,在10L的密闭容器中加入0.1molSO2和0.05molO2,经过2min达到平衡状态,反应放热0. 025a kJ。下列判断正确的是
2SO3 (g) △H =-a kJ·mol-1(a>0)。恒温恒容下,在10L的密闭容器中加入0.1molSO2和0.05molO2,经过2min达到平衡状态,反应放热0. 025a kJ。下列判断正确的是| A.在2min内,v (SO2)="0.25" mol·L-1·min-1 |
| B.若再充入0.1molSO3,达到平衡后SO3的质量分数会减小 |
| C.在1min时,c(SO2)+c(SO3)="0.01" mol·L-1 |
| D.若恒温恒压下,在10L的密闭容器中加入0.1molSO2和0.05molO2,平衡后反应放热小于0. 025a kJ |
您最近一年使用:0次
8 . 在一定温度下,将2mol A和2molB 两种气体相混合于容积为2L的某密闭容器中,发生如下反应:3A(g)+B(g) = xC(g)+2D(g),2分钟末反应达到平衡状态,生成了0.8mol D,并测得C的浓度为0.4 mol/L,请填写下列空白:
(1)A的转化率为_____________ ;
(2)2分钟内生成D的反应速率为____________ ;
(3)x值等于________________ ;
(4)如果增大反应体系的压强,则平衡体系中C的质量分数________ (填“增大”“减小”或“不变”)
(1)A的转化率为
(2)2分钟内生成D的反应速率为
(3)x值等于
(4)如果增大反应体系的压强,则平衡体系中C的质量分数
您最近一年使用:0次
9 . 目前工业合成氨的原理是:N2(g)+3H2(g) 2NH3(g) △H=-93.0kJ/mol
2NH3(g) △H=-93.0kJ/mol
(1)已知一定条件下:2N2(g)+6H2O(l) 4NH3(g)+3O2(g) △H=+1530.0kJ/mol。则表示氢气燃烧热的热化学方程式为____________________。
4NH3(g)+3O2(g) △H=+1530.0kJ/mol。则表示氢气燃烧热的热化学方程式为____________________。
(2)在恒温恒容装置中进行合成氨反应,各组分浓度-时间图象如下。

① 表示N2浓度变化的曲线是(填序号)。
② 前25min 内,用H2浓度变化表示的化学反应速率是。
③ 在25min时,采取下列措施,能使N2的转化率提高的是__________(填序号)。
a. 通入1molN2
b. 通入1molH2
c. 通入1molHe气
d. 通入1molHCl
e. 通入1molN2和3molH2
(3)在恒温恒压装置中进行工业合成氨反应,下列说法错误的是__________(填序号)。
a.气体体积不再变化,则已平衡
b.气体密度不再变化,则已平衡
c.平衡后,压缩容器,会生成更多NH3
d.平衡后,往装置中通入一定量Ar,平衡不移动
(4)电厂烟气脱氮:主反应为:①4NH3(g)+6NO(g) 5N2(g)+6H2O(g) △H<0
5N2(g)+6H2O(g) △H<0
副反应为:②2NH3(g)+8NO(g) 5N2O(g)+3H2O(g) △H>0
5N2O(g)+3H2O(g) △H>0
平衡混合气中N2与N2O含量与温度的关系如图所示。
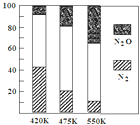
请回答:在400~600K时,随温度的升高,平衡混合气中N2含量_____________(填“升高”、“降低”或“不变”),导致这种规律的原因是_______________________。
 2NH3(g) △H=-93.0kJ/mol
2NH3(g) △H=-93.0kJ/mol(1)已知一定条件下:2N2(g)+6H2O(l)
 4NH3(g)+3O2(g) △H=+1530.0kJ/mol。则表示氢气燃烧热的热化学方程式为____________________。
4NH3(g)+3O2(g) △H=+1530.0kJ/mol。则表示氢气燃烧热的热化学方程式为____________________。(2)在恒温恒容装置中进行合成氨反应,各组分浓度-时间图象如下。

① 表示N2浓度变化的曲线是(填序号)。
② 前25min 内,用H2浓度变化表示的化学反应速率是。
③ 在25min时,采取下列措施,能使N2的转化率提高的是__________(填序号)。
a. 通入1molN2
b. 通入1molH2
c. 通入1molHe气
d. 通入1molHCl
e. 通入1molN2和3molH2
(3)在恒温恒压装置中进行工业合成氨反应,下列说法错误的是__________(填序号)。
a.气体体积不再变化,则已平衡
b.气体密度不再变化,则已平衡
c.平衡后,压缩容器,会生成更多NH3
d.平衡后,往装置中通入一定量Ar,平衡不移动
(4)电厂烟气脱氮:主反应为:①4NH3(g)+6NO(g)
 5N2(g)+6H2O(g) △H<0
5N2(g)+6H2O(g) △H<0副反应为:②2NH3(g)+8NO(g)
 5N2O(g)+3H2O(g) △H>0
5N2O(g)+3H2O(g) △H>0平衡混合气中N2与N2O含量与温度的关系如图所示。

请回答:在400~600K时,随温度的升高,平衡混合气中N2含量_____________(填“升高”、“降低”或“不变”),导致这种规律的原因是_______________________。
您最近一年使用:0次
2017-02-17更新
|
465次组卷
|
2卷引用:2017届广西钦州市钦州港区高三12月月考化学试卷
10 . 合成氨工业是工农业生产和国防工业的基础产业,也是国民经济的命脉产业。其原理如下:N2(g)+3H2(g)⇌2NH3(g)△H〈 0 。

(1)在恒温恒容装置中进行合成氨反应,各组分浓度-时间图象如图1所示。
① 表示H2浓度变化的曲线是___________ (填序号)。
② 前25min 内,用NH3浓度变化表示的化学反应速率是_______________ 。
(2)某学习小组研究:在其他条件不变的情况下,研究改变起始物氢气的物质的量对该合成氨反应的影响.实验结果如图2所示:(图中T表示温度,n表示物质的量)
①比较T1___________ T2(填“>”,“<”, “=”)。
②比较在a、b、c三点N2的转化率最高的是__________ ;H2的百分含量最高的是______ (填字母)。
③在起始体系中加入N2的物质的量为______ mol时(用含n的代数式表示),反应后氨的百分含量最大;若容器容积为1L,n=3mol反应达到平衡时H2的转化率为60%,则在T2条件下,该反应的平衡常数K=_______ 。(保留3位有效数字)

(1)在恒温恒容装置中进行合成氨反应,各组分浓度-时间图象如图1所示。
① 表示H2浓度变化的曲线是
② 前25min 内,用NH3浓度变化表示的化学反应速率是
(2)某学习小组研究:在其他条件不变的情况下,研究改变起始物氢气的物质的量对该合成氨反应的影响.实验结果如图2所示:(图中T表示温度,n表示物质的量)
①比较T1
②比较在a、b、c三点N2的转化率最高的是
③在起始体系中加入N2的物质的量为
您最近一年使用:0次



