解题方法
1 . 根据化学反应与能量情景综合应用。
(1)一定条件下,将等物质的量的A和B,混合于2L的密闭容器中,发生如下反应:3A(g)+B(g)⇌mC(g)+2D(g),经过5min后,反应达到平衡。此时测得,D的浓度为0.5mol/L,c(A)∶c(B)=1∶3,C的反应速率是0.1mol·L-1·min-1。根据已知条件填空:
①m的值为___________ 。
②A在5min末的浓度___________ 。
(2)①已知:NO2(g)+SO2(g)⇌SO3(g)+NO(g)。现将体积比为1:2的NO2和SO2的混合气体置于恒温恒容的密闭容器中发生上述反应,下列能说明反应达到平衡状态的是___________ (填序号)
a.混合气体总物质的量保持不变b.混合气体密度保持不变
c.NO2(g)和SO2(g)的体积比保持不变
d.每消耗1molSO2,同时消耗0.5molSO3(g)
e.混合气体的平均相对分子质量保持不变
f.NO2的转化率保持不变
②在一绝热(不与外界发生热交换)的恒容容器中,发生反应:2A(g)+B(s)⇌C(g)+D(g),下列描述中能表明反应已达到平衡状态的有___________ (填序号)
①容器内温度不变
②混合气体的密度不变
③混合气体的压强不变
④混合气体的平均相对分子质量不变
⑤C(g)的物质的量浓度不变
⑥容器内A、C、D三种气体的浓度之比为2:1:1
⑦某时刻v(A)=2v(C)且不等于零
⑧单位时间内生成nmolD,同时生成2nmolA
(3)在一定容密闭容器中,保持一定的温度,在一定条件下进行以下反应:A(g)+2B(g)⇌3C(g),已知加入1molA和3molB,达到平衡后,生成amolC。在相同的实验条件下,若在同一容器中改为加入2molA和8molB,若要求平衡后C在反应混合物中的百分含量不变,则还应加入C___________ mol。
(4)现有反应mA(g)+nB(g)⇌pC(g),达到平衡后,当升高温度时,B的转化率变大;当增大压强时,混合体系中C的质量分数增大,则:
①若B是有色物质,A、C均无色,则加入C(容积不变)时混合物颜色___________ (填变深、变浅或不变,下同)。
②若维持容器内压强不变,充入Ne时,混合物的颜色___________ 。
(5)NH3和NO都是有毒气体,但在催化剂条件下,它们可通过反应得到对环境无害的N2和H2O:4NH3(g)+6NO(g)⇌5N2(g)+6H2O(g) ΔH
已知几种化学键的键能数据如表:
根据键能数据估算上述反应中反应热数值为___________ kJ。
(6)CO与H2反应还可制备CH3OH,CH3OH可作为燃料使用,用CH3OH和O2组合形成的质子交换膜燃料电池的结构示意图如下:

则c电极的反应方程式为___________ 。若线路中转移2mol电子,则上述CH3OH燃料电池,消耗的O2在标准状况下的体积为___________ L。
(7))2023年12月丰城顺利通过了创文明城的验收,文明驾驶就是其中的一条。一种基于碱性燃料电池原理设计的酒精检测仪,负极上的反应为___________ 。
(1)一定条件下,将等物质的量的A和B,混合于2L的密闭容器中,发生如下反应:3A(g)+B(g)⇌mC(g)+2D(g),经过5min后,反应达到平衡。此时测得,D的浓度为0.5mol/L,c(A)∶c(B)=1∶3,C的反应速率是0.1mol·L-1·min-1。根据已知条件填空:
①m的值为
②A在5min末的浓度
(2)①已知:NO2(g)+SO2(g)⇌SO3(g)+NO(g)。现将体积比为1:2的NO2和SO2的混合气体置于恒温恒容的密闭容器中发生上述反应,下列能说明反应达到平衡状态的是
a.混合气体总物质的量保持不变b.混合气体密度保持不变
c.NO2(g)和SO2(g)的体积比保持不变
d.每消耗1molSO2,同时消耗0.5molSO3(g)
e.混合气体的平均相对分子质量保持不变
f.NO2的转化率保持不变
②在一绝热(不与外界发生热交换)的恒容容器中,发生反应:2A(g)+B(s)⇌C(g)+D(g),下列描述中能表明反应已达到平衡状态的有
①容器内温度不变
②混合气体的密度不变
③混合气体的压强不变
④混合气体的平均相对分子质量不变
⑤C(g)的物质的量浓度不变
⑥容器内A、C、D三种气体的浓度之比为2:1:1
⑦某时刻v(A)=2v(C)且不等于零
⑧单位时间内生成nmolD,同时生成2nmolA
(3)在一定容密闭容器中,保持一定的温度,在一定条件下进行以下反应:A(g)+2B(g)⇌3C(g),已知加入1molA和3molB,达到平衡后,生成amolC。在相同的实验条件下,若在同一容器中改为加入2molA和8molB,若要求平衡后C在反应混合物中的百分含量不变,则还应加入C
(4)现有反应mA(g)+nB(g)⇌pC(g),达到平衡后,当升高温度时,B的转化率变大;当增大压强时,混合体系中C的质量分数增大,则:
①若B是有色物质,A、C均无色,则加入C(容积不变)时混合物颜色
②若维持容器内压强不变,充入Ne时,混合物的颜色
(5)NH3和NO都是有毒气体,但在催化剂条件下,它们可通过反应得到对环境无害的N2和H2O:4NH3(g)+6NO(g)⇌5N2(g)+6H2O(g) ΔH
已知几种化学键的键能数据如表:
| 共价键 | N≡N | N-H | N≡O | H-O |
| 键能/kJ/mol | 946 | 391 | 607 | 464 |
(6)CO与H2反应还可制备CH3OH,CH3OH可作为燃料使用,用CH3OH和O2组合形成的质子交换膜燃料电池的结构示意图如下:

则c电极的反应方程式为
(7))2023年12月丰城顺利通过了创文明城的验收,文明驾驶就是其中的一条。一种基于碱性燃料电池原理设计的酒精检测仪,负极上的反应为
您最近半年使用:0次
名校
2 .  、CO、
、CO、 、
、 等都是重要的能源,也是重要为化工原料。
等都是重要的能源,也是重要为化工原料。
(1)已知25℃,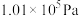 时,8.00g
时,8.00g  完全燃烧生成二氧化碳气体和液态水放出444.8kJ热量。写出该反应的热化学反应方程式:
完全燃烧生成二氧化碳气体和液态水放出444.8kJ热量。写出该反应的热化学反应方程式:___________ 。
(2)为倡导“节能减排”和“低碳经济”,降低大气中 的含量及有效地开发利用
的含量及有效地开发利用 。工业可以用
。工业可以用 来生产燃料甲醇。在体积为2L的密闭容器中,充入1mol
来生产燃料甲醇。在体积为2L的密闭容器中,充入1mol  和3mol
和3mol  ,一定条件下发生反应:
,一定条件下发生反应:
 。经测定
。经测定 和
和 (g)的物质的量随时间变化如图所示。
(g)的物质的量随时间变化如图所示。
①从反应开始平衡时, 的平均反应速率
的平均反应速率
___________ 。
②达到平衡时, 的转化率为
的转化率为___________ 。
③下列措施不能提高反应速率的是___________ 。
A.升高温度 B.加入催化剂
C.增大压强 D.及时分离出
(3)工业上也用 和
和 为原料制备
为原料制备 ,反应方程式为:
,反应方程式为: ,在一体积固定的密闭容器中投入一定量的CO和
,在一体积固定的密闭容器中投入一定量的CO和 气体进行上述反应。下列叙述中能说明上述反应达到平衡状态的是
气体进行上述反应。下列叙述中能说明上述反应达到平衡状态的是________ 。
A.反应中CO与 的物质的量之比为1∶1
的物质的量之比为1∶1
B.混合气体的压强不随时间的变化而变化
C.单位时间内每消耗1mol CO,同时生成1mol
D. 的质量分数在混合气体中保持不变
的质量分数在混合气体中保持不变
E.混合气体的密度保持不变
(4)燃料电池是一种高效、环境友好的供电装置,如图为乙醇燃料电池的工作原理示意图,a、b均为惰性电极。

①使用时,空气从口通入___________ (填“A”或“B”);
②a极的电极反应为:___________ 。
 、CO、
、CO、 、
、 等都是重要的能源,也是重要为化工原料。
等都是重要的能源,也是重要为化工原料。(1)已知25℃,
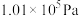 时,8.00g
时,8.00g  完全燃烧生成二氧化碳气体和液态水放出444.8kJ热量。写出该反应的热化学反应方程式:
完全燃烧生成二氧化碳气体和液态水放出444.8kJ热量。写出该反应的热化学反应方程式:(2)为倡导“节能减排”和“低碳经济”,降低大气中
 的含量及有效地开发利用
的含量及有效地开发利用 。工业可以用
。工业可以用 来生产燃料甲醇。在体积为2L的密闭容器中,充入1mol
来生产燃料甲醇。在体积为2L的密闭容器中,充入1mol  和3mol
和3mol  ,一定条件下发生反应:
,一定条件下发生反应:
 。经测定
。经测定 和
和 (g)的物质的量随时间变化如图所示。
(g)的物质的量随时间变化如图所示。
①从反应开始平衡时,
 的平均反应速率
的平均反应速率
②达到平衡时,
 的转化率为
的转化率为③下列措施不能提高反应速率的是
A.升高温度 B.加入催化剂
C.增大压强 D.及时分离出

(3)工业上也用
 和
和 为原料制备
为原料制备 ,反应方程式为:
,反应方程式为: ,在一体积固定的密闭容器中投入一定量的CO和
,在一体积固定的密闭容器中投入一定量的CO和 气体进行上述反应。下列叙述中能说明上述反应达到平衡状态的是
气体进行上述反应。下列叙述中能说明上述反应达到平衡状态的是A.反应中CO与
 的物质的量之比为1∶1
的物质的量之比为1∶1B.混合气体的压强不随时间的变化而变化
C.单位时间内每消耗1mol CO,同时生成1mol

D.
 的质量分数在混合气体中保持不变
的质量分数在混合气体中保持不变E.混合气体的密度保持不变
(4)燃料电池是一种高效、环境友好的供电装置,如图为乙醇燃料电池的工作原理示意图,a、b均为惰性电极。

①使用时,空气从口通入
②a极的电极反应为:
您最近半年使用:0次
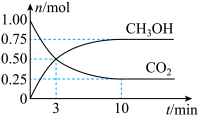
3 . 为倡导“节能减排”和“低碳经济”,降低大气中CO2的含量,有效地开发利用CO2,工业上可以用CO2来生产甲醇燃料。在体积为2L的密闭容器中,充入1molCO2和3molH2,一定条件下发生反应:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)。经测得CH3OH和CO2的物质的量随时间变化如图所示。
(1)从反应开始到平衡,CO2的平均反应速率v(CO2)=___________ 。
(2)达到平衡时,H2的浓度为___________ mol·L-1。
(3)改变条件后,化学反应速率会减小的是___________(填字母)
(4)平衡时,CO2的体积分数为___________ %
(5)工业上也可以用CO和H2为原料制备CH3OH,反应方程式为CO(g)+2H2(g)⇌CH3OH(g),在一体积固定的密闭容器中投入一定量的CO和H2进行上述反应。下列叙述中能说明上述反应达到平衡状态的是___________。(填字母)

(1)从反应开始到平衡,CO2的平均反应速率v(CO2)=
(2)达到平衡时,H2的浓度为
(3)改变条件后,化学反应速率会减小的是___________(填字母)
| A.降低温度 | B.加入催化剂 | C.增大容器容积 | D.恒容下充入He |
(5)工业上也可以用CO和H2为原料制备CH3OH,反应方程式为CO(g)+2H2(g)⇌CH3OH(g),在一体积固定的密闭容器中投入一定量的CO和H2进行上述反应。下列叙述中能说明上述反应达到平衡状态的是___________。(填字母)
| A.反应中CO与CH3OH的物质的量之比为1∶1 |
| B.混合气体的压强不随时间的变化而变化 |
| C.单位时间内每消耗1molCO,同时生成1molCH3OH |
| D.CH3OH的质量分数在混合气体中保持不变 |
您最近半年使用:0次
解题方法
4 . CH4、CH3OH、CO等都是重要的能源,也是重要的化工原料。
(1)为倡导“节能减排”和“低碳经济”,降低大气中CO2的含量、有效地开发利用CO2,工业上可以用CO2来生产甲醇。在体积为2L的密闭容器中,充入1mol CO2和3molH2,一定条件下发生反应: 。测得
。测得 和CO2的物质的量随时间变化如图所示:
和CO2的物质的量随时间变化如图所示:
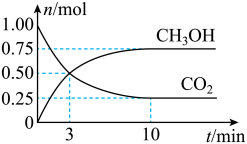
①3min时,正、逆反应速率的大小关系为v正_____ v逆(填“>”、“<”或“=”)。
②从反应开始到平衡,CO2的平均反应速率v(CO2)=_____ 。
③达到平衡时,H2的浓度为_____ mol⋅L-1。
(2)工业上也可以用CO和H2为原料制备CH3OH,反应的化学方程式为: ,在一体积固定的密闭容器中投入一定量的CO和H2进行上述反应。下列叙述中能说明上述反应达到平衡状态的是_____(填字母序号)。
,在一体积固定的密闭容器中投入一定量的CO和H2进行上述反应。下列叙述中能说明上述反应达到平衡状态的是_____(填字母序号)。
(3)某种甲烷燃料电池的工作原理如图所示。
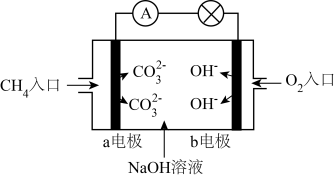
甲烷通入的一极为电池的_____ 极,电极反应式为:_____ 。当电路中有2mol电子通过时,消耗标准状况下氧气的体积为_____ L。
(1)为倡导“节能减排”和“低碳经济”,降低大气中CO2的含量、有效地开发利用CO2,工业上可以用CO2来生产甲醇。在体积为2L的密闭容器中,充入1mol CO2和3molH2,一定条件下发生反应:
 。测得
。测得 和CO2的物质的量随时间变化如图所示:
和CO2的物质的量随时间变化如图所示:
①3min时,正、逆反应速率的大小关系为v正
②从反应开始到平衡,CO2的平均反应速率v(CO2)=
③达到平衡时,H2的浓度为
(2)工业上也可以用CO和H2为原料制备CH3OH,反应的化学方程式为:
 ,在一体积固定的密闭容器中投入一定量的CO和H2进行上述反应。下列叙述中能说明上述反应达到平衡状态的是_____(填字母序号)。
,在一体积固定的密闭容器中投入一定量的CO和H2进行上述反应。下列叙述中能说明上述反应达到平衡状态的是_____(填字母序号)。| A.反应体系中CO与CH3OH的物质的量之比为1∶1 |
| B.混合气体的压强不随时间的变化而变化 |
| C.单位时间内每消耗1molCO、同时生成lmol CH3OH |
| D.CH3OH的质量分数在混合气体中保持不变 |

甲烷通入的一极为电池的
您最近半年使用:0次
名校
5 .  、
、 、
、 、
、 等都是重要的能源,也是重要为化工原料。
等都是重要的能源,也是重要为化工原料。
(1)已知破坏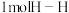 键、
键、 键、
键、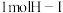 键分别需要吸收的能量为436kJ、151kJ、299kJ。则由氢气和碘单质反应生成
键分别需要吸收的能量为436kJ、151kJ、299kJ。则由氢气和碘单质反应生成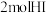 需要放出
需要放出___________ kJ的热量。
(2)将两铂片插入KOH溶液中作为电极,在两极区分别通入甲烷和氧气构成燃料电池,则通入氧气的电极反应式是___________ ,电池工作时如果消耗甲烷160g,假设化学能完全转化为电能,则转移电子的数目为___________ (用 表示)。
表示)。
(3)为倡导“节能减排”和“低碳经济”,降低大气中 的含量及有效地开发利用
的含量及有效地开发利用 ,工业上可以用
,工业上可以用 来生产燃料甲醇。在体积为2L的密闭容器中,充入
来生产燃料甲醇。在体积为2L的密闭容器中,充入 和
和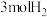 ,一定条件下发生反应:
,一定条件下发生反应: 。经测得
。经测得 和
和 的物质的量随时间变化如图所示。
的物质的量随时间变化如图所示。
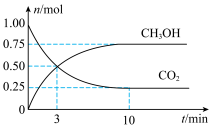
①从反应开始到平衡, 的平均反应速率
的平均反应速率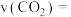
___________ 。
②达到平衡时, 的转化率为
的转化率为___________ 。
(4)工业上也用CO和 为原料制备
为原料制备 ,反应方程式为:
,反应方程式为: ,在一体积固定的密闭容器中投入一定量的CO和
,在一体积固定的密闭容器中投入一定量的CO和 气体进行上述反应。下列叙述中能说明上述反应达到平衡状态的是
气体进行上述反应。下列叙述中能说明上述反应达到平衡状态的是___________ 。
a.反应中CO与 的物质的量之比为1:1
的物质的量之比为1:1
b.混合气体的压强不随时间的变化而变化
c.单位时间内每消耗 ,同时生成
,同时生成
d. 的质量分数在混合气体中保持不变
的质量分数在混合气体中保持不变
e.混合气体的密度保持不变
 、
、 、
、 、
、 等都是重要的能源,也是重要为化工原料。
等都是重要的能源,也是重要为化工原料。(1)已知破坏
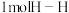 键、
键、 键、
键、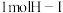 键分别需要吸收的能量为436kJ、151kJ、299kJ。则由氢气和碘单质反应生成
键分别需要吸收的能量为436kJ、151kJ、299kJ。则由氢气和碘单质反应生成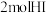 需要放出
需要放出(2)将两铂片插入KOH溶液中作为电极,在两极区分别通入甲烷和氧气构成燃料电池,则通入氧气的电极反应式是
 表示)。
表示)。(3)为倡导“节能减排”和“低碳经济”,降低大气中
 的含量及有效地开发利用
的含量及有效地开发利用 ,工业上可以用
,工业上可以用 来生产燃料甲醇。在体积为2L的密闭容器中,充入
来生产燃料甲醇。在体积为2L的密闭容器中,充入 和
和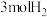 ,一定条件下发生反应:
,一定条件下发生反应: 。经测得
。经测得 和
和 的物质的量随时间变化如图所示。
的物质的量随时间变化如图所示。
①从反应开始到平衡,
 的平均反应速率
的平均反应速率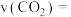
②达到平衡时,
 的转化率为
的转化率为(4)工业上也用CO和
 为原料制备
为原料制备 ,反应方程式为:
,反应方程式为: ,在一体积固定的密闭容器中投入一定量的CO和
,在一体积固定的密闭容器中投入一定量的CO和 气体进行上述反应。下列叙述中能说明上述反应达到平衡状态的是
气体进行上述反应。下列叙述中能说明上述反应达到平衡状态的是a.反应中CO与
 的物质的量之比为1:1
的物质的量之比为1:1b.混合气体的压强不随时间的变化而变化
c.单位时间内每消耗
 ,同时生成
,同时生成
d.
 的质量分数在混合气体中保持不变
的质量分数在混合气体中保持不变e.混合气体的密度保持不变
您最近半年使用:0次
6 . 纳米氧化锌具有颗粒微小,比表面积大,分散性好,疏松多孔等物理特性和极强的化学活性,目前已广泛用于橡胶、陶瓷、催化剂、涂料和磁性材料的辅助生产。以铜转炉烟灰为原料,采用浸取、均相沉淀、干燥煅烧等工艺制备纳米氧化锌的工艺方法过程简单,生产成本低。具体流程如下:
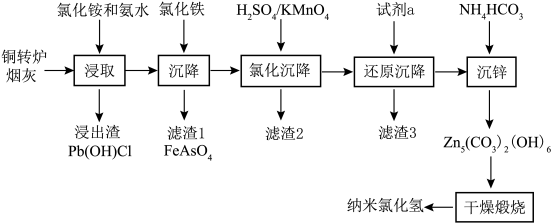
已知某铜转炉烟灰化学成分百分含量分析如下表:
铜转炉烟灰主要化学成分分析结果 %
以上金属元素在铜转炉烟灰中均以硫酸盐和氧化物形式存在,砷以砷酸盐形式存在。
流程中涉及离子的氢氧化物溶度积常数如下表:
请回答下列问题:
(1)“浸取”温度应选择40℃左右为宜。温度高于40℃ ,浸出率随温度升高而降低的原因可能是___________ ;
(2)若“浸取”所得滤液中锌元素以[Zn(NH3)4]2+形式存在,则浸取时ZnO发生反应的离子方程式为___________ 。
(3)在“沉降”过程中,FeCl3做沉淀剂可起到两点作用,一是与砷酸根结合生成FeAsO4沉淀,二是___________ ,缩短沉降时间;
(4)用酸性高锰酸钾溶液“氧化沉降”时,需调整溶液pH=5 ,使还原产物为MnO2,滤渣2主要成分为___________ ;
(5)“还原沉降”选用的“试剂a”为___________ (填化学式);
(6)“沉锌”反应的离子方程式为___________ ,整个流程中可以循环利用的副产品是___________ (填化学式);
(7)若想通过“干燥煅烧”得到更多活性较高的纳米氧化锌,应在“沉锌”时注意调整 和Zn2+的浓度,以保证最终沉淀物粒径在1um 以下,通过下表可判断,当Zn2+的浓度恒定在0.8 mol·L-1时,
和Zn2+的浓度,以保证最终沉淀物粒径在1um 以下,通过下表可判断,当Zn2+的浓度恒定在0.8 mol·L-1时,  的浓度为
的浓度为___________ 沉淀物的粒径最佳。

已知某铜转炉烟灰化学成分百分含量分析如下表:
铜转炉烟灰主要化学成分分析结果 %
| Cu | Zn | Pb | Fe( Ⅱ) | As |
| 10.30 | 8.75 | 19.07 | 2.51 | 4.68 |
流程中涉及离子的氢氧化物溶度积常数如下表:
| 离子 | Cu2+ | Zn2+ | Fe2+ | Fe3+ |
| Ksp | 2.2× 10-20 | 6.7×10-17 | 8.0×10-16 | 4.0×10-38 |
(1)“浸取”温度应选择40℃左右为宜。温度高于40℃ ,浸出率随温度升高而降低的原因可能是
(2)若“浸取”所得滤液中锌元素以[Zn(NH3)4]2+形式存在,则浸取时ZnO发生反应的离子方程式为
(3)在“沉降”过程中,FeCl3做沉淀剂可起到两点作用,一是与砷酸根结合生成FeAsO4沉淀,二是
(4)用酸性高锰酸钾溶液“氧化沉降”时,需调整溶液pH=5 ,使还原产物为MnO2,滤渣2主要成分为
(5)“还原沉降”选用的“试剂a”为
(6)“沉锌”反应的离子方程式为
(7)若想通过“干燥煅烧”得到更多活性较高的纳米氧化锌,应在“沉锌”时注意调整
 和Zn2+的浓度,以保证最终沉淀物粒径在1um 以下,通过下表可判断,当Zn2+的浓度恒定在0.8 mol·L-1时,
和Zn2+的浓度,以保证最终沉淀物粒径在1um 以下,通过下表可判断,当Zn2+的浓度恒定在0.8 mol·L-1时,  的浓度为
的浓度为n( )/n(Zn2+) )/n(Zn2+) | 粒度分布质量分数1% | ||||
| 0.0-0.1um | 0.1~0.5um | 0.5~1.0um | 1.0~5.0um | 5.0um以上 | |
| 2 | 25.3 | 38.41 | 34.55 | 1.74 | 0.001 |
| 2.5 | 40.82 | 50.35 | 8.37 | 0.46 | 0.001 |
| 3 | 35.2 | 55.37 | 8.2 | 1.23 | 0.001 |
您最近半年使用:0次
2023-04-29更新
|
213次组卷
|
2卷引用:内蒙古呼和浩特市2023届高三下学期第二次质量数据监测理科综合化学试题
7 . 为倡导“节能减排”和“低碳经济”,降低大气中CO2的含量及有效地开发利用CO2,工业上可以用CO2来生产燃料甲醇。在体积为2L的密闭容器中,充入1mol CO2、3mol H2,一定条件下发生反应:CO2(g)+3H2(g)  CH3OH(g)+H2O(g)。经测得CO2和CH3OH的物质的量随时间变化如图所示。
CH3OH(g)+H2O(g)。经测得CO2和CH3OH的物质的量随时间变化如图所示。
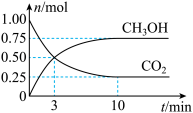
(1)在3min末,H2的浓度为_______ ,这时,反应速率 υ(正)_______ υ(逆)(选填>、<或 =)。
(2)从反应开始到平衡,平均反应速率υ(CO2)=_______ 。达到平衡时,H2的转化率为_______ 。
(3)下列措施不能提高反应速率的是_______。
(4)若上述反应分别在甲、乙、丙三个相同的密闭容器中进行,经同一段时间后,测得三个容器中的反应速率分别为甲:υ(H2)=0.3 mol∙L−1∙s−1;乙:υ(CO2)=0.12 mol∙L−1∙s−1;丙:υ(CH3OH)=4.8 mol∙L−1∙min−1,则甲、乙、丙三个容器中反应速率由快到慢的顺序为_______ 。
(5)在一体积固定的密闭容器中投入一定量的CO2和H2进行上述反应。下列叙述中能说明上述反应达到平衡状态的是_______ 。
A.反应中CO2与CH3OH的物质的量之比为1:1
B.混合气体的压强不随时间的变化而变化
C.单位时间内每消耗1mol CO2,同时生成1mol CH3OH
D.CH3OH的质量分数在混合气体中保持不变
E.混合气体的密度保持不变
 CH3OH(g)+H2O(g)。经测得CO2和CH3OH的物质的量随时间变化如图所示。
CH3OH(g)+H2O(g)。经测得CO2和CH3OH的物质的量随时间变化如图所示。
(1)在3min末,H2的浓度为
(2)从反应开始到平衡,平均反应速率υ(CO2)=
(3)下列措施不能提高反应速率的是_______。
| A.升高温度 | B.加入催化剂 | C.增大压强 | D.及时分离出CH3OH |
(5)在一体积固定的密闭容器中投入一定量的CO2和H2进行上述反应。下列叙述中能说明上述反应达到平衡状态的是
A.反应中CO2与CH3OH的物质的量之比为1:1
B.混合气体的压强不随时间的变化而变化
C.单位时间内每消耗1mol CO2,同时生成1mol CH3OH
D.CH3OH的质量分数在混合气体中保持不变
E.混合气体的密度保持不变
您最近半年使用:0次
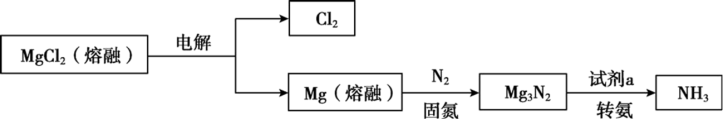
8 . 合成NH3是重要的研究课题,一种合成NH3的流程示意如图。
相关数据如表:
已知:Mg3N2溶于水发生反应Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑
I.固氮:
(1)从结构上解释N2化学性质稳定的原因_____ 。上述固氮反应的化学方程式是_____ 。固氮的适宜温度范围是_____ 。(填编号)
a.500~600℃ b.700~800℃ c.900~1000℃
(2)检测固氮作用:向固氮后的产物中加水,_____ (填操作和现象),说明Mg能起到固氮作用。
II.转氨:选用试剂a完成转化。
(3)选用H2O进行转化,发现从体系中分离出NH3较困难,若选用HCl气体进行转化,发现能产生NH3,且产物MgCl2能直接循环利用,但NH3的收率较低,原因是_____ 。
活性炭还原NO2的原理为2NO2(g)+2C(s) N2(g)+2CO2(g)。一定温度下,在2L恒容密闭容器中充入1molNO2和足量C发生该反应(不考虑2NO2
N2(g)+2CO2(g)。一定温度下,在2L恒容密闭容器中充入1molNO2和足量C发生该反应(不考虑2NO2 N2O4)。实验测得NO2的转化率与时间的关系如图所示:
N2O4)。实验测得NO2的转化率与时间的关系如图所示:
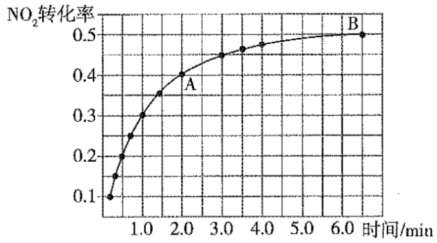
(4)反应达到平衡时CO2的体积分数为_____ ,混合气体的平均摩尔质量 (A)
(A)_____  (B)(填“大于”“小于”或“等于”)。
(B)(填“大于”“小于”或“等于”)。
(5)下列能够判断该反应已达到平衡状态的是_____ 。(填序号)
a.CO2的质量分数保持不变
b.容器中N2与CO2的百分含量之比保持不变
c.2v(逆)(NO2)=V(正)(N2)
d.混合气体的颜色保持不变

相关数据如表:
| 物质 | 熔点/℃ | 沸点/℃ | 与N2反应温度/℃ | 分解温度/℃ |
| Mg | 649 | 1090 | >300 | Mg3N2:>800 |
已知:Mg3N2溶于水发生反应Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑
I.固氮:
(1)从结构上解释N2化学性质稳定的原因
a.500~600℃ b.700~800℃ c.900~1000℃
(2)检测固氮作用:向固氮后的产物中加水,
II.转氨:选用试剂a完成转化。
(3)选用H2O进行转化,发现从体系中分离出NH3较困难,若选用HCl气体进行转化,发现能产生NH3,且产物MgCl2能直接循环利用,但NH3的收率较低,原因是
活性炭还原NO2的原理为2NO2(g)+2C(s)
 N2(g)+2CO2(g)。一定温度下,在2L恒容密闭容器中充入1molNO2和足量C发生该反应(不考虑2NO2
N2(g)+2CO2(g)。一定温度下,在2L恒容密闭容器中充入1molNO2和足量C发生该反应(不考虑2NO2 N2O4)。实验测得NO2的转化率与时间的关系如图所示:
N2O4)。实验测得NO2的转化率与时间的关系如图所示:
(4)反应达到平衡时CO2的体积分数为
 (A)
(A) (B)(填“大于”“小于”或“等于”)。
(B)(填“大于”“小于”或“等于”)。(5)下列能够判断该反应已达到平衡状态的是
a.CO2的质量分数保持不变
b.容器中N2与CO2的百分含量之比保持不变
c.2v(逆)(NO2)=V(正)(N2)
d.混合气体的颜色保持不变
您最近半年使用:0次
名校
解题方法
9 . 化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程。
(1)在煤的气化反应器中发生如下几种反应:
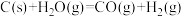




则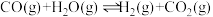

_______
(2)已知830℃时,在一个容积固定的密闭容器中,发生反应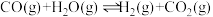 下列能判断该反应达到化学平衡状态的是
下列能判断该反应达到化学平衡状态的是 _______
a.容器中的压强不变 b.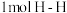 键断裂的同时断裂
键断裂的同时断裂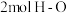 键
键
c.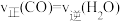 d.
d.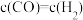
此温度下该反应的 ,等物质的量的
,等物质的量的 和
和 反应达平衡时,
反应达平衡时, 的转化率为
的转化率为_______
(3)将不同量的 和
和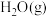 分别通入到体积为2L的恒容密闭容器中,进行反应
分别通入到体积为2L的恒容密闭容器中,进行反应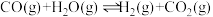 ,得到如表三组数据:
,得到如表三组数据:
①实验1中以 表示的反应速率为
表示的反应速率为_______ 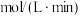 ;
;
②该反应的逆反应为_______ (填“吸”或“放”)热反应;
③若实验3要达到与实验2相同的平衡状态(即各物质的质量分数分别相等),且 ,则a、b应满足的关系是
,则a、b应满足的关系是_______ (用含a、b的数学式表示).
(4)目前工业上有一种方法是用 来生产甲醇。一定条件下发生反应:
来生产甲醇。一定条件下发生反应: ,如图1,表示该反应进行过程中能量(单位为
,如图1,表示该反应进行过程中能量(单位为 )的变化
)的变化

①在体积为1L的恒容密闭容器中,充入 和
和 ,下列措施中能使
,下列措施中能使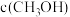 增大的是
增大的是_______ (填字母)
a.升高温度 b.充入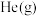 ,使体系压强增大
,使体系压强增大
c.将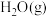 从体系中分离出来 d.再充入
从体系中分离出来 d.再充入 和
和
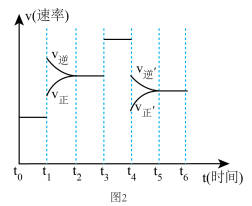
②当反应达到平衡时不断改变条件(但不改变各组分物质的量和状态且只改变一个条件)反应速率随时间的变化.如图2:其中表示平衡混合物中 含量最高的一段时间是
含量最高的一段时间是_______ ;如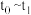 平衡常数为
平衡常数为 ,
,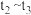 平衡常数为
平衡常数为 ,则
,则
_______  (填>、=、<)。
(填>、=、<)。
(1)在煤的气化反应器中发生如下几种反应:
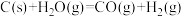


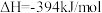


则
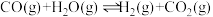

(2)已知830℃时,在一个容积固定的密闭容器中,发生反应
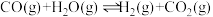 下列能判断该反应达到化学平衡状态的是
下列能判断该反应达到化学平衡状态的是 a.容器中的压强不变 b.
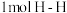 键断裂的同时断裂
键断裂的同时断裂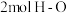 键
键c.
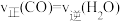 d.
d.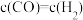
此温度下该反应的
 ,等物质的量的
,等物质的量的 和
和 反应达平衡时,
反应达平衡时, 的转化率为
的转化率为(3)将不同量的
 和
和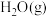 分别通入到体积为2L的恒容密闭容器中,进行反应
分别通入到体积为2L的恒容密闭容器中,进行反应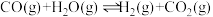 ,得到如表三组数据:
,得到如表三组数据:| 实验组 | 温度/℃ | 起始量 | 平衡量 | 达到平衡所需时间/min | ||
 |  |  |  | |||
| 1 | 650 | 2 | 4 | 1.6 | 1.6 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 0.4 | 3 |
| 3 | 900 | a | b | c | d | t |
 表示的反应速率为
表示的反应速率为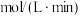 ;
;②该反应的逆反应为
③若实验3要达到与实验2相同的平衡状态(即各物质的质量分数分别相等),且
 ,则a、b应满足的关系是
,则a、b应满足的关系是(4)目前工业上有一种方法是用
 来生产甲醇。一定条件下发生反应:
来生产甲醇。一定条件下发生反应: ,如图1,表示该反应进行过程中能量(单位为
,如图1,表示该反应进行过程中能量(单位为 )的变化
)的变化
①在体积为1L的恒容密闭容器中,充入
 和
和 ,下列措施中能使
,下列措施中能使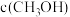 增大的是
增大的是a.升高温度 b.充入
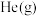 ,使体系压强增大
,使体系压强增大c.将
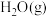 从体系中分离出来 d.再充入
从体系中分离出来 d.再充入 和
和
②当反应达到平衡时不断改变条件(但不改变各组分物质的量和状态且只改变一个条件)反应速率随时间的变化.如图2:其中表示平衡混合物中
 含量最高的一段时间是
含量最高的一段时间是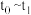 平衡常数为
平衡常数为 ,
,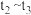 平衡常数为
平衡常数为 ,则
,则
 (填>、=、<)。
(填>、=、<)。
您最近半年使用:0次
名校
解题方法
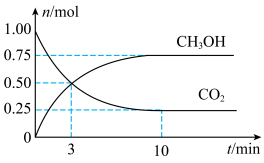
10 . CH3OH、CO、CH4等都是重要的能源,也是重要的化工原料。
(1)为倡导“节能减排”和“低碳经济”,降低大气中CO2的含量,有效地开发利用CO2,工业上可以用CO2来生产甲醇燃料。在体积为2 L的密闭容器中,充入1 mol CO2和3 mol H2,一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g)。经测得CH3OH和CO2的物质的量随时间变化如图所示。
CH3OH(g)+H2O(g)。经测得CH3OH和CO2的物质的量随时间变化如图所示。
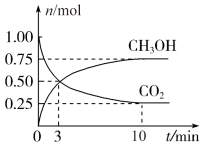
①从反应开始到平衡,CO2的平均反应速率v(CO2)=____ 。
②达到平衡时,H2的浓度为____ mol/L。
(2)工业上也可以用CO和H2为原料制备CH3OH,反应方程式为:CO(g)+2H2(g) CH3OH(g),在一体积固定的密闭容器中投入一定量的CO和H2进行上述反应。下列叙述中能说明上述反应达到平衡状态的是
CH3OH(g),在一体积固定的密闭容器中投入一定量的CO和H2进行上述反应。下列叙述中能说明上述反应达到平衡状态的是____ 。
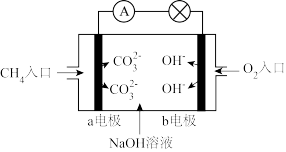
(3)某种甲烷燃料电池的工作原理如图所示氧气通入的一极为电源的____ 极,a电极反应式:____ ,b电极反应式:____ 。
(4)当电路中累计有2 mol电子通过时,消耗的甲烷体积为(在标准状况下)____ L。
(1)为倡导“节能减排”和“低碳经济”,降低大气中CO2的含量,有效地开发利用CO2,工业上可以用CO2来生产甲醇燃料。在体积为2 L的密闭容器中,充入1 mol CO2和3 mol H2,一定条件下发生反应:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)。经测得CH3OH和CO2的物质的量随时间变化如图所示。
CH3OH(g)+H2O(g)。经测得CH3OH和CO2的物质的量随时间变化如图所示。
①从反应开始到平衡,CO2的平均反应速率v(CO2)=
②达到平衡时,H2的浓度为
(2)工业上也可以用CO和H2为原料制备CH3OH,反应方程式为:CO(g)+2H2(g)
 CH3OH(g),在一体积固定的密闭容器中投入一定量的CO和H2进行上述反应。下列叙述中能说明上述反应达到平衡状态的是
CH3OH(g),在一体积固定的密闭容器中投入一定量的CO和H2进行上述反应。下列叙述中能说明上述反应达到平衡状态的是| A.反应中CO与CH3OH的物质的量之比为1:1 |
| B.混合气体的压强不随时间的变化而变化 |
| C.单位时间内每消耗1 mol CO,同时生成1 mol CH3OH |
| D.CH3OH的质量分数在混合气体中保持不变 |
(4)当电路中累计有2 mol电子通过时,消耗的甲烷体积为(在标准状况下)

您最近半年使用:0次
2022-05-12更新
|
429次组卷
|
3卷引用:河南省南阳市2021-2022学年高一下学期期中质量评估化学试题



