纳米氧化锌具有颗粒微小,比表面积大,分散性好,疏松多孔等物理特性和极强的化学活性,目前已广泛用于橡胶、陶瓷、催化剂、涂料和磁性材料的辅助生产。以铜转炉烟灰为原料,采用浸取、均相沉淀、干燥煅烧等工艺制备纳米氧化锌的工艺方法过程简单,生产成本低。具体流程如下:
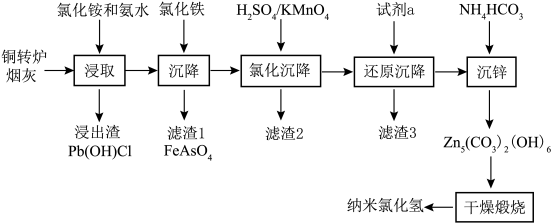
已知某铜转炉烟灰化学成分百分含量分析如下表:
铜转炉烟灰主要化学成分分析结果 %
以上金属元素在铜转炉烟灰中均以硫酸盐和氧化物形式存在,砷以砷酸盐形式存在。
流程中涉及离子的氢氧化物溶度积常数如下表:
请回答下列问题:
(1)“浸取”温度应选择40℃左右为宜。温度高于40℃ ,浸出率随温度升高而降低的原因可能是___________ ;
(2)若“浸取”所得滤液中锌元素以[Zn(NH3)4]2+形式存在,则浸取时ZnO发生反应的离子方程式为___________ 。
(3)在“沉降”过程中,FeCl3做沉淀剂可起到两点作用,一是与砷酸根结合生成FeAsO4沉淀,二是___________ ,缩短沉降时间;
(4)用酸性高锰酸钾溶液“氧化沉降”时,需调整溶液pH=5 ,使还原产物为MnO2,滤渣2主要成分为___________ ;
(5)“还原沉降”选用的“试剂a”为___________ (填化学式);
(6)“沉锌”反应的离子方程式为___________ ,整个流程中可以循环利用的副产品是___________ (填化学式);
(7)若想通过“干燥煅烧”得到更多活性较高的纳米氧化锌,应在“沉锌”时注意调整 和Zn2+的浓度,以保证最终沉淀物粒径在1um 以下,通过下表可判断,当Zn2+的浓度恒定在0.8 mol·L-1时,
和Zn2+的浓度,以保证最终沉淀物粒径在1um 以下,通过下表可判断,当Zn2+的浓度恒定在0.8 mol·L-1时,  的浓度为
的浓度为___________ 沉淀物的粒径最佳。

已知某铜转炉烟灰化学成分百分含量分析如下表:
铜转炉烟灰主要化学成分分析结果 %
| Cu | Zn | Pb | Fe( Ⅱ) | As |
| 10.30 | 8.75 | 19.07 | 2.51 | 4.68 |
流程中涉及离子的氢氧化物溶度积常数如下表:
| 离子 | Cu2+ | Zn2+ | Fe2+ | Fe3+ |
| Ksp | 2.2× 10-20 | 6.7×10-17 | 8.0×10-16 | 4.0×10-38 |
(1)“浸取”温度应选择40℃左右为宜。温度高于40℃ ,浸出率随温度升高而降低的原因可能是
(2)若“浸取”所得滤液中锌元素以[Zn(NH3)4]2+形式存在,则浸取时ZnO发生反应的离子方程式为
(3)在“沉降”过程中,FeCl3做沉淀剂可起到两点作用,一是与砷酸根结合生成FeAsO4沉淀,二是
(4)用酸性高锰酸钾溶液“氧化沉降”时,需调整溶液pH=5 ,使还原产物为MnO2,滤渣2主要成分为
(5)“还原沉降”选用的“试剂a”为
(6)“沉锌”反应的离子方程式为
(7)若想通过“干燥煅烧”得到更多活性较高的纳米氧化锌,应在“沉锌”时注意调整
 和Zn2+的浓度,以保证最终沉淀物粒径在1um 以下,通过下表可判断,当Zn2+的浓度恒定在0.8 mol·L-1时,
和Zn2+的浓度,以保证最终沉淀物粒径在1um 以下,通过下表可判断,当Zn2+的浓度恒定在0.8 mol·L-1时,  的浓度为
的浓度为n( )/n(Zn2+) )/n(Zn2+) | 粒度分布质量分数1% | ||||
| 0.0-0.1um | 0.1~0.5um | 0.5~1.0um | 1.0~5.0um | 5.0um以上 | |
| 2 | 25.3 | 38.41 | 34.55 | 1.74 | 0.001 |
| 2.5 | 40.82 | 50.35 | 8.37 | 0.46 | 0.001 |
| 3 | 35.2 | 55.37 | 8.2 | 1.23 | 0.001 |
更新时间:2023-04-29 18:00:00
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】碳的资源化利用是实现碳中和目标的重要环节,将碳氧化物催化氢化制备燃料甲醇,对绿色化与可持续发展意义重大。已知催化氢化时同时存在:
反应I: (主反应)
(主反应)
反应Ⅱ: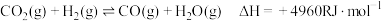 (R为大于0的常数,下同)
(R为大于0的常数,下同)
反应Ⅲ: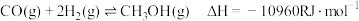
回答下列问题:
(1)在500K下,增大 平衡产率的方法有
平衡产率的方法有___________ (写两条)。
(2)目前应着力开发活性温度___________ (填“更低”或“更高”)的催化剂。
(3)已知 (K为平衡常数,
(K为平衡常数, 、R和C均视为常数),反应Ⅰ在不同温度T下的
、R和C均视为常数),反应Ⅰ在不同温度T下的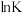 如下表中数据:
如下表中数据:
(i)反应I的
___________ (填“>”或“<”)0,判断理由是___________ 。
(ii)反应I的
___________  (用含常数R的式子表示)。
(用含常数R的式子表示)。
(4)判断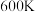 时,反应
时,反应___________ (填“I”或“Ⅲ”)在热力学上趋势更大。
(5)在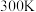 、恒压
、恒压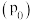 容器中加入
容器中加入 和
和 ,发生上述反应I和Ⅱ,
,发生上述反应I和Ⅱ, 后达平衡,
后达平衡, 平衡转化率为20%,甲醇的选择性(
平衡转化率为20%,甲醇的选择性(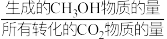 )为50%。
)为50%。
(i)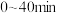 时,
时,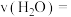
___________ 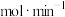 。
。
(ii)反应I的分压平衡常数
___________ (列出计算式)。
反应I:
 (主反应)
(主反应)反应Ⅱ:
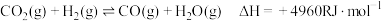 (R为大于0的常数,下同)
(R为大于0的常数,下同)反应Ⅲ:
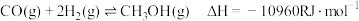
回答下列问题:
(1)在500K下,增大
 平衡产率的方法有
平衡产率的方法有(2)目前应着力开发活性温度
(3)已知
 (K为平衡常数,
(K为平衡常数, 、R和C均视为常数),反应Ⅰ在不同温度T下的
、R和C均视为常数),反应Ⅰ在不同温度T下的 如下表中数据:
如下表中数据: |  |
| 300 |  |
| 600 | 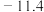 |

(ii)反应I的

 (用含常数R的式子表示)。
(用含常数R的式子表示)。(4)判断
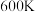 时,反应
时,反应(5)在
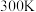 、恒压
、恒压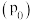 容器中加入
容器中加入 和
和 ,发生上述反应I和Ⅱ,
,发生上述反应I和Ⅱ, 后达平衡,
后达平衡, 平衡转化率为20%,甲醇的选择性(
平衡转化率为20%,甲醇的选择性(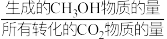 )为50%。
)为50%。(i)
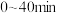 时,
时,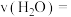
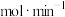 。
。(ii)反应I的分压平衡常数

您最近一年使用:0次
【推荐2】甲烷在工业上有很多用途。回答下列问题:
Ⅰ.利用甲烷催化还原 消除氮氧化物的污染:
消除氮氧化物的污染:
ⅰ.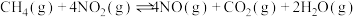
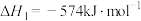
ⅱ.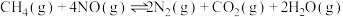
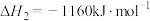
ⅲ.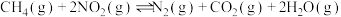

(1) =
=___________ 。
(2)在4L某恒容密闭容器中充入1mol 和2mol
和2mol 进行反应ⅲ,
进行反应ⅲ, 的平衡转化率
的平衡转化率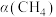 随温度的变化关系如图所示。
随温度的变化关系如图所示。
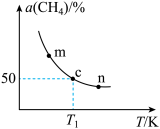
①曲线上m、c、n三点的正反应速率由大到小的顺序为___________ 。
② 时,若反应进行到5min时达到平衡,则0~5min内,
时,若反应进行到5min时达到平衡,则0~5min内,
___________  ,反应平衡常数K=
,反应平衡常数K=___________ 。
③下列说法正确的是___________ (填标号)。
A.当混合气体的压强不再随时间改变时,该反应达到平衡
B.该反应的反应物的键能总和大于生成物的键能总和
C.降低温度,有利于提高 的转化率,反应平衡常数也增大
的转化率,反应平衡常数也增大
D.加入合适的催化剂, 的绝对值增大
的绝对值增大
Ⅱ.甲烷-氧气燃料电池的工作原理如图所示(L、K均为惰性电极)。
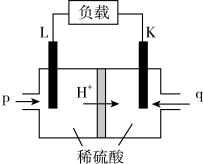
(3)电池工作时,K电极通入的气体q为___________ 。
(4)L电极上的电极反应式为___________ 。
(5)电路中转移电子的物质的量为2mol时,正极上消耗气体的体积为___________ (标准状况)。
Ⅰ.利用甲烷催化还原
 消除氮氧化物的污染:
消除氮氧化物的污染:ⅰ.
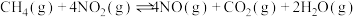
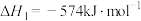
ⅱ.
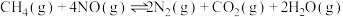
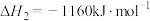
ⅲ.
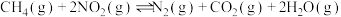

(1)
 =
=(2)在4L某恒容密闭容器中充入1mol
 和2mol
和2mol 进行反应ⅲ,
进行反应ⅲ, 的平衡转化率
的平衡转化率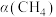 随温度的变化关系如图所示。
随温度的变化关系如图所示。
①曲线上m、c、n三点的正反应速率由大到小的顺序为
②
 时,若反应进行到5min时达到平衡,则0~5min内,
时,若反应进行到5min时达到平衡,则0~5min内,
 ,反应平衡常数K=
,反应平衡常数K=③下列说法正确的是
A.当混合气体的压强不再随时间改变时,该反应达到平衡
B.该反应的反应物的键能总和大于生成物的键能总和
C.降低温度,有利于提高
 的转化率,反应平衡常数也增大
的转化率,反应平衡常数也增大D.加入合适的催化剂,
 的绝对值增大
的绝对值增大Ⅱ.甲烷-氧气燃料电池的工作原理如图所示(L、K均为惰性电极)。

(3)电池工作时,K电极通入的气体q为
(4)L电极上的电极反应式为
(5)电路中转移电子的物质的量为2mol时,正极上消耗气体的体积为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐3】节能减排措施是我国“十一五”期间提出的政策措施。
(1)煤的燃烧,会产生大量有害气体。将煤转化为水煤气,可有效降低排放。
C(s)+O2(g)=CO2(g)△H=-393.5 kJ·mol-1
H2(g)+ O2(g)=H2O(g) △H=-242.0kJ·mol-1
O2(g)=H2O(g) △H=-242.0kJ·mol-1
CO(g)+ O2(g)=CO2(g) △H=-283.0kJ·mol-1
O2(g)=CO2(g) △H=-283.0kJ·mol-1
根据以上数据,写出C(s)与水蒸气反应生成CO和H2的热化学方程式___________ 。
(2)汽车尾气的排放是大气污染物的重要来源,其中含有NO气体。根据资料显示用活性炭还原法可以处理氮氧化物,某研究小组向固定容积的密闭容器中加入一定量的活性炭和NO发生反应C(s)+2NO(g) CO2(g)+N2(g) △H=-574kJ·mol-1,并在温度T时将所测反应数据制成下表:
CO2(g)+N2(g) △H=-574kJ·mol-1,并在温度T时将所测反应数据制成下表:
①0到10min内,NO的平均反应速率v(NO)=___________ mol·L-1·min-1。
②下列数据不再变化可表示该反应达到平衡的是___________ 。
a.容器内压强b.混合气体的平均摩尔质量c.混合气体的密度
③若容器改为可变容积容器,达平衡后改变某一条件,一段时间后,反应再次达到原平衡,请写出可能改变的条件是___________ (任写一种)。
(3)在某温度T时能同时发生反应:
2N2O5(g) 2N2O4(g)+O2(g) K1
2N2O4(g)+O2(g) K1
N2O4(g) 2NO2(g) K2
2NO2(g) K2
若向一体积固定为2L的密闭容器内加入N2O52mol,一段时间后,容器内的反应达到平衡,此时n(NO2)=0.4mol,已知K2=0.1,请计算出K1=___________ 。
(4)一定条件下,将汽车尾气通入到氢氧化钠溶液,尾气中氮的氧化物可以转化为亚硝酸钠,工业上可以用亚硝酸钠来制备亚硝酸。已知,25℃时亚硝酸(HNO2)、亚硫酸(H2SO3)的电离平衡常数分别如下:
请回答下列问题
①常温下,将0.1mol·L-1的亚硝酸稀释100倍,c(H+)将___________ (填“不变”、增大”、“减小”);Ka值将(填“不变”、“增大”、“减小”)___________ 。
②下列离子方程式能发生的是___________ (填字母)。
a.NO2-+SO2+H2O=HNO2+HSO3-b.2HNO2+SO32-=2NO2-+SO2↑+H2O
c.2NO2-+SO2+H2O=2HNO2+SO32-d.HNO2+SO32-= NO2-+ HSO3-
(1)煤的燃烧,会产生大量有害气体。将煤转化为水煤气,可有效降低排放。
C(s)+O2(g)=CO2(g)△H=-393.5 kJ·mol-1
H2(g)+
 O2(g)=H2O(g) △H=-242.0kJ·mol-1
O2(g)=H2O(g) △H=-242.0kJ·mol-1CO(g)+
 O2(g)=CO2(g) △H=-283.0kJ·mol-1
O2(g)=CO2(g) △H=-283.0kJ·mol-1根据以上数据,写出C(s)与水蒸气反应生成CO和H2的热化学方程式
(2)汽车尾气的排放是大气污染物的重要来源,其中含有NO气体。根据资料显示用活性炭还原法可以处理氮氧化物,某研究小组向固定容积的密闭容器中加入一定量的活性炭和NO发生反应C(s)+2NO(g)
 CO2(g)+N2(g) △H=-574kJ·mol-1,并在温度T时将所测反应数据制成下表:
CO2(g)+N2(g) △H=-574kJ·mol-1,并在温度T时将所测反应数据制成下表:时间(min) 浓度(mol  mol-1) mol-1) | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.00 | 0.52 | 0.36 | 0.36 | 0.54 | 0.54 |
| CO2 | 0 | 0.24 | 0.32 | 0.32 | 0.48 | 0.48 |
| N2 | 0 | 0.24 | 0.32 | 0.32 | 0.48 | 0.48 |
②下列数据不再变化可表示该反应达到平衡的是
a.容器内压强b.混合气体的平均摩尔质量c.混合气体的密度
③若容器改为可变容积容器,达平衡后改变某一条件,一段时间后,反应再次达到原平衡,请写出可能改变的条件是
(3)在某温度T时能同时发生反应:
2N2O5(g)
 2N2O4(g)+O2(g) K1
2N2O4(g)+O2(g) K1N2O4(g)
 2NO2(g) K2
2NO2(g) K2若向一体积固定为2L的密闭容器内加入N2O52mol,一段时间后,容器内的反应达到平衡,此时n(NO2)=0.4mol,已知K2=0.1,请计算出K1=
(4)一定条件下,将汽车尾气通入到氢氧化钠溶液,尾气中氮的氧化物可以转化为亚硝酸钠,工业上可以用亚硝酸钠来制备亚硝酸。已知,25℃时亚硝酸(HNO2)、亚硫酸(H2SO3)的电离平衡常数分别如下:
| Ka1 | Ka2 | |
| 亚硝酸(HNO2) | 7.1×10-4 | |
| 亚硫酸(H2SO3) | 1.54×10-2 | 1.02×10-7 |
请回答下列问题
①常温下,将0.1mol·L-1的亚硝酸稀释100倍,c(H+)将
②下列离子方程式能发生的是
a.NO2-+SO2+H2O=HNO2+HSO3-b.2HNO2+SO32-=2NO2-+SO2↑+H2O
c.2NO2-+SO2+H2O=2HNO2+SO32-d.HNO2+SO32-= NO2-+ HSO3-
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐1】过氧化钙是具有较强的漂白、杀菌、消毒作用,难溶于水的固体。对环境无危害而具有很高的应用价值。一种生产过氧化钙的工艺流程如图所示:
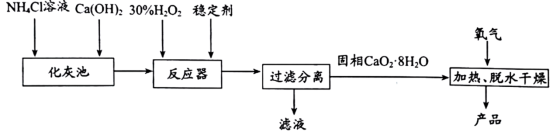
已知:CaO2在274℃开始分解,350℃迅速分解生成CaO和O2;H2O2具有弱酸性。回答下列问题:
(1)在化灰池中应控制Ca(OH)2的加入速度防止气体生成,化灰池中发生反应的化学方程式为_______ 。
(2)反应器中发生反应的化学方程式为____________ 。
(3)实验室中进行过滤操作时用到的玻璃仪器有___________ 。
(4)该生产工艺中可循环使用的物质是_______ (填化学式)。
(5)常采用Ca(OH)2过量而不是H2O2过量的方式来生产的原因是________ 。
(6)加热、脱水干燥过程中要控制加热温度并通入氧气,通入氧气的目的是______ 。(从化学平衡移动角度回答)

已知:CaO2在274℃开始分解,350℃迅速分解生成CaO和O2;H2O2具有弱酸性。回答下列问题:
(1)在化灰池中应控制Ca(OH)2的加入速度防止气体生成,化灰池中发生反应的化学方程式为
(2)反应器中发生反应的化学方程式为
(3)实验室中进行过滤操作时用到的玻璃仪器有
(4)该生产工艺中可循环使用的物质是
(5)常采用Ca(OH)2过量而不是H2O2过量的方式来生产的原因是
(6)加热、脱水干燥过程中要控制加热温度并通入氧气,通入氧气的目的是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】Ⅰ.回答下列问题
(1)写出甲基的电子式___________ ;写出纯碱的化学式___________ 。
(2)过氧化钠可用作呼吸面具中的供氧剂,写出Na2O2与CO2反应的化学方程式___________ 。
(3)用平衡移动原理解释为什么用饱和食盐水除去氯气中的杂质气体HCl___________ 。
Ⅱ.已知在25℃时,次氯酸、碳酸和亚硫酸的电离平衡常数分别为:
(4)HClO、H2CO3、H2SO3三种酸酸性由强到弱的顺序是___________ ;
(5)下列离子在溶液中不能大量共存的是___________
(1)写出甲基的电子式
(2)过氧化钠可用作呼吸面具中的供氧剂,写出Na2O2与CO2反应的化学方程式
(3)用平衡移动原理解释为什么用饱和食盐水除去氯气中的杂质气体HCl
Ⅱ.已知在25℃时,次氯酸、碳酸和亚硫酸的电离平衡常数分别为:
| 物质 | 平衡常数 |
| HClO | Ka=4.7×10-8 |
| H2CO3 | Ka1=4.2×10-7 Ka2=5.6×10-11 |
| H2SO3 | Ka1=1.54×10-2 Ka2=1.02×10-7 |
(5)下列离子在溶液中不能大量共存的是___________
A.SO 、HCO 、HCO | B.HSO 、CO 、CO | C.SO 、CO 、CO | D.ClO-、HCO |
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】在800℃时,在2L密闭容器中将一定量的NO和O2混合发生反应,n(NO)随时间的变化如下表:
请回答下列问题:
(1)用O2表示从0~20s内该反应的速率为___________ 。
(2)若升温到850℃,平衡后n(NO)= n(NO2),则该反应是______ 热反应(填:“吸”、“放”)
(3)若改变某一条件,达新平衡时n(NO)= 0.06 mol,下列说法正确的是_______ 。
A.平衡一定正向移动
B.可能是向容器中加入了一定量的NO气体
C.可能是缩小了容器的体积
(4)假设在一定条件下0.2molNO气体与氧气反应,达到平衡时测得放出热量akJ,此时NO转化率为80%,写出在此条件下该反应的热化学方程式_________ 。
(5)等温时,a、b容器开始体积相等,各充入2molNO和1molO2,平衡时NO的转化率a___ b(填“大于”“小于”“等于”)

| 时间/S | 0 | 10 | 20 | 30 | 40 | 50 |
| n(NO)/mol | 0.2 | 0.1 | 0.08 | 0.07 | 0.07 | 0.07 |
(1)用O2表示从0~20s内该反应的速率为
(2)若升温到850℃,平衡后n(NO)= n(NO2),则该反应是
(3)若改变某一条件,达新平衡时n(NO)= 0.06 mol,下列说法正确的是
A.平衡一定正向移动
B.可能是向容器中加入了一定量的NO气体
C.可能是缩小了容器的体积
(4)假设在一定条件下0.2molNO气体与氧气反应,达到平衡时测得放出热量akJ,此时NO转化率为80%,写出在此条件下该反应的热化学方程式
(5)等温时,a、b容器开始体积相等,各充入2molNO和1molO2,平衡时NO的转化率a

您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐1】β-MnS作为一种缓冲材料在太阳能电池上有巨大的应用潜力。β-MnS在空气中会慢慢氧化为硫酸锰,加热则生成二氧化硫和四氧化三锰。实验小组在实验室制备硫化锰(β-MnS)的装置如下。
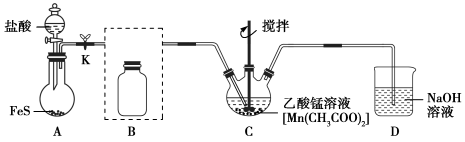
回答下列问题:
(1)检查装置A的气密性的方法是_______ 。
(2)请将除杂装置B补充完整并标明所用试剂________ 。
(3)C中制得β-MnS反应的化学方程式为_______ 。
将C中反应后的混合液经以下操作可得到纯净的β−MnS。

操作1是__ (填名称),洗涤操作中不用水而用H2S溶液的原因是___ ,β-MnS适于在___ (填“高温”或“低温”)的环境下干燥。
(4)某工业废水中含有大量的Mn2+、Hg2+,向此工业废水中加入适量的Na2S,当Mn2+恰好完全沉淀时,废水中Hg2+的浓度为_____ mol·L−1。[已知:Ksp(MnS)=2.5×10−13,Ksp(HgS)=6.4×10−53,当离子的浓度=1.0×10−5mol·L−1时可视为恰好完全沉淀]。
(5)点燃不纯的H2S气体可能会发生爆炸,为了防止意外,可连接一个安全装置,下图中的装置能起到作用的是_______ 。


回答下列问题:
(1)检查装置A的气密性的方法是
(2)请将除杂装置B补充完整并标明所用试剂
(3)C中制得β-MnS反应的化学方程式为
将C中反应后的混合液经以下操作可得到纯净的β−MnS。

操作1是
(4)某工业废水中含有大量的Mn2+、Hg2+,向此工业废水中加入适量的Na2S,当Mn2+恰好完全沉淀时,废水中Hg2+的浓度为
(5)点燃不纯的H2S气体可能会发生爆炸,为了防止意外,可连接一个安全装置,下图中的装置能起到作用的是

您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】工业上以菱锰矿(主要成分是MnCO3,还含有Fe2+、Ni2+等)为原料制备电解锰的工艺流程如图所示。

溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
回答下列问题:
(1)浸出槽中发生多个反应:如主要成分与稀硫酸的反应、MnO2与Fe2+间的氧化还原反应等。这两个反应的离子方程式分别为___________ 、___________ 。
(2)加入氨水的目的是为除去杂质,根据流程图及表中数据,pH应调控在___________ 范围内。常温下,Ksp[Fe(OH)3]=4.0×10-38,当pH=4时,溶液中c(Fe3+)=___________ 。
(3)加入硫化铵是为除去剩余的Ni2+,由此可判断相同温度下溶解度:NiS_______ Ni(OH)2(填“大于”或“小于”)。
(4)电解硫酸锰溶液的化学方程式为___________ 。
(5)工业上也可以用MnO2和Al粉作为原料,用铝热反应来制取金属锰,反应的化学方程式为_____ 。
(6)将分离出电解锰后的稀硫酸收集、循环使用,其意义是________ 。

溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
金属离子 | Ni2+ | Mn2+ | Fe3+ | Fe2+ |
| 开始沉淀时(c=0.01mol‧L-1)的pH | 7.2 | 8.3 | 2.2 | 7.5 |
| 沉淀完全时(c=1.0×10-5mol‧L-1)的pH | 8.7 | 9.8 | 3.2 | 9.0 |
(1)浸出槽中发生多个反应:如主要成分与稀硫酸的反应、MnO2与Fe2+间的氧化还原反应等。这两个反应的离子方程式分别为
(2)加入氨水的目的是为除去杂质,根据流程图及表中数据,pH应调控在
(3)加入硫化铵是为除去剩余的Ni2+,由此可判断相同温度下溶解度:NiS
(4)电解硫酸锰溶液的化学方程式为
(5)工业上也可以用MnO2和Al粉作为原料,用铝热反应来制取金属锰,反应的化学方程式为
(6)将分离出电解锰后的稀硫酸收集、循环使用,其意义是
您最近一年使用:0次

 、
、 、
、 和
和 ,还有少量
,还有少量 、
、 、
、 的盐或氧化物等,通过下图流程实现铅的回收。
的盐或氧化物等,通过下图流程实现铅的回收。




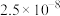
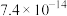
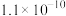

 的原因
的原因

