名校
1 .  、CO、
、CO、 、
、 等都是重要的能源,也是重要为化工原料。
等都是重要的能源,也是重要为化工原料。
(1)已知25℃,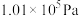 时,8.00g
时,8.00g  完全燃烧生成二氧化碳气体和液态水放出444.8kJ热量。写出该反应的热化学反应方程式:
完全燃烧生成二氧化碳气体和液态水放出444.8kJ热量。写出该反应的热化学反应方程式:___________ 。
(2)为倡导“节能减排”和“低碳经济”,降低大气中 的含量及有效地开发利用
的含量及有效地开发利用 。工业可以用
。工业可以用 来生产燃料甲醇。在体积为2L的密闭容器中,充入1mol
来生产燃料甲醇。在体积为2L的密闭容器中,充入1mol  和3mol
和3mol  ,一定条件下发生反应:
,一定条件下发生反应:
 。经测定
。经测定 和
和 (g)的物质的量随时间变化如图所示。
(g)的物质的量随时间变化如图所示。
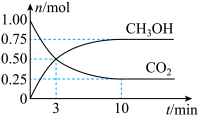
①从反应开始平衡时, 的平均反应速率
的平均反应速率
___________ 。
②达到平衡时, 的转化率为
的转化率为___________ 。
③下列措施不能提高反应速率的是___________ 。
A.升高温度 B.加入催化剂
C.增大压强 D.及时分离出
(3)工业上也用 和
和 为原料制备
为原料制备 ,反应方程式为:
,反应方程式为: ,在一体积固定的密闭容器中投入一定量的CO和
,在一体积固定的密闭容器中投入一定量的CO和 气体进行上述反应。下列叙述中能说明上述反应达到平衡状态的是
气体进行上述反应。下列叙述中能说明上述反应达到平衡状态的是________ 。
A.反应中CO与 的物质的量之比为1∶1
的物质的量之比为1∶1
B.混合气体的压强不随时间的变化而变化
C.单位时间内每消耗1mol CO,同时生成1mol
D. 的质量分数在混合气体中保持不变
的质量分数在混合气体中保持不变
E.混合气体的密度保持不变
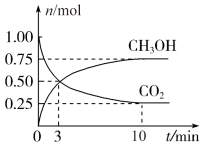
(4)燃料电池是一种高效、环境友好的供电装置,如图为乙醇燃料电池的工作原理示意图,a、b均为惰性电极。

①使用时,空气从口通入___________ (填“A”或“B”);
②a极的电极反应为:___________ 。
 、CO、
、CO、 、
、 等都是重要的能源,也是重要为化工原料。
等都是重要的能源,也是重要为化工原料。(1)已知25℃,
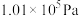 时,8.00g
时,8.00g  完全燃烧生成二氧化碳气体和液态水放出444.8kJ热量。写出该反应的热化学反应方程式:
完全燃烧生成二氧化碳气体和液态水放出444.8kJ热量。写出该反应的热化学反应方程式:(2)为倡导“节能减排”和“低碳经济”,降低大气中
 的含量及有效地开发利用
的含量及有效地开发利用 。工业可以用
。工业可以用 来生产燃料甲醇。在体积为2L的密闭容器中,充入1mol
来生产燃料甲醇。在体积为2L的密闭容器中,充入1mol  和3mol
和3mol  ,一定条件下发生反应:
,一定条件下发生反应:
 。经测定
。经测定 和
和 (g)的物质的量随时间变化如图所示。
(g)的物质的量随时间变化如图所示。
①从反应开始平衡时,
 的平均反应速率
的平均反应速率
②达到平衡时,
 的转化率为
的转化率为③下列措施不能提高反应速率的是
A.升高温度 B.加入催化剂
C.增大压强 D.及时分离出

(3)工业上也用
 和
和 为原料制备
为原料制备 ,反应方程式为:
,反应方程式为: ,在一体积固定的密闭容器中投入一定量的CO和
,在一体积固定的密闭容器中投入一定量的CO和 气体进行上述反应。下列叙述中能说明上述反应达到平衡状态的是
气体进行上述反应。下列叙述中能说明上述反应达到平衡状态的是A.反应中CO与
 的物质的量之比为1∶1
的物质的量之比为1∶1B.混合气体的压强不随时间的变化而变化
C.单位时间内每消耗1mol CO,同时生成1mol

D.
 的质量分数在混合气体中保持不变
的质量分数在混合气体中保持不变E.混合气体的密度保持不变
(4)燃料电池是一种高效、环境友好的供电装置,如图为乙醇燃料电池的工作原理示意图,a、b均为惰性电极。

①使用时,空气从口通入
②a极的电极反应为:
您最近一年使用:0次
解题方法
2 . CH4、CH3OH、CO等都是重要的能源,也是重要的化工原料。
(1)为倡导“节能减排”和“低碳经济”,降低大气中CO2的含量、有效地开发利用CO2,工业上可以用CO2来生产甲醇。在体积为2L的密闭容器中,充入1mol CO2和3molH2,一定条件下发生反应: 。测得
。测得 和CO2的物质的量随时间变化如图所示:
和CO2的物质的量随时间变化如图所示:
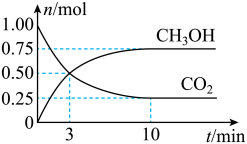
①3min时,正、逆反应速率的大小关系为v正_____ v逆(填“>”、“<”或“=”)。
②从反应开始到平衡,CO2的平均反应速率v(CO2)=_____ 。
③达到平衡时,H2的浓度为_____ mol⋅L-1。
(2)工业上也可以用CO和H2为原料制备CH3OH,反应的化学方程式为: ,在一体积固定的密闭容器中投入一定量的CO和H2进行上述反应。下列叙述中能说明上述反应达到平衡状态的是_____(填字母序号)。
,在一体积固定的密闭容器中投入一定量的CO和H2进行上述反应。下列叙述中能说明上述反应达到平衡状态的是_____(填字母序号)。
(3)某种甲烷燃料电池的工作原理如图所示。
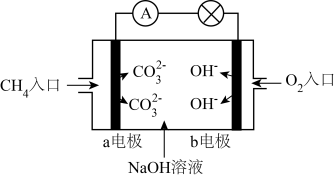
甲烷通入的一极为电池的_____ 极,电极反应式为:_____ 。当电路中有2mol电子通过时,消耗标准状况下氧气的体积为_____ L。
(1)为倡导“节能减排”和“低碳经济”,降低大气中CO2的含量、有效地开发利用CO2,工业上可以用CO2来生产甲醇。在体积为2L的密闭容器中,充入1mol CO2和3molH2,一定条件下发生反应:
 。测得
。测得 和CO2的物质的量随时间变化如图所示:
和CO2的物质的量随时间变化如图所示:
①3min时,正、逆反应速率的大小关系为v正
②从反应开始到平衡,CO2的平均反应速率v(CO2)=
③达到平衡时,H2的浓度为
(2)工业上也可以用CO和H2为原料制备CH3OH,反应的化学方程式为:
 ,在一体积固定的密闭容器中投入一定量的CO和H2进行上述反应。下列叙述中能说明上述反应达到平衡状态的是_____(填字母序号)。
,在一体积固定的密闭容器中投入一定量的CO和H2进行上述反应。下列叙述中能说明上述反应达到平衡状态的是_____(填字母序号)。| A.反应体系中CO与CH3OH的物质的量之比为1∶1 |
| B.混合气体的压强不随时间的变化而变化 |
| C.单位时间内每消耗1molCO、同时生成lmol CH3OH |
| D.CH3OH的质量分数在混合气体中保持不变 |

甲烷通入的一极为电池的
您最近一年使用:0次
名校
3 .  、
、 、
、 、
、 等都是重要的能源,也是重要为化工原料。
等都是重要的能源,也是重要为化工原料。
(1)已知破坏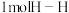 键、
键、 键、
键、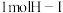 键分别需要吸收的能量为436kJ、151kJ、299kJ。则由氢气和碘单质反应生成
键分别需要吸收的能量为436kJ、151kJ、299kJ。则由氢气和碘单质反应生成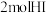 需要放出
需要放出___________ kJ的热量。
(2)将两铂片插入KOH溶液中作为电极,在两极区分别通入甲烷和氧气构成燃料电池,则通入氧气的电极反应式是___________ ,电池工作时如果消耗甲烷160g,假设化学能完全转化为电能,则转移电子的数目为___________ (用 表示)。
表示)。
(3)为倡导“节能减排”和“低碳经济”,降低大气中 的含量及有效地开发利用
的含量及有效地开发利用 ,工业上可以用
,工业上可以用 来生产燃料甲醇。在体积为2L的密闭容器中,充入
来生产燃料甲醇。在体积为2L的密闭容器中,充入 和
和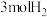 ,一定条件下发生反应:
,一定条件下发生反应: 。经测得
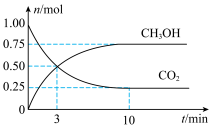
。经测得 和
和 的物质的量随时间变化如图所示。
的物质的量随时间变化如图所示。
①从反应开始到平衡, 的平均反应速率
的平均反应速率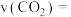
___________ 。
②达到平衡时, 的转化率为
的转化率为___________ 。
(4)工业上也用CO和 为原料制备
为原料制备 ,反应方程式为:
,反应方程式为: ,在一体积固定的密闭容器中投入一定量的CO和
,在一体积固定的密闭容器中投入一定量的CO和 气体进行上述反应。下列叙述中能说明上述反应达到平衡状态的是
气体进行上述反应。下列叙述中能说明上述反应达到平衡状态的是___________ 。
a.反应中CO与 的物质的量之比为1:1
的物质的量之比为1:1
b.混合气体的压强不随时间的变化而变化
c.单位时间内每消耗 ,同时生成
,同时生成
d. 的质量分数在混合气体中保持不变
的质量分数在混合气体中保持不变
e.混合气体的密度保持不变
 、
、 、
、 、
、 等都是重要的能源,也是重要为化工原料。
等都是重要的能源,也是重要为化工原料。(1)已知破坏
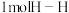 键、
键、 键、
键、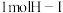 键分别需要吸收的能量为436kJ、151kJ、299kJ。则由氢气和碘单质反应生成
键分别需要吸收的能量为436kJ、151kJ、299kJ。则由氢气和碘单质反应生成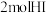 需要放出
需要放出(2)将两铂片插入KOH溶液中作为电极,在两极区分别通入甲烷和氧气构成燃料电池,则通入氧气的电极反应式是
 表示)。
表示)。(3)为倡导“节能减排”和“低碳经济”,降低大气中
 的含量及有效地开发利用
的含量及有效地开发利用 ,工业上可以用
,工业上可以用 来生产燃料甲醇。在体积为2L的密闭容器中,充入
来生产燃料甲醇。在体积为2L的密闭容器中,充入 和
和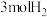 ,一定条件下发生反应:
,一定条件下发生反应: 。经测得
。经测得 和
和 的物质的量随时间变化如图所示。
的物质的量随时间变化如图所示。
①从反应开始到平衡,
 的平均反应速率
的平均反应速率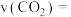
②达到平衡时,
 的转化率为
的转化率为(4)工业上也用CO和
 为原料制备
为原料制备 ,反应方程式为:
,反应方程式为: ,在一体积固定的密闭容器中投入一定量的CO和
,在一体积固定的密闭容器中投入一定量的CO和 气体进行上述反应。下列叙述中能说明上述反应达到平衡状态的是
气体进行上述反应。下列叙述中能说明上述反应达到平衡状态的是a.反应中CO与
 的物质的量之比为1:1
的物质的量之比为1:1b.混合气体的压强不随时间的变化而变化
c.单位时间内每消耗
 ,同时生成
,同时生成
d.
 的质量分数在混合气体中保持不变
的质量分数在混合气体中保持不变e.混合气体的密度保持不变
您最近一年使用:0次
名校
解题方法
4 . 化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程。
(1)在煤的气化反应器中发生如下几种反应:
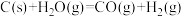


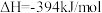


则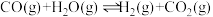

_______
(2)已知830℃时,在一个容积固定的密闭容器中,发生反应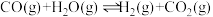 下列能判断该反应达到化学平衡状态的是
下列能判断该反应达到化学平衡状态的是 _______
a.容器中的压强不变 b.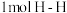 键断裂的同时断裂
键断裂的同时断裂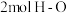 键
键
c.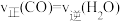 d.
d.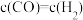
此温度下该反应的 ,等物质的量的
,等物质的量的 和
和 反应达平衡时,
反应达平衡时, 的转化率为
的转化率为_______
(3)将不同量的 和
和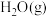 分别通入到体积为2L的恒容密闭容器中,进行反应
分别通入到体积为2L的恒容密闭容器中,进行反应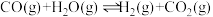 ,得到如表三组数据:
,得到如表三组数据:
①实验1中以 表示的反应速率为
表示的反应速率为_______ 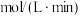 ;
;
②该反应的逆反应为_______ (填“吸”或“放”)热反应;
③若实验3要达到与实验2相同的平衡状态(即各物质的质量分数分别相等),且 ,则a、b应满足的关系是
,则a、b应满足的关系是_______ (用含a、b的数学式表示).
(4)目前工业上有一种方法是用 来生产甲醇。一定条件下发生反应:
来生产甲醇。一定条件下发生反应: ,如图1,表示该反应进行过程中能量(单位为
,如图1,表示该反应进行过程中能量(单位为 )的变化
)的变化

①在体积为1L的恒容密闭容器中,充入 和
和 ,下列措施中能使
,下列措施中能使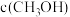 增大的是
增大的是_______ (填字母)
a.升高温度 b.充入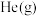 ,使体系压强增大
,使体系压强增大
c.将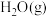 从体系中分离出来 d.再充入
从体系中分离出来 d.再充入 和
和
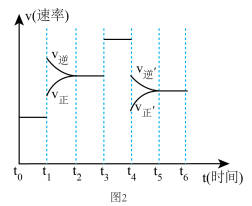
②当反应达到平衡时不断改变条件(但不改变各组分物质的量和状态且只改变一个条件)反应速率随时间的变化.如图2:其中表示平衡混合物中 含量最高的一段时间是
含量最高的一段时间是_______ ;如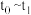 平衡常数为
平衡常数为 ,
,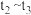 平衡常数为
平衡常数为 ,则
,则
_______  (填>、=、<)。
(填>、=、<)。
(1)在煤的气化反应器中发生如下几种反应:
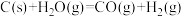


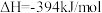


则
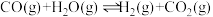

(2)已知830℃时,在一个容积固定的密闭容器中,发生反应
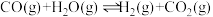 下列能判断该反应达到化学平衡状态的是
下列能判断该反应达到化学平衡状态的是 a.容器中的压强不变 b.
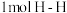 键断裂的同时断裂
键断裂的同时断裂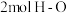 键
键c.
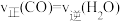 d.
d.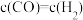
此温度下该反应的
 ,等物质的量的
,等物质的量的 和
和 反应达平衡时,
反应达平衡时, 的转化率为
的转化率为(3)将不同量的
 和
和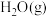 分别通入到体积为2L的恒容密闭容器中,进行反应
分别通入到体积为2L的恒容密闭容器中,进行反应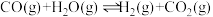 ,得到如表三组数据:
,得到如表三组数据:| 实验组 | 温度/℃ | 起始量 | 平衡量 | 达到平衡所需时间/min | ||
 |  |  |  | |||
| 1 | 650 | 2 | 4 | 1.6 | 1.6 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 0.4 | 3 |
| 3 | 900 | a | b | c | d | t |
 表示的反应速率为
表示的反应速率为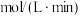 ;
;②该反应的逆反应为
③若实验3要达到与实验2相同的平衡状态(即各物质的质量分数分别相等),且
 ,则a、b应满足的关系是
,则a、b应满足的关系是(4)目前工业上有一种方法是用
 来生产甲醇。一定条件下发生反应:
来生产甲醇。一定条件下发生反应: ,如图1,表示该反应进行过程中能量(单位为
,如图1,表示该反应进行过程中能量(单位为 )的变化
)的变化
①在体积为1L的恒容密闭容器中,充入
 和
和 ,下列措施中能使
,下列措施中能使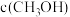 增大的是
增大的是a.升高温度 b.充入
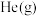 ,使体系压强增大
,使体系压强增大c.将
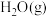 从体系中分离出来 d.再充入
从体系中分离出来 d.再充入 和
和
②当反应达到平衡时不断改变条件(但不改变各组分物质的量和状态且只改变一个条件)反应速率随时间的变化.如图2:其中表示平衡混合物中
 含量最高的一段时间是
含量最高的一段时间是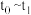 平衡常数为
平衡常数为 ,
,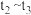 平衡常数为
平衡常数为 ,则
,则
 (填>、=、<)。
(填>、=、<)。
您最近一年使用:0次
名校
解题方法
5 . CH3OH、CO、CH4等都是重要的能源,也是重要的化工原料。
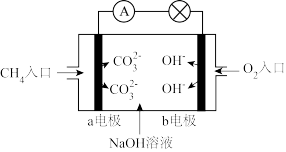
(1)为倡导“节能减排”和“低碳经济”,降低大气中CO2的含量,有效地开发利用CO2,工业上可以用CO2来生产甲醇燃料。在体积为2 L的密闭容器中,充入1 mol CO2和3 mol H2,一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g)。经测得CH3OH和CO2的物质的量随时间变化如图所示。
CH3OH(g)+H2O(g)。经测得CH3OH和CO2的物质的量随时间变化如图所示。
①从反应开始到平衡,CO2的平均反应速率v(CO2)=____ 。
②达到平衡时,H2的浓度为____ mol/L。
(2)工业上也可以用CO和H2为原料制备CH3OH,反应方程式为:CO(g)+2H2(g) CH3OH(g),在一体积固定的密闭容器中投入一定量的CO和H2进行上述反应。下列叙述中能说明上述反应达到平衡状态的是
CH3OH(g),在一体积固定的密闭容器中投入一定量的CO和H2进行上述反应。下列叙述中能说明上述反应达到平衡状态的是____ 。
(3)某种甲烷燃料电池的工作原理如图所示氧气通入的一极为电源的____ 极,a电极反应式:____ ,b电极反应式:____ 。
(4)当电路中累计有2 mol电子通过时,消耗的甲烷体积为(在标准状况下)____ L。
(1)为倡导“节能减排”和“低碳经济”,降低大气中CO2的含量,有效地开发利用CO2,工业上可以用CO2来生产甲醇燃料。在体积为2 L的密闭容器中,充入1 mol CO2和3 mol H2,一定条件下发生反应:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)。经测得CH3OH和CO2的物质的量随时间变化如图所示。
CH3OH(g)+H2O(g)。经测得CH3OH和CO2的物质的量随时间变化如图所示。
①从反应开始到平衡,CO2的平均反应速率v(CO2)=
②达到平衡时,H2的浓度为
(2)工业上也可以用CO和H2为原料制备CH3OH,反应方程式为:CO(g)+2H2(g)
 CH3OH(g),在一体积固定的密闭容器中投入一定量的CO和H2进行上述反应。下列叙述中能说明上述反应达到平衡状态的是
CH3OH(g),在一体积固定的密闭容器中投入一定量的CO和H2进行上述反应。下列叙述中能说明上述反应达到平衡状态的是| A.反应中CO与CH3OH的物质的量之比为1:1 |
| B.混合气体的压强不随时间的变化而变化 |
| C.单位时间内每消耗1 mol CO,同时生成1 mol CH3OH |
| D.CH3OH的质量分数在混合气体中保持不变 |
(4)当电路中累计有2 mol电子通过时,消耗的甲烷体积为(在标准状况下)

您最近一年使用:0次
2022-05-12更新
|
440次组卷
|
3卷引用:河南省南阳市2021-2022学年高一下学期期中质量评估化学试题
6 . CH4、CH3OH、CO等都是重要的能源,也是重要的化工原料。
(1)已知25℃、101kPa时,1g甲烷完全燃烧生成CO和液态水时放出38kJ热量,则该条件下反应的热化学反应方程式___________ 。
(2)为倡导“节能减排”和“低碳经济”,降低大气中CO2的含量,有效地开发利用CO2,工业上可以用CO2来生产甲醇燃料。在体积为2L的密闭容器中,充入lmolCO2和3molH2,一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g)。经测得CH3OH和CO2的物质的量随时间变化如图所示。
CH3OH(g)+H2O(g)。经测得CH3OH和CO2的物质的量随时间变化如图所示。
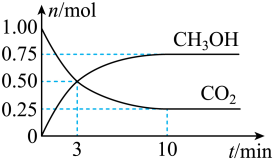
①从反应开始到平衡,CO2的平均反应速率v(CO2)=___________ 。
②达到平衡时,H2的转化率为___________ 。
(3)工业上也可以用CO和H2为原料制备CH3OH,反应方程式为:CO(g)+2H2(g) CH3OH(g),在一体积固定的密闭容器中投入一定量的CO和H2气体进行上述反应。下列叙述中能说明上述反应达到平衡状态的是
CH3OH(g),在一体积固定的密闭容器中投入一定量的CO和H2气体进行上述反应。下列叙述中能说明上述反应达到平衡状态的是___________ 。
A.反应中CO与CH3OH的物质的量之比为1:1
B.混合气体的压强不随时间的变化而变化
C.单位时间内每消耗1molCO,同时生成1molCH3OH
D.CH3OH的质量分数在混合气体中保持不变
(1)已知25℃、101kPa时,1g甲烷完全燃烧生成CO和液态水时放出38kJ热量,则该条件下反应的热化学反应方程式
(2)为倡导“节能减排”和“低碳经济”,降低大气中CO2的含量,有效地开发利用CO2,工业上可以用CO2来生产甲醇燃料。在体积为2L的密闭容器中,充入lmolCO2和3molH2,一定条件下发生反应:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)。经测得CH3OH和CO2的物质的量随时间变化如图所示。
CH3OH(g)+H2O(g)。经测得CH3OH和CO2的物质的量随时间变化如图所示。
①从反应开始到平衡,CO2的平均反应速率v(CO2)=
②达到平衡时,H2的转化率为
(3)工业上也可以用CO和H2为原料制备CH3OH,反应方程式为:CO(g)+2H2(g)
 CH3OH(g),在一体积固定的密闭容器中投入一定量的CO和H2气体进行上述反应。下列叙述中能说明上述反应达到平衡状态的是
CH3OH(g),在一体积固定的密闭容器中投入一定量的CO和H2气体进行上述反应。下列叙述中能说明上述反应达到平衡状态的是A.反应中CO与CH3OH的物质的量之比为1:1
B.混合气体的压强不随时间的变化而变化
C.单位时间内每消耗1molCO,同时生成1molCH3OH
D.CH3OH的质量分数在混合气体中保持不变
您最近一年使用:0次
名校
7 . 在生产和生活中,人们关注化学反应进行的快慢和程度,以提高生产效率和调控反应条件。
Ⅰ.合成氨的反应对人类解决粮食问题贡献巨大,反应为 。
。
(1)德国化学家F·Haber利用 和
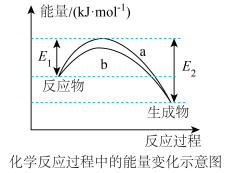
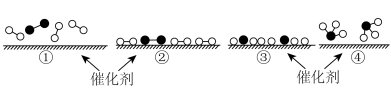
和 在催化剂表面合成氨气而获得诺贝尔奖,该反应的能量变化及微观历程的示意图如下,用
在催化剂表面合成氨气而获得诺贝尔奖,该反应的能量变化及微观历程的示意图如下,用 、
、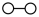 、
、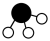 分别
分别 、
、 、
、 。
。_______ 。
A.氢气燃烧 B.氯化铵与 的反应
的反应
C.锌片与稀硫酸的反应 D.钠与冷水的反应
②下列说法正确的是_______ 。
A.使用催化剂,可以加快合成氨的反应速率
B.②→③过程,是吸热过程且只有H-H键断裂
C.③→④过程,N原子和H原子形成了含有极性键的
D.合成氨反应中,反应物断键吸收能量大于生成物成键释放的能量
(2)一定温度下,向恒容的密闭容器中充入一定量的 和
和 发生反应,测得各组分浓度随时间变化如图所示。
发生反应,测得各组分浓度随时间变化如图所示。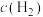 变化的曲线是
变化的曲线是_______ (填“A”“B”或“C”)。
②下列能说明该反应达到平衡状态的是_______ (填序号)。
a.容器中的压强不随时间变化
b.
c.容器中混合气体的密度不随时间变化
d.单位时间内生成3mol 的同时生成2mol
的同时生成2mol
e.容器内 的质量分数不变
的质量分数不变
(3)一定条件下,将2mol 和3mol
和3mol 通入2L的恒容密闭容器中,10min后达到化学平衡,测得
通入2L的恒容密闭容器中,10min后达到化学平衡,测得 的物质的量为2.4mol,则10min内
的物质的量为2.4mol,则10min内 的平均反应速率为
的平均反应速率为_______ , 的转化率是
的转化率是_______ ,混合气中 的物质的量分数是
的物质的量分数是_______ 。
Ⅱ.探究一定条件下反应物浓度对硫代硫酸钠( )与硫酸反应速率的影响。
)与硫酸反应速率的影响。
【查阅资料】
a. 易溶于水,能与硫酸发生反应:
易溶于水,能与硫酸发生反应: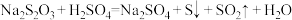
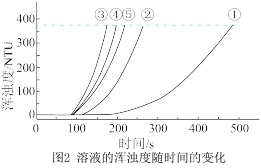
b.浊度计用于测量浑浊度的变化。产生的沉淀越多,浑浊度(单位为NTU)值越大。
【实验过程】
实验数据:
(4)选用浊度计进行测量,原因是 溶液与
溶液与 溶液反应生成了
溶液反应生成了_______ 。
(5)实验③中,x=_______ 。
(6)实验①、②、③的目的是_______ 。
(7)通过比较①、②、③与③、④、⑤两组实验,可推断:反应物浓度的改变对 与硫酸反应的化学反应速率的影响,
与硫酸反应的化学反应速率的影响, 溶液浓度的改变影响更大。该推断的证据是
溶液浓度的改变影响更大。该推断的证据是_______ 。
Ⅰ.合成氨的反应对人类解决粮食问题贡献巨大,反应为
 。
。(1)德国化学家F·Haber利用
 和
和 在催化剂表面合成氨气而获得诺贝尔奖,该反应的能量变化及微观历程的示意图如下,用
在催化剂表面合成氨气而获得诺贝尔奖,该反应的能量变化及微观历程的示意图如下,用 、
、 、
、 分别
分别 、
、 、
、 。
。
A.氢气燃烧 B.氯化铵与
 的反应
的反应C.锌片与稀硫酸的反应 D.钠与冷水的反应
②下列说法正确的是
A.使用催化剂,可以加快合成氨的反应速率
B.②→③过程,是吸热过程且只有H-H键断裂
C.③→④过程,N原子和H原子形成了含有极性键的

D.合成氨反应中,反应物断键吸收能量大于生成物成键释放的能量
(2)一定温度下,向恒容的密闭容器中充入一定量的
 和
和 发生反应,测得各组分浓度随时间变化如图所示。
发生反应,测得各组分浓度随时间变化如图所示。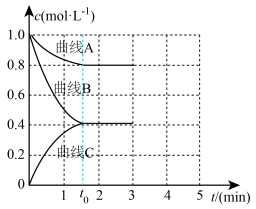
 变化的曲线是
变化的曲线是②下列能说明该反应达到平衡状态的是
a.容器中的压强不随时间变化
b.

c.容器中混合气体的密度不随时间变化
d.单位时间内生成3mol
 的同时生成2mol
的同时生成2mol
e.容器内
 的质量分数不变
的质量分数不变(3)一定条件下,将2mol
 和3mol
和3mol 通入2L的恒容密闭容器中,10min后达到化学平衡,测得
通入2L的恒容密闭容器中,10min后达到化学平衡,测得 的物质的量为2.4mol,则10min内
的物质的量为2.4mol,则10min内 的平均反应速率为
的平均反应速率为 的转化率是
的转化率是 的物质的量分数是
的物质的量分数是Ⅱ.探究一定条件下反应物浓度对硫代硫酸钠(
 )与硫酸反应速率的影响。
)与硫酸反应速率的影响。【查阅资料】
a.
 易溶于水,能与硫酸发生反应:
易溶于水,能与硫酸发生反应: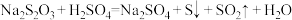
b.浊度计用于测量浑浊度的变化。产生的沉淀越多,浑浊度(单位为NTU)值越大。
【实验过程】
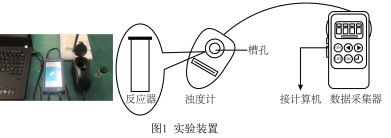
| 实验编号 |  溶液 溶液 |  溶液 溶液 | 蒸馏水 | ||
 | V/mL |  | V/mL | V/mL | |
| ① | 0.1 | 1.5 | 0.1 | 3.5 | 10 |
| ② | 0.1 | 2.5 | 0.1 | 3.5 | 9 |
| ③ | 0.1 | 3.5 | 0.1 | 3.5 | x |
| ④ | 0.1 | 3.5 | 0.1 | 2.5 | 9 |
| ⑤ | 0.1 | 3.5 | 0.1 | 1.5 | 10 |
(4)选用浊度计进行测量,原因是
 溶液与
溶液与 溶液反应生成了
溶液反应生成了(5)实验③中,x=
(6)实验①、②、③的目的是
(7)通过比较①、②、③与③、④、⑤两组实验,可推断:反应物浓度的改变对
 与硫酸反应的化学反应速率的影响,
与硫酸反应的化学反应速率的影响, 溶液浓度的改变影响更大。该推断的证据是
溶液浓度的改变影响更大。该推断的证据是
您最近一年使用:0次
2024-04-25更新
|
294次组卷
|
2卷引用:广东省广州市育才中学2023-2024学年高一下学期 期中考试化学试题
8 . 在某温度下,5L密闭容器内发生如下反应:CH4(g)+H2O (g) CO(g)+3H2(g) △H>0
CO(g)+3H2(g) △H>0
(1)反应中的非极性分子为:______ 、______ 。
(2)一个可逆反应的平衡常数只随温度而变化,请写出该反应的平衡常数表达式______ ,当温度升高,该平衡常数______ (填“增大”、“减小”或“不变”)。
(3)反应20min后生成了18g氢气,甲烷的平均反应速率为______ 。
(4)下列选项中的物理量不变时,一定可以判断反应达到平衡的是______(双选)。
(5)在某一时刻,v正=v逆=v,此时反应达到平衡。若改变一条件,可使得v正<v逆<v,指出可以改变的条件______ ,并说明理由:__________________ 。
A.升高温度 B.增大压强 C.降低温度 D.降低压强
(6)已知CO与H2合成CH3OH是可逆反应:CO+2H2 CH3OH。试求:当投料比n(CO):n(H2)=
CH3OH。试求:当投料比n(CO):n(H2)= ______ 时,平衡时CO与H2的转化率相同。
 CO(g)+3H2(g) △H>0
CO(g)+3H2(g) △H>0(1)反应中的非极性分子为:
(2)一个可逆反应的平衡常数只随温度而变化,请写出该反应的平衡常数表达式
(3)反应20min后生成了18g氢气,甲烷的平均反应速率为
(4)下列选项中的物理量不变时,一定可以判断反应达到平衡的是______(双选)。
| A.氢元素的质量分数 | B.容器内的压强 |
| C.反应的平衡常数 | D.容器内气体的平均分子量 |
A.升高温度 B.增大压强 C.降低温度 D.降低压强
(6)已知CO与H2合成CH3OH是可逆反应:CO+2H2
 CH3OH。试求:当投料比n(CO):n(H2)=
CH3OH。试求:当投料比n(CO):n(H2)=
您最近一年使用:0次
名校
解题方法
9 . 含氮化合物在农业、工业、国防等领域都有着广泛的应用。如图是氮元素部分常见物质间的相互转化示意图。

请回答下列问题:
(1)常温常压下,NO2为___________ 色气体;过程II、III、IV的转化中,都存在氮元素___________ (填“被氧化”或“被还原”)的变化。
(2)写出过程II的化学方程式:___________ 。若NO2最终完全转化为HNO3,计算1.7tNH3理论上可以得到质量分数为63%的硝酸溶液___________ t。
(3)过程V是工业生产中吸收尾气NO2的一种方法,该过程中除生成NaNO2外,还产生一种气体和另一种盐,写出该反应的离子方程式:___________ 。
(4)用200mL稀硝酸可以将5.6g铁粉恰好完全溶解(假设还原产物只有NO),并且溶液中的Fe2+与Fe3+的物质的量之比为3:1,该稀硝酸的物质的量浓度为___________ mol∙L-1。
(5)NO2和N2O4(无色)两种气体之间的转化为 。
。
①如果1mol NO2 (g)完全转化成N2O4 (g)时放出的热量为238.5kJ,请从化学键角度描述能量变化的原因:___________ 。
②上述转化是一个典型的可逆反应。在恒温恒容密闭容器中反应,下列状况不能说明该反应达到化学平衡状态的是___________ (填字母)。
A.容器内气体的颜色不再变化 B.生成1mol N2O4的同时消耗1mol N2O4
C. D.容器中混合气体的密度不再变化
D.容器中混合气体的密度不再变化

请回答下列问题:
(1)常温常压下,NO2为
(2)写出过程II的化学方程式:
(3)过程V是工业生产中吸收尾气NO2的一种方法,该过程中除生成NaNO2外,还产生一种气体和另一种盐,写出该反应的离子方程式:
(4)用200mL稀硝酸可以将5.6g铁粉恰好完全溶解(假设还原产物只有NO),并且溶液中的Fe2+与Fe3+的物质的量之比为3:1,该稀硝酸的物质的量浓度为
(5)NO2和N2O4(无色)两种气体之间的转化为
 。
。①如果1mol NO2 (g)完全转化成N2O4 (g)时放出的热量为238.5kJ,请从化学键角度描述能量变化的原因:
②上述转化是一个典型的可逆反应。在恒温恒容密闭容器中反应,下列状况不能说明该反应达到化学平衡状态的是
A.容器内气体的颜色不再变化 B.生成1mol N2O4的同时消耗1mol N2O4
C.
 D.容器中混合气体的密度不再变化
D.容器中混合气体的密度不再变化
您最近一年使用:0次
名校
解题方法
10 . 过氧乙酸(CH3CO3H)是一种广谱高效消毒剂,不稳定、易分解,高浓度易爆炸。常用于空气器材的消毒,可由乙酸与 在硫酸催化下反应制得,热化学方程式为:
在硫酸催化下反应制得,热化学方程式为: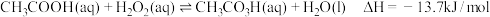
(1)市售过氧乙酸的浓度一般不超过21%,原因是___________ 。
(2)以下措施中能提高乙酸平衡转化率的措施有___________。
(3)取质量相等的冰醋酸和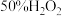 溶液混合均匀,在一定量硫酸催化下进行如下实验。
溶液混合均匀,在一定量硫酸催化下进行如下实验。
实验1:在 下,测定不同时间所得溶液中过氧乙酸的质量分数。数据如图1所示。
下,测定不同时间所得溶液中过氧乙酸的质量分数。数据如图1所示。
实验2:在不同温度下反应,测定24小时所得溶液中过氧乙酸的质量分数。数据如图2所示。
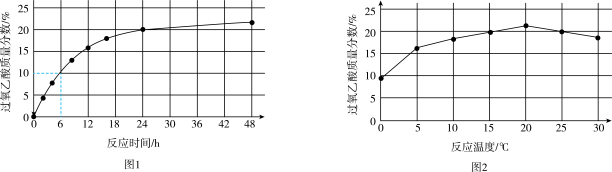
①实验1中,若反应混合液的总质量为 ,依据图1数据计算,在
,依据图1数据计算,在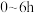 间,
间,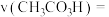
___________ 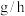 。(用含m的代数式表示)
。(用含m的代数式表示)
②综合图1、图2分析,与 相比,
相比, 时过氧乙酸产率降低的可能原因是
时过氧乙酸产率降低的可能原因是___________ (写出2条)。
(4)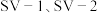 是两种常用于实验研究的病毒,病毒在水中可能会聚集成团簇。不同
是两种常用于实验研究的病毒,病毒在水中可能会聚集成团簇。不同 下,病毒团簇粒径及过氧乙酸对两种病毒的相对杀灭速率分别如图3、图4所示。
下,病毒团簇粒径及过氧乙酸对两种病毒的相对杀灭速率分别如图3、图4所示。
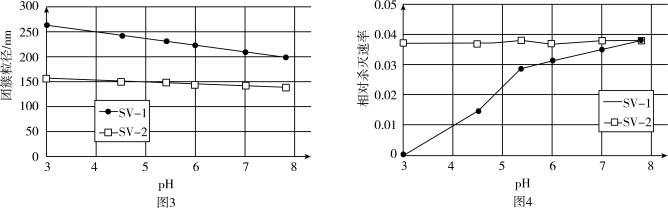
依据图3、图4分析,过氧乙酸对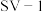 的杀灭速率随
的杀灭速率随 增大而增大的原因可能是
增大而增大的原因可能是___________ 。
 在硫酸催化下反应制得,热化学方程式为:
在硫酸催化下反应制得,热化学方程式为: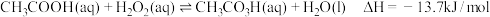
(1)市售过氧乙酸的浓度一般不超过21%,原因是
(2)以下措施中能提高乙酸平衡转化率的措施有___________。
| A.降低温度 | B.增加 用量(溶液体积不变) 用量(溶液体积不变) |
| C.加水稀释溶液 | D.增加乙酸的用量(溶液体积不变) |
(3)取质量相等的冰醋酸和
 溶液混合均匀,在一定量硫酸催化下进行如下实验。
溶液混合均匀,在一定量硫酸催化下进行如下实验。实验1:在
 下,测定不同时间所得溶液中过氧乙酸的质量分数。数据如图1所示。
下,测定不同时间所得溶液中过氧乙酸的质量分数。数据如图1所示。实验2:在不同温度下反应,测定24小时所得溶液中过氧乙酸的质量分数。数据如图2所示。

①实验1中,若反应混合液的总质量为
 ,依据图1数据计算,在
,依据图1数据计算,在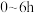 间,
间,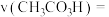
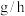 。(用含m的代数式表示)
。(用含m的代数式表示)②综合图1、图2分析,与
 相比,
相比, 时过氧乙酸产率降低的可能原因是
时过氧乙酸产率降低的可能原因是(4)
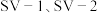 是两种常用于实验研究的病毒,病毒在水中可能会聚集成团簇。不同
是两种常用于实验研究的病毒,病毒在水中可能会聚集成团簇。不同 下,病毒团簇粒径及过氧乙酸对两种病毒的相对杀灭速率分别如图3、图4所示。
下,病毒团簇粒径及过氧乙酸对两种病毒的相对杀灭速率分别如图3、图4所示。
依据图3、图4分析,过氧乙酸对
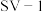 的杀灭速率随
的杀灭速率随 增大而增大的原因可能是
增大而增大的原因可能是
您最近一年使用:0次



