解题方法
1 . CH4、CH3OH、CO等都是重要的能源,也是重要的化工原料。
(1)为倡导“节能减排”和“低碳经济”,降低大气中CO2的含量、有效地开发利用CO2,工业上可以用CO2来生产甲醇。在体积为2L的密闭容器中,充入1mol CO2和3molH2,一定条件下发生反应: 。测得
。测得 和CO2的物质的量随时间变化如图所示:
和CO2的物质的量随时间变化如图所示:
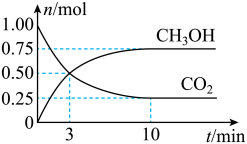
①3min时,正、逆反应速率的大小关系为v正_____ v逆(填“>”、“<”或“=”)。
②从反应开始到平衡,CO2的平均反应速率v(CO2)=_____ 。
③达到平衡时,H2的浓度为_____ mol⋅L-1。
(2)工业上也可以用CO和H2为原料制备CH3OH,反应的化学方程式为: ,在一体积固定的密闭容器中投入一定量的CO和H2进行上述反应。下列叙述中能说明上述反应达到平衡状态的是_____(填字母序号)。
,在一体积固定的密闭容器中投入一定量的CO和H2进行上述反应。下列叙述中能说明上述反应达到平衡状态的是_____(填字母序号)。
(3)某种甲烷燃料电池的工作原理如图所示。
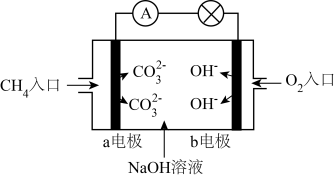
甲烷通入的一极为电池的_____ 极,电极反应式为:_____ 。当电路中有2mol电子通过时,消耗标准状况下氧气的体积为_____ L。
(1)为倡导“节能减排”和“低碳经济”,降低大气中CO2的含量、有效地开发利用CO2,工业上可以用CO2来生产甲醇。在体积为2L的密闭容器中,充入1mol CO2和3molH2,一定条件下发生反应:
 。测得
。测得 和CO2的物质的量随时间变化如图所示:
和CO2的物质的量随时间变化如图所示:
①3min时,正、逆反应速率的大小关系为v正
②从反应开始到平衡,CO2的平均反应速率v(CO2)=
③达到平衡时,H2的浓度为
(2)工业上也可以用CO和H2为原料制备CH3OH,反应的化学方程式为:
 ,在一体积固定的密闭容器中投入一定量的CO和H2进行上述反应。下列叙述中能说明上述反应达到平衡状态的是_____(填字母序号)。
,在一体积固定的密闭容器中投入一定量的CO和H2进行上述反应。下列叙述中能说明上述反应达到平衡状态的是_____(填字母序号)。| A.反应体系中CO与CH3OH的物质的量之比为1∶1 |
| B.混合气体的压强不随时间的变化而变化 |
| C.单位时间内每消耗1molCO、同时生成lmol CH3OH |
| D.CH3OH的质量分数在混合气体中保持不变 |

甲烷通入的一极为电池的
您最近一年使用:0次
名校
解题方法
2 . CH3OH、CO、CH4等都是重要的能源,也是重要的化工原料。
(1)为倡导“节能减排”和“低碳经济”,降低大气中CO2的含量,有效地开发利用CO2,工业上可以用CO2来生产甲醇燃料。在体积为2 L的密闭容器中,充入1 mol CO2和3 mol H2,一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g)。经测得CH3OH和CO2的物质的量随时间变化如图所示。
CH3OH(g)+H2O(g)。经测得CH3OH和CO2的物质的量随时间变化如图所示。
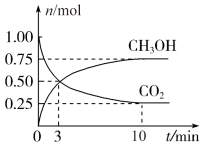
①从反应开始到平衡,CO2的平均反应速率v(CO2)=____ 。
②达到平衡时,H2的浓度为____ mol/L。
(2)工业上也可以用CO和H2为原料制备CH3OH,反应方程式为:CO(g)+2H2(g) CH3OH(g),在一体积固定的密闭容器中投入一定量的CO和H2进行上述反应。下列叙述中能说明上述反应达到平衡状态的是
CH3OH(g),在一体积固定的密闭容器中投入一定量的CO和H2进行上述反应。下列叙述中能说明上述反应达到平衡状态的是____ 。
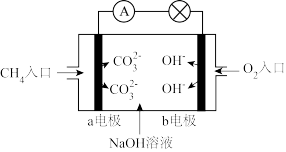
(3)某种甲烷燃料电池的工作原理如图所示氧气通入的一极为电源的____ 极,a电极反应式:____ ,b电极反应式:____ 。
(4)当电路中累计有2 mol电子通过时,消耗的甲烷体积为(在标准状况下)____ L。
(1)为倡导“节能减排”和“低碳经济”,降低大气中CO2的含量,有效地开发利用CO2,工业上可以用CO2来生产甲醇燃料。在体积为2 L的密闭容器中,充入1 mol CO2和3 mol H2,一定条件下发生反应:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)。经测得CH3OH和CO2的物质的量随时间变化如图所示。
CH3OH(g)+H2O(g)。经测得CH3OH和CO2的物质的量随时间变化如图所示。
①从反应开始到平衡,CO2的平均反应速率v(CO2)=
②达到平衡时,H2的浓度为
(2)工业上也可以用CO和H2为原料制备CH3OH,反应方程式为:CO(g)+2H2(g)
 CH3OH(g),在一体积固定的密闭容器中投入一定量的CO和H2进行上述反应。下列叙述中能说明上述反应达到平衡状态的是
CH3OH(g),在一体积固定的密闭容器中投入一定量的CO和H2进行上述反应。下列叙述中能说明上述反应达到平衡状态的是| A.反应中CO与CH3OH的物质的量之比为1:1 |
| B.混合气体的压强不随时间的变化而变化 |
| C.单位时间内每消耗1 mol CO,同时生成1 mol CH3OH |
| D.CH3OH的质量分数在混合气体中保持不变 |
(4)当电路中累计有2 mol电子通过时,消耗的甲烷体积为(在标准状况下)

您最近一年使用:0次
2022-05-12更新
|
440次组卷
|
3卷引用:福建省福州第八中学2021-2022学年高一下学期期末考试化学试题
3 . 减少CO的排放和降低空气中CO含量都是实现碳达峰、碳中和的重要手段。
I.化学链燃烧(CLC)是利用载氧体将空气中的氧传输至燃料的新技术,与传统燃烧方式相比,避免了空气和燃料的直接接触,有利于高效捕集CO2,从而减少CO2的排放。基于CuO/Cu2O载体的甲烷化学链燃烧技术如图所示。

空气反应器与燃料反应器中发生的反应分别如下:
i.2Cu2O(s)+O2(g) 4CuO(s) ΔH1=-227kJ·mol-1
4CuO(s) ΔH1=-227kJ·mol-1
ii.8CuO(s)+CH4(g) 4Cu2O(s)+CO2(g)+2H2O(g) ΔH2=-348kJ·mol-1
4Cu2O(s)+CO2(g)+2H2O(g) ΔH2=-348kJ·mol-1
回答下列问题:
(1)反应iii.CH4(g)+2O2(g) CO2(g)+2H2O(g) ΔH3=
CO2(g)+2H2O(g) ΔH3=___________ 。
(2)氧的质量分数::载氧体I___________ (填>”“<”或“=”)载氧体Ⅱ。
II.催化还原CO2是降低空气中CO2含量的重要手段之一、研究表明,在催化剂存在下,CO2和H2可发生两个平行应分别生成CH3OH和CO。反应的热化学方程式如下:
iv.CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH4
CH3OH(g)+H2O(g) ΔH4
v.CO2(g)+H2(g) CO(g)+H2O(g) ΔH5
CO(g)+H2O(g) ΔH5
某实验兴趣小组在一定温度下,将0.1molCO2和0.3molH2充人容积为2L的恒容密闭容器中,4min后,反应达到平衡,此时测得反应前后的压强比为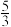 H2O(g)的物质的量分数为37.5%。回答下列问题:
H2O(g)的物质的量分数为37.5%。回答下列问题:
(3)对于反应iv,在___________ (填“高温”或“低温”)下有利于该反应自发进行。
(4)反应达平衡后:
①c(CO)=___________ mol·L,0~4min,v(CH3OH)=___________ mol·L-1.min-1。
②H2的转化率为___________ %(保留三位有效数字)。
③该温度下,反应iv的平衡常数K=___________ 。
④若再往该容器中充人0.45molH2和0.09molCO,对于反应V,此时V正___________ (填“>”“<”或“=”)V逆,判断的理由是___________ 。
I.化学链燃烧(CLC)是利用载氧体将空气中的氧传输至燃料的新技术,与传统燃烧方式相比,避免了空气和燃料的直接接触,有利于高效捕集CO2,从而减少CO2的排放。基于CuO/Cu2O载体的甲烷化学链燃烧技术如图所示。

空气反应器与燃料反应器中发生的反应分别如下:
i.2Cu2O(s)+O2(g)
 4CuO(s) ΔH1=-227kJ·mol-1
4CuO(s) ΔH1=-227kJ·mol-1ii.8CuO(s)+CH4(g)
 4Cu2O(s)+CO2(g)+2H2O(g) ΔH2=-348kJ·mol-1
4Cu2O(s)+CO2(g)+2H2O(g) ΔH2=-348kJ·mol-1回答下列问题:
(1)反应iii.CH4(g)+2O2(g)
 CO2(g)+2H2O(g) ΔH3=
CO2(g)+2H2O(g) ΔH3=(2)氧的质量分数::载氧体I
II.催化还原CO2是降低空气中CO2含量的重要手段之一、研究表明,在催化剂存在下,CO2和H2可发生两个平行应分别生成CH3OH和CO。反应的热化学方程式如下:
iv.CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH4
CH3OH(g)+H2O(g) ΔH4v.CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH5
CO(g)+H2O(g) ΔH5某实验兴趣小组在一定温度下,将0.1molCO2和0.3molH2充人容积为2L的恒容密闭容器中,4min后,反应达到平衡,此时测得反应前后的压强比为
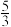 H2O(g)的物质的量分数为37.5%。回答下列问题:
H2O(g)的物质的量分数为37.5%。回答下列问题:(3)对于反应iv,在
(4)反应达平衡后:
①c(CO)=
②H2的转化率为
③该温度下,反应iv的平衡常数K=
④若再往该容器中充人0.45molH2和0.09molCO,对于反应V,此时V正
您最近一年使用:0次
4 . CH4、CH3OH、CO等都是重要的能源,也是重要的化工原料。
(1)已知25℃、101kPa时,1g甲烷燃烧生成CO和液态水时放出38kJ热量,则该条件下反应2CH4(g)+3O2(g)=2CO(g)+4H2O(l)的 =
=___________ 。
(2)为倡导“节能减排”和“低碳经济”,降低大气中CO2的含量,有效地开发利用CO2,工业上可以用CO2来生产甲醇燃料。在体积为2L的密闭容器中,充入lmolCO2和3molH2,一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g)。经测得CH3OH和CO2的物质的量随时间变化如图所示。
CH3OH(g)+H2O(g)。经测得CH3OH和CO2的物质的量随时间变化如图所示。

①从反应开始到平衡,CO2的平均反应速率v(CO2)=___________ 。
②达到平衡时,H2的浓度为___________ mol/L。
(3)工业上也可以用CO和H2为原料制备CH3OH,反应方程式为:CO(g)+2H2(g) CH3OH(g),在一体积固定的密闭容器中投入一定量的CO和H2进行上述反应。下列叙述中能说明上述反应达到平衡状态的是
CH3OH(g),在一体积固定的密闭容器中投入一定量的CO和H2进行上述反应。下列叙述中能说明上述反应达到平衡状态的是___________ 。
A.反应中CO与CH3OH的物质的量之比为1:1
B.混合气体的压强不随时间的变化而变化
C.单位时间内每消耗1molCO,同时生成1molCH3OH
D.CH3OH的质量分数在混合气体中保持不变
(4)某种甲烷燃料电池的工作原理如图所示

甲烷通入的一极为电源的___________ 极,该电极反应式:___________ 当电路中累计有2mol电子通过时,消耗的氧气体积为(在标准状况下)___________ L
(1)已知25℃、101kPa时,1g甲烷燃烧生成CO和液态水时放出38kJ热量,则该条件下反应2CH4(g)+3O2(g)=2CO(g)+4H2O(l)的
 =
=(2)为倡导“节能减排”和“低碳经济”,降低大气中CO2的含量,有效地开发利用CO2,工业上可以用CO2来生产甲醇燃料。在体积为2L的密闭容器中,充入lmolCO2和3molH2,一定条件下发生反应:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)。经测得CH3OH和CO2的物质的量随时间变化如图所示。
CH3OH(g)+H2O(g)。经测得CH3OH和CO2的物质的量随时间变化如图所示。
①从反应开始到平衡,CO2的平均反应速率v(CO2)=
②达到平衡时,H2的浓度为
(3)工业上也可以用CO和H2为原料制备CH3OH,反应方程式为:CO(g)+2H2(g)
 CH3OH(g),在一体积固定的密闭容器中投入一定量的CO和H2进行上述反应。下列叙述中能说明上述反应达到平衡状态的是
CH3OH(g),在一体积固定的密闭容器中投入一定量的CO和H2进行上述反应。下列叙述中能说明上述反应达到平衡状态的是A.反应中CO与CH3OH的物质的量之比为1:1
B.混合气体的压强不随时间的变化而变化
C.单位时间内每消耗1molCO,同时生成1molCH3OH
D.CH3OH的质量分数在混合气体中保持不变
(4)某种甲烷燃料电池的工作原理如图所示

甲烷通入的一极为电源的
您最近一年使用:0次
名校
5 . H2、CO、CH4、CH3OH等都是重要的能源,也是重要为化工原料。
(1)已知25℃,1.01×105Pa时,8.0g CH4完全燃烧生成二氧化碳气体和液态水放出444.8kJ热量。写出该反应的热化学反应方程式:___________________________________________ 。
(2)为倡导“节能减排”和“低碳经济”,降低大气中CO2的含量及有效地开发利用CO2,工业上可以用CO2来生产燃料甲醇。在体积为2L的密闭容器中,充入lmol CO2和3mol H2,一定条件下发生反应:CO2(g) + 3H2(g) CH3OH(g) + H2O(g)。经测得CO2和CH3OH(g)的物质的量随时间变化如图所示。
CH3OH(g) + H2O(g)。经测得CO2和CH3OH(g)的物质的量随时间变化如图所示。

①从反应开始到平衡,CO2的平均反应速率v(CO2)=___________________ 。
②达到平衡时,H2的转化率为__________ 。
③该反应的平衡常数K=___________________ (表达式)。
④下列措施不能提高反应速率的是__________ 。
A.升高温度 B.加入催化剂 C.增大压强 D.及时分离出CH3OH
(3)工业上也用CO和H2为原料制备CH3OH,反应方程式为:CO(g) + 2H2(g) CH3OH(g),在一体积固定的密闭容器中投入一定量的CO和H2气体进行上述反应。下列叙述中能说明上述反应达到平衡状态的是
CH3OH(g),在一体积固定的密闭容器中投入一定量的CO和H2气体进行上述反应。下列叙述中能说明上述反应达到平衡状态的是______ 。
A.反应中CO与CH3OH的物质的量之比为1:1
B.混合气体的压强不随时间的变化而变化
C.单位时间内每消耗1 mol CO,同时生成1 mol CH3OH
D.CH3OH的质量分数在混合气体中保持不变
E.混合气体的密度保持不变
(1)已知25℃,1.01×105Pa时,8.0g CH4完全燃烧生成二氧化碳气体和液态水放出444.8kJ热量。写出该反应的热化学反应方程式:
(2)为倡导“节能减排”和“低碳经济”,降低大气中CO2的含量及有效地开发利用CO2,工业上可以用CO2来生产燃料甲醇。在体积为2L的密闭容器中,充入lmol CO2和3mol H2,一定条件下发生反应:CO2(g) + 3H2(g)
 CH3OH(g) + H2O(g)。经测得CO2和CH3OH(g)的物质的量随时间变化如图所示。
CH3OH(g) + H2O(g)。经测得CO2和CH3OH(g)的物质的量随时间变化如图所示。
①从反应开始到平衡,CO2的平均反应速率v(CO2)=
②达到平衡时,H2的转化率为
③该反应的平衡常数K=
④下列措施不能提高反应速率的是
A.升高温度 B.加入催化剂 C.增大压强 D.及时分离出CH3OH
(3)工业上也用CO和H2为原料制备CH3OH,反应方程式为:CO(g) + 2H2(g)
 CH3OH(g),在一体积固定的密闭容器中投入一定量的CO和H2气体进行上述反应。下列叙述中能说明上述反应达到平衡状态的是
CH3OH(g),在一体积固定的密闭容器中投入一定量的CO和H2气体进行上述反应。下列叙述中能说明上述反应达到平衡状态的是A.反应中CO与CH3OH的物质的量之比为1:1
B.混合气体的压强不随时间的变化而变化
C.单位时间内每消耗1 mol CO,同时生成1 mol CH3OH
D.CH3OH的质量分数在混合气体中保持不变
E.混合气体的密度保持不变
您最近一年使用:0次
2018-07-24更新
|
326次组卷
|
4卷引用:【全国市级联考】江苏省无锡市普通高中2017-2018学年高一下学期期末考试化学试题
【全国市级联考】江苏省无锡市普通高中2017-2018学年高一下学期期末考试化学试题【全国百强校】内蒙古集宁一中(西校区)2017-2018学年高一下学期期末考试化学试题(已下线)【新东方】高中化学140(已下线)2022年浙江1月高考真题变式题(26-31)
解题方法
6 . I.研究化学反应中的能量变化可以为提高工业生产效率提供指导性的理论依据。请结合所学化学反应原理相关知识回答下列问题:
(1)计算化学反应中的能量变化有多种途径。通过化学键的键能计算。已知:
计算可得: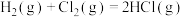

_______  。
。
(2)通过盖斯定律计算。已知下列反应的反应热为:
①CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) ΔH=−870.3kJ∙mol−1
②C(s)+O2(g)=CO2(g) ΔH=−393.5kJ∙mol−1
③H2(g)+ O2(g)=H2O(l) ΔH=−285.8kJ∙mol−1。
O2(g)=H2O(l) ΔH=−285.8kJ∙mol−1。
试计算下列反应的反应热:2C(s)+2H2(g)+O2(g)=CH3COOH(l) ΔH=_______  。
。
Ⅱ.某温度时,在一个容积为 的密闭容器中,
的密闭容器中,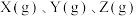 三种物质的物质的量随时间的变化曲线如图所示。根据图中数据,填写下列空白。
三种物质的物质的量随时间的变化曲线如图所示。根据图中数据,填写下列空白。

(3)该反应的化学方程式为_______ 。
(4)反应开始至 ,气体
,气体 的平均反应速率
的平均反应速率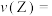
_______ mol∙L-1.min-1。
(5)反应开始至 ,气体X的转化率
,气体X的转化率_______ 。
Ⅲ.现有反应aA(g)+bB(g)⇌pC(g),达到平衡后,当升高温度时,B的浓度减小;当减小压强时,混合体系中C的质量分数也减小,则:
(6)该反应是_______ 热反应,且a+b_______ p(填“>”“<”或“=”)。
(7)减压时,A的质量分数_______ (填“增大”“减小”或“不变”,下同),正反应速率_______ 。
(8)若降低温度,则平衡时,B、C的浓度之比c(B)/c(C)将_______ 。
(9)若B是有色物质,A、C均为无色物质,则加入C(体积不变)时混合物的颜色_______ (填“变浅”“变深”或“不变”)。
(1)计算化学反应中的能量变化有多种途径。通过化学键的键能计算。已知:
| 化学键 |  |  |  |
键能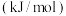 | 436 | 247 | 434 |
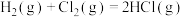

 。
。(2)通过盖斯定律计算。已知下列反应的反应热为:
①CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) ΔH=−870.3kJ∙mol−1
②C(s)+O2(g)=CO2(g) ΔH=−393.5kJ∙mol−1
③H2(g)+
 O2(g)=H2O(l) ΔH=−285.8kJ∙mol−1。
O2(g)=H2O(l) ΔH=−285.8kJ∙mol−1。试计算下列反应的反应热:2C(s)+2H2(g)+O2(g)=CH3COOH(l) ΔH=
 。
。Ⅱ.某温度时,在一个容积为
 的密闭容器中,
的密闭容器中,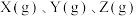 三种物质的物质的量随时间的变化曲线如图所示。根据图中数据,填写下列空白。
三种物质的物质的量随时间的变化曲线如图所示。根据图中数据,填写下列空白。
(3)该反应的化学方程式为
(4)反应开始至
 ,气体
,气体 的平均反应速率
的平均反应速率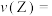
(5)反应开始至
 ,气体X的转化率
,气体X的转化率Ⅲ.现有反应aA(g)+bB(g)⇌pC(g),达到平衡后,当升高温度时,B的浓度减小;当减小压强时,混合体系中C的质量分数也减小,则:
(6)该反应是
(7)减压时,A的质量分数
(8)若降低温度,则平衡时,B、C的浓度之比c(B)/c(C)将
(9)若B是有色物质,A、C均为无色物质,则加入C(体积不变)时混合物的颜色
您最近一年使用:0次
7 . 回答下列问题
(1)下列各种说法或表述正确的是_________ 。(填序号)
①石油、煤、天然气、可燃冰、植物油都属于化石燃料。
②开发核能、太阳能等新能源,推广甲醇汽油,使用无磷洗涤剂都可直接降低碳排放
③利用太阳能在催化剂参与下分解水制氢是把光能转化为化学能的绿色化学方法
④淀粉、纤维素、蛋白质、油脂均属于天然有机高分子化合物
⑤CH3—CH=CH—C≡C—CH3分子中所有碳原子一定在同一平面上
⑥ 的二氯代物有12种
的二氯代物有12种
(2)有机物由碳、氢、氧、氮四种元素组成,其中含碳32%,氢6.7%,氧43%(均为质量分数)。该有机物的相对分子质量为75,其分子式为_________ 。若该有机物是蛋白质水解的产物,它与乙醇反应生成的酯可用于合成医药和农药,写出生成该酯的化学方程式__________________ 。
(3)甲醇是一种基础有机化工原料,广泛应用于有机合成、医药、农药、染料、高分子等化工生产领域。利用二氧化碳合成甲醇,能有效降低二氧化碳排放量,为甲醇合成提供了一条绿色合成的新途径。工业上利用该反应合成甲醇。已知:25℃,101KPa下:
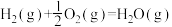 ΔH1=-242kJ·mol-1
ΔH1=-242kJ·mol-1
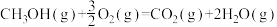 ΔH2=-676kJ·mol-1
ΔH2=-676kJ·mol-1
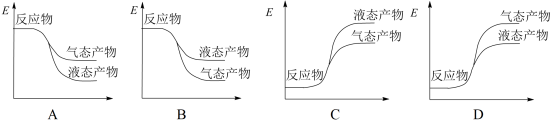
①写出CO2和H2生成气态甲醇等产物的热化学方程式__________________ 。
②下面表示合成甲醇的反应的能量变化示意图,其中正确的是_________ (填字母序号)。
③某兴趣小组对该反应进行了实验探究。在一定温度和催化剂条件下,将1molCO2和3molH2通入2L密闭容器中进行反应(此时容器内总压强为200kPa),反应物和产物的分压随时间的变化曲线如图所示。
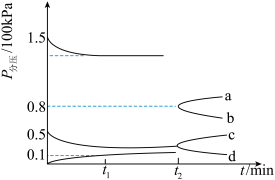
若保持容器体积不变,t1时反应达到平衡,测得H2的体积分数为 ,此时用H2压强表示0-t1时间内的反应速率v(H2)=
,此时用H2压强表示0-t1时间内的反应速率v(H2)=_________ kPa·min-1。
(1)下列各种说法或表述正确的是
①石油、煤、天然气、可燃冰、植物油都属于化石燃料。
②开发核能、太阳能等新能源,推广甲醇汽油,使用无磷洗涤剂都可直接降低碳排放
③利用太阳能在催化剂参与下分解水制氢是把光能转化为化学能的绿色化学方法
④淀粉、纤维素、蛋白质、油脂均属于天然有机高分子化合物
⑤CH3—CH=CH—C≡C—CH3分子中所有碳原子一定在同一平面上
⑥
 的二氯代物有12种
的二氯代物有12种(2)有机物由碳、氢、氧、氮四种元素组成,其中含碳32%,氢6.7%,氧43%(均为质量分数)。该有机物的相对分子质量为75,其分子式为
(3)甲醇是一种基础有机化工原料,广泛应用于有机合成、医药、农药、染料、高分子等化工生产领域。利用二氧化碳合成甲醇,能有效降低二氧化碳排放量,为甲醇合成提供了一条绿色合成的新途径。工业上利用该反应合成甲醇。已知:25℃,101KPa下:
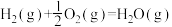 ΔH1=-242kJ·mol-1
ΔH1=-242kJ·mol-1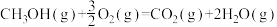 ΔH2=-676kJ·mol-1
ΔH2=-676kJ·mol-1①写出CO2和H2生成气态甲醇等产物的热化学方程式
②下面表示合成甲醇的反应的能量变化示意图,其中正确的是

③某兴趣小组对该反应进行了实验探究。在一定温度和催化剂条件下,将1molCO2和3molH2通入2L密闭容器中进行反应(此时容器内总压强为200kPa),反应物和产物的分压随时间的变化曲线如图所示。

若保持容器体积不变,t1时反应达到平衡,测得H2的体积分数为
 ,此时用H2压强表示0-t1时间内的反应速率v(H2)=
,此时用H2压强表示0-t1时间内的反应速率v(H2)=
您最近一年使用:0次
8 . 研究化学反应的原理,对掌握物质的应用有重要的意义。
Ⅰ.硅是太阳能电池的重要材料。“精炼硅”反应历程中的能量变化如下图所示:
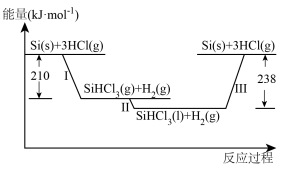
(1)工业上用 为原料制备粗硅。
为原料制备粗硅。
①反应的化学方程式为______ 。
② 的用途是
的用途是______ (任写一种)。
(2)反应Ⅲ生成2 mol Si(s)时,______ (填“吸收”或“放出”)______ 热量。
(3)在2L密闭容器中投入过量Si(s)和3 mol HCl(g)发生反应Ⅰ,经过t min反应达到平衡状态,测得容器中HCl的平衡浓度为0.6 mol·L 。
。
①反应开始到t min,用HCl浓度变化表示的平均反应速率为______ mol⋅L ⋅min
⋅min 。
。
②为加快反应速率,可采取的措施为______ (任写一种)。
③下列叙述不能说明反应Ⅰ一定达到平衡状态的是______ (填标号)。
a.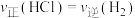 b.硅的质量保持不变
b.硅的质量保持不变
c.HCl的质量分数保持不变 d. 保持不变
保持不变
Ⅱ.用于检测酒驾的酸性燃料电池酒精检测仪工作原理如图所示。

(4)电极X为______ (填“正极”、“负极”)。
(5)电池工作时,质子通过交换膜______ (填“从左到右”、“从右到左”)迁移。
(6)正极的电极反应式为______ 。
Ⅰ.硅是太阳能电池的重要材料。“精炼硅”反应历程中的能量变化如下图所示:

(1)工业上用
 为原料制备粗硅。
为原料制备粗硅。①反应的化学方程式为
②
 的用途是
的用途是(2)反应Ⅲ生成2 mol Si(s)时,
(3)在2L密闭容器中投入过量Si(s)和3 mol HCl(g)发生反应Ⅰ,经过t min反应达到平衡状态,测得容器中HCl的平衡浓度为0.6 mol·L
 。
。①反应开始到t min,用HCl浓度变化表示的平均反应速率为
 ⋅min
⋅min 。
。②为加快反应速率,可采取的措施为
③下列叙述不能说明反应Ⅰ一定达到平衡状态的是
a.
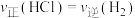 b.硅的质量保持不变
b.硅的质量保持不变c.HCl的质量分数保持不变 d.
 保持不变
保持不变Ⅱ.用于检测酒驾的酸性燃料电池酒精检测仪工作原理如图所示。

(4)电极X为
(5)电池工作时,质子通过交换膜
(6)正极的电极反应式为
您最近一年使用:0次
名校
解题方法
9 .  催化加氢制甲醇(
催化加氢制甲醇( )是实现碳达峰、碳中和的途径之一,其反应可表示为
)是实现碳达峰、碳中和的途径之一,其反应可表示为
 。
。
(1)该反应分两步进行,反应过程能量变化如图所示,所有物质均为气态。
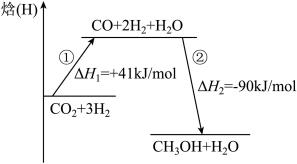
总反应
___________ 。第①步反应的热化学方程式为___________ 。
(2)用 和
和 合成甲醇有利于减少碳排放,其反应原理为
合成甲醇有利于减少碳排放,其反应原理为 。向甲、乙两个体积都为2.0L的恒容密闭容器中均充入
。向甲、乙两个体积都为2.0L的恒容密闭容器中均充入 和
和 的混合气体,分别在
的混合气体,分别在 、
、 温度下进行反应并达到平衡,反应过程中甲、乙两容器中
温度下进行反应并达到平衡,反应过程中甲、乙两容器中 随时间的变化情况如下表:
随时间的变化情况如下表:
①两容器的温度
___________  。
。
②甲容器中,0~6min内用 表示的平均反应速率为
表示的平均反应速率为___________ 。
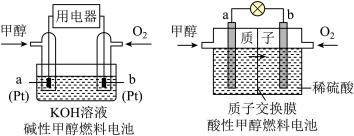
③甲容器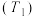 中反应达平衡时容器内气体压强与起始时容器内气体压强之比为
中反应达平衡时容器内气体压强与起始时容器内气体压强之比为___________ 。
④一定温度下,在一体积固定的密闭容器中投入一定量的 和
和 进行上述反应。下列叙述中能说明上述反应达到平衡状态的是
进行上述反应。下列叙述中能说明上述反应达到平衡状态的是___________ 。
A.反应中 与
与 的物质的量之比为
的物质的量之比为
B.混合气体的压强不随时间的变化而变化
C.单位时间内每消耗 ,同时生成
,同时生成
D. 的质量分数在混合气体中保持不变
的质量分数在混合气体中保持不变
E.混合气体的密度保持不变
(3)捕碳 技术在降低温室气体排放中具有重要的作用。目前
技术在降低温室气体排放中具有重要的作用。目前 和
和 已经被用作工业捕碳剂,它们与
已经被用作工业捕碳剂,它们与 可发生如下可逆反应:
可发生如下可逆反应:
反应Ⅰ:

反应Ⅱ:

反应Ⅲ:

则 与
与 、
、 之间的关系是:
之间的关系是:
___________ 。
(4)甲醇燃料电池具有很多优点。
①碱性甲醇燃料电池中,电极a上发生的电极反应式为___________ 。
②酸性甲醇燃料电池中,电极b上发生的电极反应式为___________ 。
 催化加氢制甲醇(
催化加氢制甲醇( )是实现碳达峰、碳中和的途径之一,其反应可表示为
)是实现碳达峰、碳中和的途径之一,其反应可表示为
 。
。(1)该反应分两步进行,反应过程能量变化如图所示,所有物质均为气态。

总反应

(2)用
 和
和 合成甲醇有利于减少碳排放,其反应原理为
合成甲醇有利于减少碳排放,其反应原理为 。向甲、乙两个体积都为2.0L的恒容密闭容器中均充入
。向甲、乙两个体积都为2.0L的恒容密闭容器中均充入 和
和 的混合气体,分别在
的混合气体,分别在 、
、 温度下进行反应并达到平衡,反应过程中甲、乙两容器中
温度下进行反应并达到平衡,反应过程中甲、乙两容器中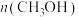 随时间的变化情况如下表:
随时间的变化情况如下表: | 0 | 3 | 6 | 12 | 24 | 36 |
甲容器 | 0 | 0.36 | 0.60 | 0.80 | 0.80 | 0.80 |
乙容器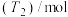 | 0 | 0.34 | 0.55 | 0.70 | 0.83 | 0.83 |

 。
。②甲容器中,0~6min内用
 表示的平均反应速率为
表示的平均反应速率为③甲容器
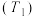 中反应达平衡时容器内气体压强与起始时容器内气体压强之比为
中反应达平衡时容器内气体压强与起始时容器内气体压强之比为④一定温度下,在一体积固定的密闭容器中投入一定量的
 和
和 进行上述反应。下列叙述中能说明上述反应达到平衡状态的是
进行上述反应。下列叙述中能说明上述反应达到平衡状态的是A.反应中
 与
与 的物质的量之比为
的物质的量之比为
B.混合气体的压强不随时间的变化而变化
C.单位时间内每消耗
 ,同时生成
,同时生成
D.
 的质量分数在混合气体中保持不变
的质量分数在混合气体中保持不变E.混合气体的密度保持不变
(3)捕碳
 技术在降低温室气体排放中具有重要的作用。目前
技术在降低温室气体排放中具有重要的作用。目前 和
和 已经被用作工业捕碳剂,它们与
已经被用作工业捕碳剂,它们与 可发生如下可逆反应:
可发生如下可逆反应:反应Ⅰ:


反应Ⅱ:


反应Ⅲ:


则
 与
与 、
、 之间的关系是:
之间的关系是:
(4)甲醇燃料电池具有很多优点。

①碱性甲醇燃料电池中,电极a上发生的电极反应式为
②酸性甲醇燃料电池中,电极b上发生的电极反应式为
您最近一年使用:0次
10 . 合成氨技术的发展开辟了人工固氮的重要途径,解决了亿万人口的生存问题。
(1)可用作合成氨的催化剂有很多,如Os、Fe、Pt、Mn、Co等金属及相应的合金或化合物。该反应在LaCoSi催化作用的化学吸附及初步表面反应历程如下:

注:方框内包含微粒种类及数目、微粒的相对总能量(括号里的数字单位:eV),TS表示过渡态,*表示吸附态。
①写出 参与化学吸附的反应方程式:
参与化学吸附的反应方程式:_______ 。
②以上历程须克服的最大能垒为_______ eV。
(2)某合成氨速率方程为 。
。
①根据表中数据,
_______ 。
②在合成氨过程中,需要不断分离出氨的原因为_______ (填字母)。
a.有利于平衡正向移动
b.防止催化剂中毒
c.提高正反应速率
(3)在一定条件下,向某反应容器中投入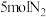 ,
,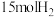 在不同温度下反应,平衡体系中氨的质量分数随压强变化曲线如图所示。
在不同温度下反应,平衡体系中氨的质量分数随压强变化曲线如图所示。

①温度 、
、 、
、 中,由低到高为
中,由低到高为_______ ,M点 的转化率为
的转化率为_______ 。
②1939年捷姆金和佩热夫推出氨合成反应在接近平衡时净速率方程式为 ,
, 、
、 分别为正反应和逆反应的速率常数;
分别为正反应和逆反应的速率常数; 、
、 、
、 代表各组分的分压(分压=总压×物质的量分数);a为常数,工业上以铁触媒为催化剂时,a=0.5。温度为
代表各组分的分压(分压=总压×物质的量分数);a为常数,工业上以铁触媒为催化剂时,a=0.5。温度为 时,由M点计算
时,由M点计算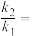
_______ 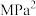 (计算结果保留一位小数)。
(计算结果保留一位小数)。
(1)可用作合成氨的催化剂有很多,如Os、Fe、Pt、Mn、Co等金属及相应的合金或化合物。该反应在LaCoSi催化作用的化学吸附及初步表面反应历程如下:

注:方框内包含微粒种类及数目、微粒的相对总能量(括号里的数字单位:eV),TS表示过渡态,*表示吸附态。
①写出
 参与化学吸附的反应方程式:
参与化学吸附的反应方程式:②以上历程须克服的最大能垒为
(2)某合成氨速率方程为
 。
。| 实验 | 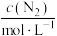 |  |  |  |
| 1 | m | n | p | q |
| 2 | 2m | n | p | 2q |
| 3 | m | n | 0.1p | 10q |
| 4 | m | 2n | p | 2.828q |
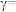
②在合成氨过程中,需要不断分离出氨的原因为
a.有利于平衡正向移动
b.防止催化剂中毒
c.提高正反应速率
(3)在一定条件下,向某反应容器中投入
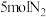 ,
,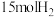 在不同温度下反应,平衡体系中氨的质量分数随压强变化曲线如图所示。
在不同温度下反应,平衡体系中氨的质量分数随压强变化曲线如图所示。
①温度
 、
、 、
、 中,由低到高为
中,由低到高为 的转化率为
的转化率为②1939年捷姆金和佩热夫推出氨合成反应在接近平衡时净速率方程式为
 ,
, 、
、 分别为正反应和逆反应的速率常数;
分别为正反应和逆反应的速率常数; 、
、 、
、 代表各组分的分压(分压=总压×物质的量分数);a为常数,工业上以铁触媒为催化剂时,a=0.5。温度为
代表各组分的分压(分压=总压×物质的量分数);a为常数,工业上以铁触媒为催化剂时,a=0.5。温度为 时,由M点计算
时,由M点计算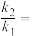
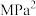 (计算结果保留一位小数)。
(计算结果保留一位小数)。
您最近一年使用:0次



