1 . 氨气中氢含量高,是一种优良的小分子储氢载体,且安全、易储运,可通过下面方法由氨气得到氢气。
方法:氨热分解法制氢气
反应2NH3(g) N2(g)+3H2(g) ΔH=+90.8 kJ·mol-1;
N2(g)+3H2(g) ΔH=+90.8 kJ·mol-1;
(1)已知该反应的ΔS=198.9 J·mol-1·K-1,在下列哪些温度下反应能自发进行?___________(填字母);
(2)某兴趣小组对该反应进行了实验探究。在一定温度和催化剂的条件下,将0.1mol NH3通入3L的密闭容器中进行反应(此时容器内总压为200kPa),各物质的分压随时间的变化曲线如图所示。

①若保持容器体积不变,t1时反应达到平衡,用H2的浓度变化表示0~t1时间内的反应速率v(H2)=___________ mol·L-1·min-1(用含t1的代数式表示);
②t2时将容器体积迅速缩小至原来的一半并保持不变,图中能正确表示压缩后N2分压变化趋势的曲线是___________ (用图中a、b、c、d表示),理由是___________ ;
③在该温度下,反应的标准平衡常数Kθ=___________ 。(已知:分压=总压×该组分物质的量分数,对于反应dD(g)+eE(g) gG(g)+hH(g),Kθ=
gG(g)+hH(g),Kθ= ,其中pθ=100 kPa,pG、pH、pD、pE为各组分的平衡分压)。
,其中pθ=100 kPa,pG、pH、pD、pE为各组分的平衡分压)。
方法:氨热分解法制氢气
反应2NH3(g)
 N2(g)+3H2(g) ΔH=+90.8 kJ·mol-1;
N2(g)+3H2(g) ΔH=+90.8 kJ·mol-1;(1)已知该反应的ΔS=198.9 J·mol-1·K-1,在下列哪些温度下反应能自发进行?___________(填字母);
| A.25 ℃ | B.125 ℃ | C.225 ℃ | D.325 ℃ |

①若保持容器体积不变,t1时反应达到平衡,用H2的浓度变化表示0~t1时间内的反应速率v(H2)=
②t2时将容器体积迅速缩小至原来的一半并保持不变,图中能正确表示压缩后N2分压变化趋势的曲线是
③在该温度下,反应的标准平衡常数Kθ=
 gG(g)+hH(g),Kθ=
gG(g)+hH(g),Kθ= ,其中pθ=100 kPa,pG、pH、pD、pE为各组分的平衡分压)。
,其中pθ=100 kPa,pG、pH、pD、pE为各组分的平衡分压)。
您最近一年使用:0次
解题方法
2 . 世界上许多国家规定未成年人不得饮用葡萄酒等酒精饮料,虽然葡萄酒中酒精含量不是很高,但是其中含有酒化酶,在人体内可催化葡萄糖发生反应:C6H12O6 2C2H5OH+2CO2。当C6H12O6减少的速率是0.5 mol·L−1·h−1时,C2H5OH增加的速率是
2C2H5OH+2CO2。当C6H12O6减少的速率是0.5 mol·L−1·h−1时,C2H5OH增加的速率是_______ mol·L−1·h−1。
 2C2H5OH+2CO2。当C6H12O6减少的速率是0.5 mol·L−1·h−1时,C2H5OH增加的速率是
2C2H5OH+2CO2。当C6H12O6减少的速率是0.5 mol·L−1·h−1时,C2H5OH增加的速率是
您最近一年使用:0次
2022-12-06更新
|
111次组卷
|
2卷引用:6.1.1化学反应速率(课中)-2019苏教版必修2课前课中课后
名校
解题方法
3 . 氨气中氢含量高,是一种优良的小分子储氢载体,且安全、易储运,可通过下面两种方法由氨气得到氢气。某兴趣小组对该反应进行了实验探究。在一定温度和催化剂的条件下,将0.1mol NH3通入3L的密闭容器中进行反应(此时容器内总压为200kPa),各物质的分压随时间的变化曲线如图所示。

(1)若保持容器容积不变,t1时反应达到平衡,用H2的浓度变化表示0~t1时间内的反应速率v(H2)=_______ mol·L-1·min-1(用含t1的代数式表示);
(2)t2时将容器容积迅速缩小至原来的一半并保持不变,图中能正确表示压缩后N2分压变化趋势的曲线是___________ (用图中a、b、c、d表示),理由是___________
(3)在该温度下,反应的标准平衡常数Kθ=____ 。[已知:分压=总压×该组分物质的量分数,对于反应dD(g)+eE(g)⇌gG(g)+hH(g) Kθ= ,其中pθ=100kPa,pG、pH、pD、pE为各组分的平衡分压]。
,其中pθ=100kPa,pG、pH、pD、pE为各组分的平衡分压]。

(1)若保持容器容积不变,t1时反应达到平衡,用H2的浓度变化表示0~t1时间内的反应速率v(H2)=
(2)t2时将容器容积迅速缩小至原来的一半并保持不变,图中能正确表示压缩后N2分压变化趋势的曲线是
(3)在该温度下,反应的标准平衡常数Kθ=
 ,其中pθ=100kPa,pG、pH、pD、pE为各组分的平衡分压]。
,其中pθ=100kPa,pG、pH、pD、pE为各组分的平衡分压]。
您最近一年使用:0次
名校
解题方法
4 . (1)一定温度下,在密闭容器内进行某化学反应,气体X、Y的物质的量随反应时间变化的曲线如图所示。

①写出该反应的化学方程式:__________ 。
②在 和
和 时正反应速率分别为
时正反应速率分别为 和
和 ,则二者大小关系为
,则二者大小关系为
_______  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
③在 、
、 和
和 三个时刻中,反应程度最大的是
三个时刻中,反应程度最大的是__________ (填“ ”“
”“ ”或“
”或“ ”)。
”)。
(2)一定温度下,将一定量的 和
和 充入固定容积的密闭容器中进行反应
充入固定容积的密闭容器中进行反应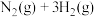
 。
。
①下列描述能说明该可逆反应达到化学平衡状态的有_________ (填序号)。
A 容器内的压强不变
B 容器内气体的密度不变
C 相同时间内有3molH—H键断裂,有6molN—H键形成
D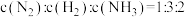
E 的质量分数不再改变
的质量分数不再改变
②若起始时向容器中充入 的N2和
的N2和 的
的 ,10min时测得容器内
,10min时测得容器内 的浓度为
的浓度为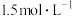 。10min内用
。10min内用 表示的反应速率为
表示的反应速率为__________ ;此时 的转化率为
的转化率为________ 。

①写出该反应的化学方程式:
②在
 和
和 时正反应速率分别为
时正反应速率分别为 和
和 ,则二者大小关系为
,则二者大小关系为
 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。③在
 、
、 和
和 三个时刻中,反应程度最大的是
三个时刻中,反应程度最大的是 ”“
”“ ”或“
”或“ ”)。
”)。(2)一定温度下,将一定量的
 和
和 充入固定容积的密闭容器中进行反应
充入固定容积的密闭容器中进行反应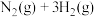
 。
。①下列描述能说明该可逆反应达到化学平衡状态的有
A 容器内的压强不变
B 容器内气体的密度不变
C 相同时间内有3molH—H键断裂,有6molN—H键形成
D
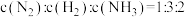
E
 的质量分数不再改变
的质量分数不再改变②若起始时向容器中充入
 的N2和
的N2和 的
的 ,10min时测得容器内
,10min时测得容器内 的浓度为
的浓度为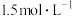 。10min内用
。10min内用 表示的反应速率为
表示的反应速率为 的转化率为
的转化率为
您最近一年使用:0次
2020-09-24更新
|
771次组卷
|
6卷引用:高一必修第二册(人教2019版)第六章 第二节 化学反应的速率与限度 课时2 化学反应的限度
高一必修第二册(人教2019版)第六章 第二节 化学反应的速率与限度 课时2 化学反应的限度安徽省淮北市第一中学2017-2018学年高一下学期期中考试化学试题(已下线)第14讲 化学反应的限度(word讲义)-【帮课堂】2021-2022学年高一化学同步精品讲义(人教版2019必修第二册)河南省焦作市武陟县第一中学东校区2021-2022学年高一下学期4月月考化学试题 安徽省滁州市定远县民族中学2021-2022学年高一下学期期中考试化学试题广东省广州大同中学2022-2023学年高一下学期期中考试化学试题
21-22高二上·四川成都·期末
解题方法
5 . 在容积为1L的密闭容器中发生如下反应: ,开始时A为2mol、B为3mol,5min时测得C为1.5mol,用D表示的平均反应速率为0.1
,开始时A为2mol、B为3mol,5min时测得C为1.5mol,用D表示的平均反应速率为0.1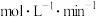 。求:
。求:
(1)5min时B的物质的量浓度为___________ 。
(2)5min内A的平均反应速率v(A)=___________ 。
(3)x的值为___________ ,5min时容器中压强与起始压强之比为___________ 。
(4)若5min时该反应达到平衡,则平衡常数K=___________ (计算结果保留两位有效数字)。
(5)下列可作为该反应达到平衡状态的标志的是___________(填正确答案标号)。
 ,开始时A为2mol、B为3mol,5min时测得C为1.5mol,用D表示的平均反应速率为0.1
,开始时A为2mol、B为3mol,5min时测得C为1.5mol,用D表示的平均反应速率为0.1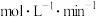 。求:
。求:(1)5min时B的物质的量浓度为
(2)5min内A的平均反应速率v(A)=
(3)x的值为
(4)若5min时该反应达到平衡,则平衡常数K=
(5)下列可作为该反应达到平衡状态的标志的是___________(填正确答案标号)。
| A.压强不再改变 |
| B.C的百分含量保持不变 |
| C.A的消耗速率与B的消耗速率之比为1:2 |
| D.气体密度不再变化 |
您最近一年使用:0次
20-21高一下·浙江·阶段练习
解题方法
6 . 为测定空气中SO2的含量,某课外小组将空气样品通入到密闭容器中的200mL0.100mol·L-1酸性高锰酸钾溶液,经过b min溶液恰好褪色,已知SO2与该溶液反应的离子方程式为:5SO2 + 2MnO + 2H2O=2Mn2+ + 4H+ + 5SO
+ 2H2O=2Mn2+ + 4H+ + 5SO
(1)用KMnO4来表示该反应速率,v(KMnO4)=___________ 。
(2)若通入的空气为aL,则该空气中SO2的含量为:___________ g/L
 + 2H2O=2Mn2+ + 4H+ + 5SO
+ 2H2O=2Mn2+ + 4H+ + 5SO
(1)用KMnO4来表示该反应速率,v(KMnO4)=
(2)若通入的空气为aL,则该空气中SO2的含量为:
您最近一年使用:0次
21-22高二上·福建厦门·期中
名校
解题方法
7 . 回答下列问题:
(1)汽车尾气里含有的 NO 气体是由内燃机燃烧造成高温而引起氮气和氧气反应所产生的:N2(g)+O2(g) 2NO(g) ΔH>0,请回答:
2NO(g) ΔH>0,请回答:
①某温度下,向2 L的密闭容器中充入N2和O2各1 mol,5 min后O2的物质的量为0.5 mol,则N2的反应速率为___________ 。
②假定该反应在恒容条件下进行,判断该反应达到平衡的标志是___________ 。
A.消耗 1 mol N2的同时生成 1 mol O2 B.混合气体的密度不变
C.混合气体的平均相对分子质量不变 D.2v正(N2)=v逆(NO)
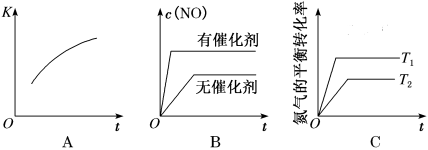
③将N2、O2的混合气体充入恒温恒容密闭容器中,如图中变化趋势正确的是___________ (填字母)。
(2)NH 硝化过程发生反应2NH
硝化过程发生反应2NH +3O2
+3O2 2HNO3+2H2O+2H+,恒温时在亚硝酸菌的作用下发生该反应。
2HNO3+2H2O+2H+,恒温时在亚硝酸菌的作用下发生该反应。
①实验测得在其它条件一定时,NH 硝化反应的速率随温度变化曲线如下图A所示,温度高于35℃时反应速率迅速下降的原因可能是
硝化反应的速率随温度变化曲线如下图A所示,温度高于35℃时反应速率迅速下降的原因可能是___________ 。

②亚硝酸盐含量过高对人和动植物都会造成一定的危害,因此要对亚硝酸盐含量过高的废水进行处理。处理方法之一是用NaClO将亚硝酸盐氧化为硝酸盐,其反应为ClO-+NO =NO
=NO +Cl-。25 ℃和35 ℃下,分别向NO
+Cl-。25 ℃和35 ℃下,分别向NO 初始浓度为5×10-3 mol/L的溶液中按不同的投料比
初始浓度为5×10-3 mol/L的溶液中按不同的投料比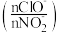 加入次氯酸钠固体(忽略溶液体积的变化),平衡时NO
加入次氯酸钠固体(忽略溶液体积的变化),平衡时NO 的去除率和温度、投料比的关系如上图B所示,a、b、c、d四点ClO-的转化率由小到大的顺序是
的去除率和温度、投料比的关系如上图B所示,a、b、c、d四点ClO-的转化率由小到大的顺序是___________ ,35 ℃时该反应的平衡常数K=___________
(3)下图是一种染料敏化太阳能电池示意图,电池的一个电极由吸附光敏染料(D)的TiO2,纳米晶体涂敷在导电玻璃上构成,另一电极由Pt-导电玻璃构成,工作原理为:
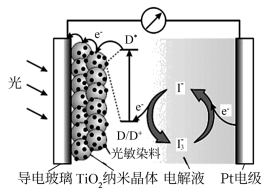
i.TiO2/D TiO2/D*(激发态)
TiO2/D*(激发态)
ii.TiO2/D*→TiO2/D+ + e-
iii.还原剂A+D+→D+氧化产物B
iv.还原剂A再生
回答下列问题:
①Pt电极是该电池的___________ 极(填“正”或“负”)。
②结合图示写出iii反应的离子方程式(其中染料分子用D表示)___________ 。
③电池工作过程中,导带中的e-会与D+发生复合,该反应的速率为vˊ,步骤iii的速率为v,若该电池持续稳定工作,则v___________ vˊ(填“>”或“<”)。
④导电玻璃材料的选择非常重要,你认为该材料应具备哪些性能(回答一条即可)___________ 。
(1)汽车尾气里含有的 NO 气体是由内燃机燃烧造成高温而引起氮气和氧气反应所产生的:N2(g)+O2(g)
 2NO(g) ΔH>0,请回答:
2NO(g) ΔH>0,请回答:①某温度下,向2 L的密闭容器中充入N2和O2各1 mol,5 min后O2的物质的量为0.5 mol,则N2的反应速率为
②假定该反应在恒容条件下进行,判断该反应达到平衡的标志是
A.消耗 1 mol N2的同时生成 1 mol O2 B.混合气体的密度不变
C.混合气体的平均相对分子质量不变 D.2v正(N2)=v逆(NO)
③将N2、O2的混合气体充入恒温恒容密闭容器中,如图中变化趋势正确的是

(2)NH
 硝化过程发生反应2NH
硝化过程发生反应2NH +3O2
+3O2 2HNO3+2H2O+2H+,恒温时在亚硝酸菌的作用下发生该反应。
2HNO3+2H2O+2H+,恒温时在亚硝酸菌的作用下发生该反应。①实验测得在其它条件一定时,NH
 硝化反应的速率随温度变化曲线如下图A所示,温度高于35℃时反应速率迅速下降的原因可能是
硝化反应的速率随温度变化曲线如下图A所示,温度高于35℃时反应速率迅速下降的原因可能是
②亚硝酸盐含量过高对人和动植物都会造成一定的危害,因此要对亚硝酸盐含量过高的废水进行处理。处理方法之一是用NaClO将亚硝酸盐氧化为硝酸盐,其反应为ClO-+NO
 =NO
=NO +Cl-。25 ℃和35 ℃下,分别向NO
+Cl-。25 ℃和35 ℃下,分别向NO 初始浓度为5×10-3 mol/L的溶液中按不同的投料比
初始浓度为5×10-3 mol/L的溶液中按不同的投料比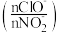 加入次氯酸钠固体(忽略溶液体积的变化),平衡时NO
加入次氯酸钠固体(忽略溶液体积的变化),平衡时NO 的去除率和温度、投料比的关系如上图B所示,a、b、c、d四点ClO-的转化率由小到大的顺序是
的去除率和温度、投料比的关系如上图B所示,a、b、c、d四点ClO-的转化率由小到大的顺序是(3)下图是一种染料敏化太阳能电池示意图,电池的一个电极由吸附光敏染料(D)的TiO2,纳米晶体涂敷在导电玻璃上构成,另一电极由Pt-导电玻璃构成,工作原理为:

i.TiO2/D
 TiO2/D*(激发态)
TiO2/D*(激发态)ii.TiO2/D*→TiO2/D+ + e-
iii.还原剂A+D+→D+氧化产物B
iv.还原剂A再生
回答下列问题:
①Pt电极是该电池的
②结合图示写出iii反应的离子方程式(其中染料分子用D表示)
③电池工作过程中,导带中的e-会与D+发生复合,该反应的速率为vˊ,步骤iii的速率为v,若该电池持续稳定工作,则v
④导电玻璃材料的选择非常重要,你认为该材料应具备哪些性能(回答一条即可)
您最近一年使用:0次
8 . 温室气体的利用是当前环境和能源领域的研究热点。
I.CH4与CO2重整可以同时利用两种温室气体,其工艺过程中涉及如下反应:
反应①CH4(g) + CO2(g)⇌2CO(g)+2H2 (g) ΔH1
反应②CO2 (g)+ H2 (g)⇌CO(g) + H2O(g) ΔH2= +41.2 kJ·mol-1
反应③CH4 (g)+ O2(g)⇌CO(g) + 2H2(g) ΔH3 = -35.6 kJ·mol-1
O2(g)⇌CO(g) + 2H2(g) ΔH3 = -35.6 kJ·mol-1
(1)已知: O 2(g)+H2(g)= H2O(g) ΔH = -241.8 kJ·mol-1,则ΔH1 =
O 2(g)+H2(g)= H2O(g) ΔH = -241.8 kJ·mol-1,则ΔH1 =______ kJ·mol-1。
(2)一定条件下,向体积为VL的密闭容器中通入CH4、CO2各1.0 mol及少量O2,测得不同温度下反应平衡时各产物产量如图所示。
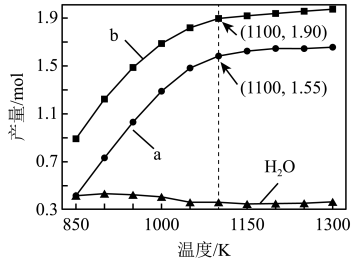
①图中a和b分别代表产物______ 和______ ,当温度高于900 K, H2O的含量随温度升高而下降的主要原因是______ 。
②1100 K时,CH4与CO2的转化率分别为95%和90%,反应①的平衡常数K=______ ( 写出计算式)。
II.Ni-CeO2催化CO2加H2形成CH4的反应历程如图1所示(吸附在催化剂表面的物种用*标注),含碳产物中CH4的物质的量百分数(Y)及CO2的转化率随温度的变化如图2所示。

(3)下列对CO2甲烷化反应体系的说法合理的有______ 。
A.含碳副产物的产率均低于CH4
B.存在反应CO2+4H2⇌CH4 + 2H2O
C.存在副反应CO2+ H2⇌CO+ H2O
D. CO2 转化为CH4的过程中发生了能量转化
E.温度高于260℃后,升高温度,甲烷产率几乎不变
(4) CO2甲烷化的过程中,保持CO2与H2的体积比为1:4,反应气的总流量控制在40 mL·min-1,320 ℃时测得CO2转化率为80%,则CO2反应速率为______ mL·min-1。
I.CH4与CO2重整可以同时利用两种温室气体,其工艺过程中涉及如下反应:
反应①CH4(g) + CO2(g)⇌2CO(g)+2H2 (g) ΔH1
反应②CO2 (g)+ H2 (g)⇌CO(g) + H2O(g) ΔH2= +41.2 kJ·mol-1
反应③CH4 (g)+
 O2(g)⇌CO(g) + 2H2(g) ΔH3 = -35.6 kJ·mol-1
O2(g)⇌CO(g) + 2H2(g) ΔH3 = -35.6 kJ·mol-1(1)已知:
 O 2(g)+H2(g)= H2O(g) ΔH = -241.8 kJ·mol-1,则ΔH1 =
O 2(g)+H2(g)= H2O(g) ΔH = -241.8 kJ·mol-1,则ΔH1 =(2)一定条件下,向体积为VL的密闭容器中通入CH4、CO2各1.0 mol及少量O2,测得不同温度下反应平衡时各产物产量如图所示。

①图中a和b分别代表产物
②1100 K时,CH4与CO2的转化率分别为95%和90%,反应①的平衡常数K=
II.Ni-CeO2催化CO2加H2形成CH4的反应历程如图1所示(吸附在催化剂表面的物种用*标注),含碳产物中CH4的物质的量百分数(Y)及CO2的转化率随温度的变化如图2所示。

(3)下列对CO2甲烷化反应体系的说法合理的有
A.含碳副产物的产率均低于CH4
B.存在反应CO2+4H2⇌CH4 + 2H2O
C.存在副反应CO2+ H2⇌CO+ H2O
D. CO2 转化为CH4的过程中发生了能量转化
E.温度高于260℃后,升高温度,甲烷产率几乎不变
(4) CO2甲烷化的过程中,保持CO2与H2的体积比为1:4,反应气的总流量控制在40 mL·min-1,320 ℃时测得CO2转化率为80%,则CO2反应速率为
您最近一年使用:0次
2021-01-25更新
|
2443次组卷
|
9卷引用:选择性必修1(SJ)专题2专项拓展训练? 化学平衡图象分析
选择性必修1(SJ)专题2专项拓展训练? 化学平衡图象分析2.3.3化学平衡中的图像问题 课后广东省2021年普通高中学业水平选择考适应性测试化学试题(已下线)大题06 化学反应原理综合题(一)-【考前抓大题】备战2021年高考化学(全国通用)(已下线)解密08 化学反应与能量(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)解密08 化学反应与能量(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)考点18 化学平衡状态 化学平衡移动-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点18 化学平衡状态 化学平衡移动-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)考点22 化学平衡状态与化学平衡移动-备战2023年高考化学一轮复习考点帮(全国通用)
名校
9 . Ⅰ.(1)反应 常用于精盐中碘含量测定。某同学利用该反应探究浓度对反应速率的影响。实验时均加入1mL淀粉溶液作指示剂,若不经计算,直接通过褪色时间的长短判断浓度与反应速率的关系,下列试剂中应选择
常用于精盐中碘含量测定。某同学利用该反应探究浓度对反应速率的影响。实验时均加入1mL淀粉溶液作指示剂,若不经计算,直接通过褪色时间的长短判断浓度与反应速率的关系,下列试剂中应选择_________ (填序号)。
①1mL 的碘水 ②1mL
的碘水 ②1mL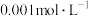 的碘水
的碘水
③4mL 的
的 溶液 ④4mL
溶液 ④4mL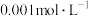 的
的 溶液
溶液
(2)若某同学选取①③进行实验,测得褪色时间为4s,计算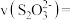
_________ 。
Ⅱ.一定条件下,将 与
与 以体积比为1:2置于密闭容器中发生反应
以体积比为1:2置于密闭容器中发生反应
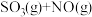 ,下列能说明反应达到平衡状态的是
,下列能说明反应达到平衡状态的是_____ (填序号)。
a.体系压强保持不变
b.混合气体颜色保持不变
c. 和
和 的物质的量之比保持不变
的物质的量之比保持不变
d.每消耗1mol 的同时生成1mol
的同时生成1mol
Ⅲ.已知
 。现将
。现将 和
和 的混合气体通入容积为2L的恒容密闭容器中,恒温条件下反应体系中物质浓度随时间的变化关系如图所示。
的混合气体通入容积为2L的恒容密闭容器中,恒温条件下反应体系中物质浓度随时间的变化关系如图所示。

(1)平衡时 的转化率为
的转化率为_________________ ;
(2)起始压强与平衡时压强之比为_________________ 。
 常用于精盐中碘含量测定。某同学利用该反应探究浓度对反应速率的影响。实验时均加入1mL淀粉溶液作指示剂,若不经计算,直接通过褪色时间的长短判断浓度与反应速率的关系,下列试剂中应选择
常用于精盐中碘含量测定。某同学利用该反应探究浓度对反应速率的影响。实验时均加入1mL淀粉溶液作指示剂,若不经计算,直接通过褪色时间的长短判断浓度与反应速率的关系,下列试剂中应选择①1mL
 的碘水 ②1mL
的碘水 ②1mL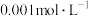 的碘水
的碘水③4mL
 的
的 溶液 ④4mL
溶液 ④4mL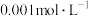 的
的 溶液
溶液(2)若某同学选取①③进行实验,测得褪色时间为4s,计算
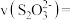
Ⅱ.一定条件下,将
 与
与 以体积比为1:2置于密闭容器中发生反应
以体积比为1:2置于密闭容器中发生反应
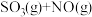 ,下列能说明反应达到平衡状态的是
,下列能说明反应达到平衡状态的是a.体系压强保持不变
b.混合气体颜色保持不变
c.
 和
和 的物质的量之比保持不变
的物质的量之比保持不变d.每消耗1mol
 的同时生成1mol
的同时生成1mol
Ⅲ.已知

 。现将
。现将 和
和 的混合气体通入容积为2L的恒容密闭容器中,恒温条件下反应体系中物质浓度随时间的变化关系如图所示。
的混合气体通入容积为2L的恒容密闭容器中,恒温条件下反应体系中物质浓度随时间的变化关系如图所示。
(1)平衡时
 的转化率为
的转化率为(2)起始压强与平衡时压强之比为
您最近一年使用:0次
2020-09-24更新
|
1311次组卷
|
6卷引用:高一必修第二册(人教2019版)第六章 第二节 化学反应的速率与限度 综合训练
21-22高二上·湖北省直辖县级单位·开学考试
解题方法
10 . 恒温恒容下,将2molA气体和2molB气体通入体积为2L的密闭容器中发生如下反应:2A(g)+B(g) xC(g)+2D(s),2min时反应达到平衡状态,此时剩余1.2molB,并测得C的浓度为1.2mol·L-1。
xC(g)+2D(s),2min时反应达到平衡状态,此时剩余1.2molB,并测得C的浓度为1.2mol·L-1。
(1)从开始反应至达到平衡状态,生成C的平均反应速率为___ 。
(2)x=__ 。
(3)下列各项可作为该反应达到平衡状态的标志的是__ 。
A.压强不再变化
B.气体密度不再变化
C.A的消耗速率与B的消耗速率之比为2∶1
D.A的百分含量保持不变
 xC(g)+2D(s),2min时反应达到平衡状态,此时剩余1.2molB,并测得C的浓度为1.2mol·L-1。
xC(g)+2D(s),2min时反应达到平衡状态,此时剩余1.2molB,并测得C的浓度为1.2mol·L-1。(1)从开始反应至达到平衡状态,生成C的平均反应速率为
(2)x=
(3)下列各项可作为该反应达到平衡状态的标志的是
A.压强不再变化
B.气体密度不再变化
C.A的消耗速率与B的消耗速率之比为2∶1
D.A的百分含量保持不变
您最近一年使用:0次
2021-04-20更新
|
1129次组卷
|
3卷引用:2.2.1 化学平衡状态(素养提优B练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)
(已下线)2.2.1 化学平衡状态(素养提优B练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)湖北i省华中师范大学潜江附属中学2020-2021学年高二上学期入学考试化学试题河南省济源市第五中学2020-2021学年高二下学期6月月考化学试题



