解题方法
1 . 根据化学反应与能量情景综合应用。
(1)一定条件下,将等物质的量的A和B,混合于2L的密闭容器中,发生如下反应:3A(g)+B(g)⇌mC(g)+2D(g),经过5min后,反应达到平衡。此时测得,D的浓度为0.5mol/L,c(A)∶c(B)=1∶3,C的反应速率是0.1mol·L-1·min-1。根据已知条件填空:
①m的值为___________ 。
②A在5min末的浓度___________ 。
(2)①已知:NO2(g)+SO2(g)⇌SO3(g)+NO(g)。现将体积比为1:2的NO2和SO2的混合气体置于恒温恒容的密闭容器中发生上述反应,下列能说明反应达到平衡状态的是___________ (填序号)
a.混合气体总物质的量保持不变b.混合气体密度保持不变
c.NO2(g)和SO2(g)的体积比保持不变
d.每消耗1molSO2,同时消耗0.5molSO3(g)
e.混合气体的平均相对分子质量保持不变
f.NO2的转化率保持不变
②在一绝热(不与外界发生热交换)的恒容容器中,发生反应:2A(g)+B(s)⇌C(g)+D(g),下列描述中能表明反应已达到平衡状态的有___________ (填序号)
①容器内温度不变
②混合气体的密度不变
③混合气体的压强不变
④混合气体的平均相对分子质量不变
⑤C(g)的物质的量浓度不变
⑥容器内A、C、D三种气体的浓度之比为2:1:1
⑦某时刻v(A)=2v(C)且不等于零
⑧单位时间内生成nmolD,同时生成2nmolA
(3)在一定容密闭容器中,保持一定的温度,在一定条件下进行以下反应:A(g)+2B(g)⇌3C(g),已知加入1molA和3molB,达到平衡后,生成amolC。在相同的实验条件下,若在同一容器中改为加入2molA和8molB,若要求平衡后C在反应混合物中的百分含量不变,则还应加入C___________ mol。
(4)现有反应mA(g)+nB(g)⇌pC(g),达到平衡后,当升高温度时,B的转化率变大;当增大压强时,混合体系中C的质量分数增大,则:
①若B是有色物质,A、C均无色,则加入C(容积不变)时混合物颜色___________ (填变深、变浅或不变,下同)。
②若维持容器内压强不变,充入Ne时,混合物的颜色___________ 。
(5)NH3和NO都是有毒气体,但在催化剂条件下,它们可通过反应得到对环境无害的N2和H2O:4NH3(g)+6NO(g)⇌5N2(g)+6H2O(g) ΔH
已知几种化学键的键能数据如表:
根据键能数据估算上述反应中反应热数值为___________ kJ。
(6)CO与H2反应还可制备CH3OH,CH3OH可作为燃料使用,用CH3OH和O2组合形成的质子交换膜燃料电池的结构示意图如下:

则c电极的反应方程式为___________ 。若线路中转移2mol电子,则上述CH3OH燃料电池,消耗的O2在标准状况下的体积为___________ L。
(7))2023年12月丰城顺利通过了创文明城的验收,文明驾驶就是其中的一条。一种基于碱性燃料电池原理设计的酒精检测仪,负极上的反应为___________ 。
(1)一定条件下,将等物质的量的A和B,混合于2L的密闭容器中,发生如下反应:3A(g)+B(g)⇌mC(g)+2D(g),经过5min后,反应达到平衡。此时测得,D的浓度为0.5mol/L,c(A)∶c(B)=1∶3,C的反应速率是0.1mol·L-1·min-1。根据已知条件填空:
①m的值为
②A在5min末的浓度
(2)①已知:NO2(g)+SO2(g)⇌SO3(g)+NO(g)。现将体积比为1:2的NO2和SO2的混合气体置于恒温恒容的密闭容器中发生上述反应,下列能说明反应达到平衡状态的是
a.混合气体总物质的量保持不变b.混合气体密度保持不变
c.NO2(g)和SO2(g)的体积比保持不变
d.每消耗1molSO2,同时消耗0.5molSO3(g)
e.混合气体的平均相对分子质量保持不变
f.NO2的转化率保持不变
②在一绝热(不与外界发生热交换)的恒容容器中,发生反应:2A(g)+B(s)⇌C(g)+D(g),下列描述中能表明反应已达到平衡状态的有
①容器内温度不变
②混合气体的密度不变
③混合气体的压强不变
④混合气体的平均相对分子质量不变
⑤C(g)的物质的量浓度不变
⑥容器内A、C、D三种气体的浓度之比为2:1:1
⑦某时刻v(A)=2v(C)且不等于零
⑧单位时间内生成nmolD,同时生成2nmolA
(3)在一定容密闭容器中,保持一定的温度,在一定条件下进行以下反应:A(g)+2B(g)⇌3C(g),已知加入1molA和3molB,达到平衡后,生成amolC。在相同的实验条件下,若在同一容器中改为加入2molA和8molB,若要求平衡后C在反应混合物中的百分含量不变,则还应加入C
(4)现有反应mA(g)+nB(g)⇌pC(g),达到平衡后,当升高温度时,B的转化率变大;当增大压强时,混合体系中C的质量分数增大,则:
①若B是有色物质,A、C均无色,则加入C(容积不变)时混合物颜色
②若维持容器内压强不变,充入Ne时,混合物的颜色
(5)NH3和NO都是有毒气体,但在催化剂条件下,它们可通过反应得到对环境无害的N2和H2O:4NH3(g)+6NO(g)⇌5N2(g)+6H2O(g) ΔH
已知几种化学键的键能数据如表:
| 共价键 | N≡N | N-H | N≡O | H-O |
| 键能/kJ/mol | 946 | 391 | 607 | 464 |
(6)CO与H2反应还可制备CH3OH,CH3OH可作为燃料使用,用CH3OH和O2组合形成的质子交换膜燃料电池的结构示意图如下:

则c电极的反应方程式为
(7))2023年12月丰城顺利通过了创文明城的验收,文明驾驶就是其中的一条。一种基于碱性燃料电池原理设计的酒精检测仪,负极上的反应为
您最近一年使用:0次
2 . 纳米氧化锌具有颗粒微小,比表面积大,分散性好,疏松多孔等物理特性和极强的化学活性,目前已广泛用于橡胶、陶瓷、催化剂、涂料和磁性材料的辅助生产。以铜转炉烟灰为原料,采用浸取、均相沉淀、干燥煅烧等工艺制备纳米氧化锌的工艺方法过程简单,生产成本低。具体流程如下:
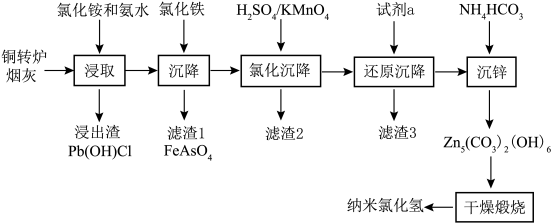
已知某铜转炉烟灰化学成分百分含量分析如下表:
铜转炉烟灰主要化学成分分析结果 %
以上金属元素在铜转炉烟灰中均以硫酸盐和氧化物形式存在,砷以砷酸盐形式存在。
流程中涉及离子的氢氧化物溶度积常数如下表:
请回答下列问题:
(1)“浸取”温度应选择40℃左右为宜。温度高于40℃ ,浸出率随温度升高而降低的原因可能是___________ ;
(2)若“浸取”所得滤液中锌元素以[Zn(NH3)4]2+形式存在,则浸取时ZnO发生反应的离子方程式为___________ 。
(3)在“沉降”过程中,FeCl3做沉淀剂可起到两点作用,一是与砷酸根结合生成FeAsO4沉淀,二是___________ ,缩短沉降时间;
(4)用酸性高锰酸钾溶液“氧化沉降”时,需调整溶液pH=5 ,使还原产物为MnO2,滤渣2主要成分为___________ ;
(5)“还原沉降”选用的“试剂a”为___________ (填化学式);
(6)“沉锌”反应的离子方程式为___________ ,整个流程中可以循环利用的副产品是___________ (填化学式);
(7)若想通过“干燥煅烧”得到更多活性较高的纳米氧化锌,应在“沉锌”时注意调整 和Zn2+的浓度,以保证最终沉淀物粒径在1um 以下,通过下表可判断,当Zn2+的浓度恒定在0.8 mol·L-1时,
和Zn2+的浓度,以保证最终沉淀物粒径在1um 以下,通过下表可判断,当Zn2+的浓度恒定在0.8 mol·L-1时,  的浓度为
的浓度为___________ 沉淀物的粒径最佳。

已知某铜转炉烟灰化学成分百分含量分析如下表:
铜转炉烟灰主要化学成分分析结果 %
| Cu | Zn | Pb | Fe( Ⅱ) | As |
| 10.30 | 8.75 | 19.07 | 2.51 | 4.68 |
流程中涉及离子的氢氧化物溶度积常数如下表:
| 离子 | Cu2+ | Zn2+ | Fe2+ | Fe3+ |
| Ksp | 2.2× 10-20 | 6.7×10-17 | 8.0×10-16 | 4.0×10-38 |
(1)“浸取”温度应选择40℃左右为宜。温度高于40℃ ,浸出率随温度升高而降低的原因可能是
(2)若“浸取”所得滤液中锌元素以[Zn(NH3)4]2+形式存在,则浸取时ZnO发生反应的离子方程式为
(3)在“沉降”过程中,FeCl3做沉淀剂可起到两点作用,一是与砷酸根结合生成FeAsO4沉淀,二是
(4)用酸性高锰酸钾溶液“氧化沉降”时,需调整溶液pH=5 ,使还原产物为MnO2,滤渣2主要成分为
(5)“还原沉降”选用的“试剂a”为
(6)“沉锌”反应的离子方程式为
(7)若想通过“干燥煅烧”得到更多活性较高的纳米氧化锌,应在“沉锌”时注意调整
 和Zn2+的浓度,以保证最终沉淀物粒径在1um 以下,通过下表可判断,当Zn2+的浓度恒定在0.8 mol·L-1时,
和Zn2+的浓度,以保证最终沉淀物粒径在1um 以下,通过下表可判断,当Zn2+的浓度恒定在0.8 mol·L-1时,  的浓度为
的浓度为n( )/n(Zn2+) )/n(Zn2+) | 粒度分布质量分数1% | ||||
| 0.0-0.1um | 0.1~0.5um | 0.5~1.0um | 1.0~5.0um | 5.0um以上 | |
| 2 | 25.3 | 38.41 | 34.55 | 1.74 | 0.001 |
| 2.5 | 40.82 | 50.35 | 8.37 | 0.46 | 0.001 |
| 3 | 35.2 | 55.37 | 8.2 | 1.23 | 0.001 |
您最近一年使用:0次
2023-04-29更新
|
213次组卷
|
2卷引用:内蒙古呼和浩特市2023届高三下学期第二次质量数据监测理科综合化学试题
3 . 减少CO的排放和降低空气中CO含量都是实现碳达峰、碳中和的重要手段。
I.化学链燃烧(CLC)是利用载氧体将空气中的氧传输至燃料的新技术,与传统燃烧方式相比,避免了空气和燃料的直接接触,有利于高效捕集CO2,从而减少CO2的排放。基于CuO/Cu2O载体的甲烷化学链燃烧技术如图所示。

空气反应器与燃料反应器中发生的反应分别如下:
i.2Cu2O(s)+O2(g) 4CuO(s) ΔH1=-227kJ·mol-1
4CuO(s) ΔH1=-227kJ·mol-1
ii.8CuO(s)+CH4(g) 4Cu2O(s)+CO2(g)+2H2O(g) ΔH2=-348kJ·mol-1
4Cu2O(s)+CO2(g)+2H2O(g) ΔH2=-348kJ·mol-1
回答下列问题:
(1)反应iii.CH4(g)+2O2(g) CO2(g)+2H2O(g) ΔH3=
CO2(g)+2H2O(g) ΔH3=___________ 。
(2)氧的质量分数::载氧体I___________ (填>”“<”或“=”)载氧体Ⅱ。
II.催化还原CO2是降低空气中CO2含量的重要手段之一、研究表明,在催化剂存在下,CO2和H2可发生两个平行应分别生成CH3OH和CO。反应的热化学方程式如下:
iv.CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH4
CH3OH(g)+H2O(g) ΔH4
v.CO2(g)+H2(g) CO(g)+H2O(g) ΔH5
CO(g)+H2O(g) ΔH5
某实验兴趣小组在一定温度下,将0.1molCO2和0.3molH2充人容积为2L的恒容密闭容器中,4min后,反应达到平衡,此时测得反应前后的压强比为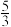 H2O(g)的物质的量分数为37.5%。回答下列问题:
H2O(g)的物质的量分数为37.5%。回答下列问题:
(3)对于反应iv,在___________ (填“高温”或“低温”)下有利于该反应自发进行。
(4)反应达平衡后:
①c(CO)=___________ mol·L,0~4min,v(CH3OH)=___________ mol·L-1.min-1。
②H2的转化率为___________ %(保留三位有效数字)。
③该温度下,反应iv的平衡常数K=___________ 。
④若再往该容器中充人0.45molH2和0.09molCO,对于反应V,此时V正___________ (填“>”“<”或“=”)V逆,判断的理由是___________ 。
I.化学链燃烧(CLC)是利用载氧体将空气中的氧传输至燃料的新技术,与传统燃烧方式相比,避免了空气和燃料的直接接触,有利于高效捕集CO2,从而减少CO2的排放。基于CuO/Cu2O载体的甲烷化学链燃烧技术如图所示。

空气反应器与燃料反应器中发生的反应分别如下:
i.2Cu2O(s)+O2(g)
 4CuO(s) ΔH1=-227kJ·mol-1
4CuO(s) ΔH1=-227kJ·mol-1ii.8CuO(s)+CH4(g)
 4Cu2O(s)+CO2(g)+2H2O(g) ΔH2=-348kJ·mol-1
4Cu2O(s)+CO2(g)+2H2O(g) ΔH2=-348kJ·mol-1回答下列问题:
(1)反应iii.CH4(g)+2O2(g)
 CO2(g)+2H2O(g) ΔH3=
CO2(g)+2H2O(g) ΔH3=(2)氧的质量分数::载氧体I
II.催化还原CO2是降低空气中CO2含量的重要手段之一、研究表明,在催化剂存在下,CO2和H2可发生两个平行应分别生成CH3OH和CO。反应的热化学方程式如下:
iv.CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH4
CH3OH(g)+H2O(g) ΔH4v.CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH5
CO(g)+H2O(g) ΔH5某实验兴趣小组在一定温度下,将0.1molCO2和0.3molH2充人容积为2L的恒容密闭容器中,4min后,反应达到平衡,此时测得反应前后的压强比为
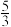 H2O(g)的物质的量分数为37.5%。回答下列问题:
H2O(g)的物质的量分数为37.5%。回答下列问题:(3)对于反应iv,在
(4)反应达平衡后:
①c(CO)=
②H2的转化率为
③该温度下,反应iv的平衡常数K=
④若再往该容器中充人0.45molH2和0.09molCO,对于反应V,此时V正
您最近一年使用:0次
名校
解题方法
4 . t℃时,将1mol气体A和1mol气体B充入容积为2L的恒容密闭容器中,发生反应: ,测得4min时体系中有0.4molB和
,测得4min时体系中有0.4molB和 C。请回答下列问题:
C。请回答下列问题:
(1)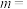
______ ,0~4min内用A(g)表示的平均反应速率为______  。
。
(2)下列表述能说明上述反应已经达到平衡状态的是______ (填字母)。
a.相同时间内,消耗A(g)和生成C(g)的物质的量之比为1:2
b.物质B(g)的质量分数不再发生变化
c.混合气体的平均相对分子质量不再发生变化
d.混合气体的密度不再发生变化
(3)某化学兴趣小组的同学为了研究上述反应的反应速率,将A(g)、B(g)在一定条件下反应,测得C(g)的反应速率随时间的变化如图所示。______ (填“放热”或“吸热”)反应,后测得速率为0的原因是______ 。
(4)已知:1molA(g)、B(g)、C(g)中的化学键全部断裂形成气态原子所需要的能量如下表所示。
上述反应在6min时达到平衡,此时测得A的物质的量浓度为 。
。
①A的平衡转化率为______ ( )。
)。
②根据表中数据计算出该反应达到平衡过程中的能量变化为______ kJ(用含x、y、z的代数式表示)。
 ,测得4min时体系中有0.4molB和
,测得4min时体系中有0.4molB和 C。请回答下列问题:
C。请回答下列问题:(1)
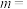
 。
。(2)下列表述能说明上述反应已经达到平衡状态的是
a.相同时间内,消耗A(g)和生成C(g)的物质的量之比为1:2
b.物质B(g)的质量分数不再发生变化
c.混合气体的平均相对分子质量不再发生变化
d.混合气体的密度不再发生变化
(3)某化学兴趣小组的同学为了研究上述反应的反应速率,将A(g)、B(g)在一定条件下反应,测得C(g)的反应速率随时间的变化如图所示。

(4)已知:1molA(g)、B(g)、C(g)中的化学键全部断裂形成气态原子所需要的能量如下表所示。
物质 | A | B | C |
能量/( | x | y | z |
 。
。①A的平衡转化率为
 )。
)。②根据表中数据计算出该反应达到平衡过程中的能量变化为
您最近一年使用:0次
5 . 研究 、
、 、CO等气体的无害化处理对治理大气污染、建设生态文明具有重要意义。已知:
、CO等气体的无害化处理对治理大气污染、建设生态文明具有重要意义。已知:
反应I.
 ;
;
反应Ⅱ.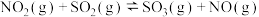
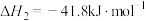 。
。
(1)则反应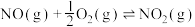

___________  ;该反应的平衡常数表达式为
;该反应的平衡常数表达式为___________ 。
(2)在某一恒容密闭容器中,通入一定量的 和
和 ,仅发生反应
,仅发生反应 :
:
①下列能说明该反应达到平衡状态的是___________ (填标号)。
A.当混合气体的密度不再随时间变化而改变时,该反应达到平衡
B.当混合气体的平均相对分子质量不再随时间变化而改变时,该反应达到平衡
C.当 不再随时间变化而改变时,该反应达到平衡
不再随时间变化而改变时,该反应达到平衡
D.当 的质量分数不再随时间变化而改变时,该反应达到平衡
的质量分数不再随时间变化而改变时,该反应达到平衡
②既能加快反应 的反应速率,又能提高
的反应速率,又能提高 的平衡转化率,可采取的措施有
的平衡转化率,可采取的措施有___________ (填标号)。
A.使用合适的催化剂 B.通入适量的
C.及时抽走部分NO D.升高温度
(3) 下,在2L的恒容密闭容器中,充入
下,在2L的恒容密闭容器中,充入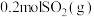 和
和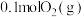 ,仅发生反应
,仅发生反应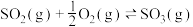 ,tmin时,该反应达到平衡,此时测得容器中混合气体的压强为起始时混合气体压强的80%:
,tmin时,该反应达到平衡,此时测得容器中混合气体的压强为起始时混合气体压强的80%:
①___________ (填“低温”、“高温”或“任意温度”)下,有利于该反应自发进行。
②保持其他条件不变,仅改变温度, ,仅发生该反应,反应达到平衡时,该反应的平衡常数
,仅发生该反应,反应达到平衡时,该反应的平衡常数 ,则
,则
___________ (填“>”或“<”) 。
。
③该反应达到平衡后,保持其他条件不变,仅再通入 、
、 和
和 ,则此时
,则此时
________ (填“>”、“<”或“=”) ,判断的理由为
,判断的理由为_________ 。
 、
、 、CO等气体的无害化处理对治理大气污染、建设生态文明具有重要意义。已知:
、CO等气体的无害化处理对治理大气污染、建设生态文明具有重要意义。已知:反应I.

 ;
;反应Ⅱ.
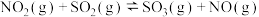
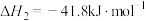 。
。(1)则反应
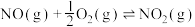

 ;该反应的平衡常数表达式为
;该反应的平衡常数表达式为(2)在某一恒容密闭容器中,通入一定量的
 和
和 ,仅发生反应
,仅发生反应 :
:①下列能说明该反应达到平衡状态的是
A.当混合气体的密度不再随时间变化而改变时,该反应达到平衡
B.当混合气体的平均相对分子质量不再随时间变化而改变时,该反应达到平衡
C.当
 不再随时间变化而改变时,该反应达到平衡
不再随时间变化而改变时,该反应达到平衡D.当
 的质量分数不再随时间变化而改变时,该反应达到平衡
的质量分数不再随时间变化而改变时,该反应达到平衡②既能加快反应
 的反应速率,又能提高
的反应速率,又能提高 的平衡转化率,可采取的措施有
的平衡转化率,可采取的措施有A.使用合适的催化剂 B.通入适量的

C.及时抽走部分NO D.升高温度
(3)
 下,在2L的恒容密闭容器中,充入
下,在2L的恒容密闭容器中,充入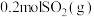 和
和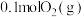 ,仅发生反应
,仅发生反应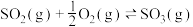 ,tmin时,该反应达到平衡,此时测得容器中混合气体的压强为起始时混合气体压强的80%:
,tmin时,该反应达到平衡,此时测得容器中混合气体的压强为起始时混合气体压强的80%:①
②保持其他条件不变,仅改变温度,
 ,仅发生该反应,反应达到平衡时,该反应的平衡常数
,仅发生该反应,反应达到平衡时,该反应的平衡常数 ,则
,则
 。
。③该反应达到平衡后,保持其他条件不变,仅再通入
 、
、 和
和 ,则此时
,则此时
 ,判断的理由为
,判断的理由为
您最近一年使用:0次
6 . 研究化学反应的原理,对掌握物质的应用有重要的意义。
Ⅰ.硅是太阳能电池的重要材料。“精炼硅”反应历程中的能量变化如下图所示:
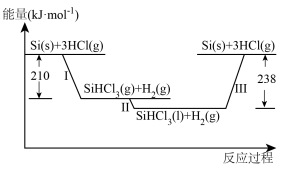
(1)工业上用 为原料制备粗硅。
为原料制备粗硅。
①反应的化学方程式为______ 。
② 的用途是
的用途是______ (任写一种)。
(2)反应Ⅲ生成2 mol Si(s)时,______ (填“吸收”或“放出”)______ 热量。
(3)在2L密闭容器中投入过量Si(s)和3 mol HCl(g)发生反应Ⅰ,经过t min反应达到平衡状态,测得容器中HCl的平衡浓度为0.6 mol·L 。
。
①反应开始到t min,用HCl浓度变化表示的平均反应速率为______ mol⋅L ⋅min
⋅min 。
。
②为加快反应速率,可采取的措施为______ (任写一种)。
③下列叙述不能说明反应Ⅰ一定达到平衡状态的是______ (填标号)。
a.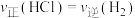 b.硅的质量保持不变
b.硅的质量保持不变
c.HCl的质量分数保持不变 d. 保持不变
保持不变
Ⅱ.用于检测酒驾的酸性燃料电池酒精检测仪工作原理如图所示。

(4)电极X为______ (填“正极”、“负极”)。
(5)电池工作时,质子通过交换膜______ (填“从左到右”、“从右到左”)迁移。
(6)正极的电极反应式为______ 。
Ⅰ.硅是太阳能电池的重要材料。“精炼硅”反应历程中的能量变化如下图所示:

(1)工业上用
 为原料制备粗硅。
为原料制备粗硅。①反应的化学方程式为
②
 的用途是
的用途是(2)反应Ⅲ生成2 mol Si(s)时,
(3)在2L密闭容器中投入过量Si(s)和3 mol HCl(g)发生反应Ⅰ,经过t min反应达到平衡状态,测得容器中HCl的平衡浓度为0.6 mol·L
 。
。①反应开始到t min,用HCl浓度变化表示的平均反应速率为
 ⋅min
⋅min 。
。②为加快反应速率,可采取的措施为
③下列叙述不能说明反应Ⅰ一定达到平衡状态的是
a.
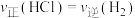 b.硅的质量保持不变
b.硅的质量保持不变c.HCl的质量分数保持不变 d.
 保持不变
保持不变Ⅱ.用于检测酒驾的酸性燃料电池酒精检测仪工作原理如图所示。

(4)电极X为
(5)电池工作时,质子通过交换膜
(6)正极的电极反应式为
您最近一年使用:0次
名校
解题方法
7 . 将CO2与H2反应转化为甲醇(CH3OH)是变废为宝的好方法,其原理为:CO2(g)+3H2(g) CH3OH(g)+H2O(g)。一定温度下,在2L的密闭容器中CO2转化为甲醇过程中浓度随时间的变化曲线如图所示(已知反应物和生成物在此条件下均为气体)。
CH3OH(g)+H2O(g)。一定温度下,在2L的密闭容器中CO2转化为甲醇过程中浓度随时间的变化曲线如图所示(已知反应物和生成物在此条件下均为气体)。

(1)在0~3min内用CO2表示该反应的速率是_____ 。(保留2位有效数字)。该反应达到最大限度时H2的转化率_____ ,此时CH3OH在平衡混合物中的体积分数为_____ (均用百分数表示,且保留3位有效数字)。
(2)10min后,反应处于化学平衡状态,下列说法中能作为该反应处于平衡状态的依据的是_____ 。
a.3v正(H2)=v逆(CO2)
b.混合气体的密度不再发生变化
c.混合气体的平均相对分子质量不再发生改变
d.体系的温度不再发生改变
e.混合气体的颜色不再发生改变
f.CO2与H2的物质的量之比不再发生改变
g.甲醇的质量分数不再发生改变
h.体系压强不再发生改变
(3)若上述反应在甲、乙、丙三个相同容器内同时进行,测得甲中v(CO2)=0.1mol•L-1•min-1,乙中v(H2)=0.2mol•L-1•min-1,丙中v(CH3OH)=0.3mol•L-1•s-1,则反应速率最快的是_____ 。
(4)甲醇(CH3OH)是一种有毒物质,常温下检测甲醇含量的测试仪工作原理示意图如图:
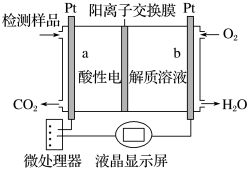
a电极发生的电极反应式为_____ 。
 CH3OH(g)+H2O(g)。一定温度下,在2L的密闭容器中CO2转化为甲醇过程中浓度随时间的变化曲线如图所示(已知反应物和生成物在此条件下均为气体)。
CH3OH(g)+H2O(g)。一定温度下,在2L的密闭容器中CO2转化为甲醇过程中浓度随时间的变化曲线如图所示(已知反应物和生成物在此条件下均为气体)。
(1)在0~3min内用CO2表示该反应的速率是
(2)10min后,反应处于化学平衡状态,下列说法中能作为该反应处于平衡状态的依据的是
a.3v正(H2)=v逆(CO2)
b.混合气体的密度不再发生变化
c.混合气体的平均相对分子质量不再发生改变
d.体系的温度不再发生改变
e.混合气体的颜色不再发生改变
f.CO2与H2的物质的量之比不再发生改变
g.甲醇的质量分数不再发生改变
h.体系压强不再发生改变
(3)若上述反应在甲、乙、丙三个相同容器内同时进行,测得甲中v(CO2)=0.1mol•L-1•min-1,乙中v(H2)=0.2mol•L-1•min-1,丙中v(CH3OH)=0.3mol•L-1•s-1,则反应速率最快的是
(4)甲醇(CH3OH)是一种有毒物质,常温下检测甲醇含量的测试仪工作原理示意图如图:

a电极发生的电极反应式为
您最近一年使用:0次
2023-05-06更新
|
247次组卷
|
2卷引用:湖北省巴东县第一高级中学2020-2021学年高一下学期第四次月考化学试题
8 . 回答下列问题
(1)下列各种说法或表述正确的是_________ 。(填序号)
①石油、煤、天然气、可燃冰、植物油都属于化石燃料。
②开发核能、太阳能等新能源,推广甲醇汽油,使用无磷洗涤剂都可直接降低碳排放
③利用太阳能在催化剂参与下分解水制氢是把光能转化为化学能的绿色化学方法
④淀粉、纤维素、蛋白质、油脂均属于天然有机高分子化合物
⑤CH3—CH=CH—C≡C—CH3分子中所有碳原子一定在同一平面上
⑥ 的二氯代物有12种
的二氯代物有12种
(2)有机物由碳、氢、氧、氮四种元素组成,其中含碳32%,氢6.7%,氧43%(均为质量分数)。该有机物的相对分子质量为75,其分子式为_________ 。若该有机物是蛋白质水解的产物,它与乙醇反应生成的酯可用于合成医药和农药,写出生成该酯的化学方程式__________________ 。
(3)甲醇是一种基础有机化工原料,广泛应用于有机合成、医药、农药、染料、高分子等化工生产领域。利用二氧化碳合成甲醇,能有效降低二氧化碳排放量,为甲醇合成提供了一条绿色合成的新途径。工业上利用该反应合成甲醇。已知:25℃,101KPa下:
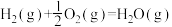 ΔH1=-242kJ·mol-1
ΔH1=-242kJ·mol-1
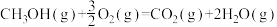 ΔH2=-676kJ·mol-1
ΔH2=-676kJ·mol-1
①写出CO2和H2生成气态甲醇等产物的热化学方程式__________________ 。
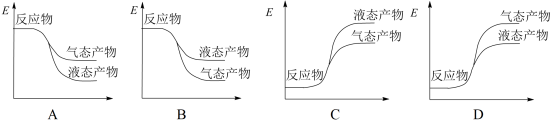
②下面表示合成甲醇的反应的能量变化示意图,其中正确的是_________ (填字母序号)。
③某兴趣小组对该反应进行了实验探究。在一定温度和催化剂条件下,将1molCO2和3molH2通入2L密闭容器中进行反应(此时容器内总压强为200kPa),反应物和产物的分压随时间的变化曲线如图所示。
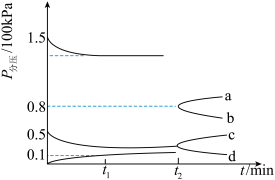
若保持容器体积不变,t1时反应达到平衡,测得H2的体积分数为 ,此时用H2压强表示0-t1时间内的反应速率v(H2)=
,此时用H2压强表示0-t1时间内的反应速率v(H2)=_________ kPa·min-1。
(1)下列各种说法或表述正确的是
①石油、煤、天然气、可燃冰、植物油都属于化石燃料。
②开发核能、太阳能等新能源,推广甲醇汽油,使用无磷洗涤剂都可直接降低碳排放
③利用太阳能在催化剂参与下分解水制氢是把光能转化为化学能的绿色化学方法
④淀粉、纤维素、蛋白质、油脂均属于天然有机高分子化合物
⑤CH3—CH=CH—C≡C—CH3分子中所有碳原子一定在同一平面上
⑥
 的二氯代物有12种
的二氯代物有12种(2)有机物由碳、氢、氧、氮四种元素组成,其中含碳32%,氢6.7%,氧43%(均为质量分数)。该有机物的相对分子质量为75,其分子式为
(3)甲醇是一种基础有机化工原料,广泛应用于有机合成、医药、农药、染料、高分子等化工生产领域。利用二氧化碳合成甲醇,能有效降低二氧化碳排放量,为甲醇合成提供了一条绿色合成的新途径。工业上利用该反应合成甲醇。已知:25℃,101KPa下:
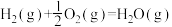 ΔH1=-242kJ·mol-1
ΔH1=-242kJ·mol-1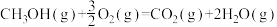 ΔH2=-676kJ·mol-1
ΔH2=-676kJ·mol-1①写出CO2和H2生成气态甲醇等产物的热化学方程式
②下面表示合成甲醇的反应的能量变化示意图,其中正确的是

③某兴趣小组对该反应进行了实验探究。在一定温度和催化剂条件下,将1molCO2和3molH2通入2L密闭容器中进行反应(此时容器内总压强为200kPa),反应物和产物的分压随时间的变化曲线如图所示。

若保持容器体积不变,t1时反应达到平衡,测得H2的体积分数为
 ,此时用H2压强表示0-t1时间内的反应速率v(H2)=
,此时用H2压强表示0-t1时间内的反应速率v(H2)=
您最近一年使用:0次
2023高一下·浙江杭州·期中
9 . CH3OH是无色有刺激性气味的液体,在生产生活中有重要用途,同时也是一种重要的化工原料。
(1)已知CH3OH(g)+ O2(g)⇌CO2(g)+2H2(g)的能量变化如图所示,下列说法正确的是
O2(g)⇌CO2(g)+2H2(g)的能量变化如图所示,下列说法正确的是___________ (填字母)。
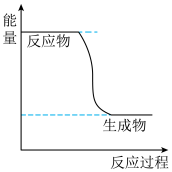
a.CH3OH转变成H2的过程是一个吸收能量的过程
b.1molH-O键断裂的同时2molC=O键断裂,则反应达最大限度
c.化学变化不仅有新物质生成,同时也一定有能量变化
d.H2的生成速率与CH3OH的消耗速率之比为1
(2)化学键的键能如表所示,若1molCH3OH(g)完全转化为1molCO2(g)和2molH2(g),放出能量___________ kJ。
(3)某温度下,将10molCH3OH和4molO2充入2L的密闭容器中,经过5min反应达到平衡,测得c(O2)=0.4mol/L,5min内平均反应速率v(H2)=________ ,则CH3OH的转化率为_________ 。
(4)CH3OH燃料电池是目前较成熟的燃料电池之一,由甲醇、空气(氧气)、KOH(电解质溶液)构成其中负极反应式为CH3OH+8OH--6e-= +6H2O,则电池放电时通入空气的电极反应式为
+6H2O,则电池放电时通入空气的电极反应式为___________ ,电池放电时,电解质溶液的碱性逐渐___________ (填“增加“减小”或“不变”)若线路中转移0.2mol电子,则消耗的O2在标准状况下的体积为___________ L。
(5)工业上可以用CO和H2为原料制备CH3OH,反应方程式为:CO(g)+2H2(g)⇌CH3OH(g),在体积固定的密闭容器中投入一定量的CO和H2气体进行上述反应。
①下列叙述中能说明上述反应达到平衡状态的是___________ 。
A.反应中CO与CH3OH的物质的量之比为1:1
B.混合气体的压强不随时间的变化而变化
C.CH3OH的质量分数在混合气体中保持不变
D.混合气体的密度保持不变
E.混合气体的平均相对分子质量不再改变
②若已知生成2.24LCH3OH(g)(已折算为标准状况下)时放出热量为4.9kJ,固定的密闭容器中投入1molCO和2molH2气体充分反应实际放热总量小于49kJ其原因是___________ 。
③下列措施不使提高反应速率的是___________ 。
A.升高温度
B.选择高效催化剂
C.向容器中充入一定量的氩气增大体系压强
D.及时分离出甲醇
(1)已知CH3OH(g)+
 O2(g)⇌CO2(g)+2H2(g)的能量变化如图所示,下列说法正确的是
O2(g)⇌CO2(g)+2H2(g)的能量变化如图所示,下列说法正确的是
a.CH3OH转变成H2的过程是一个吸收能量的过程
b.1molH-O键断裂的同时2molC=O键断裂,则反应达最大限度
c.化学变化不仅有新物质生成,同时也一定有能量变化
d.H2的生成速率与CH3OH的消耗速率之比为1
(2)化学键的键能如表所示,若1molCH3OH(g)完全转化为1molCO2(g)和2molH2(g),放出能量
| 化学键 | C一H | C一O | O一H | O=O | C=O | H一H |
| 键能/kJ | 44 | 360 | 464 | 498 | 799 | 416 |
(4)CH3OH燃料电池是目前较成熟的燃料电池之一,由甲醇、空气(氧气)、KOH(电解质溶液)构成其中负极反应式为CH3OH+8OH--6e-=
 +6H2O,则电池放电时通入空气的电极反应式为
+6H2O,则电池放电时通入空气的电极反应式为(5)工业上可以用CO和H2为原料制备CH3OH,反应方程式为:CO(g)+2H2(g)⇌CH3OH(g),在体积固定的密闭容器中投入一定量的CO和H2气体进行上述反应。
①下列叙述中能说明上述反应达到平衡状态的是
A.反应中CO与CH3OH的物质的量之比为1:1
B.混合气体的压强不随时间的变化而变化
C.CH3OH的质量分数在混合气体中保持不变
D.混合气体的密度保持不变
E.混合气体的平均相对分子质量不再改变
②若已知生成2.24LCH3OH(g)(已折算为标准状况下)时放出热量为4.9kJ,固定的密闭容器中投入1molCO和2molH2气体充分反应实际放热总量小于49kJ其原因是
③下列措施不使提高反应速率的是
A.升高温度
B.选择高效催化剂
C.向容器中充入一定量的氩气增大体系压强
D.及时分离出甲醇
您最近一年使用:0次
2023·上海·模拟预测
名校
解题方法
10 . 某温度下,在体积为5 L的密闭容器内发生如下反应: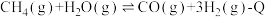
(1)在上述反应的反应物与生成物中,非极性分子为:_______ 。
(2)若反应20 min后气体总物质的量增加了10 mol,则甲烷的平均反应速率为_______ 。
(3)下列选项中的物理量不变时,一定可以判断反应达到平衡的是_______。
(4)在某一时刻,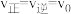 ,反应若改变某一条件,可使得
,反应若改变某一条件,可使得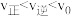 ,指出可以改变的条件,并说明理由:
,指出可以改变的条件,并说明理由:_______ 。
已知CO与合成 是可逆反应:
是可逆反应: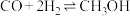 。
。
(5)若上述反应达到平衡时CO与 的转化率相同,则投料比
的转化率相同,则投料比
_______ 。
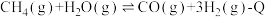
(1)在上述反应的反应物与生成物中,非极性分子为:
(2)若反应20 min后气体总物质的量增加了10 mol,则甲烷的平均反应速率为
(3)下列选项中的物理量不变时,一定可以判断反应达到平衡的是_______。
| A.容器内氢元素的质量分数 | B.容器内的压强 |
| C.反应的平衡常数 | D.容器内气体的平均相对分子质量 |
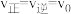 ,反应若改变某一条件,可使得
,反应若改变某一条件,可使得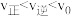 ,指出可以改变的条件,并说明理由:
,指出可以改变的条件,并说明理由:已知CO与合成
 是可逆反应:
是可逆反应: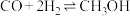 。
。(5)若上述反应达到平衡时CO与
 的转化率相同,则投料比
的转化率相同,则投料比
您最近一年使用:0次



