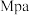1 . 在2L密闭容器中加入C(s)和NO2(g)发生反应:2C(s)+2NO2(g) N2(g)+2CO2(g) △H=-64.2 kJ/mol,NO2含量变化如图所示,下列说法错误的是
N2(g)+2CO2(g) △H=-64.2 kJ/mol,NO2含量变化如图所示,下列说法错误的是

 N2(g)+2CO2(g) △H=-64.2 kJ/mol,NO2含量变化如图所示,下列说法错误的是
N2(g)+2CO2(g) △H=-64.2 kJ/mol,NO2含量变化如图所示,下列说法错误的是
| A.5min内用C(s)物质的量变化来表示反应速率:0.16 mol/min |
| B.若在8min时容器体积压缩为1L,NO2变化曲线应为b |
| C.当此反应的密度不再发生改变时,说明了该反应已经达到平衡 |
| D.在8min时向容器中加入NO2和CO2各0.8mol,则平衡逆向移动 |
您最近一年使用:0次
2 . 化学反应速率、限度及能量与生产、生活密切相关。回答下列问题:
(1)化学能与其他形式的能相互转化的途径是___________ 。
(2)为了探究锌与盐酸反应过程中的速率变化,在200mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
2~4分钟时间段以盐酸的浓度变化来表示的该反应速率是___________ (设溶液体积不变)。反应速率最大的(即0~1min、1~2min、2~3min、3~4min、4~5min)时间段为___________ ,原因是___________ 。
(3)向某体积固定的密闭容器中加入0.3molA、0.1molC和一定量(未知)的B三种气体,一定条件下发生反应,各物质浓度随时间变化如图所示。
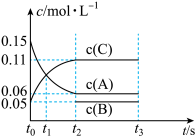
已知在反应过程中混合气体的平均相对分子质量没有变化。
①t1时,正反应速率___________ 逆反应速率(填“>”“<”或“=”)。
②反应的化学方程式是___________ 。
③B的起始的物质的量是___________ mol,平衡时体系内的压强为初始状态的___________ 倍。
④下列情况不能说明该反应一定达到化学平衡的是___________ (填标号)。
a.v(A)、v(C)之比为3:2 b.A的质量保持不变
c.B的含量保持不变 d.生成1molB的同时生成3molA
(4)燃料电池是一种高效、环境友好的供电装置,如图为甲烷燃料电池的工作原理示意图,a、b均为惰性电极。使用时,空气从___________ 口通入(填“A”或“B”),a极的电极反应式为___________ 。

(1)化学能与其他形式的能相互转化的途径是
(2)为了探究锌与盐酸反应过程中的速率变化,在200mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL)(标准状况) | 50 | 190 | 414 | 526 | 570 |
(3)向某体积固定的密闭容器中加入0.3molA、0.1molC和一定量(未知)的B三种气体,一定条件下发生反应,各物质浓度随时间变化如图所示。

已知在反应过程中混合气体的平均相对分子质量没有变化。
①t1时,正反应速率
②反应的化学方程式是
③B的起始的物质的量是
④下列情况不能说明该反应一定达到化学平衡的是
a.v(A)、v(C)之比为3:2 b.A的质量保持不变
c.B的含量保持不变 d.生成1molB的同时生成3molA
(4)燃料电池是一种高效、环境友好的供电装置,如图为甲烷燃料电池的工作原理示意图,a、b均为惰性电极。使用时,空气从

您最近一年使用:0次
解题方法
3 . 选择性催化还原法(SCR)技术是目前国际上主流高效去除尾气中NOx起始终点的技术路线,主要用于还原尾气中的NOx。在一定温度范围内,催化剂将NOx分解成无害的氮气(N2)和水(H2O),同时,在SCR催化剂的末端涂覆ASC(氨氧化催化剂),将未反应完全的氨气氧化,防止氨气泄露。其反应原理及主要方程式如图所示:
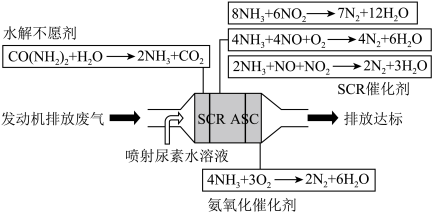
SCR标准主反应: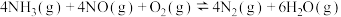

SCR辅助反应: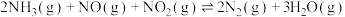

ASC反应:
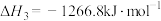
反应Ⅰ: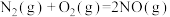
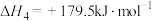
反应Ⅱ:

请回答下列问题:
(1)由上述反应可知,SCR标准主反应的△H1=_______ kJ∙mol-1,该反应在_______ (填“高温”、“低温”或“任意温度”)条件下能自发进行。
(2)在密闭容器中进行SCR标准主反应时,氨氮比[ ]与温度均会影响该反应的脱硝效率(单位时间内脱除的NOx量与未经脱硝前烟气中所含NOx量的百分比),其关系如图所示:
]与温度均会影响该反应的脱硝效率(单位时间内脱除的NOx量与未经脱硝前烟气中所含NOx量的百分比),其关系如图所示:
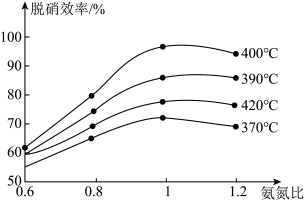
①根据图像信息判断,脱硝的最佳条件是_______ 。
②氨氮比一定时,在400℃脱硝效率最大,其可能的原因是_______ 。
③当 时,烟气中的NO含量反而增大,主要原因是
时,烟气中的NO含量反而增大,主要原因是_______ 。
(3)T℃时,在2L恒容密闭容器中充入1molNO、1molNO2和2molNH3,仅发生SCR辅助反应: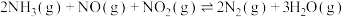 ,5min时反应达到平衡,测得N2的物质的量分数为
,5min时反应达到平衡,测得N2的物质的量分数为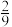 ,体系压强为
,体系压强为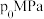 。
。
①在0~5min内,
_______  ,NO的平衡转化率为
,NO的平衡转化率为_______ 。
②T℃时,该反应的压强平衡常数Kp=_______ MPa(Kp为以分压表示的平衡常数,分压=总压×物质的量分数)。

SCR标准主反应:
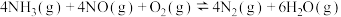

SCR辅助反应:
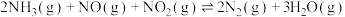

ASC反应:

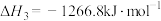
反应Ⅰ:
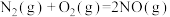
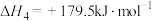
反应Ⅱ:


请回答下列问题:
(1)由上述反应可知,SCR标准主反应的△H1=
(2)在密闭容器中进行SCR标准主反应时,氨氮比[
 ]与温度均会影响该反应的脱硝效率(单位时间内脱除的NOx量与未经脱硝前烟气中所含NOx量的百分比),其关系如图所示:
]与温度均会影响该反应的脱硝效率(单位时间内脱除的NOx量与未经脱硝前烟气中所含NOx量的百分比),其关系如图所示:
①根据图像信息判断,脱硝的最佳条件是
②氨氮比一定时,在400℃脱硝效率最大,其可能的原因是
③当
 时,烟气中的NO含量反而增大,主要原因是
时,烟气中的NO含量反而增大,主要原因是(3)T℃时,在2L恒容密闭容器中充入1molNO、1molNO2和2molNH3,仅发生SCR辅助反应:
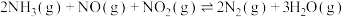 ,5min时反应达到平衡,测得N2的物质的量分数为
,5min时反应达到平衡,测得N2的物质的量分数为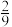 ,体系压强为
,体系压强为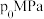 。
。①在0~5min内,

 ,NO的平衡转化率为
,NO的平衡转化率为②T℃时,该反应的压强平衡常数Kp=
您最近一年使用:0次
名校
4 . 臭氧在烟气脱硝中的反应为2NO2(g)+O3(g) N2O5(g)+O2(g)。若此反应在恒容密闭容器中进行,相关图像如下,其中对应分析结论正确的是
N2O5(g)+O2(g)。若此反应在恒容密闭容器中进行,相关图像如下,其中对应分析结论正确的是
 N2O5(g)+O2(g)。若此反应在恒容密闭容器中进行,相关图像如下,其中对应分析结论正确的是
N2O5(g)+O2(g)。若此反应在恒容密闭容器中进行,相关图像如下,其中对应分析结论正确的是A.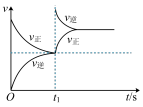 恒温,t1时再充入O3 恒温,t1时再充入O3 |
B. 0~2 s内,υ(O3)=0.2 mol·L-1·s-1 0~2 s内,υ(O3)=0.2 mol·L-1·s-1 |
C.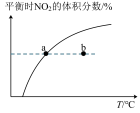 υ正:b点<a点,b点:υ逆<υ正 υ正:b点<a点,b点:υ逆<υ正 |
D.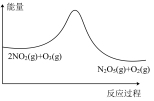 平衡后降温,NO2含量降低 平衡后降温,NO2含量降低 |
您最近一年使用:0次
2022-09-01更新
|
323次组卷
|
18卷引用:山西省太原市第五中学校2022-2023学年高二上学期10月月考化学试题
山西省太原市第五中学校2022-2023学年高二上学期10月月考化学试题2015届天津市河西区高三下学期总复习质量调查(二)化学试卷2017届湖南师大附中高三上学期入学摸底考试化学试卷2017届河北省武邑中学高三上学期第三次调研化学试卷湖南省湖南师范大学附属中学2019届高三上学期月考(一)化学试题【全国百强校】湖南省师范大学附属中学2019届高三上学期月考化学试题【全国百强校】内蒙古鄂尔多斯市第一中学2018-2019学年高二上学期期中考试模拟化学试题【全国百强校】广东省深圳市高级中学2018-2019学年高二上学期期中考试化学试题【全国百强校】山东省泰安市第一中学2019届高三上学期12月学情诊断化学试题江西省九江市同文中学2019届高三上学期期中考试化学试题陕西省商南县高级中学2019届高三上学期四模考试理科综合化学试题【全国百强校】安徽省合肥市第六中学2018-2019学年高二下学期开学考试化学试题【市级联考】河南省八市2018-2019学年高二下学期第三次质量检测化学试题安徽省砀山县第二中学2019-2020学年高二10月月考化学试题安徽省砀山县第二中学2020届高三上学期第四次月考化学试题湖南省长郡中学2019-2020学年高二上学期第三次月考化学试题广东省深圳市宝安区2019-2020学年高二上学期期末调研考试化学试题江西省吉安市安福二中、吉安县三中、井大附中三校2021-2022学年高二上学期12月联考化学试题
5 . 在一定温度下,将2molA和2molB两种气体相混合于容积为2L的某密闭容器中,发生如下反应:3A(g)+B(g) xC(g)+2D(g),2分钟末反应达到平衡状态,生成了0.8molD,并测得C的浓度为0.4mol·L-1,请填写下列空白:
xC(g)+2D(g),2分钟末反应达到平衡状态,生成了0.8molD,并测得C的浓度为0.4mol·L-1,请填写下列空白:
(1)x值等于______ ;
(2)A的转化率为_____ ;
(3)生成D的反应速率为______ ;
(4)如果增大反应体系的压强,则平衡体系中C的质量分数____ (增大、减小、不变)
(5)写出该反应的平衡常数表达式____ ,并计算在该温度下的平衡常数为_____ 。
 xC(g)+2D(g),2分钟末反应达到平衡状态,生成了0.8molD,并测得C的浓度为0.4mol·L-1,请填写下列空白:
xC(g)+2D(g),2分钟末反应达到平衡状态,生成了0.8molD,并测得C的浓度为0.4mol·L-1,请填写下列空白:(1)x值等于
(2)A的转化率为
(3)生成D的反应速率为
(4)如果增大反应体系的压强,则平衡体系中C的质量分数
(5)写出该反应的平衡常数表达式
您最近一年使用:0次
名校
解题方法
6 . Ⅰ.工业合成氨是人类科学技术发展史上的一项重大成就,在很大程度上解决了地球上因粮食不足而导致的饥饿问题。工业合成氨反应方程式如下 。
。
(1)已知 键键能为
键键能为 键键能为
键键能为 键键能为
键键能为 。
。
若有 完全转化为
完全转化为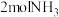 ,理论上
,理论上_______ (选填“放出”或“吸收”) 热量。
热量。
(2)为探究影响合成氨转化率的因素,小芳同学利用控制变量法测得平衡状态下 含量如下表(其他因素相同)。
含量如下表(其他因素相同)。
①当合成氨反应达到平衡状态时,若再升高温度,v(正)_______ (填“增大”“不变”“减小”,下同),v(逆)_______ 。
②请分析为什么工业合成氨压强通常控制在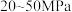 而不是选择更大的压强?
而不是选择更大的压强?_______ 。
Ⅱ.在恒温下,将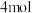 的
的 和
和 的
的 充入
充入 恒容的密闭容器中发生如下反应:
恒容的密闭容器中发生如下反应: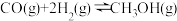 。下图是
。下图是 和
和 的浓度随时间变化的关系图。
的浓度随时间变化的关系图。

(3)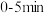 内,
内, 的平均反应速率是
的平均反应速率是_______ 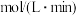 。
。
(4)设起始压强为p,平衡时压强为 ,则
,则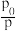 的值为
的值为_______ 。
(5)根据反应原理下列描述能说明反应达到最大限度的是_______。
 。
。(1)已知
 键键能为
键键能为 键键能为
键键能为 键键能为
键键能为 。
。若有
 完全转化为
完全转化为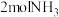 ,理论上
,理论上 热量。
热量。(2)为探究影响合成氨转化率的因素,小芳同学利用控制变量法测得平衡状态下
 含量如下表(其他因素相同)。
含量如下表(其他因素相同)。压强/ 温度  | 0.1 | 10 | 20 | 30 | 60 | 100 |
| 200 | 15.3% | 81.5% | 86.49% | 89.9% | 95.4% | 98.8% |
| 300 | 2.2% | 52.0% | 64.2% | 71.0% | 84.2% | 92.6% |
| 400 | 0.49% | 25.1% | 38.2% | 47.0% | 65.2% | 79.8% |
| 500 | 0.19% | 10.6% | 19.1% | 26.49% | 42.2% | 57.5% |
| 600 | 0.05% | 4.5% | 9.1% | 13.89% | 23.1% | 3.14% |
②请分析为什么工业合成氨压强通常控制在
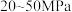 而不是选择更大的压强?
而不是选择更大的压强?Ⅱ.在恒温下,将
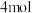 的
的 和
和 的
的 充入
充入 恒容的密闭容器中发生如下反应:
恒容的密闭容器中发生如下反应: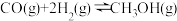 。下图是
。下图是 和
和 的浓度随时间变化的关系图。
的浓度随时间变化的关系图。
(3)
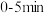 内,
内, 的平均反应速率是
的平均反应速率是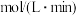 。
。(4)设起始压强为p,平衡时压强为
 ,则
,则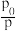 的值为
的值为(5)根据反应原理下列描述能说明反应达到最大限度的是_______。
A. 、 、 、 、 的物质的量比为1∶2∶1 的物质的量比为1∶2∶1 |
| B.混合气体的压强不随时间的变化而改变 |
C.单位时间内每消耗 ,同时生成 ,同时生成 |
D.反应速率: |
您最近一年使用:0次
名校
7 . 以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业叫煤化工
(1)将水蒸气通过红热的碳即可产生水煤气。反应为:C(s)+H2O(g) CO(g)+H2(g) ΔH=+131.3 kJ•mol-1。
CO(g)+H2(g) ΔH=+131.3 kJ•mol-1。
①该反应在常温下____________ 自发进行(填“能”与“不能”);
②一定温度下,在一个容积可变的密闭容器中,发生上述反应,下列能判断该反应达到化学平衡状态的是______________ (填字母,下同)。
a.容器中的压强不变 b.1 mol H—H键断裂的同时断裂2 mol H—O键
c.c(CO)=c(H2) d.密闭容器的容积不再改变
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g) CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
①实验1中以v(CO2) 表示的反应速率为________________ 。(取小数二位,下同)
②该反应为_____ (填“吸”或“放”)热反应,实验2条件下平衡常数K=________ 。
③若实验3达平衡时与实验2平衡状态中各物质的质量分数分别相等,且t<3min,则a、b应满足的关系是________________________ (用含a、b的数学式表示)。
(3)目前工业上有一种方法是用CO2来生产甲醇。一定条件下发生反应: CO2(g)+3H2(g) CH3OH(g)+H2O(g) ,如图表示该反应进行过程中能量(单位为kJ•mol-1)的变化。在体积为1 L的恒容密闭容器中,充入1mol CO2和3mol H2,下列措施中能使c(CH3OH)增大的是
CH3OH(g)+H2O(g) ,如图表示该反应进行过程中能量(单位为kJ•mol-1)的变化。在体积为1 L的恒容密闭容器中,充入1mol CO2和3mol H2,下列措施中能使c(CH3OH)增大的是___________ 。
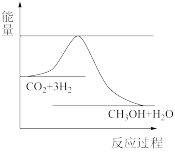
a.升高温度
b.充入He(g),使体系压强增大
c.将H2O(g)从体系中分离出来
d.再充入1mol CO2和3mol H2
(1)将水蒸气通过红热的碳即可产生水煤气。反应为:C(s)+H2O(g)
 CO(g)+H2(g) ΔH=+131.3 kJ•mol-1。
CO(g)+H2(g) ΔH=+131.3 kJ•mol-1。①该反应在常温下
②一定温度下,在一个容积可变的密闭容器中,发生上述反应,下列能判断该反应达到化学平衡状态的是
a.容器中的压强不变 b.1 mol H—H键断裂的同时断裂2 mol H—O键
c.c(CO)=c(H2) d.密闭容器的容积不再改变
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)
 CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| H2O | CO | H2 | CO | |||
| 1 | 650 | 2 | 4 | 1.6 | 2.4 | 6 |
| 2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
①实验1中以v(CO2) 表示的反应速率为
②该反应为
③若实验3达平衡时与实验2平衡状态中各物质的质量分数分别相等,且t<3min,则a、b应满足的关系是
(3)目前工业上有一种方法是用CO2来生产甲醇。一定条件下发生反应: CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ,如图表示该反应进行过程中能量(单位为kJ•mol-1)的变化。在体积为1 L的恒容密闭容器中,充入1mol CO2和3mol H2,下列措施中能使c(CH3OH)增大的是
CH3OH(g)+H2O(g) ,如图表示该反应进行过程中能量(单位为kJ•mol-1)的变化。在体积为1 L的恒容密闭容器中,充入1mol CO2和3mol H2,下列措施中能使c(CH3OH)增大的是
a.升高温度
b.充入He(g),使体系压强增大
c.将H2O(g)从体系中分离出来
d.再充入1mol CO2和3mol H2
您最近一年使用:0次
名校
解题方法
8 . 某温度下,在 2 L 恒容密闭容器中 3 种物质间进行反应,X、Y、Z 的物质的量随时间的变化曲线如图所示,反应在 t1 min 时达到平衡。
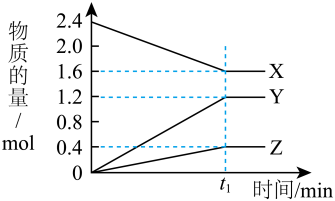
(1)请写出该反应的化学方程式:_____ 。
(2)若上述反应中X、Y、Z 分别为 NH3、H2、N2,在此 t1 min 时间内,用H2表示该反应的平均速率 v(H2)为_____ 。
(3)拆开 1mol 共价键所需吸收的能量如下表:
1mol N2完全反应为NH3_____ (填:吸收或放出)_____ kJ 能量。事实上,将 1molN2和3molH2放在反应容器中,使它们充分反应,反应的热量变化总小于计算值,原因是_________ 。
(4)下列叙述能判断该反应达到平衡状态的是_____ (填字母代号)。
A 容器内各气体组分的质量分数不再发生改变
B 正反应速率与逆反应速率相等
C 容器内气体的密度不再发生改变
D 混合气体的平均相对分子质量不再发生改变

(1)请写出该反应的化学方程式:
(2)若上述反应中X、Y、Z 分别为 NH3、H2、N2,在此 t1 min 时间内,用H2表示该反应的平均速率 v(H2)为
(3)拆开 1mol 共价键所需吸收的能量如下表:
共价键 | H-H | N≡N | N-H |
吸收的能量/kJ | 436 | 946 | 391 |
(4)下列叙述能判断该反应达到平衡状态的是
A 容器内各气体组分的质量分数不再发生改变
B 正反应速率与逆反应速率相等
C 容器内气体的密度不再发生改变
D 混合气体的平均相对分子质量不再发生改变
您最近一年使用:0次
9 . 将纯净的A置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:A(s) 2B(g)+C(g)+D(g)。下列说法正确的是
2B(g)+C(g)+D(g)。下列说法正确的是
 2B(g)+C(g)+D(g)。下列说法正确的是
2B(g)+C(g)+D(g)。下列说法正确的是| A.2v(B)=v(C) |
| B.增大A的物质的量,化学反应速率加快 |
| C.若B的质量分数不变,则反应达平衡 |
| D.平衡后移除C,A的转化率增大 |
您最近一年使用:0次
名校
解题方法
10 . 对于一个可逆反应不仅要考虑反应的快慢还要考虑反应的限度,化学反应不仅存在物质间的转化还存在能量间的转化。请回答下列有关化学反应的问题。
Ⅰ.已知反应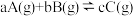 ,某温度下,在2L密闭容器中投入一定量的A、B,两种气体的物质的量浓度随时间变化的曲线如图所示。
,某温度下,在2L密闭容器中投入一定量的A、B,两种气体的物质的量浓度随时间变化的曲线如图所示。
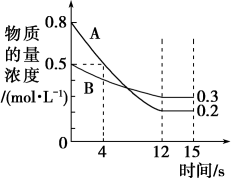
(1)从反应开始到12s时,用A表示的反应速率为___________ 。
(2)经测定,前4s内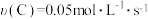 ,则该反应的化学方程式为
,则该反应的化学方程式为___________ 。
(3)若上述反应分别在甲、乙、丙三个相同的密闭容器中进行,经相同时间后,测得三个容器中的反应速率分别为甲: ,乙:
,乙: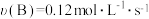 ,丙:
,丙: 。则甲、乙、丙三个容器中反应速率由快到慢的顺序为
。则甲、乙、丙三个容器中反应速率由快到慢的顺序为___________ 。
(4)判断该反应达到平衡状态的依据是___________ (填字母序号)。
A.该条件下,正、逆反应速率都为零 B.该条件下,混合气体的密度不再发生变化
C.该条件下,混合气体的压强不再发生变化 D.容器内分子数不再发生变化
Ⅱ.某甲醛气体探测仪利用燃料电池工作原理对甲醛含量进行检测,电池结构如图所示。
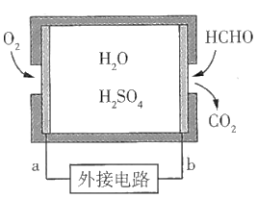
(1)a电极上发生的反应类型为___________ 反应(选填“氧化”或“还原”)。
(2)探测仪工作时,电子从___________ (选填“a”或“b”)极流出,a电极的电极反应式为___________ 。
(3)如果在外电路中有1mol电子发生转移,则检测出标准状况下甲醛的体积为___________ L。
Ⅰ.已知反应
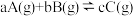 ,某温度下,在2L密闭容器中投入一定量的A、B,两种气体的物质的量浓度随时间变化的曲线如图所示。
,某温度下,在2L密闭容器中投入一定量的A、B,两种气体的物质的量浓度随时间变化的曲线如图所示。
(1)从反应开始到12s时,用A表示的反应速率为
(2)经测定,前4s内
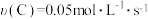 ,则该反应的化学方程式为
,则该反应的化学方程式为(3)若上述反应分别在甲、乙、丙三个相同的密闭容器中进行,经相同时间后,测得三个容器中的反应速率分别为甲:
 ,乙:
,乙: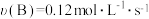 ,丙:
,丙: 。则甲、乙、丙三个容器中反应速率由快到慢的顺序为
。则甲、乙、丙三个容器中反应速率由快到慢的顺序为(4)判断该反应达到平衡状态的依据是
A.该条件下,正、逆反应速率都为零 B.该条件下,混合气体的密度不再发生变化
C.该条件下,混合气体的压强不再发生变化 D.容器内分子数不再发生变化
Ⅱ.某甲醛气体探测仪利用燃料电池工作原理对甲醛含量进行检测,电池结构如图所示。

(1)a电极上发生的反应类型为
(2)探测仪工作时,电子从
(3)如果在外电路中有1mol电子发生转移,则检测出标准状况下甲醛的体积为
您最近一年使用:0次
2021-07-11更新
|
155次组卷
|
2卷引用:山西省吕梁市2020-2021学年高一下学期期末考试化学试题