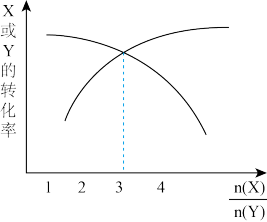
1 . 一定条件下,将X和Y两种气体按不同比例放入固定容积的密闭容器中,反应达平衡后,测得X、Y的转化率与起始时物质的量之比的关系如下图。改变温度和压强,生成物Z的百分含量见下表,则该反应的化学方程式可表示为

| 温度/℃ | 压强/kPa | Z的质量分数 |
| 200 | 101 | 0.40 |
| 300 | 101 | 0.48 |
| 400 | 202 | 0.52 |
| 400 | 303 | 0.52 |
A.3X(g)+Y(g) 3Z(g) ΔH<0 3Z(g) ΔH<0 |
B.X(g)+3Y(g) 4Z(g) ΔH>0 4Z(g) ΔH>0 |
C.3X(g)+Y(g) 4Z(g) ΔH>0 4Z(g) ΔH>0 |
D.X(g)+3Y(g) 3Z(g) ΔH<0 3Z(g) ΔH<0 |
您最近一年使用:0次
解题方法
2 . 含氯化合物的反应在化学工业中具有重要的地位。回答下列问题:
(1)工业上,常用 检验输送氯气的管道是否泄漏。
检验输送氯气的管道是否泄漏。
已知: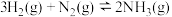
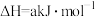
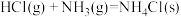
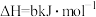


反应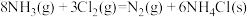 的
的
_______  。
。
(2)氯乙烷是重要的含氯化合物,常用于医药、农药的制造。可用乙烯和氯化氢反应制备氯乙烷,反应方程式为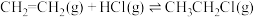 。在1L恒温恒容密闭容器中充入2.5
。在1L恒温恒容密闭容器中充入2.5
 和1.5
和1.5
 ,在催化剂作用下发生反应,测得
,在催化剂作用下发生反应,测得 及
及 的物质的量随时间变化如图1所示:
的物质的量随时间变化如图1所示:

①12.5s时反应恰好达到平衡,则0~12.5s内, 的平均反应速率为
的平均反应速率为_______  。
。
②第一次平衡时, 的平衡转化率为
的平衡转化率为_______ 。
③在第20s时,仅改变了某一个条件,则改变的条件是_______ ;第25s后,反应重新达到平衡,则该反应的平衡常数
_______ (保留两位有效数字)。
④在1L的恒温恒容密闭容器中发生上述反应,下列能说明反应已经达到平衡的是_______ (填标号)。
A.容器内气体的总压强不变
B.容器内碳元素的质量分数不变
C.单位时间内,断裂1
 键的同时,有1
键的同时,有1
 键形成
键形成
D.容器内气体的密度不变
(3)工业上常用氯苯(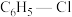 )和硫化氢(
)和硫化氢( )反应来制备一种用途广泛的有机合成中间体苯硫酚(
)反应来制备一种用途广泛的有机合成中间体苯硫酚( ),但会有副产物苯(
),但会有副产物苯( )生成,发生的反应如下:
)生成,发生的反应如下:
I.
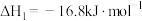 ;
;
II.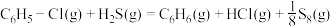
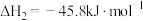 。
。
现将一定量的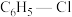 和
和 置于一固定容积的容器中模拟工业生产过程,在不同温度下均反应20min,测定生成物的浓度,得到图2和图3(R为
置于一固定容积的容器中模拟工业生产过程,在不同温度下均反应20min,测定生成物的浓度,得到图2和图3(R为 与
与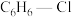 的起始物质的量之比)。
的起始物质的量之比)。

结合图2和图3,该模拟工业生产制备 的适宜条件为
的适宜条件为_______ 。
(1)工业上,常用
 检验输送氯气的管道是否泄漏。
检验输送氯气的管道是否泄漏。已知:
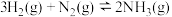
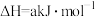
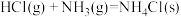
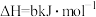


反应
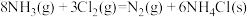 的
的
 。
。(2)氯乙烷是重要的含氯化合物,常用于医药、农药的制造。可用乙烯和氯化氢反应制备氯乙烷,反应方程式为
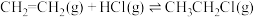 。在1L恒温恒容密闭容器中充入2.5
。在1L恒温恒容密闭容器中充入2.5
 和1.5
和1.5
 ,在催化剂作用下发生反应,测得
,在催化剂作用下发生反应,测得 及
及 的物质的量随时间变化如图1所示:
的物质的量随时间变化如图1所示:
①12.5s时反应恰好达到平衡,则0~12.5s内,
 的平均反应速率为
的平均反应速率为 。
。②第一次平衡时,
 的平衡转化率为
的平衡转化率为③在第20s时,仅改变了某一个条件,则改变的条件是

④在1L的恒温恒容密闭容器中发生上述反应,下列能说明反应已经达到平衡的是
A.容器内气体的总压强不变
B.容器内碳元素的质量分数不变
C.单位时间内,断裂1

 键的同时,有1
键的同时,有1
 键形成
键形成D.容器内气体的密度不变
(3)工业上常用氯苯(
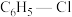 )和硫化氢(
)和硫化氢( )反应来制备一种用途广泛的有机合成中间体苯硫酚(
)反应来制备一种用途广泛的有机合成中间体苯硫酚( ),但会有副产物苯(
),但会有副产物苯( )生成,发生的反应如下:
)生成,发生的反应如下:I.

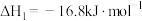 ;
;II.
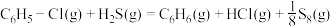
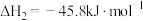 。
。现将一定量的
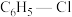 和
和 置于一固定容积的容器中模拟工业生产过程,在不同温度下均反应20min,测定生成物的浓度,得到图2和图3(R为
置于一固定容积的容器中模拟工业生产过程,在不同温度下均反应20min,测定生成物的浓度,得到图2和图3(R为 与
与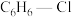 的起始物质的量之比)。
的起始物质的量之比)。
结合图2和图3,该模拟工业生产制备
 的适宜条件为
的适宜条件为
您最近一年使用:0次
3 . I.汽车行驶、某些化工厂生产过程,会向空气中排放出NOx、CO、SO2等有害气体,影响生态环境。
(1)汽油中含有某种烃A。已知A的相对分子质量为100,其中氢元素的质量分数为16%,A的分子式为____ 。
II.为防止氮的氧化物污染空气,可用氨或活性炭还原氮氧化物。回答下列问题:
(2)为了减少重型柴油车排放NOx,向尾气处理装置内自动喷入的尿素溶液在一定条件下先转化为NH3,NH3再与NOx反应生成两种无污染的物质。
①写出其中NH3与NO在一定条件下反应的化学方程式:____ 。
②为提高此反应的速率,下列措施可行的是_____ (填字母代号)。
A.缩小容器体积 B.降低温度 C.使用适合催化剂 D.移出产物
(3)向两个1L的密闭容器中各加入活性炭(足量)和1.0molNO,发生反应为:C(s)+2NO(g) N2(g)+CO2(g)。实验测得不同温度下NO和N2的物质的量变化如表所示:
N2(g)+CO2(g)。实验测得不同温度下NO和N2的物质的量变化如表所示:
①温度为T1℃时,0~5min内,以CO2表示的该反应的平均速率v(CO2)=____ mol·L-1·min-1;反应达到最大限度(即平衡状态)时,混合气体中N2的物质的量分数为____ 。从反应开始到建立平衡的过程中,体系内气体的总压强____ (填“变大”“变小”或“不变”)。
②两容器中的温度关系为T1____ T2(填“>”“<”或“=”)。
③下列情况能说明该反应C(s)+2NO(g) N2(g)+CO2(g)达到平衡状态的是
N2(g)+CO2(g)达到平衡状态的是____ 。
A.2v正(NO)=v逆(CO2)
B.混合气体中N2的体积分数保持不变
C.单位时间内断裂1个N≡N同时生成1个C=O
D.恒温、恒容条件下,混合气体的密度保持不变
E.恒温、恒容条件下,混合气体的平均摩尔质量保持不变
(1)汽油中含有某种烃A。已知A的相对分子质量为100,其中氢元素的质量分数为16%,A的分子式为
II.为防止氮的氧化物污染空气,可用氨或活性炭还原氮氧化物。回答下列问题:
(2)为了减少重型柴油车排放NOx,向尾气处理装置内自动喷入的尿素溶液在一定条件下先转化为NH3,NH3再与NOx反应生成两种无污染的物质。
①写出其中NH3与NO在一定条件下反应的化学方程式:
②为提高此反应的速率,下列措施可行的是
A.缩小容器体积 B.降低温度 C.使用适合催化剂 D.移出产物
(3)向两个1L的密闭容器中各加入活性炭(足量)和1.0molNO,发生反应为:C(s)+2NO(g)
 N2(g)+CO2(g)。实验测得不同温度下NO和N2的物质的量变化如表所示:
N2(g)+CO2(g)。实验测得不同温度下NO和N2的物质的量变化如表所示:| 温度/℃ | 物质的量/mol | 时间 | ||||
| 0 | 5min | 9min | 10min | 12min | ||
| T1 | NO | 1.0 | 0.58 | 0.42 | 0.40 | 0.40 |
| N2 | 0 | 0.21 | 0.29 | x | x | |
| T2 | NO | 1.0 | 0.50 | 0.34 | 0.34 | |
| N2 | 0 | 0.25 | 0.33 | 0.33 | ||
②两容器中的温度关系为T1
③下列情况能说明该反应C(s)+2NO(g)
 N2(g)+CO2(g)达到平衡状态的是
N2(g)+CO2(g)达到平衡状态的是A.2v正(NO)=v逆(CO2)
B.混合气体中N2的体积分数保持不变
C.单位时间内断裂1个N≡N同时生成1个C=O
D.恒温、恒容条件下,混合气体的密度保持不变
E.恒温、恒容条件下,混合气体的平均摩尔质量保持不变
您最近一年使用:0次
名校
解题方法
4 . 我国力争2030年前实现碳达峰,2060年前实现碳中和。 的捕集利用已成为科学家们研究的重要课题。
的捕集利用已成为科学家们研究的重要课题。 加氢可转化为二甲醚
加氢可转化为二甲醚 ,反应原理为:
,反应原理为: 。该反应的能量变化如图所示。
。该反应的能量变化如图所示。
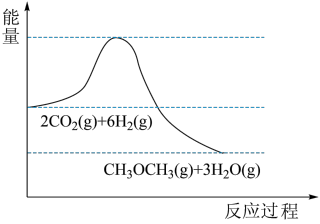
回答问题:
(1)该反应为_____ (填“放热”或“吸热”)反应。
(2)在固定体积的密闭容器中发生该反应,能说明该反应达到平衡状态的是_____ (填字母)。
a. 的含量保持不变
的含量保持不变
b.混合气体的密度不变
c.混合气体的平均相对分子质量不变
d.
(3)在体积为 密闭容器中充入
密闭容器中充入 和
和 ,测得
,测得 、
、 的物质的量随时间变化如图所示。
的物质的量随时间变化如图所示。
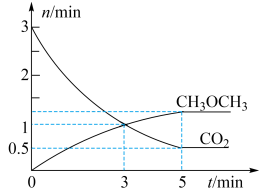

回答下列问题:
①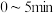 内,
内,
_____ 。
②反应达到平衡状态时, 的体积分数为
的体积分数为_____ %(保留1位小数)。
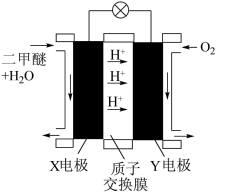
③“二甲醚 酸性燃料池”的工作原理示意图如图所示。X电极反应式
酸性燃料池”的工作原理示意图如图所示。X电极反应式_____ ;若此燃料电池电路中转移 电子,则消耗的
电子,则消耗的 在标准状况下的体积为
在标准状况下的体积为_____ L。
(4)实验室用 溶液与
溶液与 溶液反应探究条件的改变对化学反应速率的影响,设计的实验方案如下表(已知
溶液反应探究条件的改变对化学反应速率的影响,设计的实验方案如下表(已知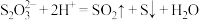 ):
):
①对比实验1和2可探究_____ 因素对化学反应速率的影响。
②对比实验1和3来探究浓度对化学反应速率的影响,则
_____ 。
 的捕集利用已成为科学家们研究的重要课题。
的捕集利用已成为科学家们研究的重要课题。 加氢可转化为二甲醚
加氢可转化为二甲醚 ,反应原理为:
,反应原理为: 。该反应的能量变化如图所示。
。该反应的能量变化如图所示。
回答问题:
(1)该反应为
(2)在固定体积的密闭容器中发生该反应,能说明该反应达到平衡状态的是
a.
 的含量保持不变
的含量保持不变b.混合气体的密度不变
c.混合气体的平均相对分子质量不变
d.

(3)在体积为
 密闭容器中充入
密闭容器中充入 和
和 ,测得
,测得 、
、 的物质的量随时间变化如图所示。
的物质的量随时间变化如图所示。

回答下列问题:
①
 内,
内,
②反应达到平衡状态时,
 的体积分数为
的体积分数为③“二甲醚
 酸性燃料池”的工作原理示意图如图所示。X电极反应式
酸性燃料池”的工作原理示意图如图所示。X电极反应式 电子,则消耗的
电子,则消耗的 在标准状况下的体积为
在标准状况下的体积为
(4)实验室用
 溶液与
溶液与 溶液反应探究条件的改变对化学反应速率的影响,设计的实验方案如下表(已知
溶液反应探究条件的改变对化学反应速率的影响,设计的实验方案如下表(已知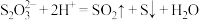 ):
):| 实验序号 | 体积/mL | 温度/℃ | 溶液出现浑浊的时间/s | ||
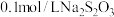 溶液 溶液 | 水 | 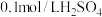 溶液 溶液 | |||
| 1 | 2.0 | 0.0 | 2.0 | 25 | 8 |
| 2 | 2.0 | 0.0 | 2.0 | 50 | 5 |
| 3 | 1.0 | V | 2.0 | 25 | 10 |
②对比实验1和3来探究浓度对化学反应速率的影响,则

您最近一年使用:0次
2023-08-15更新
|
266次组卷
|
2卷引用:辽宁省东港市第二中学2023-2024学年高二上学期开学考试化学试题
5 . 由于温室效应和资源短缺等问题,如何降低大气中的 含量并加以开发利用,引起了各国的普遍重视。目前工业上有二种方法是用
含量并加以开发利用,引起了各国的普遍重视。目前工业上有二种方法是用 生产燃料甲醇:
生产燃料甲醇: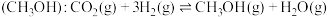 。该反应进行过程中能量的变化(单位为
。该反应进行过程中能量的变化(单位为 )如图1所示。
)如图1所示。

请回答下列问题:
(1)观察图1可知上述反应过程中,断裂反应物中的化学键吸收的总能量___________ (填“大于”“小于”或“等于”“不确定”)形成生成物中的化学键释放的总能量。
(2)在体积为 的密闭容器中,充入
的密闭容器中,充入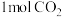 和
和 ,一定条件下发生反应。测得
,一定条件下发生反应。测得 和
和 的物质的量随时间变化图2所示:
的物质的量随时间变化图2所示:

①反应开始到 ,用
,用 表示反应速率为
表示反应速率为___________  。
。
②达到平衡时, 的转化率为
的转化率为___________ 。
③能说明上述反应达到平衡状态的是___________ (填序号)。
A.
B.混合气体的密度不再发生变化
C.单位时间内消耗 ,同时生成
,同时生成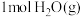
D. 的体积分数在混合气体中保持不变
的体积分数在混合气体中保持不变
E.容器内压强保持不变
(3)甲醇燃料电池和氢气燃料电池在北京冬奥会上得到广泛应用。如下图是碱性氢氧燃料电池的模拟示意图:

①a电极是___________ (填正、负)极,b电极发生的电极反应式是___________ 。
②当消耗标准状况下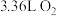 时,导线上转移的电子的物质的量是
时,导线上转移的电子的物质的量是___________ mol。
③将上图中的 改为甲醇就构成了碱性甲醇燃料电池,a电极发生的电极反应式是
改为甲醇就构成了碱性甲醇燃料电池,a电极发生的电极反应式是___________ 。
 含量并加以开发利用,引起了各国的普遍重视。目前工业上有二种方法是用
含量并加以开发利用,引起了各国的普遍重视。目前工业上有二种方法是用 生产燃料甲醇:
生产燃料甲醇: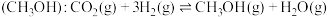 。该反应进行过程中能量的变化(单位为
。该反应进行过程中能量的变化(单位为 )如图1所示。
)如图1所示。
请回答下列问题:
(1)观察图1可知上述反应过程中,断裂反应物中的化学键吸收的总能量
(2)在体积为
 的密闭容器中,充入
的密闭容器中,充入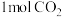 和
和 ,一定条件下发生反应。测得
,一定条件下发生反应。测得 和
和 的物质的量随时间变化图2所示:
的物质的量随时间变化图2所示:
①反应开始到
 ,用
,用 表示反应速率为
表示反应速率为 。
。②达到平衡时,
 的转化率为
的转化率为③能说明上述反应达到平衡状态的是
A.

B.混合气体的密度不再发生变化
C.单位时间内消耗
 ,同时生成
,同时生成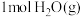
D.
 的体积分数在混合气体中保持不变
的体积分数在混合气体中保持不变E.容器内压强保持不变
(3)甲醇燃料电池和氢气燃料电池在北京冬奥会上得到广泛应用。如下图是碱性氢氧燃料电池的模拟示意图:

①a电极是
②当消耗标准状况下
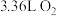 时,导线上转移的电子的物质的量是
时,导线上转移的电子的物质的量是③将上图中的
 改为甲醇就构成了碱性甲醇燃料电池,a电极发生的电极反应式是
改为甲醇就构成了碱性甲醇燃料电池,a电极发生的电极反应式是
您最近一年使用:0次
名校
解题方法
6 . 一定温度下,在体积为2L的密闭容器中,充入1mol 和3mol
和3mol 发生如下反应:
发生如下反应: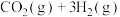
 。经测得
。经测得 和
和 (g)的物质的量随时间变化如图所示。
(g)的物质的量随时间变化如图所示。
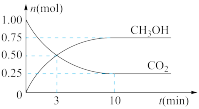
①从反应开始到平衡, 的平均反应速率
的平均反应速率
__ 。
②达到平衡时, 的转化率为
的转化率为__ 。(用百分数表示)
③下列措施不能提高反应速率的是____ 。
A.升高温度 B.加入适当催化剂
C.缩小体积,增大压强 D.恒温、恒压下通入氦气
④下列叙述中不能说明上述反应达到平衡状态的是___ 。
A.混合气体的平均相对分子质量保持不变
B.混合气体的压强不随时间的变化而变化
C. 在混合气体中的质量分数保持不变
在混合气体中的质量分数保持不变
D.反应中 与
与 的物质的量之比为1∶1
的物质的量之比为1∶1
E.单位时间内每消耗1mol 同时生成1mol
同时生成1mol
 和3mol
和3mol 发生如下反应:
发生如下反应: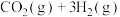
 。经测得
。经测得 和
和 (g)的物质的量随时间变化如图所示。
(g)的物质的量随时间变化如图所示。
①从反应开始到平衡,
 的平均反应速率
的平均反应速率
②达到平衡时,
 的转化率为
的转化率为③下列措施不能提高反应速率的是
A.升高温度 B.加入适当催化剂
C.缩小体积,增大压强 D.恒温、恒压下通入氦气
④下列叙述中不能说明上述反应达到平衡状态的是
A.混合气体的平均相对分子质量保持不变
B.混合气体的压强不随时间的变化而变化
C.
 在混合气体中的质量分数保持不变
在混合气体中的质量分数保持不变D.反应中
 与
与 的物质的量之比为1∶1
的物质的量之比为1∶1E.单位时间内每消耗1mol
 同时生成1mol
同时生成1mol
您最近一年使用:0次
名校
7 . I.SO2在工农业生产中有着重要的应用,请回答下列问题:
(1)工业上用软锰矿(主要成分为MnO2)制备Mn(H2PO4)2•2H2O。常用稀硫酸酸浸软锰矿,同时通入SO2,此时发生反应的离子方程式为_____ ,SO2作_____ (填“氧化剂”或“还原剂”)。
Ⅱ.一定温度下,向容积为2L的恒容密闭容器中通入2molSO2和1molO2,在一定条件下发生反应2SO2(g)+O2(g) 2SO3(g)。O2的物质的量随时间变化的实验数据如表所示:
2SO3(g)。O2的物质的量随时间变化的实验数据如表所示:
(2)下列说法能够判断上述反应达到化学平衡状态的是_____ (填标号)。
(3)上述反应体系的正反应速率和逆反应速率相等的时间段是_____ (填“0~4”、“4~8”、“8~12”“12~18”或“18~25”)min。
(4)0~8min内,用SO3表示该反应的平均速率为_____ mol•L-1•min-1,12min时,SO2的转化率为_____ 。
(5)若起始时容器内压强为p0MPa,则平衡时,容器内压强约为_____ (用含p0的代数式表示,保留2位有效数字)MPa。
(1)工业上用软锰矿(主要成分为MnO2)制备Mn(H2PO4)2•2H2O。常用稀硫酸酸浸软锰矿,同时通入SO2,此时发生反应的离子方程式为
Ⅱ.一定温度下,向容积为2L的恒容密闭容器中通入2molSO2和1molO2,在一定条件下发生反应2SO2(g)+O2(g)
 2SO3(g)。O2的物质的量随时间变化的实验数据如表所示:
2SO3(g)。O2的物质的量随时间变化的实验数据如表所示:| 时间/min | 4 | 8 | 12 | 18 | 25 |
| n(O2)/mol | 0.70 | 0.50 | 0.40 | 0.32 | 0.32 |
| A.v(SO2)=2v(O2) | B.容器内气体的平均摩尔质量不再发生变化 |
| C.SO2和O2的浓度之比为2:1 | D.SO3的百分含量不再发生变化 |
(4)0~8min内,用SO3表示该反应的平均速率为
(5)若起始时容器内压强为p0MPa,则平衡时,容器内压强约为
您最近一年使用:0次
2023-05-03更新
|
281次组卷
|
3卷引用:辽宁省部分学校联考2022-2023学年高一下学期4月月考化学试题
8 . 合成氨是目前人工固氮最重要的途径,研究合成氨的反应和氨气的用途具有重要意义。工业上合成氨的反应为: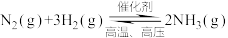 。请回答下列问题:
。请回答下列问题:
(1)①合成氨反应过程片段的作用机理,可以用如下模拟示意图表示。
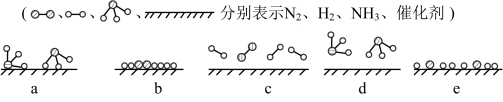
写出符合在催化剂表面合成氨反应过程的正确排序_______ (用字母标号表示)。
②已知:键能是指气态分子中1mol化学键解离成气态原子所吸收的能量或气态原子形成1mol化学键所放出的能量。结合下表中化学键的键能数值,计算合成氨反应中生成2molNH3(g)时_______ (填“吸收”或“放出”)的热量是_______ kJ。
(2)某同学在实验室模拟工业合成氨的反应:恒温下,在2L定容密闭容器中通入1molN2(g)和3molH2(g),催化剂存在下发生反应。
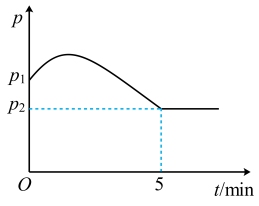
①容器中压强(P)随时间(t)的变化图象如图所示,测得p2=0.8p1,反应开始至5min,用NH3的浓度变化表示反应的平均速率为_______ mol/(L·min),平衡时氢气的转化率为_______ 。
②下列情况能说明该反应一定达到化学平衡状态的是_______ (填标号)。
A.每消耗nmolN2的同时生成2nmolNH3 B.3v正(H2)=2v逆(NH3)
C.H2的含量保持不变 D.混合气体的平均相对分子质量不变
(3)潜艇中使用的液氨—液氧燃料电池工作原理如图所示。
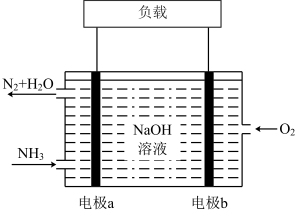
①电极b为电池的_______ (填“正极”或“负极”)。
②溶液中OH-向电极移动_______ (填“a”或“b”)。
③电极a的电极反应式为_______ 。
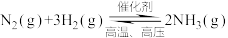 。请回答下列问题:
。请回答下列问题:(1)①合成氨反应过程片段的作用机理,可以用如下模拟示意图表示。

写出符合在催化剂表面合成氨反应过程的正确排序
②已知:键能是指气态分子中1mol化学键解离成气态原子所吸收的能量或气态原子形成1mol化学键所放出的能量。结合下表中化学键的键能数值,计算合成氨反应中生成2molNH3(g)时
| 化学键 | H-H | N-H | N≡N |
| 键能/(kJ·mol-1) | 436 | 391 | 946 |
①容器中压强(P)随时间(t)的变化图象如图所示,测得p2=0.8p1,反应开始至5min,用NH3的浓度变化表示反应的平均速率为

②下列情况能说明该反应一定达到化学平衡状态的是
A.每消耗nmolN2的同时生成2nmolNH3 B.3v正(H2)=2v逆(NH3)
C.H2的含量保持不变 D.混合气体的平均相对分子质量不变
(3)潜艇中使用的液氨—液氧燃料电池工作原理如图所示。

①电极b为电池的
②溶液中OH-向电极移动
③电极a的电极反应式为
您最近一年使用:0次
2022-07-12更新
|
585次组卷
|
4卷引用:辽宁省锦州市2021-2022学年高一下学期期末考试化学试卷
9 . 我国提出2060年前实现碳中和,为有效降低大气CO2中的含量,以CO2为原料制备甲烷、戊烷、甲醇等能源物质具有较好的发展前景。CO2在固体催化剂表面加氢合成甲烷过程中发生如下反应:
Ⅰ.主反应:
Ⅱ.副反应:
(1)已知:Ⅲ.
Ⅳ.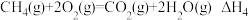
则
_______
(2)CO2加氢合成甲烷时,通常控制温度为 左右,其可能的原因为_______
左右,其可能的原因为_______
(3) 时,向1L恒容密闭容器中充入
时,向1L恒容密闭容器中充入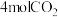 和
和 ,初始压强为p,
,初始压强为p, 时主、副反应都达到平衡状态,测得
时主、副反应都达到平衡状态,测得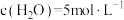 ,体系压强为
,体系压强为 ,则
,则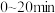 内
内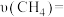
_______ ,平衡时 选择性=
选择性=_______ ( 选择性
选择性 ,计算保留三位有效数字)
,计算保留三位有效数字)
(4)以 催化加氢合成的甲醇为原料,在催化剂作用下可以制取丙烯,反应的化学方程式为
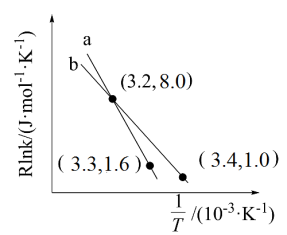
催化加氢合成的甲醇为原料,在催化剂作用下可以制取丙烯,反应的化学方程式为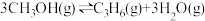 。该反应的Arrhenius经验公式的实验数据如图中曲线a所示,已知Arhenius经验公式
。该反应的Arrhenius经验公式的实验数据如图中曲线a所示,已知Arhenius经验公式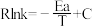 (
( 为活化能,k为速率常数,R和C为常数)。则该反应的活化能
为活化能,k为速率常数,R和C为常数)。则该反应的活化能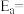
_______  。当改变外界条件时,实验数据如图中的曲线b所示,则实验可能改变的外界条件是
。当改变外界条件时,实验数据如图中的曲线b所示,则实验可能改变的外界条件是_______ 。
Ⅰ.主反应:

Ⅱ.副反应:

(1)已知:Ⅲ.

Ⅳ.
则

(2)CO2加氢合成甲烷时,通常控制温度为
 左右,其可能的原因为_______
左右,其可能的原因为_______| A.反应速率快 | B.平衡转化率高 |
| C.催化剂活性高 | D.主反应催化剂选择性好 |
 时,向1L恒容密闭容器中充入
时,向1L恒容密闭容器中充入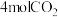 和
和 ,初始压强为p,
,初始压强为p, 时主、副反应都达到平衡状态,测得
时主、副反应都达到平衡状态,测得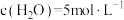 ,体系压强为
,体系压强为 ,则
,则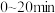 内
内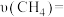
 选择性=
选择性= 选择性
选择性 ,计算保留三位有效数字)
,计算保留三位有效数字)(4)以
 催化加氢合成的甲醇为原料,在催化剂作用下可以制取丙烯,反应的化学方程式为
催化加氢合成的甲醇为原料,在催化剂作用下可以制取丙烯,反应的化学方程式为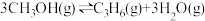 。该反应的Arrhenius经验公式的实验数据如图中曲线a所示,已知Arhenius经验公式
。该反应的Arrhenius经验公式的实验数据如图中曲线a所示,已知Arhenius经验公式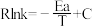 (
( 为活化能,k为速率常数,R和C为常数)。则该反应的活化能
为活化能,k为速率常数,R和C为常数)。则该反应的活化能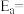
 。当改变外界条件时,实验数据如图中的曲线b所示,则实验可能改变的外界条件是
。当改变外界条件时,实验数据如图中的曲线b所示,则实验可能改变的外界条件是
您最近一年使用:0次
名校
解题方法
10 . 研究碳、氮、硫及卤素等单质及其化合物在生产生活和环境保护中有着重要意义。
I.反应I2+2S2O =2I-+S4O
=2I-+S4O 常用于精盐中碘含量测定。某同学利用该反应探究浓度对反应速率的影响。实验时均加入1 mL淀粉溶液作指示剂,若不经计算,可直接通过褪色时间的长短来判断浓度与反应速率的关系,下列试剂中:①1 mL 0.001 mol·L-1的碘水;②1 mL 0.01 mol·L-1的碘水③3 mL 0.001 mol·L-1的Na2S2O3溶液;④3 mL 0.01 mol·L-1的Na2S2O3溶液。
常用于精盐中碘含量测定。某同学利用该反应探究浓度对反应速率的影响。实验时均加入1 mL淀粉溶液作指示剂,若不经计算,可直接通过褪色时间的长短来判断浓度与反应速率的关系,下列试剂中:①1 mL 0.001 mol·L-1的碘水;②1 mL 0.01 mol·L-1的碘水③3 mL 0.001 mol·L-1的Na2S2O3溶液;④3 mL 0.01 mol·L-1的Na2S2O3溶液。
(1)应选择___________ (填代号)。
(2)若某同学选取②④进行实验,测得褪色时间为4s,忽略混合后溶液体积的变化,试计算v(S2O )=
)=___________ 。
II.一定条件下,在水溶液中1 mol Cl-、ClO (x=1,2,3,4)的能量(kJ)相对大小如图所示。
(x=1,2,3,4)的能量(kJ)相对大小如图所示。
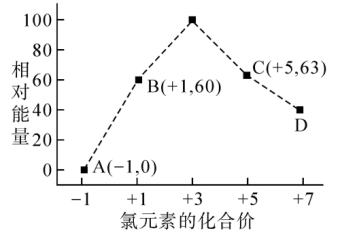
(3)D是___________ (填离子符号);
(4)B→A+C反应的离子方程式为:___________ ;当生成1 mol C时,___________ kJ的热量(填吸收或放出以及具体数值)。
III.工业上可以利用CO2和H2一定条件下合成甲醇,
(5)恒温恒容密闭容器中充入3 molH2和1 molCO2进行反应CO2(g)+3H2(g) CH3OH(g)+H2O(g),测得CO2(g)和CH3OH(g)浓度随时间变化如图所示。
CH3OH(g)+H2O(g),测得CO2(g)和CH3OH(g)浓度随时间变化如图所示。
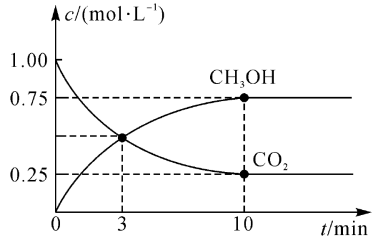
①从0min到3min,以H2的浓度变化表示的化学反应速率v(H2)=___________ 。
②下列表述不正确的是___________ (填字母)。
a.第3分钟时v正(CH3OH)小于第10分钟时v逆(CH3OH)
b.混合气体的平均相对分子质量不随时间的变化而变化,反应达到平衡状态
c.达到平衡时H2的转化率为75%
d.平衡混合气体中CO2(g)和H2(g)的质量之比是22:1
e.反应前的压强与平衡时的压强之比为8:5
(6)用CO2和H2合成甲醇时存在副反应,向某恒容容器中充入1mol CO2和3mol H2,发生如下反应:
①CO2(g)+3H2(g) CH3OH(g)+H2O(g);②CO2(g)+H2(g)
CH3OH(g)+H2O(g);②CO2(g)+H2(g)  CO(g)+H2O(g);③CO(g)+2H2(g)
CO(g)+H2O(g);③CO(g)+2H2(g)  CH3OH(g)。平衡时测得n(CH3OH)=a mol,n(CO)=b mol,则n(H2)=
CH3OH(g)。平衡时测得n(CH3OH)=a mol,n(CO)=b mol,则n(H2)=___________ mol。
I.反应I2+2S2O
 =2I-+S4O
=2I-+S4O 常用于精盐中碘含量测定。某同学利用该反应探究浓度对反应速率的影响。实验时均加入1 mL淀粉溶液作指示剂,若不经计算,可直接通过褪色时间的长短来判断浓度与反应速率的关系,下列试剂中:①1 mL 0.001 mol·L-1的碘水;②1 mL 0.01 mol·L-1的碘水③3 mL 0.001 mol·L-1的Na2S2O3溶液;④3 mL 0.01 mol·L-1的Na2S2O3溶液。
常用于精盐中碘含量测定。某同学利用该反应探究浓度对反应速率的影响。实验时均加入1 mL淀粉溶液作指示剂,若不经计算,可直接通过褪色时间的长短来判断浓度与反应速率的关系,下列试剂中:①1 mL 0.001 mol·L-1的碘水;②1 mL 0.01 mol·L-1的碘水③3 mL 0.001 mol·L-1的Na2S2O3溶液;④3 mL 0.01 mol·L-1的Na2S2O3溶液。(1)应选择
(2)若某同学选取②④进行实验,测得褪色时间为4s,忽略混合后溶液体积的变化,试计算v(S2O
 )=
)=II.一定条件下,在水溶液中1 mol Cl-、ClO
 (x=1,2,3,4)的能量(kJ)相对大小如图所示。
(x=1,2,3,4)的能量(kJ)相对大小如图所示。
(3)D是
(4)B→A+C反应的离子方程式为:
III.工业上可以利用CO2和H2一定条件下合成甲醇,
(5)恒温恒容密闭容器中充入3 molH2和1 molCO2进行反应CO2(g)+3H2(g)
 CH3OH(g)+H2O(g),测得CO2(g)和CH3OH(g)浓度随时间变化如图所示。
CH3OH(g)+H2O(g),测得CO2(g)和CH3OH(g)浓度随时间变化如图所示。
①从0min到3min,以H2的浓度变化表示的化学反应速率v(H2)=
②下列表述不正确的是
a.第3分钟时v正(CH3OH)小于第10分钟时v逆(CH3OH)
b.混合气体的平均相对分子质量不随时间的变化而变化,反应达到平衡状态
c.达到平衡时H2的转化率为75%
d.平衡混合气体中CO2(g)和H2(g)的质量之比是22:1
e.反应前的压强与平衡时的压强之比为8:5
(6)用CO2和H2合成甲醇时存在副反应,向某恒容容器中充入1mol CO2和3mol H2,发生如下反应:
①CO2(g)+3H2(g)
 CH3OH(g)+H2O(g);②CO2(g)+H2(g)
CH3OH(g)+H2O(g);②CO2(g)+H2(g)  CO(g)+H2O(g);③CO(g)+2H2(g)
CO(g)+H2O(g);③CO(g)+2H2(g)  CH3OH(g)。平衡时测得n(CH3OH)=a mol,n(CO)=b mol,则n(H2)=
CH3OH(g)。平衡时测得n(CH3OH)=a mol,n(CO)=b mol,则n(H2)=
您最近一年使用:0次



