1 . 纳米氧化锌具有颗粒微小,比表面积大,分散性好,疏松多孔等物理特性和极强的化学活性,目前已广泛用于橡胶、陶瓷、催化剂、涂料和磁性材料的辅助生产。以铜转炉烟灰为原料,采用浸取、均相沉淀、干燥煅烧等工艺制备纳米氧化锌的工艺方法过程简单,生产成本低。具体流程如下:
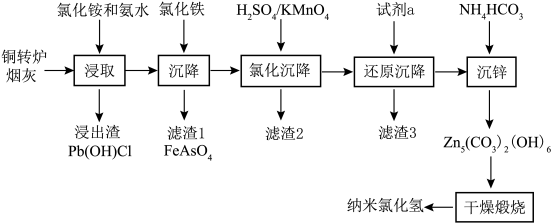
已知某铜转炉烟灰化学成分百分含量分析如下表:
铜转炉烟灰主要化学成分分析结果 %
以上金属元素在铜转炉烟灰中均以硫酸盐和氧化物形式存在,砷以砷酸盐形式存在。
流程中涉及离子的氢氧化物溶度积常数如下表:
请回答下列问题:
(1)“浸取”温度应选择40℃左右为宜。温度高于40℃ ,浸出率随温度升高而降低的原因可能是___________ ;
(2)若“浸取”所得滤液中锌元素以[Zn(NH3)4]2+形式存在,则浸取时ZnO发生反应的离子方程式为___________ 。
(3)在“沉降”过程中,FeCl3做沉淀剂可起到两点作用,一是与砷酸根结合生成FeAsO4沉淀,二是___________ ,缩短沉降时间;
(4)用酸性高锰酸钾溶液“氧化沉降”时,需调整溶液pH=5 ,使还原产物为MnO2,滤渣2主要成分为___________ ;
(5)“还原沉降”选用的“试剂a”为___________ (填化学式);
(6)“沉锌”反应的离子方程式为___________ ,整个流程中可以循环利用的副产品是___________ (填化学式);
(7)若想通过“干燥煅烧”得到更多活性较高的纳米氧化锌,应在“沉锌”时注意调整 和Zn2+的浓度,以保证最终沉淀物粒径在1um 以下,通过下表可判断,当Zn2+的浓度恒定在0.8 mol·L-1时,
和Zn2+的浓度,以保证最终沉淀物粒径在1um 以下,通过下表可判断,当Zn2+的浓度恒定在0.8 mol·L-1时,  的浓度为
的浓度为___________ 沉淀物的粒径最佳。

已知某铜转炉烟灰化学成分百分含量分析如下表:
铜转炉烟灰主要化学成分分析结果 %
| Cu | Zn | Pb | Fe( Ⅱ) | As |
| 10.30 | 8.75 | 19.07 | 2.51 | 4.68 |
流程中涉及离子的氢氧化物溶度积常数如下表:
| 离子 | Cu2+ | Zn2+ | Fe2+ | Fe3+ |
| Ksp | 2.2× 10-20 | 6.7×10-17 | 8.0×10-16 | 4.0×10-38 |
(1)“浸取”温度应选择40℃左右为宜。温度高于40℃ ,浸出率随温度升高而降低的原因可能是
(2)若“浸取”所得滤液中锌元素以[Zn(NH3)4]2+形式存在,则浸取时ZnO发生反应的离子方程式为
(3)在“沉降”过程中,FeCl3做沉淀剂可起到两点作用,一是与砷酸根结合生成FeAsO4沉淀,二是
(4)用酸性高锰酸钾溶液“氧化沉降”时,需调整溶液pH=5 ,使还原产物为MnO2,滤渣2主要成分为
(5)“还原沉降”选用的“试剂a”为
(6)“沉锌”反应的离子方程式为
(7)若想通过“干燥煅烧”得到更多活性较高的纳米氧化锌,应在“沉锌”时注意调整
 和Zn2+的浓度,以保证最终沉淀物粒径在1um 以下,通过下表可判断,当Zn2+的浓度恒定在0.8 mol·L-1时,
和Zn2+的浓度,以保证最终沉淀物粒径在1um 以下,通过下表可判断,当Zn2+的浓度恒定在0.8 mol·L-1时,  的浓度为
的浓度为n( )/n(Zn2+) )/n(Zn2+) | 粒度分布质量分数1% | ||||
| 0.0-0.1um | 0.1~0.5um | 0.5~1.0um | 1.0~5.0um | 5.0um以上 | |
| 2 | 25.3 | 38.41 | 34.55 | 1.74 | 0.001 |
| 2.5 | 40.82 | 50.35 | 8.37 | 0.46 | 0.001 |
| 3 | 35.2 | 55.37 | 8.2 | 1.23 | 0.001 |
您最近一年使用:0次
2023-04-29更新
|
213次组卷
|
2卷引用:内蒙古呼和浩特市2023届高三下学期第二次质量数据监测理科综合化学试题
名校
2 . H2、CO、CH4、CH3OH等都是重要的能源,也是重要为化工原料。
(1)已知25℃,1.01×105Pa时,8.0g CH4完全燃烧生成二氧化碳气体和液态水放出444.8kJ热量。写出该反应的热化学反应方程式:___________________________________________ 。
(2)为倡导“节能减排”和“低碳经济”,降低大气中CO2的含量及有效地开发利用CO2,工业上可以用CO2来生产燃料甲醇。在体积为2L的密闭容器中,充入lmol CO2和3mol H2,一定条件下发生反应:CO2(g) + 3H2(g) CH3OH(g) + H2O(g)。经测得CO2和CH3OH(g)的物质的量随时间变化如图所示。
CH3OH(g) + H2O(g)。经测得CO2和CH3OH(g)的物质的量随时间变化如图所示。

①从反应开始到平衡,CO2的平均反应速率v(CO2)=___________________ 。
②达到平衡时,H2的转化率为__________ 。
③该反应的平衡常数K=___________________ (表达式)。
④下列措施不能提高反应速率的是__________ 。
A.升高温度 B.加入催化剂 C.增大压强 D.及时分离出CH3OH
(3)工业上也用CO和H2为原料制备CH3OH,反应方程式为:CO(g) + 2H2(g) CH3OH(g),在一体积固定的密闭容器中投入一定量的CO和H2气体进行上述反应。下列叙述中能说明上述反应达到平衡状态的是
CH3OH(g),在一体积固定的密闭容器中投入一定量的CO和H2气体进行上述反应。下列叙述中能说明上述反应达到平衡状态的是______ 。
A.反应中CO与CH3OH的物质的量之比为1:1
B.混合气体的压强不随时间的变化而变化
C.单位时间内每消耗1 mol CO,同时生成1 mol CH3OH
D.CH3OH的质量分数在混合气体中保持不变
E.混合气体的密度保持不变
(1)已知25℃,1.01×105Pa时,8.0g CH4完全燃烧生成二氧化碳气体和液态水放出444.8kJ热量。写出该反应的热化学反应方程式:
(2)为倡导“节能减排”和“低碳经济”,降低大气中CO2的含量及有效地开发利用CO2,工业上可以用CO2来生产燃料甲醇。在体积为2L的密闭容器中,充入lmol CO2和3mol H2,一定条件下发生反应:CO2(g) + 3H2(g)
 CH3OH(g) + H2O(g)。经测得CO2和CH3OH(g)的物质的量随时间变化如图所示。
CH3OH(g) + H2O(g)。经测得CO2和CH3OH(g)的物质的量随时间变化如图所示。
①从反应开始到平衡,CO2的平均反应速率v(CO2)=
②达到平衡时,H2的转化率为
③该反应的平衡常数K=
④下列措施不能提高反应速率的是
A.升高温度 B.加入催化剂 C.增大压强 D.及时分离出CH3OH
(3)工业上也用CO和H2为原料制备CH3OH,反应方程式为:CO(g) + 2H2(g)
 CH3OH(g),在一体积固定的密闭容器中投入一定量的CO和H2气体进行上述反应。下列叙述中能说明上述反应达到平衡状态的是
CH3OH(g),在一体积固定的密闭容器中投入一定量的CO和H2气体进行上述反应。下列叙述中能说明上述反应达到平衡状态的是A.反应中CO与CH3OH的物质的量之比为1:1
B.混合气体的压强不随时间的变化而变化
C.单位时间内每消耗1 mol CO,同时生成1 mol CH3OH
D.CH3OH的质量分数在混合气体中保持不变
E.混合气体的密度保持不变
您最近一年使用:0次
2018-07-24更新
|
326次组卷
|
4卷引用:【全国百强校】内蒙古集宁一中(西校区)2017-2018学年高一下学期期末考试化学试题
【全国百强校】内蒙古集宁一中(西校区)2017-2018学年高一下学期期末考试化学试题【全国市级联考】江苏省无锡市普通高中2017-2018学年高一下学期期末考试化学试题(已下线)【新东方】高中化学140(已下线)2022年浙江1月高考真题变式题(26-31)
解题方法
3 . 利用化学反应原理分析指导工业生产具有重要的现实意义,回答下列问题。
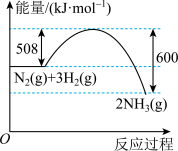
(1)如图是合成氨反应过程中能量变化示意图,请写出N2和H2反应的热化学方式:_____ 。
(2)合成氨的反应,T1℃时在容积为2L的恒容密闭容器中通入2molN2和5molH2发生反应。5min时反应达到平衡状态,达平衡时N2(g)的转化率为50%,求:
①0~5min内该反应的平均速率v(H2)=_____ mol/(L•min);平衡常数K=_____ 。
②相同条件下,改变反应物的起始通入量,某时刻测得N2、H2、NH3的物质的量分别为2mol、4mol、2mol,则此时反应达到平衡状态_____ (填“是”或“否” ),v正
),v正_____ v逆(填“>”、“<”或“=”)。
③对于该反应,既可以提高平衡体系中NH3的百分含量,又能加快反应速率的措施是_____ (填序号)。
a.升高温度 b.将平衡体系中的NH3(g)分离出来
c.减小容器的体积增大体系压强 d.加入合适的催化剂

(1)如图是合成氨反应过程中能量变化示意图,请写出N2和H2反应的热化学方式:
(2)合成氨的反应,T1℃时在容积为2L的恒容密闭容器中通入2molN2和5molH2发生反应。5min时反应达到平衡状态,达平衡时N2(g)的转化率为50%,求:
①0~5min内该反应的平均速率v(H2)=
②相同条件下,改变反应物的起始通入量,某时刻测得N2、H2、NH3的物质的量分别为2mol、4mol、2mol,则此时反应达到平衡状态
 ),v正
),v正③对于该反应,既可以提高平衡体系中NH3的百分含量,又能加快反应速率的措施是
a.升高温度 b.将平衡体系中的NH3(g)分离出来
c.减小容器的体积增大体系压强 d.加入合适的催化剂
您最近一年使用:0次
2022-12-11更新
|
83次组卷
|
2卷引用:内蒙古赤峰第四中学2023-2024学年高二上学期12月期中考试化学试题
名校
4 . 臭氧在烟气脱硝中的反应为2NO2(g)+O3(g) N2O5(g)+O2(g)。若此反应在恒容密闭容器中进行,相关图像如下,其中对应分析结论正确的是
N2O5(g)+O2(g)。若此反应在恒容密闭容器中进行,相关图像如下,其中对应分析结论正确的是
 N2O5(g)+O2(g)。若此反应在恒容密闭容器中进行,相关图像如下,其中对应分析结论正确的是
N2O5(g)+O2(g)。若此反应在恒容密闭容器中进行,相关图像如下,其中对应分析结论正确的是A.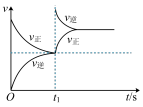 恒温,t1时再充入O3 恒温,t1时再充入O3 |
B. 0~2 s内,υ(O3)=0.2 mol·L-1·s-1 0~2 s内,υ(O3)=0.2 mol·L-1·s-1 |
C.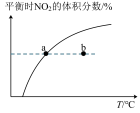 υ正:b点<a点,b点:υ逆<υ正 υ正:b点<a点,b点:υ逆<υ正 |
D.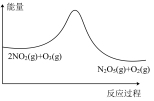 平衡后降温,NO2含量降低 平衡后降温,NO2含量降低 |
您最近一年使用:0次
2022-09-01更新
|
324次组卷
|
18卷引用:【全国百强校】内蒙古鄂尔多斯市第一中学2018-2019学年高二上学期期中考试模拟化学试题
【全国百强校】内蒙古鄂尔多斯市第一中学2018-2019学年高二上学期期中考试模拟化学试题2015届天津市河西区高三下学期总复习质量调查(二)化学试卷2017届湖南师大附中高三上学期入学摸底考试化学试卷2017届河北省武邑中学高三上学期第三次调研化学试卷湖南省湖南师范大学附属中学2019届高三上学期月考(一)化学试题【全国百强校】湖南省师范大学附属中学2019届高三上学期月考化学试题【全国百强校】广东省深圳市高级中学2018-2019学年高二上学期期中考试化学试题【全国百强校】山东省泰安市第一中学2019届高三上学期12月学情诊断化学试题江西省九江市同文中学2019届高三上学期期中考试化学试题陕西省商南县高级中学2019届高三上学期四模考试理科综合化学试题【全国百强校】安徽省合肥市第六中学2018-2019学年高二下学期开学考试化学试题【市级联考】河南省八市2018-2019学年高二下学期第三次质量检测化学试题安徽省砀山县第二中学2019-2020学年高二10月月考化学试题安徽省砀山县第二中学2020届高三上学期第四次月考化学试题湖南省长郡中学2019-2020学年高二上学期第三次月考化学试题广东省深圳市宝安区2019-2020学年高二上学期期末调研考试化学试题江西省吉安市安福二中、吉安县三中、井大附中三校2021-2022学年高二上学期12月联考化学试题山西省太原市第五中学校2022-2023学年高二上学期10月月考化学试题
解题方法
5 . 在一定温度下,将2mol A和2molB 两种气体相混合于容积为2L的某密闭容器中,发生如下反应:3A(g)+B(g)  xC(g)+2D(g),2分钟末反应达到平衡状态,生成了0.6mol D,并测得C的浓度为0.45mol/L,请填写下列空白:
xC(g)+2D(g),2分钟末反应达到平衡状态,生成了0.6mol D,并测得C的浓度为0.45mol/L,请填写下列空白:
(1)A的转化率为________
(2)2分钟内生成D的反应速率为______
(3)x值等于______
(4)如果增大反应体系的压强,则平衡体系中C的质量分数_______ (填“增大”“减小”或“不变”)
 xC(g)+2D(g),2分钟末反应达到平衡状态,生成了0.6mol D,并测得C的浓度为0.45mol/L,请填写下列空白:
xC(g)+2D(g),2分钟末反应达到平衡状态,生成了0.6mol D,并测得C的浓度为0.45mol/L,请填写下列空白:(1)A的转化率为
(2)2分钟内生成D的反应速率为
(3)x值等于
(4)如果增大反应体系的压强,则平衡体系中C的质量分数
您最近一年使用:0次
6 . 在一定温度下,将2molA和2molB两种气体相混合于容积为2L的某密闭容器中,发生如下反应:3A(g)+B(g)  xC(g)+2D(g),2min后反应达平衡状态,生成0.8molD,并测得C的浓度为0.4mol/L,请填写下列空白:
xC(g)+2D(g),2min后反应达平衡状态,生成0.8molD,并测得C的浓度为0.4mol/L,请填写下列空白:
(1)x值等于____ ;
(2)A的转化率为______ ;
(3)生成D的反应速率为___________ ;
(4)如果增大体系的压强,则平衡体系中C的质量分数_____ (填“增大”、“ 减小”或“不变”)。
 xC(g)+2D(g),2min后反应达平衡状态,生成0.8molD,并测得C的浓度为0.4mol/L,请填写下列空白:
xC(g)+2D(g),2min后反应达平衡状态,生成0.8molD,并测得C的浓度为0.4mol/L,请填写下列空白:(1)x值等于
(2)A的转化率为
(3)生成D的反应速率为
(4)如果增大体系的压强,则平衡体系中C的质量分数
您最近一年使用:0次
2019-12-12更新
|
77次组卷
|
4卷引用:内蒙古通辽市科左后旗甘旗卡第二高级中学2020-2021学年高二下学期开学考试化学试题
7 . 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,合成氨工业在国民生产中有重要意义。以下是关于合成氨的有关问题,请回答:
(1)若在一容积为 的密闭容器中加入
的密闭容器中加入 的
的 和
和 的
的 在一定条件下发生反应:
在一定条件下发生反应:
 ,若在5分钟时反应达到平衡,此时测得
,若在5分钟时反应达到平衡,此时测得 的物质的量为
的物质的量为 。则前5分钟的平均反应速率
。则前5分钟的平均反应速率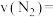
______ 。平衡时 的转化率为
的转化率为_____  。
。
(2)下列能判定(1)中合成氨反应到达平衡状态的是___________
A. 容器内压强保持不变
B. 容器内混合气体的密度保持不变
C. 容器内混合气体的平均相对分子质量保持不变
D.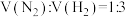
E.单位时间内每断裂 ,同时形成
,同时形成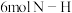
(3)平衡后,若提高 的转化率,可以采取的措施有
的转化率,可以采取的措施有___________ 。
A. 加了催化剂
B. 增大容器体积
C. 降低反应体系的温度
D. 加入一定量
(4)若在 的密闭容器中,一定量的氮气和氢气进行如下反应:
的密闭容器中,一定量的氮气和氢气进行如下反应:
 ,其化学平衡常数
,其化学平衡常数 与温度
与温度 的关系如表所示:
的关系如表所示:
请完成下列问题:
①试比较 、
、 的大小,
的大小,
___________  (填“
(填“ ”“
”“ ”或“
”或“ ”);
”);
②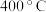 时,反应
时,反应 的化学平衡常数为
的化学平衡常数为___________ 。当测得 、
、 和
和 物质的量分别为
物质的量分别为 、
、 和
和 时,则该反应的
时,则该反应的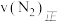
_______ 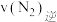 (填“
(填“ ”“
”“ ”或“
”或“ ”)。
”)。
(1)若在一容积为
 的密闭容器中加入
的密闭容器中加入 的
的 和
和 的
的 在一定条件下发生反应:
在一定条件下发生反应:
 ,若在5分钟时反应达到平衡,此时测得
,若在5分钟时反应达到平衡,此时测得 的物质的量为
的物质的量为 。则前5分钟的平均反应速率
。则前5分钟的平均反应速率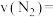
 的转化率为
的转化率为 。
。(2)下列能判定(1)中合成氨反应到达平衡状态的是
A. 容器内压强保持不变
B. 容器内混合气体的密度保持不变
C. 容器内混合气体的平均相对分子质量保持不变
D.
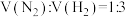
E.单位时间内每断裂
 ,同时形成
,同时形成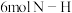
(3)平衡后,若提高
 的转化率,可以采取的措施有
的转化率,可以采取的措施有A. 加了催化剂
B. 增大容器体积
C. 降低反应体系的温度
D. 加入一定量

(4)若在
 的密闭容器中,一定量的氮气和氢气进行如下反应:
的密闭容器中,一定量的氮气和氢气进行如下反应:
 ,其化学平衡常数
,其化学平衡常数 与温度
与温度 的关系如表所示:
的关系如表所示: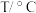 | 200 | 300 | 400 |
 |  |  | 0.5 |
①试比较
 、
、 的大小,
的大小,
 (填“
(填“ ”“
”“ ”或“
”或“ ”);
”);②
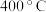 时,反应
时,反应 的化学平衡常数为
的化学平衡常数为 、
、 和
和 物质的量分别为
物质的量分别为 、
、 和
和 时,则该反应的
时,则该反应的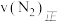
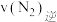 (填“
(填“ ”“
”“ ”或“
”或“ ”)。
”)。
您最近一年使用:0次
2021-01-05更新
|
216次组卷
|
2卷引用:内蒙古包头市第一中学2020-2021学年高二上学期期中考试化学试题
名校
解题方法
8 . 不同温度压强下,在合成氨平衡体系中N2(g)+3H2(g) 2NH3(g),NH3的物质的量分数见表(N2和H2起始物质的量之比为1:3)
2NH3(g),NH3的物质的量分数见表(N2和H2起始物质的量之比为1:3)

(1)已知该反应在2L密闭容器中进行,2min内氨的质量增加了3.4g,则此段时间内H2的平均反应速率为___ mol/(L·min)。
(2)该反应的平衡常数表达式K=___ ,升高温度,K值___ (选填“增大”、“减小”或“不变”)。T℃(K=3.6)的某一时刻下,c(N2)=1mol/L,c(H2)=3mol/L,c(NH3)=9mol/L,在这种情况下该反应是否处于平衡状态___ (选填“是”、“否”),此时反应速率 正
正___  逆(选填“>”“<”、“=”)。
逆(选填“>”“<”、“=”)。
(3)合成氨生产条件一般为压强在20MPa~50MPa,温度为500℃左右,选用该条件的主要原因是__ ;从表中数据可知,在该条件下氨的平衡含量并不高,为提高原料利用率,工业生产中采取的措施是___ 。
 2NH3(g),NH3的物质的量分数见表(N2和H2起始物质的量之比为1:3)
2NH3(g),NH3的物质的量分数见表(N2和H2起始物质的量之比为1:3)
(1)已知该反应在2L密闭容器中进行,2min内氨的质量增加了3.4g,则此段时间内H2的平均反应速率为
(2)该反应的平衡常数表达式K=
 正
正 逆(选填“>”“<”、“=”)。
逆(选填“>”“<”、“=”)。(3)合成氨生产条件一般为压强在20MPa~50MPa,温度为500℃左右,选用该条件的主要原因是
您最近一年使用:0次
名校
解题方法
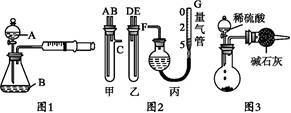
9 . 某校化学小组的同学开展了一系列的化学实验活动。
请你参与实验并完成下列问题:
(1)甲同学用图1所示装置,测量锌与硫酸反应速率:把2 g锌粒放入锥形瓶内,通过分液漏斗加入1 mol·L-1稀硫酸40 mL,收集10 mL气体,通过记录______ 得到反应速率为x mol·(L·min)-1.实验开始时检查该装置气密性的方法是______ 。
(2)乙同学用图2装置测定Na2CO3和NaCl的固体混合物中Na2CO3的质量分数:
①甲、乙两试管各有两根导管,用橡胶管连接对应接口后,倒置盛稀硫酸的试管,发生反应,放出气体,则固体混合物和稀硫酸应分别置于______ 、__ 仪器中(填仪器编号);
②G管可以用化学实验室里的一种常用仪器来替代,这种仪器是______ ;
③仪器甲、乙接口的连接方式如下:A连接__ ,B连接______ ,C连接______ (填写各接口的编号);
④为提高测量的准确性,收集完气体后,丙装置读数前应进行的操作是______ 。
(3)丙同学与甲同学实验目的相同:用图3装置测定生成的CO2的质量,但该装置存在明显缺陷,从而导致实验误差_____ ,请你分析其中使测定结果可能偏大的主要原因______ 。

请你参与实验并完成下列问题:
(1)甲同学用图1所示装置,测量锌与硫酸反应速率:把2 g锌粒放入锥形瓶内,通过分液漏斗加入1 mol·L-1稀硫酸40 mL,收集10 mL气体,通过记录
(2)乙同学用图2装置测定Na2CO3和NaCl的固体混合物中Na2CO3的质量分数:
①甲、乙两试管各有两根导管,用橡胶管连接对应接口后,倒置盛稀硫酸的试管,发生反应,放出气体,则固体混合物和稀硫酸应分别置于
②G管可以用化学实验室里的一种常用仪器来替代,这种仪器是
③仪器甲、乙接口的连接方式如下:A连接
④为提高测量的准确性,收集完气体后,丙装置读数前应进行的操作是
(3)丙同学与甲同学实验目的相同:用图3装置测定生成的CO2的质量,但该装置存在明显缺陷,从而导致实验误差
您最近一年使用:0次
名校
10 . 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,合成氨工业在国民生产中有重要意义。以下是关于合成氨的有关问题,请回答:
(1)若在一容积为2 L的密闭容器中加入0.2 mol的N2和0.6 mol的H2在一定条件下发生反应: N2(g) +3H2(g) 2NH3(g) ΔH<0,若在5分钟时反应达到平衡,此时测得NH3的物质的量为0.2 mol。则前5分钟的平均反应速率v(N2)=
2NH3(g) ΔH<0,若在5分钟时反应达到平衡,此时测得NH3的物质的量为0.2 mol。则前5分钟的平均反应速率v(N2)=___________ 。平衡时H2的转化率为__________ 。
(2)平衡后,若提高H2的转化率,可以采取的措施有____________________ 。
A.加了催化剂
B.增大容器体积
C.降低反应体系的温度
D.加入一定量N2
(3)若在0.5 L的密闭容器中,一定量的氮气和氢气进行如下反应:
N2(g)+3H2(g) 2NH3(g) ΔH<0,其化学平衡常数K与温度T的关系如表所示:
2NH3(g) ΔH<0,其化学平衡常数K与温度T的关系如表所示:
请完成下列问题:
①试比较K1、K2的大小,K1_________________ K2(填“<”“>”或“=” );
②下列各项能作为判断该反应达到化学平衡状态的依据是_______ (填序号字母)
A.容器内N2、H2、NH3的物质的量浓度之比为1:3:2
B.v(H2)正=3v(N2)逆
C.容器内压强保持不变
D.混合气体的密度保持不变
③400℃时,反应2NH3(g) N2(g)+3H2(g)的化学平衡常数为
N2(g)+3H2(g)的化学平衡常数为_______ 。当测得NH3、N2和H2物质的量分别为3 mol、2 mol和 1 mol时,则该反应的v(N2)正________ v(N2)逆(填“<”“>”或“=”)。
(1)若在一容积为2 L的密闭容器中加入0.2 mol的N2和0.6 mol的H2在一定条件下发生反应: N2(g) +3H2(g)
 2NH3(g) ΔH<0,若在5分钟时反应达到平衡,此时测得NH3的物质的量为0.2 mol。则前5分钟的平均反应速率v(N2)=
2NH3(g) ΔH<0,若在5分钟时反应达到平衡,此时测得NH3的物质的量为0.2 mol。则前5分钟的平均反应速率v(N2)=(2)平衡后,若提高H2的转化率,可以采取的措施有
A.加了催化剂
B.增大容器体积
C.降低反应体系的温度
D.加入一定量N2
(3)若在0.5 L的密闭容器中,一定量的氮气和氢气进行如下反应:
N2(g)+3H2(g)
 2NH3(g) ΔH<0,其化学平衡常数K与温度T的关系如表所示:
2NH3(g) ΔH<0,其化学平衡常数K与温度T的关系如表所示:| T/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
①试比较K1、K2的大小,K1
②下列各项能作为判断该反应达到化学平衡状态的依据是
A.容器内N2、H2、NH3的物质的量浓度之比为1:3:2
B.v(H2)正=3v(N2)逆
C.容器内压强保持不变
D.混合气体的密度保持不变
③400℃时,反应2NH3(g)
 N2(g)+3H2(g)的化学平衡常数为
N2(g)+3H2(g)的化学平衡常数为
您最近一年使用:0次



