名校
1 . 聚丙烯腈纤维俗名人造羊毛,由丙烯腈聚合而得。用丙烯合成丙烯腈的反应如下: 2C3H6(g)+2NH3(g)+3O2(g)  2C3H3N(g)+6H2O(g)+1030kJ
2C3H3N(g)+6H2O(g)+1030kJ
(1)碳在元素周期表中的位置是_______ ;C、N、O三种元素的原子半径由小到大的顺序为_______ ;
(2)某密闭容器中发生上述反应,生成丙烯腈的反应速率与反应时间的关系如下图所示。
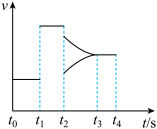
t1时刻表示体系改变的反应条件为_______ ; t2时刻表示体系改变了另一反应条件,此时平衡_______ 移动(填“正向”、“逆向”或“不”)。
丙烯的转化率与反应温度的关系如图示:

(3)有利于提高丙烯平衡转化率的反应条件有_______ ;
(4)最大转化率所对应的温度为460℃。当温度低于460℃时,丙烯的转化率_______ (填“是”或“不是”)所对应温度下的平衡转化率,理由是_______ 。
(5)一定条件下,在2L恒容密闭容器中,通入84g C3H6、34g NH3、96g O2,若该反应5 min到达a点,则0~5min内丙烯的平均反应速率为_______ mol∙L−1∙min−1。
 2C3H3N(g)+6H2O(g)+1030kJ
2C3H3N(g)+6H2O(g)+1030kJ(1)碳在元素周期表中的位置是
(2)某密闭容器中发生上述反应,生成丙烯腈的反应速率与反应时间的关系如下图所示。

t1时刻表示体系改变的反应条件为
丙烯的转化率与反应温度的关系如图示:

(3)有利于提高丙烯平衡转化率的反应条件有
(4)最大转化率所对应的温度为460℃。当温度低于460℃时,丙烯的转化率
(5)一定条件下,在2L恒容密闭容器中,通入84g C3H6、34g NH3、96g O2,若该反应5 min到达a点,则0~5min内丙烯的平均反应速率为
您最近半年使用:0次
2023-04-14更新
|
522次组卷
|
4卷引用:上海市静安区2022-2023学年高三下学期二模测试化学试题
上海市静安区2022-2023学年高三下学期二模测试化学试题(已下线)上海市静安区2022-2023学年高三下学期二模变式题(原理综合题)(已下线)【知识图鉴】单元讲练测选择性必修1第2单元02基础练河北省衡水市饶阳中学2022-2023学年高一下学期期末考试化学试题
名校
解题方法
2 . 砷及其化合物被运用在农药、除草剂、杀虫剂与多种合金中,其中三氧化二砷(AS2O3)被称为砒霜,是一 种毒性很强的物质。回答下列问题:
(1)As在元素周期表中的位置是_____________ ,AsH3的电子式_________ 。
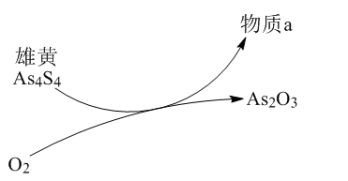
(2)一定条件下,雄黄(As4S4)与As2O3的转化关系如图所示。若该反应中1mol As4S4(其中As元素的化合价为+2)参加反应时,转移28mole-,则物质a为_________ (填化学式)。
(3)焦炭真空冶炼砷时需加入催化剂,其中部分反应的热化学方程式如下:
反应 I .As2O3(g) +3C(s) 2As(g) +3CO(g)
2As(g) +3CO(g) 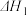 =a kJ· mol-1
=a kJ· mol-1
反应 II.As2O3(g) +3C(s)
 As4(g) +3CO(g)
As4(g) +3CO(g) 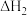 =b kJ ·mol-1
=b kJ ·mol-1
反应III.As4(g) 4As(g)
4As(g) 
①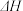 =
=_________ kJ ·mol-1 (用含a,b的代数式表示)。
②反应中催化剂的活性会因为反应II[生成As4(g)]的发生而降低,同时存在的反应III可使As4(g)的量减少。已知催化剂X、Y的相关数据如表所示:
由表中数据判断催化剂X_______ (填“优于”或“劣于”)催化剂Y。
(4)298 K 时,将 20mL 3xmol·L-1 Na3AsO3溶液、20 ml 3xmol·L-l I2溶液和 20mL 6xmol· L-l NaOH 溶液混合(忽略溶液体积变化),发生反应: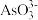 (aq) +I2(aq) +2OH-(aq)
(aq) +I2(aq) +2OH-(aq)
 (aq) +2I-(aq) +H2O(l)。溶液中 c(
(aq) +2I-(aq) +H2O(l)。溶液中 c( )与反应时间(t)的关系如图所示。
)与反应时间(t)的关系如图所示。
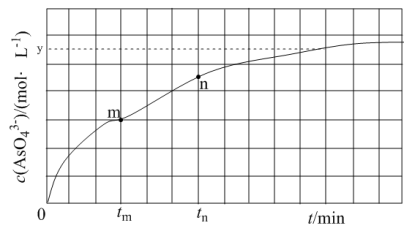
①下列可说明反应达到平衡的是_______ (填标号)。
a.v(I- ) =2v(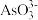 )
)
b.溶液的c(OH-)不再发生变化
c.c(I-) =ymol· L-1
d.c( )/c(
)/c(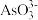 )不再发生变化
)不再发生变化
e.c(Na+) =5xmol· L-1
②tm min时,v正(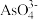 )
)_______ (填“大于”“小于”或“等于”)v逆( 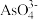 )。
)。
③tm min时,v逆(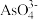 )
) _______ (填“大于”“小于”或“等于”)tn时v逆( 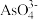 ),理由是
),理由是___________________ 。
(1)As在元素周期表中的位置是
(2)一定条件下,雄黄(As4S4)与As2O3的转化关系如图所示。若该反应中1mol As4S4(其中As元素的化合价为+2)参加反应时,转移28mole-,则物质a为

(3)焦炭真空冶炼砷时需加入催化剂,其中部分反应的热化学方程式如下:
反应 I .As2O3(g) +3C(s)
 2As(g) +3CO(g)
2As(g) +3CO(g) 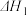 =a kJ· mol-1
=a kJ· mol-1反应 II.As2O3(g) +3C(s)

 As4(g) +3CO(g)
As4(g) +3CO(g) 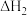 =b kJ ·mol-1
=b kJ ·mol-1反应III.As4(g)
 4As(g)
4As(g) 
①
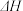 =
=②反应中催化剂的活性会因为反应II[生成As4(g)]的发生而降低,同时存在的反应III可使As4(g)的量减少。已知催化剂X、Y的相关数据如表所示:
| 反应II | 反应III | ||
| 活化能/ (kJ ·mol -1 ) | 催化剂X | 56 | 75 |
| 催化剂Y | 37 | 97 | |
由表中数据判断催化剂X
(4)298 K 时,将 20mL 3xmol·L-1 Na3AsO3溶液、20 ml 3xmol·L-l I2溶液和 20mL 6xmol· L-l NaOH 溶液混合(忽略溶液体积变化),发生反应:
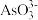 (aq) +I2(aq) +2OH-(aq)
(aq) +I2(aq) +2OH-(aq)
 (aq) +2I-(aq) +H2O(l)。溶液中 c(
(aq) +2I-(aq) +H2O(l)。溶液中 c( )与反应时间(t)的关系如图所示。
)与反应时间(t)的关系如图所示。
①下列可说明反应达到平衡的是
a.v(I- ) =2v(
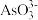 )
) b.溶液的c(OH-)不再发生变化
c.c(I-) =ymol· L-1
d.c(
 )/c(
)/c(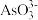 )不再发生变化
)不再发生变化e.c(Na+) =5xmol· L-1
②tm min时,v正(
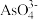 )
)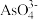 )。
)。③tm min时,v逆(
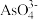 )
) 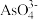 ),理由是
),理由是
您最近半年使用:0次
名校
3 . I.化学反应中伴随着能量变化,探究各种能量变化是一永恒的主题。
(1)下列变化属于放热反应的是_______ (填序号)。
a.生石灰溶于水 b.氢氧化钠固体溶于水 c.氢气与氯气化合 d.氯化铵固体与氢氧化钡晶体混合搅拌 e.盐酸与碳酸氢钠反应 f.铝和氧化铁高温下反应 g.灼热的木炭中通入 h.碘升华 i.石灰石受热分解 j.水蒸气液化 k.过氧化钠溶于水
h.碘升华 i.石灰石受热分解 j.水蒸气液化 k.过氧化钠溶于水
(2)下列图像分别表示有关反应的反应过程与能量变化的关系:
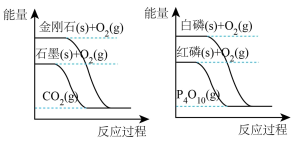
据此判断下列说法中正确的是_______ (填序号)。
a.等质量的石墨和金刚石完全燃烧释放的热量相同
b.在一定条件下,石墨转化为金刚石为吸热反应
c.白磷和红磷互为同素异形体,相同条件下白磷比红磷稳定
d.白磷与氧气反应,断开化学键所吸收的热量大于形成新的化学键所释放的能量
f.红磷的能量高于 的能量
的能量
Ⅱ.碳是一种常见元素,它以多种形式广泛存在于大气、地壳和生物之中。请回答:
(3)碳元素在元素周期表中的位置为_______ ,大气中存在温室气体 ,写出
,写出 的电子式
的电子式_______ 。
(4)工业上可利用焦炭制粗硅,写出该反应的化学方程式_______ ,该反应_______ (填“能”或“不能”)说明碳的非金属性大于硅。
Ⅲ.将等物质的量的气体A、B混合于2L的密闭容器中,发生如下反应: ,5min后,测得D的浓度为
,5min后,测得D的浓度为 ,
,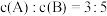 ,C的平均反应速率为
,C的平均反应速率为 。回答下列问题:
。回答下列问题:
(5)此时A的浓度: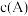 =
=_______  。
。
(6)B的平均反应速率: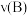 =
=_______  。
。
(7)x的值为_______ 。
(1)下列变化属于放热反应的是
a.生石灰溶于水 b.氢氧化钠固体溶于水 c.氢气与氯气化合 d.氯化铵固体与氢氧化钡晶体混合搅拌 e.盐酸与碳酸氢钠反应 f.铝和氧化铁高温下反应 g.灼热的木炭中通入
 h.碘升华 i.石灰石受热分解 j.水蒸气液化 k.过氧化钠溶于水
h.碘升华 i.石灰石受热分解 j.水蒸气液化 k.过氧化钠溶于水(2)下列图像分别表示有关反应的反应过程与能量变化的关系:

据此判断下列说法中正确的是
a.等质量的石墨和金刚石完全燃烧释放的热量相同
b.在一定条件下,石墨转化为金刚石为吸热反应
c.白磷和红磷互为同素异形体,相同条件下白磷比红磷稳定
d.白磷与氧气反应,断开化学键所吸收的热量大于形成新的化学键所释放的能量
f.红磷的能量高于
 的能量
的能量Ⅱ.碳是一种常见元素,它以多种形式广泛存在于大气、地壳和生物之中。请回答:
(3)碳元素在元素周期表中的位置为
 ,写出
,写出 的电子式
的电子式(4)工业上可利用焦炭制粗硅,写出该反应的化学方程式
Ⅲ.将等物质的量的气体A、B混合于2L的密闭容器中,发生如下反应:
 ,5min后,测得D的浓度为
,5min后,测得D的浓度为 ,
,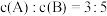 ,C的平均反应速率为
,C的平均反应速率为 。回答下列问题:
。回答下列问题:(5)此时A的浓度:
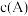 =
= 。
。(6)B的平均反应速率:
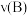 =
= 。
。(7)x的值为
您最近半年使用:0次
4 . 碲(Te)广泛用于太阳能、电子、医药等领域,对碲的综合回收利用尤为重要。工业上,从含碲化亚铜的废渣(主要成分Cu2Te,还有少量的Ag、Cu)中提取碲的流程如图:

回答下列问题:
(1)写出碲元素在元素周期表中的位置_______ 。
(2)“酸浸”过程中生成TeOSO4的离子方程式为_______ 。
(3)已知:Ksp(Ag2SO4)=7.70×10-5,Ksp(AgCl)=1.8×10-10。向含Ag2SO4滤渣中加入浓盐酸,Ag2SO4能否充分转化为AgCl,通过计算说明______
(4)电解除铜时,铜、碲沉淀的关系如表。
①电解初始阶段阴极的电极反应式是_______ 。
②最佳电解时间为30min,原因是_______ 。
(5)向“滤液II”中通入SO2反应一段时间后,Te(IV)的浓度从6.0g/L下降到0.24g/L,写出TeOSO4生成Te的化学方程式_______ ,其中Te元素的回收率为_______ (忽略溶液体积变化,结果用百分数表示,保留二位有效数字)。
(6)整个过程中可循环利用的物质为_______ (填化学式)。

回答下列问题:
(1)写出碲元素在元素周期表中的位置
(2)“酸浸”过程中生成TeOSO4的离子方程式为
(3)已知:Ksp(Ag2SO4)=7.70×10-5,Ksp(AgCl)=1.8×10-10。向含Ag2SO4滤渣中加入浓盐酸,Ag2SO4能否充分转化为AgCl,通过计算说明
(4)电解除铜时,铜、碲沉淀的关系如表。
| 电解时间(min) | 铜沉淀率 | 碲沉淀率 |
| 10 | 25% | 0.1% |
| 20 | 40% | 0.2% |
| 30 | 62% | 0.4% |
| 40 | 65% | 2.0% |
②最佳电解时间为30min,原因是
(5)向“滤液II”中通入SO2反应一段时间后,Te(IV)的浓度从6.0g/L下降到0.24g/L,写出TeOSO4生成Te的化学方程式
(6)整个过程中可循环利用的物质为
您最近半年使用:0次
名校
5 . 图是铁元素在元素周期表中的有关信息。

(1)写出铁在周期表中的位置_______ 。“55.85”是_______ 。
(2)自然界中存在的54Fe和56Fe,它们互称为_______ 。
(3)久置的FeSO4溶液变黄,一般认为是二价铁被氧化为三价铁的缘故。某研究小组为研究溶液中Fe2+被O2氧化的过程,查阅资料发现:溶液中Fe2+的氧化过程分为先后两步,首先是Fe2+水解,接着水解产物被O2氧化。于是小组同学决定研究常温下不同pH对Fe2+被O2氧化的影响,并测定了Fe2+氧化率随时间变化的关系,结果如图。
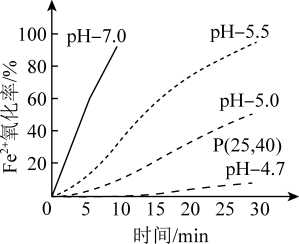
①写出Fe2+水解的离子方程式_______ ;要抑制FeSO4水解,可以采取的措施是_______ 。
②若配制的FeSO4溶液浓度为0.01 mol/L,反应过程中溶液体积不变,计算图中P点Fe2+的氧化速率_______ 。
③结合图示分析不同pH对Fe2+被O2氧化的反应产生了怎样的影响_______ 。
④研究小组在查阅资料时还得知:氧气的氧化性随溶液的酸性增强而增强。通过以上研究可知,配制FeSO4溶液的正确做法是_______ 。

(1)写出铁在周期表中的位置
(2)自然界中存在的54Fe和56Fe,它们互称为
(3)久置的FeSO4溶液变黄,一般认为是二价铁被氧化为三价铁的缘故。某研究小组为研究溶液中Fe2+被O2氧化的过程,查阅资料发现:溶液中Fe2+的氧化过程分为先后两步,首先是Fe2+水解,接着水解产物被O2氧化。于是小组同学决定研究常温下不同pH对Fe2+被O2氧化的影响,并测定了Fe2+氧化率随时间变化的关系,结果如图。

①写出Fe2+水解的离子方程式
②若配制的FeSO4溶液浓度为0.01 mol/L,反应过程中溶液体积不变,计算图中P点Fe2+的氧化速率
③结合图示分析不同pH对Fe2+被O2氧化的反应产生了怎样的影响
④研究小组在查阅资料时还得知:氧气的氧化性随溶液的酸性增强而增强。通过以上研究可知,配制FeSO4溶液的正确做法是
您最近半年使用:0次
6 . H、C、N、O、Na、S是常见的六种元素。请回答下列问题。
(1)S在元素周期表中的位置为______________ 。
(2)上述元素中非金属性最强的是______________ (填元素符号)。
(3)下列事实能说明O的非金属性比S的非金属性强的是________ (填字母代号)。
a.O2与H2S溶液反应,溶液变浑浊
b.加热条件下H2S比H2O更容易分解
c.在氧化还原反应中,1 mol O2比1 mol S得电子多
d.H2O的沸点比H2S高
(4)一定条件下,Na还原CCl4可得到金刚石与一种可溶性盐,该反应的化学方程式为_________________ 。
(5)肼(N2H4)是一种无色易溶于水的油状液体。其具有碱性和极强的还原性,在工业生产中应用非常广泛。
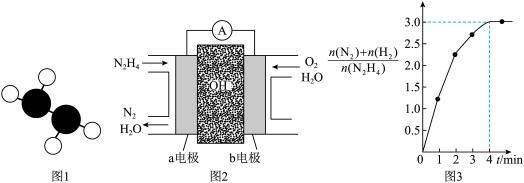
①已知肼的球棍模型如图1所示,试写出肼的电子式:______________ 。
②目前正在研发的一种肼燃料电池的结构如图2所示,________ (填“a”或“b”)电极为电池的负极。
③在1 L固定体积的密闭容器中加入0.1 mol N2H4,在303 K、Pt催化下发生反应N2H4(l) N2(g)+2H2(g),测得容器中的与时间的关系如图3所示,则 0~4 min内氮气的平均反应速率v(N2)=
N2(g)+2H2(g),测得容器中的与时间的关系如图3所示,则 0~4 min内氮气的平均反应速率v(N2)=____________ 。
(1)S在元素周期表中的位置为
(2)上述元素中非金属性最强的是
(3)下列事实能说明O的非金属性比S的非金属性强的是
a.O2与H2S溶液反应,溶液变浑浊
b.加热条件下H2S比H2O更容易分解
c.在氧化还原反应中,1 mol O2比1 mol S得电子多
d.H2O的沸点比H2S高
(4)一定条件下,Na还原CCl4可得到金刚石与一种可溶性盐,该反应的化学方程式为
(5)肼(N2H4)是一种无色易溶于水的油状液体。其具有碱性和极强的还原性,在工业生产中应用非常广泛。

①已知肼的球棍模型如图1所示,试写出肼的电子式:
②目前正在研发的一种肼燃料电池的结构如图2所示,
③在1 L固定体积的密闭容器中加入0.1 mol N2H4,在303 K、Pt催化下发生反应N2H4(l)
 N2(g)+2H2(g),测得容器中的与时间的关系如图3所示,则 0~4 min内氮气的平均反应速率v(N2)=
N2(g)+2H2(g),测得容器中的与时间的关系如图3所示,则 0~4 min内氮气的平均反应速率v(N2)=
您最近半年使用:0次
名校
解题方法
7 . A、B、C、D、E、F、G七种短周期主族元素,原子序数依次增大。其中B的单质在常温下为双原子分子,它与A的单质可形成分子X,X的水溶液呈碱性;A、D同主族,D的焰色反应为黄色;E的简单阳离子与X具有相同电子数,且E是同周期中简单离子半径最小的元素;F元素的原子最外层比次外层少两个电子,C、G两种元素的原子最外层共有13个电子。则
(1)F在元素周期表中的位置为_______________ 。
(2)在2 L的密闭容器中,充入2 mol B2和3 mol A2,在一定条件下发生反应,5 s后测得A2为1.8 mol,则以B2的表示的反应速率v(B2)为__________________________ 。
(3)常温下,液态的B2A4与气态的BC2两者发生反应生成无毒物质,16g B2A4发生反应放热akJ,该反应的热化学方程式为_______________ 。
(4)D2F溶液在空气中长期放置发生反应,生成一种强碱与D2F2。D2F2与过氧化钠的结构和化学性质相似,其溶液显黄色。D2F2的电子式为_______ ,写出D2F在空气中长期放置生成D2F2的化学反应方程式为:_____________ 。D2F2的溶液与稀硫酸反应产生的现象为_____________ 。
(5)化学家发现一种化学式为A4B4的离子化合物,一定条件下1mol A4B4熔融电离生成两种离子各1mol,则该物质熔融时的电离方程式为____________ 。
(6)向30mL某浓度由A、B、C、D中三种元素形成一元强碱溶液通入CO2气体后得溶液M,因CO2通入量的不同,溶液M的组成也不同。若向M中逐滴加入0.1mol/L盐酸,产生的气体V(CO2)与加入盐酸的体积V[HCl(aq)]的关系有下列图示两种情况(不计CO2的溶解)。
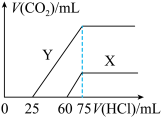
则曲线Y表明M中的溶质为________ ;原NaOH溶液的物质的量浓度为_______ ;由曲线X、Y可知,两次实验通入的CO2的体积比为_________ 。
(1)F在元素周期表中的位置为
(2)在2 L的密闭容器中,充入2 mol B2和3 mol A2,在一定条件下发生反应,5 s后测得A2为1.8 mol,则以B2的表示的反应速率v(B2)为
(3)常温下,液态的B2A4与气态的BC2两者发生反应生成无毒物质,16g B2A4发生反应放热akJ,该反应的热化学方程式为
(4)D2F溶液在空气中长期放置发生反应,生成一种强碱与D2F2。D2F2与过氧化钠的结构和化学性质相似,其溶液显黄色。D2F2的电子式为
(5)化学家发现一种化学式为A4B4的离子化合物,一定条件下1mol A4B4熔融电离生成两种离子各1mol,则该物质熔融时的电离方程式为
(6)向30mL某浓度由A、B、C、D中三种元素形成一元强碱溶液通入CO2气体后得溶液M,因CO2通入量的不同,溶液M的组成也不同。若向M中逐滴加入0.1mol/L盐酸,产生的气体V(CO2)与加入盐酸的体积V[HCl(aq)]的关系有下列图示两种情况(不计CO2的溶解)。

则曲线Y表明M中的溶质为
您最近半年使用:0次
2017-06-13更新
|
373次组卷
|
3卷引用:黑龙江省大庆实验中学2016-2017学年高一6月月考化学试题
8 . 依据图中氮元素及其化合物的转化关系,回答下列问题:______ 。
(2)回答下列关于 的问题:
的问题:
①利用下列方法制氨气,其中合理的是______ (填字母)。
A.将浓氨水滴入氢氧化钠固体中
B.将氯化铵稀溶液滴入氧化钙固体中
C.将氯化铵固体加热分解
D.加热浓氨水
E.将浓氨水滴入碱石灰固体中
②氨气是重要的化工原料,可以合成多种物质,写出其催化氧化的化学方程式:______ 。
③ 、
、 合成
合成 的反应中,当分别用以下各种物质表示反应速率时,则反应速率最快的是
的反应中,当分别用以下各种物质表示反应速率时,则反应速率最快的是______ 。
A. B.
B.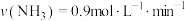
C.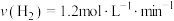 D.
D.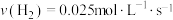
(3)下列关于NO、 的问题:
的问题:
①汽车排气管上装有催化转化器可减少尾气对环境的污染,汽车尾气中的有害气体C0和NO反应可转化为无害气体排放,写出相关反应的化学方程式:______ 。
②NO和 按一定比例混合可以被NaOH溶液完全吸收生成一种正盐,写出相关反应的化学方程式:
按一定比例混合可以被NaOH溶液完全吸收生成一种正盐,写出相关反应的化学方程式:______ 。
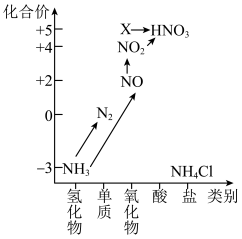
(2)回答下列关于
 的问题:
的问题:①利用下列方法制氨气,其中合理的是
A.将浓氨水滴入氢氧化钠固体中
B.将氯化铵稀溶液滴入氧化钙固体中
C.将氯化铵固体加热分解
D.加热浓氨水
E.将浓氨水滴入碱石灰固体中
②氨气是重要的化工原料,可以合成多种物质,写出其催化氧化的化学方程式:
③
 、
、 合成
合成 的反应中,当分别用以下各种物质表示反应速率时,则反应速率最快的是
的反应中,当分别用以下各种物质表示反应速率时,则反应速率最快的是A.
 B.
B.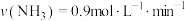
C.
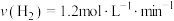 D.
D.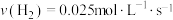
(3)下列关于NO、
 的问题:
的问题:①汽车排气管上装有催化转化器可减少尾气对环境的污染,汽车尾气中的有害气体C0和NO反应可转化为无害气体排放,写出相关反应的化学方程式:
②NO和
 按一定比例混合可以被NaOH溶液完全吸收生成一种正盐,写出相关反应的化学方程式:
按一定比例混合可以被NaOH溶液完全吸收生成一种正盐,写出相关反应的化学方程式:
您最近半年使用:0次
9 . 蕴藏在海底的“可燃冰”是高压下形成的外观像冰的甲烷水合物固体。根据你所学的知识回答下列问题:
(1)碳元素在周期表中的位置是 ,甲烷是其简单气态氢化物,与水比较不稳定的是 ;
已知1g甲烷完全燃烧生成液态水时放热55.6kJ·mol-1,写出该反应的热化学方程式 。
(2)碳有多种同素异形体,C60所属的晶体类型为 ;金刚石熔化时破坏的作用力是 ;
金刚石、石墨的能量关系如图所示,则等质量的金刚石和石墨完全燃烧 (填“金刚石”或“石墨”)
放出热量更多,写出石墨转化为金刚石的热化学方程式 。
(3)工业上常利用甲烷制氢气,反应方程式为:CH4(g)+H2O(g) CO(g)+3H2(g) ΔH=+160 kJ·mol-1;,现向容积为2L的密闭容器中分别通入2mol的甲烷和水蒸气,4s时测得氢气的反应速率为0.3mol.L-1.s-1,则4s时剩余的甲烷的浓度为 ,反应 (填“放出”或“吸收”)热量;上述反应可以通过电解池来实现,电解液为硫酸钠溶液,电解过程能量的转化形式为 。
CO(g)+3H2(g) ΔH=+160 kJ·mol-1;,现向容积为2L的密闭容器中分别通入2mol的甲烷和水蒸气,4s时测得氢气的反应速率为0.3mol.L-1.s-1,则4s时剩余的甲烷的浓度为 ,反应 (填“放出”或“吸收”)热量;上述反应可以通过电解池来实现,电解液为硫酸钠溶液,电解过程能量的转化形式为 。
(1)碳元素在周期表中的位置是 ,甲烷是其简单气态氢化物,与水比较不稳定的是 ;
已知1g甲烷完全燃烧生成液态水时放热55.6kJ·mol-1,写出该反应的热化学方程式 。
(2)碳有多种同素异形体,C60所属的晶体类型为 ;金刚石熔化时破坏的作用力是 ;
金刚石、石墨的能量关系如图所示,则等质量的金刚石和石墨完全燃烧 (填“金刚石”或“石墨”)
放出热量更多,写出石墨转化为金刚石的热化学方程式 。
(3)工业上常利用甲烷制氢气,反应方程式为:CH4(g)+H2O(g)
 CO(g)+3H2(g) ΔH=+160 kJ·mol-1;,现向容积为2L的密闭容器中分别通入2mol的甲烷和水蒸气,4s时测得氢气的反应速率为0.3mol.L-1.s-1,则4s时剩余的甲烷的浓度为 ,反应 (填“放出”或“吸收”)热量;上述反应可以通过电解池来实现,电解液为硫酸钠溶液,电解过程能量的转化形式为 。
CO(g)+3H2(g) ΔH=+160 kJ·mol-1;,现向容积为2L的密闭容器中分别通入2mol的甲烷和水蒸气,4s时测得氢气的反应速率为0.3mol.L-1.s-1,则4s时剩余的甲烷的浓度为 ,反应 (填“放出”或“吸收”)热量;上述反应可以通过电解池来实现,电解液为硫酸钠溶液,电解过程能量的转化形式为 。
您最近半年使用:0次
名校
解题方法
10 . 为加快实现“双碳”目标,CO2的资源化利用成为了科研的热门选题。
(1)工业上利用CO2和H2为原料,在催化剂Cu/ZnO的作用下合成甲醇,该反应的热化学方程式为CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H=-49kJ•mol-1。
CH3OH(g)+H2O(g)△H=-49kJ•mol-1。
①该反应在_____ (填“高温”“低温”或“任意温度”)下,易自发进行。
②该反应分两步进行:
第一步Cu/ZnO*=Cu/Zn*+H2O△H>0
第二步Cu/Zn*+2H2+CO2=Cu/ZnO*+CH3OH
已知第二步反应几乎不影响总反应达到平衡所用的时间,由此推知以下能正确表示反应过程中能量变化的示意图为______ (填序号)。
a.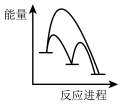 b.
b.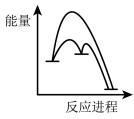 c.
c.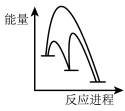 d.
d.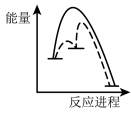
(2)Sabatier反应可实现CO2甲烷化:反应1为CO2(g)+4H2(g) CH4(g)+2H2O(g)△H=-165kJ•mol-1,该反应发生的同时还伴随着副反应;反应2为CO2(g)+H2(g)
CH4(g)+2H2O(g)△H=-165kJ•mol-1,该反应发生的同时还伴随着副反应;反应2为CO2(g)+H2(g) CO(g)+H2O(g)△H=+41kJ•mol-1,将5molCO2和20molH2通入某恒压密闭容器中将CO2甲烷化,平衡时体系中各含碳元素物质的物质的量n(X)与温度T的关系如图所示。
CO(g)+H2O(g)△H=+41kJ•mol-1,将5molCO2和20molH2通入某恒压密闭容器中将CO2甲烷化,平衡时体系中各含碳元素物质的物质的量n(X)与温度T的关系如图所示。

①曲线Y代表的物质是______ (填化学式),曲线Z所代表的物质在1100K以上物质的量减小的原因是______ 。
②800K时,若经过10min达到平衡,则该条件下0~10min内H2O的平均生成速率v(H2O)=_______ mol•min-1。
③当反应1和反应2均达到化学平衡状态时,若维持温度不变,向容器内通入惰性气体He,则反应2平衡______ (填“正向移动”“逆向移动”或“不移动”)。
④800K时,若平衡时容器内总压为p,则反应2的压强平衡常数Kp=_____ (结果保留两位有效数字,Kp为以分压表示的平衡常数,分压=总压 物质的量分数)。
物质的量分数)。
(3)在酸性水溶液中,CO2通过电催化法可生成C2H5OH,c-NC、i-NC是两种电极催化剂,转化原理如图所示。
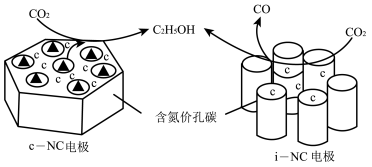
①c-NC上的电极反应式为______ 。
②当两个电极上转移相同数目的电子时,c-NC电极和i-NC电极上得到的C2H5OH的物质的量之比为5:4,则i-NC电极上产生的C2H5OH和CO的物质的量之比为______ 。
(1)工业上利用CO2和H2为原料,在催化剂Cu/ZnO的作用下合成甲醇,该反应的热化学方程式为CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)△H=-49kJ•mol-1。
CH3OH(g)+H2O(g)△H=-49kJ•mol-1。①该反应在
②该反应分两步进行:
第一步Cu/ZnO*=Cu/Zn*+H2O△H>0
第二步Cu/Zn*+2H2+CO2=Cu/ZnO*+CH3OH
已知第二步反应几乎不影响总反应达到平衡所用的时间,由此推知以下能正确表示反应过程中能量变化的示意图为
a.
 b.
b. c.
c. d.
d.
(2)Sabatier反应可实现CO2甲烷化:反应1为CO2(g)+4H2(g)
 CH4(g)+2H2O(g)△H=-165kJ•mol-1,该反应发生的同时还伴随着副反应;反应2为CO2(g)+H2(g)
CH4(g)+2H2O(g)△H=-165kJ•mol-1,该反应发生的同时还伴随着副反应;反应2为CO2(g)+H2(g) CO(g)+H2O(g)△H=+41kJ•mol-1,将5molCO2和20molH2通入某恒压密闭容器中将CO2甲烷化,平衡时体系中各含碳元素物质的物质的量n(X)与温度T的关系如图所示。
CO(g)+H2O(g)△H=+41kJ•mol-1,将5molCO2和20molH2通入某恒压密闭容器中将CO2甲烷化,平衡时体系中各含碳元素物质的物质的量n(X)与温度T的关系如图所示。
①曲线Y代表的物质是
②800K时,若经过10min达到平衡,则该条件下0~10min内H2O的平均生成速率v(H2O)=
③当反应1和反应2均达到化学平衡状态时,若维持温度不变,向容器内通入惰性气体He,则反应2平衡
④800K时,若平衡时容器内总压为p,则反应2的压强平衡常数Kp=
 物质的量分数)。
物质的量分数)。(3)在酸性水溶液中,CO2通过电催化法可生成C2H5OH,c-NC、i-NC是两种电极催化剂,转化原理如图所示。

①c-NC上的电极反应式为
②当两个电极上转移相同数目的电子时,c-NC电极和i-NC电极上得到的C2H5OH的物质的量之比为5:4,则i-NC电极上产生的C2H5OH和CO的物质的量之比为
您最近半年使用:0次



