名校
1 . 聚丙烯腈纤维俗名人造羊毛,由丙烯腈聚合而得。用丙烯合成丙烯腈的反应如下: 2C3H6(g)+2NH3(g)+3O2(g)  2C3H3N(g)+6H2O(g)+1030kJ
2C3H3N(g)+6H2O(g)+1030kJ
(1)碳在元素周期表中的位置是_______ ;C、N、O三种元素的原子半径由小到大的顺序为_______ ;
(2)某密闭容器中发生上述反应,生成丙烯腈的反应速率与反应时间的关系如下图所示。
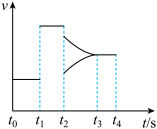
t1时刻表示体系改变的反应条件为_______ ; t2时刻表示体系改变了另一反应条件,此时平衡_______ 移动(填“正向”、“逆向”或“不”)。
丙烯的转化率与反应温度的关系如图示:

(3)有利于提高丙烯平衡转化率的反应条件有_______ ;
(4)最大转化率所对应的温度为460℃。当温度低于460℃时,丙烯的转化率_______ (填“是”或“不是”)所对应温度下的平衡转化率,理由是_______ 。
(5)一定条件下,在2L恒容密闭容器中,通入84g C3H6、34g NH3、96g O2,若该反应5 min到达a点,则0~5min内丙烯的平均反应速率为_______ mol∙L−1∙min−1。
 2C3H3N(g)+6H2O(g)+1030kJ
2C3H3N(g)+6H2O(g)+1030kJ(1)碳在元素周期表中的位置是
(2)某密闭容器中发生上述反应,生成丙烯腈的反应速率与反应时间的关系如下图所示。

t1时刻表示体系改变的反应条件为
丙烯的转化率与反应温度的关系如图示:

(3)有利于提高丙烯平衡转化率的反应条件有
(4)最大转化率所对应的温度为460℃。当温度低于460℃时,丙烯的转化率
(5)一定条件下,在2L恒容密闭容器中,通入84g C3H6、34g NH3、96g O2,若该反应5 min到达a点,则0~5min内丙烯的平均反应速率为
您最近一年使用:0次
2023-04-14更新
|
530次组卷
|
4卷引用:上海市静安区2022-2023学年高三下学期二模测试化学试题
上海市静安区2022-2023学年高三下学期二模测试化学试题(已下线)上海市静安区2022-2023学年高三下学期二模变式题(原理综合题)(已下线)【知识图鉴】单元讲练测选择性必修1第2单元02基础练河北省衡水市饶阳中学2022-2023学年高一下学期期末考试化学试题
名校
2 . I.化学反应中伴随着能量变化,探究各种能量变化是一永恒的主题。
(1)下列变化属于放热反应的是_______ (填序号)。
a.生石灰溶于水 b.氢氧化钠固体溶于水 c.氢气与氯气化合 d.氯化铵固体与氢氧化钡晶体混合搅拌 e.盐酸与碳酸氢钠反应 f.铝和氧化铁高温下反应 g.灼热的木炭中通入 h.碘升华 i.石灰石受热分解 j.水蒸气液化 k.过氧化钠溶于水
h.碘升华 i.石灰石受热分解 j.水蒸气液化 k.过氧化钠溶于水
(2)下列图像分别表示有关反应的反应过程与能量变化的关系:
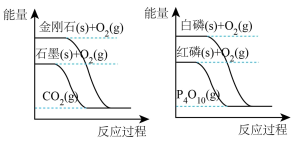
据此判断下列说法中正确的是_______ (填序号)。
a.等质量的石墨和金刚石完全燃烧释放的热量相同
b.在一定条件下,石墨转化为金刚石为吸热反应
c.白磷和红磷互为同素异形体,相同条件下白磷比红磷稳定
d.白磷与氧气反应,断开化学键所吸收的热量大于形成新的化学键所释放的能量
f.红磷的能量高于 的能量
的能量
Ⅱ.碳是一种常见元素,它以多种形式广泛存在于大气、地壳和生物之中。请回答:
(3)碳元素在元素周期表中的位置为_______ ,大气中存在温室气体 ,写出
,写出 的电子式
的电子式_______ 。
(4)工业上可利用焦炭制粗硅,写出该反应的化学方程式_______ ,该反应_______ (填“能”或“不能”)说明碳的非金属性大于硅。
Ⅲ.将等物质的量的气体A、B混合于2L的密闭容器中,发生如下反应: ,5min后,测得D的浓度为
,5min后,测得D的浓度为 ,
,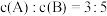 ,C的平均反应速率为
,C的平均反应速率为 。回答下列问题:
。回答下列问题:
(5)此时A的浓度: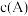 =
=_______  。
。
(6)B的平均反应速率: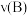 =
=_______  。
。
(7)x的值为_______ 。
(1)下列变化属于放热反应的是
a.生石灰溶于水 b.氢氧化钠固体溶于水 c.氢气与氯气化合 d.氯化铵固体与氢氧化钡晶体混合搅拌 e.盐酸与碳酸氢钠反应 f.铝和氧化铁高温下反应 g.灼热的木炭中通入
 h.碘升华 i.石灰石受热分解 j.水蒸气液化 k.过氧化钠溶于水
h.碘升华 i.石灰石受热分解 j.水蒸气液化 k.过氧化钠溶于水(2)下列图像分别表示有关反应的反应过程与能量变化的关系:

据此判断下列说法中正确的是
a.等质量的石墨和金刚石完全燃烧释放的热量相同
b.在一定条件下,石墨转化为金刚石为吸热反应
c.白磷和红磷互为同素异形体,相同条件下白磷比红磷稳定
d.白磷与氧气反应,断开化学键所吸收的热量大于形成新的化学键所释放的能量
f.红磷的能量高于
 的能量
的能量Ⅱ.碳是一种常见元素,它以多种形式广泛存在于大气、地壳和生物之中。请回答:
(3)碳元素在元素周期表中的位置为
 ,写出
,写出 的电子式
的电子式(4)工业上可利用焦炭制粗硅,写出该反应的化学方程式
Ⅲ.将等物质的量的气体A、B混合于2L的密闭容器中,发生如下反应:
 ,5min后,测得D的浓度为
,5min后,测得D的浓度为 ,
,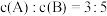 ,C的平均反应速率为
,C的平均反应速率为 。回答下列问题:
。回答下列问题:(5)此时A的浓度:
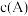 =
= 。
。(6)B的平均反应速率:
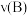 =
= 。
。(7)x的值为
您最近一年使用:0次
3 . 碲(Te)广泛用于太阳能、电子、医药等领域,对碲的综合回收利用尤为重要。工业上,从含碲化亚铜的废渣(主要成分Cu2Te,还有少量的Ag、Cu)中提取碲的流程如图:

回答下列问题:
(1)写出碲元素在元素周期表中的位置_______ 。
(2)“酸浸”过程中生成TeOSO4的离子方程式为_______ 。
(3)已知:Ksp(Ag2SO4)=7.70×10-5,Ksp(AgCl)=1.8×10-10。向含Ag2SO4滤渣中加入浓盐酸,Ag2SO4能否充分转化为AgCl,通过计算说明______
(4)电解除铜时,铜、碲沉淀的关系如表。
①电解初始阶段阴极的电极反应式是_______ 。
②最佳电解时间为30min,原因是_______ 。
(5)向“滤液II”中通入SO2反应一段时间后,Te(IV)的浓度从6.0g/L下降到0.24g/L,写出TeOSO4生成Te的化学方程式_______ ,其中Te元素的回收率为_______ (忽略溶液体积变化,结果用百分数表示,保留二位有效数字)。
(6)整个过程中可循环利用的物质为_______ (填化学式)。

回答下列问题:
(1)写出碲元素在元素周期表中的位置
(2)“酸浸”过程中生成TeOSO4的离子方程式为
(3)已知:Ksp(Ag2SO4)=7.70×10-5,Ksp(AgCl)=1.8×10-10。向含Ag2SO4滤渣中加入浓盐酸,Ag2SO4能否充分转化为AgCl,通过计算说明
(4)电解除铜时,铜、碲沉淀的关系如表。
| 电解时间(min) | 铜沉淀率 | 碲沉淀率 |
| 10 | 25% | 0.1% |
| 20 | 40% | 0.2% |
| 30 | 62% | 0.4% |
| 40 | 65% | 2.0% |
②最佳电解时间为30min,原因是
(5)向“滤液II”中通入SO2反应一段时间后,Te(IV)的浓度从6.0g/L下降到0.24g/L,写出TeOSO4生成Te的化学方程式
(6)整个过程中可循环利用的物质为
您最近一年使用:0次
名校
解题方法
4 . 为加快实现“双碳”目标,CO2的资源化利用成为了科研的热门选题。
(1)工业上利用CO2和H2为原料,在催化剂Cu/ZnO的作用下合成甲醇,该反应的热化学方程式为CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H=-49kJ•mol-1。
CH3OH(g)+H2O(g)△H=-49kJ•mol-1。
①该反应在_____ (填“高温”“低温”或“任意温度”)下,易自发进行。
②该反应分两步进行:
第一步Cu/ZnO*=Cu/Zn*+H2O△H>0
第二步Cu/Zn*+2H2+CO2=Cu/ZnO*+CH3OH
已知第二步反应几乎不影响总反应达到平衡所用的时间,由此推知以下能正确表示反应过程中能量变化的示意图为______ (填序号)。
a.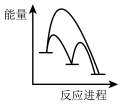 b.
b.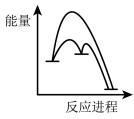 c.
c.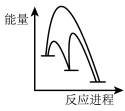 d.
d.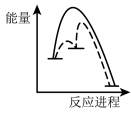
(2)Sabatier反应可实现CO2甲烷化:反应1为CO2(g)+4H2(g) CH4(g)+2H2O(g)△H=-165kJ•mol-1,该反应发生的同时还伴随着副反应;反应2为CO2(g)+H2(g)
CH4(g)+2H2O(g)△H=-165kJ•mol-1,该反应发生的同时还伴随着副反应;反应2为CO2(g)+H2(g) CO(g)+H2O(g)△H=+41kJ•mol-1,将5molCO2和20molH2通入某恒压密闭容器中将CO2甲烷化,平衡时体系中各含碳元素物质的物质的量n(X)与温度T的关系如图所示。
CO(g)+H2O(g)△H=+41kJ•mol-1,将5molCO2和20molH2通入某恒压密闭容器中将CO2甲烷化,平衡时体系中各含碳元素物质的物质的量n(X)与温度T的关系如图所示。

①曲线Y代表的物质是______ (填化学式),曲线Z所代表的物质在1100K以上物质的量减小的原因是______ 。
②800K时,若经过10min达到平衡,则该条件下0~10min内H2O的平均生成速率v(H2O)=_______ mol•min-1。
③当反应1和反应2均达到化学平衡状态时,若维持温度不变,向容器内通入惰性气体He,则反应2平衡______ (填“正向移动”“逆向移动”或“不移动”)。
④800K时,若平衡时容器内总压为p,则反应2的压强平衡常数Kp=_____ (结果保留两位有效数字,Kp为以分压表示的平衡常数,分压=总压 物质的量分数)。
物质的量分数)。
(3)在酸性水溶液中,CO2通过电催化法可生成C2H5OH,c-NC、i-NC是两种电极催化剂,转化原理如图所示。
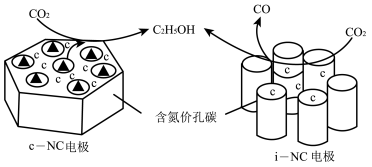
①c-NC上的电极反应式为______ 。
②当两个电极上转移相同数目的电子时,c-NC电极和i-NC电极上得到的C2H5OH的物质的量之比为5:4,则i-NC电极上产生的C2H5OH和CO的物质的量之比为______ 。
(1)工业上利用CO2和H2为原料,在催化剂Cu/ZnO的作用下合成甲醇,该反应的热化学方程式为CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)△H=-49kJ•mol-1。
CH3OH(g)+H2O(g)△H=-49kJ•mol-1。①该反应在
②该反应分两步进行:
第一步Cu/ZnO*=Cu/Zn*+H2O△H>0
第二步Cu/Zn*+2H2+CO2=Cu/ZnO*+CH3OH
已知第二步反应几乎不影响总反应达到平衡所用的时间,由此推知以下能正确表示反应过程中能量变化的示意图为
a.
 b.
b. c.
c. d.
d.
(2)Sabatier反应可实现CO2甲烷化:反应1为CO2(g)+4H2(g)
 CH4(g)+2H2O(g)△H=-165kJ•mol-1,该反应发生的同时还伴随着副反应;反应2为CO2(g)+H2(g)
CH4(g)+2H2O(g)△H=-165kJ•mol-1,该反应发生的同时还伴随着副反应;反应2为CO2(g)+H2(g) CO(g)+H2O(g)△H=+41kJ•mol-1,将5molCO2和20molH2通入某恒压密闭容器中将CO2甲烷化,平衡时体系中各含碳元素物质的物质的量n(X)与温度T的关系如图所示。
CO(g)+H2O(g)△H=+41kJ•mol-1,将5molCO2和20molH2通入某恒压密闭容器中将CO2甲烷化,平衡时体系中各含碳元素物质的物质的量n(X)与温度T的关系如图所示。
①曲线Y代表的物质是
②800K时,若经过10min达到平衡,则该条件下0~10min内H2O的平均生成速率v(H2O)=
③当反应1和反应2均达到化学平衡状态时,若维持温度不变,向容器内通入惰性气体He,则反应2平衡
④800K时,若平衡时容器内总压为p,则反应2的压强平衡常数Kp=
 物质的量分数)。
物质的量分数)。(3)在酸性水溶液中,CO2通过电催化法可生成C2H5OH,c-NC、i-NC是两种电极催化剂,转化原理如图所示。

①c-NC上的电极反应式为
②当两个电极上转移相同数目的电子时,c-NC电极和i-NC电极上得到的C2H5OH的物质的量之比为5:4,则i-NC电极上产生的C2H5OH和CO的物质的量之比为
您最近一年使用:0次
5 . 研究碳、氮、硫等元素化合物的性质或转化对建设生态文明,美丽中国具有重要意义。
(1)基态氮原子的价层电子轨道表示式为:______ 。
(2)NO加速臭氧层被破坏,其反应过程如下图所示:
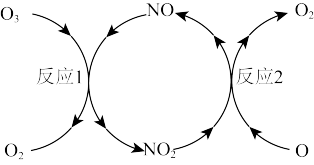
已知: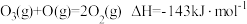
反应1: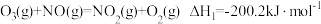 。
。
反应2的热化学方程式为___________ 。
(3)工业上以CO和 为原料合成甲醇的反应:
为原料合成甲醇的反应: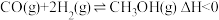 ,在容积为1L的恒容容器中,分别在T1、T2温度下合成甲醇。如图是不同温度下H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系。
,在容积为1L的恒容容器中,分别在T1、T2温度下合成甲醇。如图是不同温度下H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系。
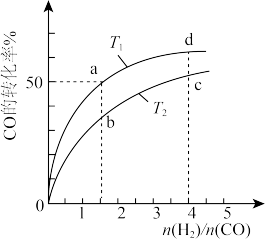
①判断T1___________ T2 (选填“<”、“>”或“=”);
②若a点达到平衡的时间是10分钟,从反应开始到平衡用H2表示的反应速率为
___________ ;
③该反应平衡常数的表达式为K=___________ ,d点的平衡常数的值为___________ ;
④a点状态下再通入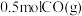 和
和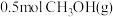 ,平衡
,平衡____ 移动(选填“正向”、“逆向”或“不”);
⑤a、b、c三点H2转化率由大到小的顺序是___________ 。
(1)基态氮原子的价层电子轨道表示式为:
(2)NO加速臭氧层被破坏,其反应过程如下图所示:

已知:
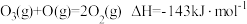
反应1:
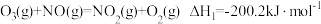 。
。反应2的热化学方程式为
(3)工业上以CO和
 为原料合成甲醇的反应:
为原料合成甲醇的反应: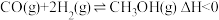 ,在容积为1L的恒容容器中,分别在T1、T2温度下合成甲醇。如图是不同温度下H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系。
,在容积为1L的恒容容器中,分别在T1、T2温度下合成甲醇。如图是不同温度下H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系。
①判断T1
②若a点达到平衡的时间是10分钟,从反应开始到平衡用H2表示的反应速率为

③该反应平衡常数的表达式为K=
④a点状态下再通入
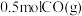 和
和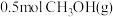 ,平衡
,平衡⑤a、b、c三点H2转化率由大到小的顺序是
您最近一年使用:0次
2022-02-16更新
|
302次组卷
|
2卷引用:江西省吉安市第三中学2022-2023学年高二上学期1月期末考试化学试题



