1 . 在人们高度重视环境和保护环境的今天,消除和利用硫氧化物、氮氧化物、碳氧化物对改善大气质量具有重要的意义。
(1)在绝热的某刚性容器中置入2mol 和1mol
和1mol ,发生反应:
,发生反应:
 。下列说法中能够判断该反应一定处于平衡状态的有
。下列说法中能够判断该反应一定处于平衡状态的有_______ (填数字序号)。
①容器中 、
、 、
、 共存
共存
②单位时间内生成2mol 的同时消耗2mol
的同时消耗2mol
③反应容器中压强不随时间变化
④容器中温度恒定不变
⑤容器中 、
、 、
、 的物质的量之比为2∶1∶2
的物质的量之比为2∶1∶2
(2)氮氧化物是造成光化学污染的罪魁祸首,用一氧化碳还原氮氧化物,可防止氮氧化物污染,如反应:
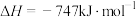 。
。
①已知该反应在不同条件下的化学反应速率如下:
a. b.
b.
c. d.
d.
上述4种情况反应速率最快的是_______ (填字母)
②实验测得反应
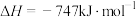 ,
,
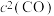 ,
,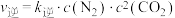 (
( 、
、 为速率常数,只与温度有关)。一定温度下达到平衡时
为速率常数,只与温度有关)。一定温度下达到平衡时 。
。
达到平衡后,仅升高温度,平衡向_______ 移动(填“正反应方向”“逆反应方向”或“不”),
_______ (填“增大”“减小”或“不变”)。
(3)已知:
 。将1mol CO和2mol
。将1mol CO和2mol 充入1L恒容密闭容器中,在一定条件下发生反应,相同时间内测得CO的转化率与温度的对应关系如图所示:
充入1L恒容密闭容器中,在一定条件下发生反应,相同时间内测得CO的转化率与温度的对应关系如图所示:

①
_______ 0(填“>”或“<”)。
②由图可知,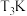 前反应中CO的转化率随温度升高而增大,原因是
前反应中CO的转化率随温度升高而增大,原因是_______ 。
③已知c点时容器内的压强为p,在 温度下该反应的压强平衡常数
温度下该反应的压强平衡常数 为
为_______ (用含p的关系式表示)。( 为以分压表示的平衡常数,分压=总压×物质的量分数)
为以分压表示的平衡常数,分压=总压×物质的量分数)
(1)在绝热的某刚性容器中置入2mol
 和1mol
和1mol ,发生反应:
,发生反应:
 。下列说法中能够判断该反应一定处于平衡状态的有
。下列说法中能够判断该反应一定处于平衡状态的有①容器中
 、
、 、
、 共存
共存②单位时间内生成2mol
 的同时消耗2mol
的同时消耗2mol
③反应容器中压强不随时间变化
④容器中温度恒定不变
⑤容器中
 、
、 、
、 的物质的量之比为2∶1∶2
的物质的量之比为2∶1∶2(2)氮氧化物是造成光化学污染的罪魁祸首,用一氧化碳还原氮氧化物,可防止氮氧化物污染,如反应:

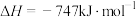 。
。①已知该反应在不同条件下的化学反应速率如下:
a.
 b.
b.
c.
 d.
d.
上述4种情况反应速率最快的是
②实验测得反应

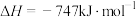 ,
,
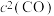 ,
,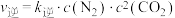 (
( 、
、 为速率常数,只与温度有关)。一定温度下达到平衡时
为速率常数,只与温度有关)。一定温度下达到平衡时 。
。达到平衡后,仅升高温度,平衡向

(3)已知:

 。将1mol CO和2mol
。将1mol CO和2mol 充入1L恒容密闭容器中,在一定条件下发生反应,相同时间内测得CO的转化率与温度的对应关系如图所示:
充入1L恒容密闭容器中,在一定条件下发生反应,相同时间内测得CO的转化率与温度的对应关系如图所示:
①

②由图可知,
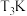 前反应中CO的转化率随温度升高而增大,原因是
前反应中CO的转化率随温度升高而增大,原因是③已知c点时容器内的压强为p,在
 温度下该反应的压强平衡常数
温度下该反应的压强平衡常数 为
为 为以分压表示的平衡常数,分压=总压×物质的量分数)
为以分压表示的平衡常数,分压=总压×物质的量分数)
您最近一年使用:0次
名校
解题方法
2 . 在人们高度重视环境和保护环境的今天,消除和利用硫氧化物、氮氧化物、碳氧化物对改善大气质量具有重要的意义。
(1)在绝热的某刚性容器中置入 和
和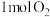 ,发生反应:
,发生反应:
 。下列说法中能够判断该反应一定处于平衡状态的有
。下列说法中能够判断该反应一定处于平衡状态的有___________ (填数字序号)。
①容器中 、
、 、
、 共存 ②单位时间内生成
共存 ②单位时间内生成 的同时消耗
的同时消耗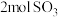
③反应容器中压强不随时间变化 ④容器中温度恒定不变
⑤容器中 、
、 、
、 的物质的量之比为2∶1∶2
的物质的量之比为2∶1∶2
(2)氮氧化物是造成光化学污染的罪魁祸首,用一氧化碳还原氮氧化物,可防止氮氧化物污染,如反应:
 =
= 。
。
①已知该反应在不同条件下的化学反应速率如下:
a.v(CO)=1.5 mol·L-1·min-1 b.v(NO)=0.03 mol·L-1·s-1
c.v(N2)=0.6 mol·L-1·min-1 d.v(CO2)=1.6 mol·L-1·min-1
上述4种情况反应速率最快的是___________ (填字母)。
②实验测得反应2CO(g)+2NO(g) 2CO2(g)+N2 (g)
2CO2(g)+N2 (g)  =
= ,v正=k正•c2(NO)•c2(CO),v逆=k逆•c(N2)•c2(CO2)(k正、k逆为速率常数,只与温度有关)。在一定温度下达到平衡时v正 = v逆,则
,v正=k正•c2(NO)•c2(CO),v逆=k逆•c(N2)•c2(CO2)(k正、k逆为速率常数,只与温度有关)。在一定温度下达到平衡时v正 = v逆,则
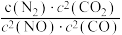 ,达到平衡后,仅升高温度,平衡向
,达到平衡后,仅升高温度,平衡向___________ 移动(填“正反应方向”“逆反应方向”或“不”)。k正增大的倍数___________ (填“>”、“<”或“=”)k逆增大的倍数。
(3)已知:
 。将1mol CO和
。将1mol CO和 充入1L恒容密闭容器中,在一定条件下发生反应,相同时间内测得CO的转化率与温度的对应关系如图所示:
充入1L恒容密闭容器中,在一定条件下发生反应,相同时间内测得CO的转化率与温度的对应关系如图所示:
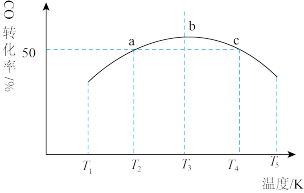
①
___________ 0(填“>”或“<”)。
②由图可知,T3前反应中CO的转化率随温度升高而增大,原因是___________ 。
③已知c点时容器内的压强为p,在 温度下该反应的压强平衡常数
温度下该反应的压强平衡常数 为
为___________ (用含p的关系式表示)。( 为以分压表示的平衡常数,分压=总压×物质的量分数)
为以分压表示的平衡常数,分压=总压×物质的量分数)
(1)在绝热的某刚性容器中置入
 和
和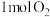 ,发生反应:
,发生反应:
 。下列说法中能够判断该反应一定处于平衡状态的有
。下列说法中能够判断该反应一定处于平衡状态的有①容器中
 、
、 、
、 共存 ②单位时间内生成
共存 ②单位时间内生成 的同时消耗
的同时消耗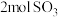
③反应容器中压强不随时间变化 ④容器中温度恒定不变
⑤容器中
 、
、 、
、 的物质的量之比为2∶1∶2
的物质的量之比为2∶1∶2(2)氮氧化物是造成光化学污染的罪魁祸首,用一氧化碳还原氮氧化物,可防止氮氧化物污染,如反应:

 =
= 。
。①已知该反应在不同条件下的化学反应速率如下:
a.v(CO)=1.5 mol·L-1·min-1 b.v(NO)=0.03 mol·L-1·s-1
c.v(N2)=0.6 mol·L-1·min-1 d.v(CO2)=1.6 mol·L-1·min-1
上述4种情况反应速率最快的是
②实验测得反应2CO(g)+2NO(g)
 2CO2(g)+N2 (g)
2CO2(g)+N2 (g)  =
= ,v正=k正•c2(NO)•c2(CO),v逆=k逆•c(N2)•c2(CO2)(k正、k逆为速率常数,只与温度有关)。在一定温度下达到平衡时v正 = v逆,则
,v正=k正•c2(NO)•c2(CO),v逆=k逆•c(N2)•c2(CO2)(k正、k逆为速率常数,只与温度有关)。在一定温度下达到平衡时v正 = v逆,则
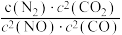 ,达到平衡后,仅升高温度,平衡向
,达到平衡后,仅升高温度,平衡向(3)已知:

 。将1mol CO和
。将1mol CO和 充入1L恒容密闭容器中,在一定条件下发生反应,相同时间内测得CO的转化率与温度的对应关系如图所示:
充入1L恒容密闭容器中,在一定条件下发生反应,相同时间内测得CO的转化率与温度的对应关系如图所示:
①

②由图可知,T3前反应中CO的转化率随温度升高而增大,原因是
③已知c点时容器内的压强为p,在
 温度下该反应的压强平衡常数
温度下该反应的压强平衡常数 为
为 为以分压表示的平衡常数,分压=总压×物质的量分数)
为以分压表示的平衡常数,分压=总压×物质的量分数)
您最近一年使用:0次
3 . 如图是硫元素的常见化合价与部分物质类别的对应关系。请回答下列问题。
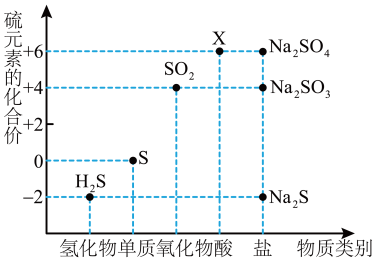
(1)X的浓溶液与碳在一定条件下可以发生反应,体现了X的___________ 性。
(2)仅从硫元素化合价变化的角度分析,图中只有还原性的物质有___________ (填化学式)。
(3)将 与
与 混合可生成淡黄色沉淀,该反应中氧化产物与还原产物的物质的量之比为
混合可生成淡黄色沉淀,该反应中氧化产物与还原产物的物质的量之比为___________ 。
(4)配平下列反应_________________ 。
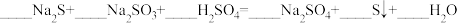
(5)一定条件下,在 密闭容器中发生反应:
密闭容器中发生反应: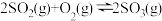 ,开始时加入
,开始时加入 、
、 、
、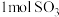 ,在
,在 末测得
末测得 的物质的量是
的物质的量是 ,用
,用 的浓度变化表示反应的平均速率为
的浓度变化表示反应的平均速率为___________ ,在 末
末 的浓度为
的浓度为___________ 。若改变下列一个条件,推测该反应的速率发生的变化(填“增大”“减小”或“不变”)
①升高温度,化学反应速率___________ ;
②再充入 ,化学反应速率
,化学反应速率___________ ;
③将容器体积变为 ,化学反应速率
,化学反应速率___________ 。

(1)X的浓溶液与碳在一定条件下可以发生反应,体现了X的
(2)仅从硫元素化合价变化的角度分析,图中只有还原性的物质有
(3)将
 与
与 混合可生成淡黄色沉淀,该反应中氧化产物与还原产物的物质的量之比为
混合可生成淡黄色沉淀,该反应中氧化产物与还原产物的物质的量之比为(4)配平下列反应
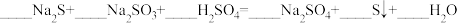
(5)一定条件下,在
 密闭容器中发生反应:
密闭容器中发生反应: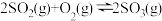 ,开始时加入
,开始时加入 、
、 、
、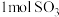 ,在
,在 末测得
末测得 的物质的量是
的物质的量是 ,用
,用 的浓度变化表示反应的平均速率为
的浓度变化表示反应的平均速率为 末
末 的浓度为
的浓度为①升高温度,化学反应速率
②再充入
 ,化学反应速率
,化学反应速率③将容器体积变为
 ,化学反应速率
,化学反应速率
您最近一年使用:0次
4 . 科学家越来越重视氮的氧化物对环境带来的污染问题。氮元素的各种价态与物质类别的对应关系如图所示。
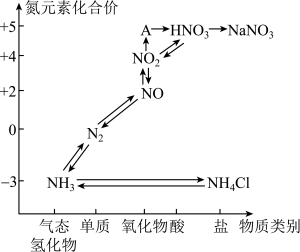
(1)A的化学式为___________ ,图中的物质属于离子化合物的是___________ (填化学式)。
(2)工业上用 经过一系列反应制取硝酸。这一转化过程的第一步反应的化学方程式为
经过一系列反应制取硝酸。这一转化过程的第一步反应的化学方程式为___________ 。
(3)铵态氮肥在存储和使用时,不能与熟石灰、草木灰(主要成分为 )等碱性物质混合,其主要原因是___________(填字母)。
)等碱性物质混合,其主要原因是___________(填字母)。
(4)一定条件下,在恒容密闭容器中发生可逆反应 。下列情况能说明该反应一定达到化学平衡的是
。下列情况能说明该反应一定达到化学平衡的是___________ (填序号)。
①
②
③体系的压强不再发生变化
④混合气体的密度不变⑤3 mol H-H键断裂的同时有2 mol N-H键也断裂
(5)汽车尾气中含有CO、 有毒气体,在催化剂作用下,它们可以相互反应生成两种无毒气体,该反应的化学方程式为
有毒气体,在催化剂作用下,它们可以相互反应生成两种无毒气体,该反应的化学方程式为___________ 。
(6)活性炭也可对汽车尾气进行处理,原理为 。一定条件下,在容积为1L的密闭容器中进行该反应,起始时充入0.4 mol
。一定条件下,在容积为1L的密闭容器中进行该反应,起始时充入0.4 mol  和0.6 mol
和0.6 mol  ,10 s后反应达到平衡状态,测得NO的物质的量为0.2 mol。该条件下,0~10 s内平均反应速率
,10 s后反应达到平衡状态,测得NO的物质的量为0.2 mol。该条件下,0~10 s内平均反应速率
___________ ; 的平衡转化率为
的平衡转化率为___________ 。

(1)A的化学式为
(2)工业上用
 经过一系列反应制取硝酸。这一转化过程的第一步反应的化学方程式为
经过一系列反应制取硝酸。这一转化过程的第一步反应的化学方程式为(3)铵态氮肥在存储和使用时,不能与熟石灰、草木灰(主要成分为
 )等碱性物质混合,其主要原因是___________(填字母)。
)等碱性物质混合,其主要原因是___________(填字母)。| A.混合后生成不溶性物质,降低肥效 | B.混合后增加土壤碱性 |
| C.混合后会放出氨气,降低肥效 | D.混合后会造成钾元素的损失,降低肥效 |
 。下列情况能说明该反应一定达到化学平衡的是
。下列情况能说明该反应一定达到化学平衡的是①

②

③体系的压强不再发生变化
④混合气体的密度不变⑤3 mol H-H键断裂的同时有2 mol N-H键也断裂
(5)汽车尾气中含有CO、
 有毒气体,在催化剂作用下,它们可以相互反应生成两种无毒气体,该反应的化学方程式为
有毒气体,在催化剂作用下,它们可以相互反应生成两种无毒气体,该反应的化学方程式为(6)活性炭也可对汽车尾气进行处理,原理为
 。一定条件下,在容积为1L的密闭容器中进行该反应,起始时充入0.4 mol
。一定条件下,在容积为1L的密闭容器中进行该反应,起始时充入0.4 mol  和0.6 mol
和0.6 mol  ,10 s后反应达到平衡状态,测得NO的物质的量为0.2 mol。该条件下,0~10 s内平均反应速率
,10 s后反应达到平衡状态,测得NO的物质的量为0.2 mol。该条件下,0~10 s内平均反应速率
 的平衡转化率为
的平衡转化率为
您最近一年使用:0次
名校
解题方法
5 . 甲醇的用途十分广泛,主要用于有机合成、作燃料、生产农药、作良好的有机溶剂等。催化 和
和 反应可以合成甲醇,反应化学方程式为
反应可以合成甲醇,反应化学方程式为 。
。
已知:① ;
;
② 。
。
回答下列问题:
(1)写出催化 和
和 合成甲醇的热化学反应方程式:
合成甲醇的热化学反应方程式:___________ 。
(2)对于催化 和
和 合成甲醇的反应,增大压强,平衡
合成甲醇的反应,增大压强,平衡___________ (填“向左”“向右”或“不”)移动;温度升高平衡常数___________ (填“变大”“变小”或“不变”)。
(3)在相同条件下研究催化剂Ⅰ、催化剂Ⅱ对反应 的影响,在密闭容器内充入一定量
的影响,在密闭容器内充入一定量 和
和 ,部分物质的浓度c随反应时间t的变化曲线如图1所示。
,部分物质的浓度c随反应时间t的变化曲线如图1所示。

①a曲线表示___________ 。
②催化剂Ⅰ比催化剂Ⅱ催化效率___________ (填“高”“低”或“相同”),原因是___________ 。
(4)523K时,在1L恒容密闭容器中充入 和
和 ,在催化剂作用下反应合成甲醇,容器内的压强变化如下。
,在催化剂作用下反应合成甲醇,容器内的压强变化如下。
反应从开始到20min时,以 浓度表示平均反应速率
浓度表示平均反应速率
___________ ;此温度下,压强平衡常数
___________  (保留三位有效数字)。
(保留三位有效数字)。
(5)一定条件下,在3个相同的密闭容器中分别充入 和
和 ,
, 分别为1:1、1:2、1:3,CO2(g)的转化率随压强的变化关系如图2所示,曲线a的
分别为1:1、1:2、1:3,CO2(g)的转化率随压强的变化关系如图2所示,曲线a的
___________ ,原因是___________ 。

 和
和 反应可以合成甲醇,反应化学方程式为
反应可以合成甲醇,反应化学方程式为 。
。已知:①
 ;
;②
 。
。回答下列问题:
(1)写出催化
 和
和 合成甲醇的热化学反应方程式:
合成甲醇的热化学反应方程式:(2)对于催化
 和
和 合成甲醇的反应,增大压强,平衡
合成甲醇的反应,增大压强,平衡(3)在相同条件下研究催化剂Ⅰ、催化剂Ⅱ对反应
 的影响,在密闭容器内充入一定量
的影响,在密闭容器内充入一定量 和
和 ,部分物质的浓度c随反应时间t的变化曲线如图1所示。
,部分物质的浓度c随反应时间t的变化曲线如图1所示。
①a曲线表示
②催化剂Ⅰ比催化剂Ⅱ催化效率
(4)523K时,在1L恒容密闭容器中充入
 和
和 ,在催化剂作用下反应合成甲醇,容器内的压强变化如下。
,在催化剂作用下反应合成甲醇,容器内的压强变化如下。| 反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 |
| 压强/MPa | 12.4 | 10.2 | 8.4 | 7.0 | 6.2 | 6.2 |
 浓度表示平均反应速率
浓度表示平均反应速率

 (保留三位有效数字)。
(保留三位有效数字)。(5)一定条件下,在3个相同的密闭容器中分别充入
 和
和 ,
, 分别为1:1、1:2、1:3,CO2(g)的转化率随压强的变化关系如图2所示,曲线a的
分别为1:1、1:2、1:3,CO2(g)的转化率随压强的变化关系如图2所示,曲线a的

您最近一年使用:0次
名校
6 . 甲醇、乙醇来源丰富、价格低廉、运输贮存方便,都是重要的化工原料,有着重要的用途和应用前景,可以用多种方法合成。用 生产甲醇、乙醇。
生产甲醇、乙醇。
(1)已知: 的燃烧热为
的燃烧热为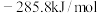 ,
, 的燃烧热为
的燃烧热为 ,
,
 ,则
,则

_______ kJ/mol。
(2)为探究用 生产燃料甲醇的反应原理,在容积为2L的密闭容器中,充入
生产燃料甲醇的反应原理,在容积为2L的密闭容器中,充入 和
和 在一定条件下发生反应,测得
在一定条件下发生反应,测得 、
、 和
和 的物质的量(n)随时间的变化如图所示:
的物质的量(n)随时间的变化如图所示:

①从反应开始到平衡,氢气的平均反应速率
_______ 。
②下列措施能使 的平衡转化率增大的是
的平衡转化率增大的是_______ (填序号)。
A.在原容器中再充入
B.在原容器中再充入
C.在原容器中充入1mol氦气
D.使用更有效的催化剂
E.缩小容器的容积
(3) 也可通过催化加氢合成乙醇,其反应原理为
也可通过催化加氢合成乙醇,其反应原理为
 。设m为起始时的投料比,即
。设m为起始时的投料比,即 。通过实验得到如图所示图象:
。通过实验得到如图所示图象:

①图甲中投料比相同,温度从高到低的顺序为_______ 。
②图乙中 、
、 、
、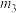 从大到小的顺序为
从大到小的顺序为_______ 。
③图丙表示在总压为5MPa的恒压条件下,且 时,平衡状态时各物质的物质的量分数与温度的关系,
时,平衡状态时各物质的物质的量分数与温度的关系, 温度时,该反应压强平衡常数
温度时,该反应压强平衡常数 的计算表达式为
的计算表达式为_______ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,代入数据,不用计算)。
 生产甲醇、乙醇。
生产甲醇、乙醇。(1)已知:
 的燃烧热为
的燃烧热为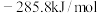 ,
, 的燃烧热为
的燃烧热为 ,
,
 ,则
,则

(2)为探究用
 生产燃料甲醇的反应原理,在容积为2L的密闭容器中,充入
生产燃料甲醇的反应原理,在容积为2L的密闭容器中,充入 和
和 在一定条件下发生反应,测得
在一定条件下发生反应,测得 、
、 和
和 的物质的量(n)随时间的变化如图所示:
的物质的量(n)随时间的变化如图所示:
①从反应开始到平衡,氢气的平均反应速率

②下列措施能使
 的平衡转化率增大的是
的平衡转化率增大的是A.在原容器中再充入

B.在原容器中再充入

C.在原容器中充入1mol氦气
D.使用更有效的催化剂
E.缩小容器的容积
(3)
 也可通过催化加氢合成乙醇,其反应原理为
也可通过催化加氢合成乙醇,其反应原理为
 。设m为起始时的投料比,即
。设m为起始时的投料比,即 。通过实验得到如图所示图象:
。通过实验得到如图所示图象:
①图甲中投料比相同,温度从高到低的顺序为
②图乙中
 、
、 、
、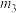 从大到小的顺序为
从大到小的顺序为③图丙表示在总压为5MPa的恒压条件下,且
 时,平衡状态时各物质的物质的量分数与温度的关系,
时,平衡状态时各物质的物质的量分数与温度的关系, 温度时,该反应压强平衡常数
温度时,该反应压强平衡常数 的计算表达式为
的计算表达式为
您最近一年使用:0次
名校
解题方法
7 . 氨的用途十分泛,如氨是制造硝酸和氮肥的重要原料。工业合成氨是人类科学技术的一项重大突破。回答下列问题:
(1)合成氨反应的历程和能量的变化如图所示,符号“·”可视为催化剂。

在合成氨的基元反应中,决速步骤的活化能为___________ kJ/mol。
(2)在不同条件下进行合成氨反应,下列反应速率由大到小的顺序是___________ (填选项序号)。
①v(N2)=0.5mol/(L·min) ②v(H2)=0.02mol/(L·s)
③v(NH3)=0.4mol/(L·min) ④v(NH3)=0.02mol/(L·s)
(3)对于合成氨反应而言,只控制一个变量,下列图像合理的是___________(填选项字母)。
(4)一定温度下,向2L恒容密闭容器中充入0.4molN2、1.2molH2发生反应,NH3的浓度随时间变化情况如表所示:
0~10min内,用H2表示的平均反应速率为___________ ;实验测得体系平衡时的压强为10MPa,则该反应的平衡常数Kp=___________ MPa-2(用分数表示,Kp为分压表示的平衡常数,分压=总压×体积分数);若维持温度不变,向另一2L恒容密闭容器中充入H2、N2和NH3各4mol时,该反应的v正___________ (填“>”“<”或“=”)v逆。
(1)合成氨反应的历程和能量的变化如图所示,符号“·”可视为催化剂。

在合成氨的基元反应中,决速步骤的活化能为
(2)在不同条件下进行合成氨反应,下列反应速率由大到小的顺序是
①v(N2)=0.5mol/(L·min) ②v(H2)=0.02mol/(L·s)
③v(NH3)=0.4mol/(L·min) ④v(NH3)=0.02mol/(L·s)
(3)对于合成氨反应而言,只控制一个变量,下列图像合理的是___________(填选项字母)。
A.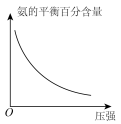 | B. |
C.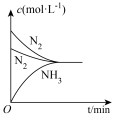 | D.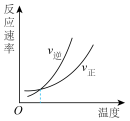 |
| 时间/min | 5 | 10 | 15 | 20 | 25 |
| 浓度/mol/L | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 |
您最近一年使用:0次
名校
解题方法
8 . 氨的用途十分广泛,如氨是制造硝酸和氮肥的重要原科。工业合成氨是人类科学技术的一项重大突破。回答下列问题:
(1)合成氨反应的历程和能量的变化如图所示,符号“·”可视为催化剂。________  。
。
(2)在不同条件下进行合成氨反应,下列反应速率由大到小的顺序是______ (填选项序号)。
①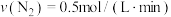 ②
②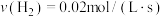
③ ④
④
(3)对于合成氨反应而言,只控制一个变量,下列图像合理的是___________(填选项字母)。
(4)一定温度下,向 恒容密闭容器中充入
恒容密闭容器中充入 、
、 发生反应,
发生反应, 的浓度随时间变化情况如表所示:
的浓度随时间变化情况如表所示:
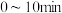 内,用
内,用 表示的平均反应速率为
表示的平均反应速率为_______ ;平衡常数
______ (结果保留一位小数);若维持温度不变,向另一 恒容密闭容器中充入
恒容密闭容器中充入 、
、 和
和 各
各 时,该反应的
时,该反应的
_____ (填 “>”“<”或“=”) 。
。
(1)合成氨反应的历程和能量的变化如图所示,符号“·”可视为催化剂。

 。
。(2)在不同条件下进行合成氨反应,下列反应速率由大到小的顺序是
①
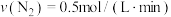 ②
②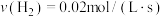
③
 ④
④
(3)对于合成氨反应而言,只控制一个变量,下列图像合理的是___________(填选项字母)。
A. | B. |
C. | D. |
(4)一定温度下,向
 恒容密闭容器中充入
恒容密闭容器中充入 、
、 发生反应,
发生反应, 的浓度随时间变化情况如表所示:
的浓度随时间变化情况如表所示:| 时间/min | 5 | 10 | 15 | 20 | 25 |
浓度/ | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 |
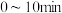 内,用
内,用 表示的平均反应速率为
表示的平均反应速率为
 恒容密闭容器中充入
恒容密闭容器中充入 、
、 和
和 各
各 时,该反应的
时,该反应的
 。
。
您最近一年使用:0次
名校
解题方法
9 . 甲醇是一种重要的有机化工原料,可通过煤间接液化的方法制备,用途广泛。
I.一定温度下,在10L的恒容密闭容器中充入 和
和 ,一定条件下发生反应:
,一定条件下发生反应: ,2min时达到平衡状态,并测得容器内气体的总压强为初始压强的0.6倍,该反应过程中的能量变化如图所示。
,2min时达到平衡状态,并测得容器内气体的总压强为初始压强的0.6倍,该反应过程中的能量变化如图所示。
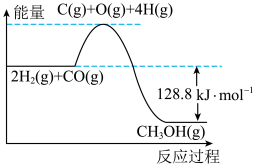
(1)已知断开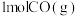 和
和 中的化学键需要吸收的能量为
中的化学键需要吸收的能量为 ,则断开
,则断开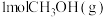 中的化学键需要吸收
中的化学键需要吸收___________  能量。
能量。
(2)从反应开始至达到平衡,以CO表示该反应的平均反应速率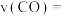
___________ 。
(3)下列描述能说明上述达到平衡状态的是___________ (填字母)。
A.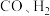 和
和 三种物质的浓度相等
三种物质的浓度相等
B.密闭容器中混合气体的密度不随时间的变化而变化
C.密闭容器中混合气体的压强不随时间的变化而变化
D.密闭容器中混合气体的平均相对分子质量不随时间的变化而变化
E.单位时间内消耗 的同时生成
的同时生成
(4)平衡时 的转化率为
的转化率为___________ (写百分数,保留2位有效数字)。
Ⅱ.甲醇燃料电池能量利用率高,且符合绿色化学理念。若以酸性溶液做电解质溶液:
(5) 应通入
应通入___________ 极(填“正”或“负”),
(6)写出甲醇所在电极的反应式:___________ 。
I.一定温度下,在10L的恒容密闭容器中充入
 和
和 ,一定条件下发生反应:
,一定条件下发生反应: ,2min时达到平衡状态,并测得容器内气体的总压强为初始压强的0.6倍,该反应过程中的能量变化如图所示。
,2min时达到平衡状态,并测得容器内气体的总压强为初始压强的0.6倍,该反应过程中的能量变化如图所示。
(1)已知断开
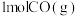 和
和 中的化学键需要吸收的能量为
中的化学键需要吸收的能量为 ,则断开
,则断开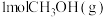 中的化学键需要吸收
中的化学键需要吸收 能量。
能量。(2)从反应开始至达到平衡,以CO表示该反应的平均反应速率
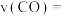
(3)下列描述能说明上述达到平衡状态的是
A.
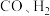 和
和 三种物质的浓度相等
三种物质的浓度相等B.密闭容器中混合气体的密度不随时间的变化而变化
C.密闭容器中混合气体的压强不随时间的变化而变化
D.密闭容器中混合气体的平均相对分子质量不随时间的变化而变化
E.单位时间内消耗
 的同时生成
的同时生成
(4)平衡时
 的转化率为
的转化率为Ⅱ.甲醇燃料电池能量利用率高,且符合绿色化学理念。若以酸性溶液做电解质溶液:
(5)
 应通入
应通入(6)写出甲醇所在电极的反应式:
您最近一年使用:0次
解题方法
10 . 氮的化合物被广泛应用于工业、航天和医药等领域。请回答下而有关氮的化合物的问题:
(1)一定温度下,在体积为2L的恒容密闭容器中发生 、
、 两种气体间的转化反应,
两种气体间的转化反应, 、
、 的物质的量随时间的变化情况如图所示。
的物质的量随时间的变化情况如图所示。

①该反应___________ (填“是”或“不是”)可逆反应;判断的依据是___________ 。
②该反应的化学方程式为___________ 。
③4min时,
___________  (填“大于”“等于”或“小于”)。
(填“大于”“等于”或“小于”)。
④若要增大该反应的速率,可采用的措施有___________ (写两条)。
⑤反应从始至7min时,用 表示的反应平均速率为
表示的反应平均速率为___________ 。
(2)肼( )具有强还原性,在工业上有广泛的用途,液态肼、空气、KOH溶液构成的燃料电池装置如下图所示:
)具有强还原性,在工业上有广泛的用途,液态肼、空气、KOH溶液构成的燃料电池装置如下图所示:

①b电极是电池的___________ (填“负”或“正”)极。
②放电时,电子的流动方向是___________ 。
③该电池的负极反应式为___________ 。
(1)一定温度下,在体积为2L的恒容密闭容器中发生
 、
、 两种气体间的转化反应,
两种气体间的转化反应, 、
、 的物质的量随时间的变化情况如图所示。
的物质的量随时间的变化情况如图所示。
①该反应
②该反应的化学方程式为
③4min时,

 (填“大于”“等于”或“小于”)。
(填“大于”“等于”或“小于”)。④若要增大该反应的速率,可采用的措施有
⑤反应从始至7min时,用
 表示的反应平均速率为
表示的反应平均速率为(2)肼(
 )具有强还原性,在工业上有广泛的用途,液态肼、空气、KOH溶液构成的燃料电池装置如下图所示:
)具有强还原性,在工业上有广泛的用途,液态肼、空气、KOH溶液构成的燃料电池装置如下图所示:
①b电极是电池的
②放电时,电子的流动方向是
③该电池的负极反应式为
您最近一年使用:0次



